| |
| Med Sci (Paris). 36(1): 16–19. doi: 10.1051/medsci/2019254.L’activation des canaux Nav1.9 par le monoxyde d’azote
à l’origine des céphalées par abus médicamenteux Caroline Bonnet1 and Patrick Delmas1* 1SomatoSens, laboratoire de neurosciences cognitives, UMR
7291 CNRS, Aix-Marseille-université, CS80011, 51 boulevard Pierre Dramard,
13344Marseille,
France MeSH keywords: Céphalée, Céphalées secondaires, Humains, Canal sodique voltage-dépendant NAV1.9, Monoxyde d'azote, Médicaments sur ordonnance, Transduction du signal, Troubles liés à une substance, induit chimiquement, métabolisme, étiologie, effets des médicaments et substances chimiques, pharmacologie, toxicité, effets indésirables, complications |
Les céphalées (maux de tête) correspondent à des douleurs locales unilatérales ou
généralisées ressenties au niveau de la boîte crânienne ou du visage. Elles constituent
une cause fréquente de consultation en médecine générale, et représentent donc un réel
problème de santé publique [1].
L’efficacité des analgésiques et des substances anti-migraineuses dites spécifiques est
souvent limitée. En conséquence, beaucoup de patients ont recours à une surconsommation
de médicaments, qui favorise la survenue d’une céphalée chronique. Dans l’étude que nous
avons réalisée [2], nous montrons
que ces céphalées par abus médicamenteux (CAM) [3] résultent d’une hypersensibilité des nocicepteurs méningés au
monoxyde d’azote (NO), un gaz qui peut être libéré dans certaines situations de stress
ou suite à l’ingestion d’aliments riches en nitrates. |
Céphalées et abus médicamenteux Les céphalées primaires surviennent sans aucun lien avec une autre maladie ou un
traumatisme identifié. Les principales céphalées primaires sont les céphalées de
tension et la migraine. Épisodiques (6 % de la population) ou chroniques (3 % de la
population), les céphalées de tension se caractérisent par des maux de tête touchant
les deux côtés du crâne, souvent associés à une sensation de pression, alors que la
migraine, qui touche environ 7 millions de personnes en France, avec une forte
prévalence chez les femmes [4], se manifeste par des douleurs locales unilatérales. Les crises de
migraine sont souvent accompagnées de nausées, de vomissements, et d’une
hypersensibilité à la lumière (photophobie), au son (phonophobie), ou aux odeurs
(osmophobie) [5]. Ces crises
peuvent être déclenchées par de nombreux facteurs, aussi bien alimentaires
(chocolat, alcool, café), que psychologiques (stress, anxiété, contrariété),
hormonaux (règles, pilule contraceptive), ou sensoriels (lumière, bruit, odeurs)
[6]. Parmi les médicaments prescrits contre les céphalées, les plus communément utilisés
sont les analgésiques simples (paracétamol), les anti-inflammatoires non stéroïdiens
(ibuprofène, aspirine, indométacine), mais également les anti-migraineux plus
spécifiques, tels que les dérivés ergotés (dihydroergotamine, tartrate d’ergotamine)
et les triptans (sumatriptan). Néanmoins, le traitement des douleurs induites par
les crises migraineuses reste faiblement efficace sur le long terme, et pris en trop
grande quantité ou trop souvent, ces médicaments peuvent entraîner une chronicité
des céphalées primaires. Les CAM affectent principalement les femmes souffrant
préalablement de céphalées primaires [7], le plus souvent migraineuses, chez lesquelles la prise
excessive et régulière d’antalgiques et/ou d’anti-migraineux spécifiques conduit à
l’induction et à l’entretien de céphalées chroniques quotidiennes. La physiopathologie des CAM, un préalable à l’amélioration de leur prise en charge
thérapeutique, nécessite d’approfondir nos connaissances sur la contribution du
système trigéminal. En effet, l’explication des CAM, bien qu’encore imprécise,
réside en partie dans une sensibilisation des fibres nerveuses dévolues à la
perception douloureuse dans le cinquième nerf crânien, ou nerf trijumeau. Dans ce
cadre, nous avons étudié les mécanismes de contrôle de l’excitabilité des
nocicepteurs méningés dans un modèle animal de CAM induites par l’administration
chronique de sumatriptan, un anti-migraineux ciblant les récepteurs 5HT1B/1D de la
sérotonine (ou 5-hydroxytryptamine, 5HT). |
Le canal Nav1.9 est exprimé dans les nocicepteurs méningés Les fibres nociceptives expriment une large gamme de canaux ioniques spécialisés dans
la détection et la propagation du message douloureux. Parmi eux, le canal ionique
Nav1.9 (isoforme 9 des canaux ioniques sélectifs pour les ions Na+) revêt
un intérêt particulier. Ce canal présente des caractéristiques inhabituelles pour un
canal sodique, qui lui confèrent un rôle prépondérant dans les phénomènes
d’hyperexcitabilité neuronale et dans la douleur, aussi bien chez l’animal que chez
l’homme [8–13] (→).
(→) Voir la Nouvelle de S. Lolignier, m/s n° 2, février 2016,
page 115 ; et la Nouvelle de P. Delmas, m/s n° 2, février 2019, page 162
Cela nous a conduits à formuler l’hypothèse selon laquelle le canal Nav1.9
contribuerait à la sensibilisation des nocicepteurs méningés et à l’activation du
système trigémino-vasculaire observée pendant la céphalée. Les immunomarquages chez
la souris montrent que le canal Nav1.9 est localisé dans les fibres trigéminales
méningées exprimant également le CGRP (calcitonin gene-related
peptide), une molécule pro-inflammatoire associée aux crises de
migraine. |
L’invalidation du gène Scn11a chez la souris abolit les symptômes induits par le
monoxyde d’azote, un déclencheur de migraine Afin de reproduire chez des souris les conditions d’une céphalée induite par abus
médicamenteux, nous leur avons administré du sumatriptan [14] (ou une solution saline) durant six jours,
à l’aide de minipompes osmotiques implantées sous la peau. La sensibilité tactile
des animaux a ensuite été évaluée à l’aide des filaments de von Frey1, environ 15 jours après l’arrêt de
l’administration du médicament ou de la solution saline. Les animaux traités avec la
solution saline développent une allodynie tactile de faible amplitude (allodynie
basale) en réponse à l’injection sous-cutanée de nitroprussiate de sodium, un
donneur de NO connu pour déclencher la crise migraineuse chez l’homme. Les animaux
traités par le sumatriptan ont en revanche une hypersensibilité tactile très marquée
suite à l’administration de NO. Ces animaux présentent une allodynie péri-orbitale
et extra-céphalique exacerbée, ainsi qu’une hypersensibilité au son et à la lumière,
des symptômes observés classiquement pendant la crise migraineuse chez l’homme. Les
souris mutantes Scn11a
-/- (dépourvues du canal Nav1.9), après l’administration du sumatriptan,
ne présentent pas d’allodynie tactile exacerbée, ni de photophobie ou phonophobie en
réponse au NO. Ainsi, les animaux soumis à un traitement chronique par le
sumatriptan présentent une sensibilisation latente aux déclencheurs de migraine qui
dépend de la présence du canal Nav1.9 dans les nocicepteurs méningés. |
Le sumatriptan sensibilise les canaux Nav1.9 au NO Afin d’explorer le rôle des canaux Nav1.9 dans les CAM, nous avons enregistré
l’activité de ces canaux dans les neurones trigéminaux qui innervent les méninges,
par la technique de patch clamp. Chez les animaux traités par le
sumatriptan, le niveau d’expression du gène Scn11a et l’amplitude
basale du courant Nav1.9 sont similaires à ceux des animaux non traités (témoins).
Cependant, l’application aiguë de NO triple l’amplitude du courant Nav1.9 chez les
animaux traités par le sumatriptan, alors qu’elle n’a que peu d’effet sur le courant
Nav1.9 dans les nocicepteurs méningés des animaux témoins. Cette augmentation du
courant est associée à un déplacement, d’environ –20 mV, de la valeur du potentiel
de membrane pour laquelle 50 % de la conductance Nav1.9 est activée (potentiel de «
demi-activation »), ce qui traduit une activation facilitée. Parce que la guanosine
monophosphate cyclique (GMPc) joue un rôle prépondérant dans la signalisation du NO,
nous avons cherché à déterminer l’implication de la guanylate cyclase soluble,
l’enzyme de synthèse du GMPc, dans l’activation des canaux Nav1.9. L’ajout de bleu
de méthylène (100 μM), un inhibiteur de cette enzyme, abolit l’effet du NO sur le
courant Nav1.9. L’ensemble de ces résultats indique que la voie NO-GMPc est
anormalement active sur le courant Nav1.9 dans les nocicepteurs méningés des animaux
traités par le sumatriptan. |
L’activation des canaux Nav1.9 par le NO induit une hyperexcitabilité des
nocicepteurs méningés Nous avons étudié les propriétés d’excitabilité des neurones afférents méningés,
identifiés par marquage rétrograde, en réponse à une exposition au NO. L’activation
du courant Nav1.9 par le NO convertit les décharges phasiques des neurones en
décharges prolongées dans environ 80 % des nocicepteurs de la dure-mère chez les
animaux traités par le sumatriptan. En outre, la présence de NO abaisse le seuil de
déclenchement du potentiel d’action (PA) dans ces neurones. En revanche, le NO n’a
pas d’effet significatif sur la décharge et le seuil de déclenchement du PA des
nocicepteurs innervant les méninges de souris témoins traitées par une simple
solution saline, ou de souris Scn11a
-/- traitées par le sumatriptan. |
L’activation des canaux Nav1.9 par le NO provoque la sécrétion de CGRP Nous avons testé si l’hyperexcitabilité induite par l’activation de Nav1.9 avait un
effet sur la sécrétion de CGRP (calcitonin-gene related peptide),
un marqueur de la céphalée migraineuse. à de très faibles concentrations, le
nitroprussiate de sodium n’a pas d’effet significatif sur le taux de CGRP sécrété
par les neurones trigéminaux de souris témoins cultivés in vitro.
En revanche, il augmente significativement (+70 %) la sécrétion de CGRP par les
neurones trigéminaux de souris traitées par le sumatriptan. Cet effet n’est pas
observé avec les neurones trigéminaux des souris Scn11a
-/-, ce qui indique que l’activation des canaux Nav1.9 est un prérequis à
la libération de CGRP. La contribution de la libération de CGRP à l’allodynie tactile induite par le NO a
été évaluée en injectant un antagoniste de ce peptide (α-CGRP8-37) 30 minutes avant
le nitroprussiate de sodium. L’injection d’α-CGRP8-37 inhibe l’allodynie tactile
exacerbée des souris traitées par le sumatriptan, indiquant que la libération de
CGRP est impliquée dans les phénomènes d’hypersensibilité induits par le NO. |
L’activation des canaux Nav1.9 par le NO induit une vasodilatation des artères
méningées Puisque les fibres des nerfs trijumeaux exprimant Nav1.9 et CGPR innervent la paroi
des artères méningées, nous avons évalué les effets du NO sur la vasodilatation des
artères méningées. Nous avons utilisé la technique d’anémométrie laser Doppler, qui
permet de mesurer le débit sanguin, et ainsi d’apprécier indirectement le calibre
des vaisseaux sanguins. Le nitroprussiate de sodium, injecté dans la veine
jugulaire, provoque une augmentation progressive du débit sanguin des artères
méningées chez les souris traitées par le sumatriptan. En revanche, il est sans
effet chez les souris Scn11a
-/- traitées de façon similaire. L’ensemble de ces résultats indique que
l’activité accrue des nocicepteurs méningés consécutive à l’activation des canaux
Nav1.9 par le NO déclenche la libération de médiateurs vasoactifs (GCRP, et
possiblement substance P) responsables de la vasodilatation des artères méningées.
Ce phénomène est particulièrement marqué chez les animaux traités avec le
sumatriptan, et sous-tend le passage de substances inflammatoires et algogènes dans
les tissus méningés. |
L’activation des canaux Nav1.9 par le NO induit une dégranulation des
mastocytes L’hyperexcitabilité des nocicepteurs méningés peut entraîner une dégranulation des
mastocytes, avec libération de médiateurs préformés vasoactifs, pro-inflammatoires,
et nociceptifs. Nous avons donc examiné si la sécrétion de médiateurs par les
nocicepteurs, chez les animaux CAM, pouvait provoquer la dégranulation des
mastocytes méningés et amplifier la douleur. Nous montrons que le cromoglycate de
sodium, un médicament qui inhibe la dégranulation des mastocytes, réduit
considérablement l’intensité de l’allodynie généralisée chez les animaux traités par
le sumatriptan lorsqu’il est injecté par voie intra-péritonéale avant le
nitroprussiate de sodium. En revanche, ce médicament n’a aucun effet sur l’allodynie
basale des souris Scn11a
-/- traitées de façon similaire. Ces résultats montrent que, chez les
animaux traités par le sumatriptan, l’activation des canaux Nav1.9 induit une
dégranulation des mastocytes qui accentue le message douloureux véhiculé par les
fibres méningées trigéminales. |
Les médiateurs mastocytaires stimulent en retour les canaux Nav1.9 Nous avons recherché si la dégranulation des mastocytes pouvait rétroagir sur les
terminaisons nerveuses trigéminales en modulant l’activité des canaux Nav1.9. Les
mastocytes se caractérisent par la présence, dans leur cytoplasme, de très nombreux
médiateurs chimiques comme la sérotonine, l’histamine, les prostaglandines, la
tryptase, ou l’héparine. Les enregistrements électrophysiologiques en patch
clamp ont montré que l’histamine et la prostaglandine E2 (PGE2) sont de
puissants activateurs du courant Nav1.9 dans les nocicepteurs méningés (amplitude du
courant augmentée de 100 ± 25 % ou 233 ± 40 %, respectivement). Ces effets sont
observés indépendamment du traitement des souris, ce qui implique que les médiateurs
mastocytaires, une fois libérés, vont exciter les fibres sensitives du nerf
trijumeau et aggraver la douleur. |
Cette étude apporte un éclairage nouveau sur les mécanismes responsables de la CAM
induite par l’usage fréquent des triptans. Ces céphalées résultent d’une activation
anormale des canaux Nav1.9 par le NO. Ces canaux agissent alors comme une plaque
tournante déclenchant une cascade d’évènements (hyperexcitabilité neuronale,
inflammation neurogène, vasodilatation artérielle, extravasation plasmatique,
dégranulation des mastocytes) qui conduit à une hypersensibilité du système
trigémino-vasculaire favorisant le déclenchement de nouvelles crises (Figure 1). Ces résultats ouvrent la
voie à de nouvelles approches pour le traitement de la migraine, fondées sur
l’association de bloqueurs des canaux Nav1.9 aux médicaments anti-migraineux.
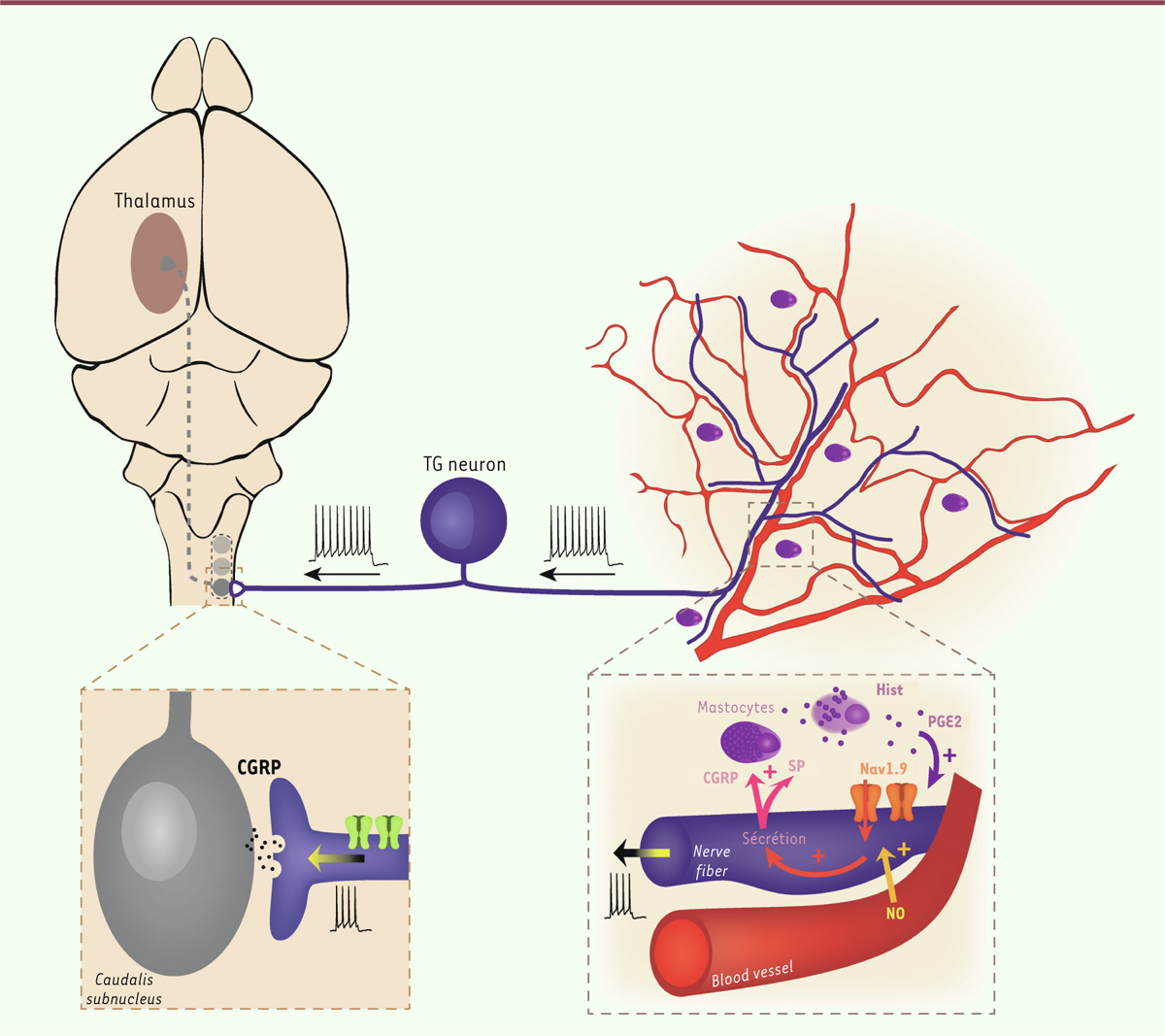
 | Figure 1. Le canal Nav1.9 : plaque tournante des céphalées par abus médicamenteux.
Le monoxyde d’azote (NO), qui peut être produit par différentes sources,
active les canaux Nav1.9 des nocicepteurs méningés chez les animaux
traités par le sumatriptan. L’activation de ces canaux induit un état
d’hyperexcitabilité neuronale à l’origine de la libération de médiateurs
inflammatoires et vasoactifs qui agissent sur les vaisseaux méningés et
les mastocytes. La sécrétion de CGRP, et peut-être d’autres médiateurs,
provoque la dégranulation des mastocytes résidents. Les médiateurs
libérés par les mastocytes potentialisent en retour l’activation des
canaux Nav1.9, renforçant ainsi l’excitation des nocicepteurs méningés,
un cercle vicieux qui conduit à un message douloureux exacerbé.
Caudalis subnucleus, noyau caudal trigéminal ; SP,
substance P ; CGRP, calcitonin-gene related peptide ;
Hist, histamine ; NO, monoxyde d’azote ; TG neuron,
neurone trigéminal ; PGE, prostaglandine E2 (© Illustration par Nancy
Osorio). |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Footnotes |
1.
Steiner
TJ
Stovner
LJ
Katsarava
Z
et al.
The impact of headache in Europe: principal results of the
Eurolight project . J Headache Pain.
2014; ; 15 : :31.. 2.
Bonnet
C,
Hao
J,
Osorio
N, et al.
Maladaptive activation of Nav1.9 channels by nitric oxide causes
triptan-induced medication overuse headache . Nature
Commun.
2019;; 10 : :4253.. 3.
Diener
HC
Dodick
D
Evers
S
et al.
Pathophysiology, prevention, and treatment of medication overuse
headache . Lancet Neurol.
2019; ; 18 :
:891.–902. 4.
Bigal
ME
Lipton
RB
Stewart
WF
The epidemiology and impact of migraine .
Curr Neurol Neurosci Rep.
2004; ; 4 :
:98.–104. 5.
Headache Classification Committee of the International Headache
Society.
IHS). The international classification of headache disorders,
3rd edition (beta version .
Cephalalgia.
2013; ; 33 :
:629.–808. 6.
Marmura
MJ
Triggers, protectors, and predictors in episodic
migraine . Curr Pain Headache Rep.
2018; ; 22 : :81.. 7.
Kristoffersen
ES
Lundqvist
C
Medication-overuse headache: a review . J
Pain Res.
2014; ; 7 :
:367.–368. 8.
Lolignier
S,
Bonnet
C,
Gaudioso
C, et al.
The Nav1.9 channel is a key determinant of cold pain sensation
and cold allodynia . Cell Rep.
2015;; 11 :
:1067.–78. 9.
Maingret
F
Coste
B
Padilla
F
et al.
Inflammatory mediators increase Nav1.9 current and excitability
in nociceptors through a coincident detection mechanism .
J Gen Physiol.
2008; ; 131 :
:211.–225. 10.
Amsalem
M
Poilbout
C
Ferracci
G
et al.
Membrane cholesterol depletion as a trigger of Nav1.9
channel-mediated inflammatory pain . EMBO J.
2018; ; 37 :
:e97349.. 11.
Lolignier
S
Eschalier
A
Bonnet
C
et al.
Le canal Nav1.9: protéine clé pour la perception du froid et
cible thérapeutique potentielle contre la douleur .
Med Sci (Paris).
2016; ; 32 :
:162.–165. 12.
Delmas
P
Padilla
F
Poilbout
C
Le cholestérol cellulaire, un régulateur important de la douleur
inflammatoire . Med Sci (Paris).
2019; ; 35 :
:115.–118. 13.
Dib-Hajj
SD
Black
JA
Waxman
SG
NaV1.9: a sodium channel linked to human pain .
Nat Rev Neurosci.
2015; ; 16 :
:511.–519. 14.
De Felice
M
Ossipov
MH
Wang
R
et al.
Triptan-induced enhancement of neuronal nitric oxide synthase in
trigeminal ganglion dural afferents underlies increased responsiveness to
potential migraine triggers . Brain.
2010; ; 133 :
:2475.–2488. |