| |
| Med Sci (Paris). 36(1): 20–23. doi: 10.1051/medsci/2019255.Des déterminants cellulaires et viraux contrôlent
l’expansion de compartiments intracellulaires séquestrant le VIH-1 dans les
macrophages infectés Leslie Lepont,1 Olivier Leymarie,1 and Clarisse Berlioz-Torrent1* 1Université de Paris, Institut Cochin, Inserm, CNRS,
laboratoire « Interactions hôte-virus », 27 rue du faubourg Saint Jacques,
F-75014Paris,
France MeSH keywords: Compartimentation cellulaire, Infections à VIH, VIH-1 (Virus de l'Immunodéficience Humaine de type 1), Interactions hôte-pathogène, Humains, Macrophages, Réplication virale, immunologie, anatomopathologie, virologie, physiologie |
L’infection par le virus de l’immunodéficience humaine (VIH), l’agent causal du syndrome
d’immunodéficience acquise (Sida), est un problème majeur de santé publique. Depuis le
début de l’épidémie, 32 millions de personnes sont mortes des suites de maladies liées
au Sida. En 2018, environ 38 millions de personnes dans le monde étaient infectées par
le VIH (Source ONUSIDA). |
Les macrophages, une cible cellulaire du VIH de type I (VIH-1) Le VIH-1 infecte les cellules immunitaires lymphoïdes et myéloïdes. Parmi ces
dernières, les macrophages, beaucoup plus résistants à l’effet cytopathique de
l’infection par le VIH-1, ont un rôle physiopathologique majeur dans l’infection en
favorisant la dissémination du virus lors de contacts cellule-cellule et en
constituant l’un des réservoirs du virus chez l’individu infecté [1]. En effet, les macrophages peuvent
produire de grandes quantités de virus et séquestrer pendant de longues périodes de
temps, dans des compartiments intracellulaires (en anglais, virus-containing
compartment ou VCC), des virus assemblés pleinement infectieux, qui
peuvent être relâchés ultérieurement dans le milieu extérieur [1]. La présence de ces virus dans les VCC des macrophages du
système nerveux central a été rapportée, dès 1988, dans des biopsies de cerveau de
patients présentant une encéphalopathie associée au Sida [2]. L’étude des mécanismes de la production et
de la séquestration de VIH-1 pleinement infectieux par ces macrophages est donc
nécessaire pour comprendre la formation des réservoirs viraux et progresser vers
leur éradication. |
Les particules virales s’accumulent dans les compartiments intracellulaires (VCC)
des macrophages infectés Longtemps un sujet de controverse, il est désormais admis que l’assemblage et le
bourgeonnement du VIH-1 dans les macrophages se produisent principalement dans des
structures intracellulaires issues de la membrane plasmique (intracellular
plasma membrane-connected compartments, ou IPMC) formant par la suite
les VCC [3,4] (Figure 1). Ces VCC, initialement décrits comme des
endosomes tardifs (late endosomes, ou LE) et des corps
multi-vésiculaires (multivesicular bodies, ou MVB) du fait de leur
enrichissement en tétraspanines CD9, CD36, CD63 et CD81, et la présence de molécules
du complexe majeur d’histocompatibilité de classe II (CMH II) [5], forment en réalité un réseau
tubulaire en partie connecté à la surface cellulaire, ayant un pH neutre,
contrairement aux LE et aux MVB [3,4].
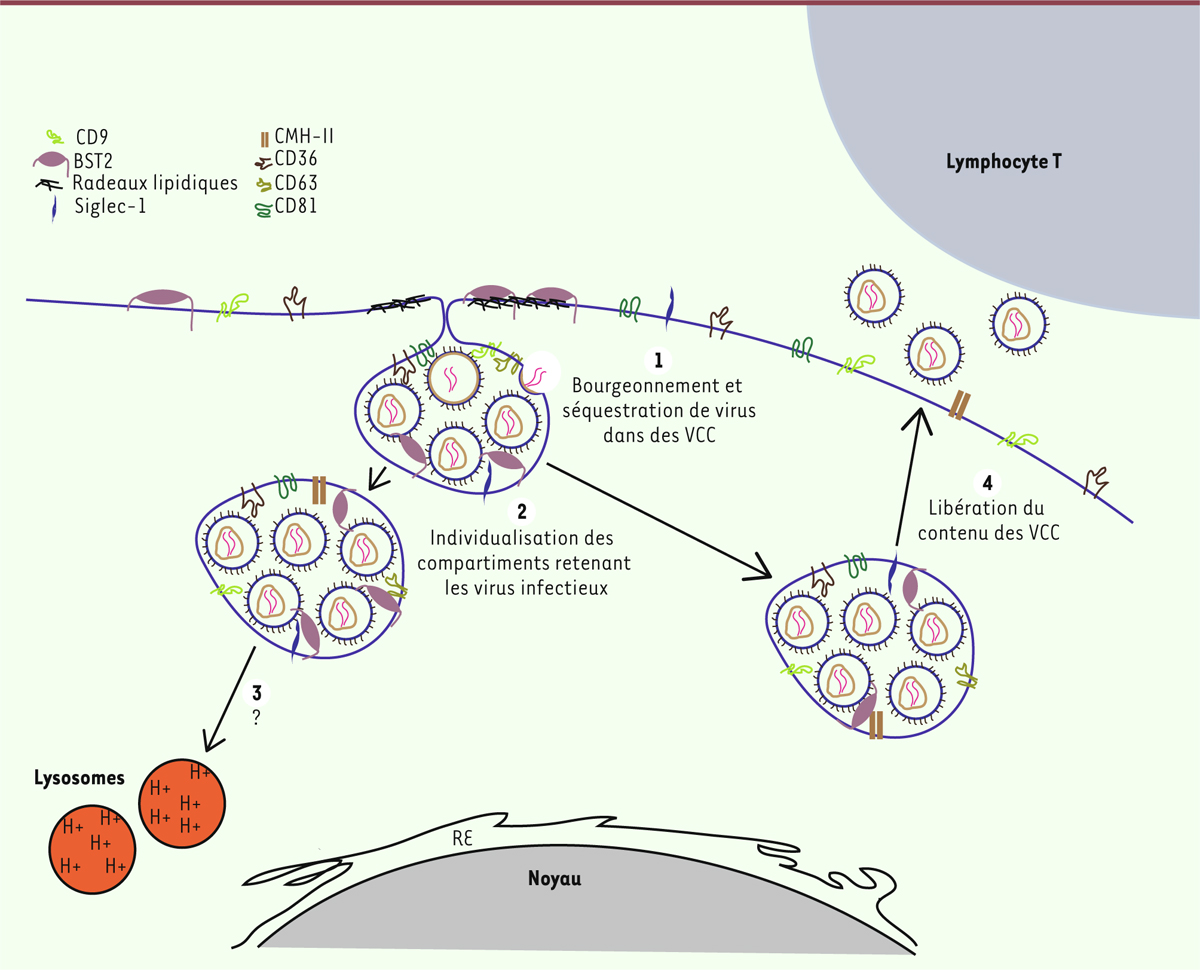
 | Figure 1. Le VIH-1 s’accumule dans des compartiments intracellulaires connectés à
la membrane cellulaire. 1. Lors des étapes
tardives du cycle viral, les virions néo-synthétisés s’accumulent dans
des compartiments intracellulaires reliés à la membrane, les VCC
(virus-containing compartments). Ces VCC sont
enrichis en tétraspanines CD9, CD36, CD63 et CD81, mais également en
molécules du complexe majeur d’histocompatibilité de classe II (CMH-II),
en glycoprotéine Siglec-1 (sialic acid-binding Ig-like lectin
1) qui se lie à l’acide sialique, et en protéine BST2
(bone marrow stromal antigen 2).
2. Ces compartiments vont ensuite
s’individualiser et perdurer dans la cellule.
3. Le devenir de ces VCC, notamment
leur dégradation par les lysosomes, reste mal connu, mais les virions
séquestrés peuvent être transférés à un lymphocyte T
via la formation de « synapses virologiques »
4. RE : réticulum
endoplasmique. |
|
Le facteur de restriction BST2, une barrière cellulaire contre la dissémination
des virus enveloppés, et son adversaire, la protéine Vpu du VIH-1 Deux études ont montré que le facteur de restriction1
bone marrow stromal antigen 2 (BST2, ou tetherin,
ou CD317, ou encore HM1.24) est présent dans les VCC [6,7]. La protéine cellulaire BST2/tetherin est
l’un des facteurs de restriction du VIH et du virus de l’immunodéficience simienne.
Il s’agit d’un acteur majeur de l’immunité innée, restreignant la dissémination de
nombreux virus enveloppés. Ce facteur retient physiquement les nouveaux virus formés
à la surface de la cellule productrice, réduisant ainsi la production et la
dissémination virale [8,9] (Figure 2). Face à cette restriction,
les lentivirus ont développé différentes stratégies pour diminuer la quantité de
BST2/tetherin présente aux sites de bourgeonnement viral et
restaurer ainsi une production virale efficace [10]. La protéine Vpu du VIH-1 est l’un des
acteurs viraux capables de contrer cette restriction [8,9]. Ainsi, de nombreuses études
réalisées sur des lignées cellulaires ont montré que Vpu favorise la libération des
particules virales. En absence de Vpu, moins de virions sont relâchés dans le milieu
extracellulaire, et des virions s’accumulent dans les cellules productrices
(Figure 2). à ce jour,
peu d’études décrivent les mécanismes par lesquels Vpu interfère avec la restriction
imposée par BST2 dans les macrophages infectés.
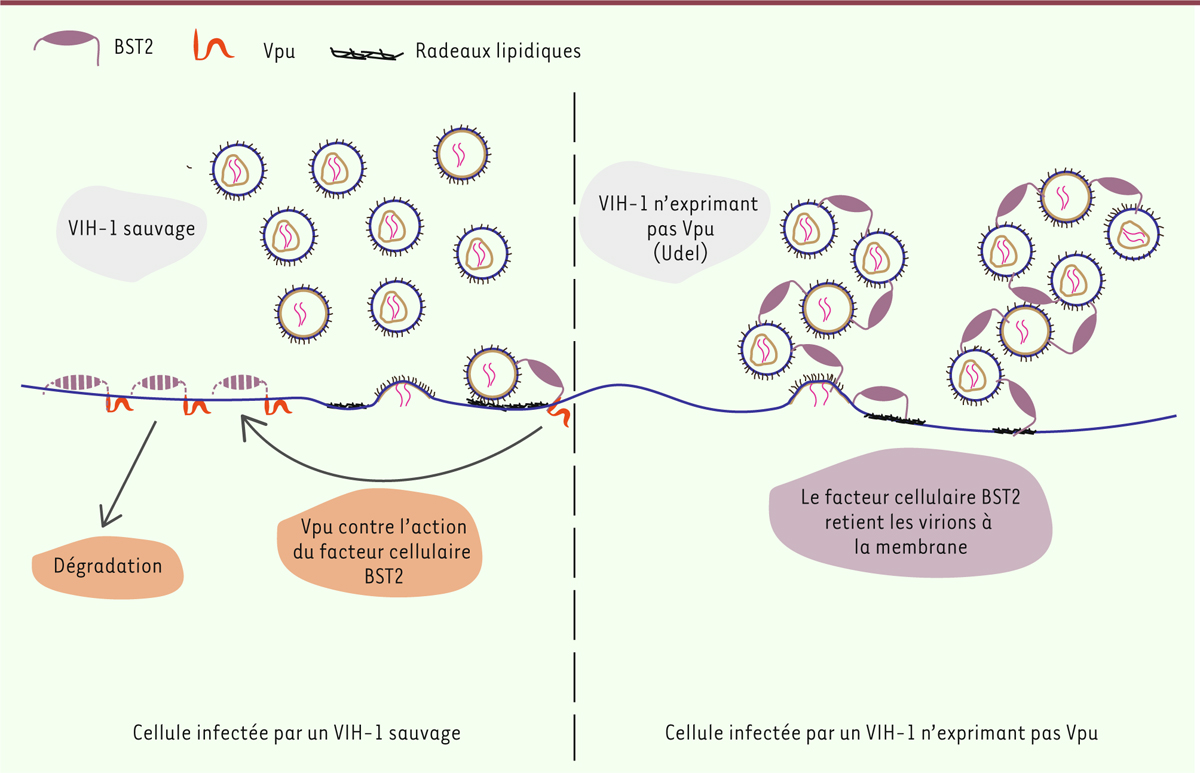
 | Figure 2. La protéine virale Vpu contrecarre l’action du facteur cellulaire de
restriction BST2 et induit sa dégradation. Lors de l’infection par un
VIH-1 du type « sauvage » (à gauche), les virions néo-formés
bourgeonnent à la membrane plasmique et sont relâchés dans le milieu
extracellulaire. Lors de l’infection par un VIH-1 privé de la protéine
Vpu (viral protein U, à droite), les virions néo-formés
s’accumulent à la membrane cellulaire. Cette rétention est due à la
présence de la protéine BST2 à la surface cellulaire : BST2 s’ancre
simultanément dans la membrane plasmique et dans l’enveloppe virale des
virions bourgeonnants. Lors de l’infection par un virus de type sauvage,
Vpu se lie à BST2 et induit sa dégradation, favorisant la libération des
particules virales. |
Notre étude publiée dans Journal of Virology [11] analyse les contributions
respectives du facteur de restriction BST2 et de la protéine virale Vpu dans la
production de nouveaux virions, ainsi que la formation et le maintien des VCC
séquestrant les virions dans les macrophages infectés. Pour étudier l’impact de Vpu
sur la production virale et la formation des VCC dans le macrophage primaire, nous
nous sommes appuyés sur un modèle de macrophages dérivés de monocytes isolés à
partir de sang humain (monocyte-derived macrophages, MDM). Les MDM
sont infectés avec un virus VIH-1 de type « sauvage » (wild-type,
WT) ou privé de sa protéine Vpu (Udel). Une quantification de la protéine virale de
capside CAp24 associée aux cellules ou présente dans le milieu extracellulaire par
la technique ELISA permet une analyse comparative de la production de virions. Ce
dosage montre que l’expression de Vpu favorise la libération des particules virales
dans le surnageant et réduit la quantité de CAp24 associée à la cellule. Vpu
favorise donc la libération des particules virales produites par les macrophages.
Par ailleurs, lorsque l’expression de BST2 est réduite par
transfection des macrophages avec un ARN interférant ciblant l’ARNm de ce gène, le
virus VIH-1 Udel (privé de Vpu) est libéré tout aussi efficacement dans le milieu
extracellulaire que le virus de type sauvage. L’effet de Vpu sur la production
virale est donc lié à l’expression de BST2 dans les
macrophages. |
La protéine virale Vpu diminue la quantité globale de protéine BST2 dans la
cellule infectée, ainsi que sa présence à la surface des macrophages Nos résultats indiquent que l’expression de Vpu augmente la production virale en
contrecarrant le facteur de restriction BST2. Deux activités différentes de Vpu sur
BST2 ont été rapportées, principalement dans les lignées cellulaires modèles
(HEK293T et HeLa, cellules T lymphoblastoïdes CEM). Vpu réduit la quantité globale
de protéine BST2 dans les cellules infectées, ainsi que sa présence à la surface de
ces cellules en favorisant son adressage aux lysosomes, et limite donc le recyclage
de la protéine vers la surface cellulaire. La seconde activité de Vpu réside dans sa
capacité à exclure BST2 des sites de bourgeonnement viral et, de ce fait, à limiter
son incorporation dans l’enveloppe virale en formation pour permettre la libération
des particules virales dans le surnageant [10]. Dans notre étude, l’analyse de la quantité de protéine BST2 présente
dans des lysats de MDM infectés, ainsi qu’une analyse de ces cellules par cytométrie
en flux, montrent que Vpu réduit significativement la quantité globale de BST2 dans
les MDM et la présence de BST2 à leur surface, un effet dont l’intensité diffère
cependant selon les donneurs. L’action de Vpu sur BST2 dans les macrophages est donc
semblable à celle décrite auparavant dans différentes lignées cellulaires. |
L’intégrité du domaine transmembranaire et de deux motifs du domaine
intracellulaire de Vpu sont nécessaires à son action sur la production des
virions L’action de Vpu sur la production des virions dépend de plusieurs caractéristiques
moléculaires de cette protéine. Une interaction directe entre le domaine
transmembranaire de Vpu et celui de BST2 est essentielle à son action sur la
présence de BST2 à la surface des cellules infectées [10]. Par ailleurs, deux motifs présents dans la séquence
protéique de Vpu participent à l’exclusion de BST2 du site de bourgeonnement viral
et à la diminution de l’expression de surface de BST2 : (1) un motif de type
dileucine, E59VSAL63V, présent dans la seconde hélice a du
domaine cytoplasmique de Vpu, et (2) deux sérines phosphorylables (S52 et
S56), requises pour son interaction avec l’E3 ubiquitine ligase
b-TRCP [10]. Nous avons donc construit, par
mutagénèse dirigée, différents clones proviraux de VIH-1 porteurs de mutations dans
la séquence codant Vpu, et particulièrement dans celle codant son domaine
transmembranaire ou l’un des deux motifs du domaine intracellulaire sus-mentionnés.
L’évaluation de la production virale pour ces différents mutants montre que
l’intégrité du domaine transmembranaire de Vpu est critique pour obtenir une
production virale optimale dans les macrophages. En outre, il apparaît que les deux
motifs du domaine cytoplasmique de Vpu contribuent, dans une moindre mesure, à
l’action de Vpu sur la dissémination virale. Deux équipes ont rapporté un enrichissement de protéines BST2 dans les VCC lors de
l’infection par le VIH-1 [6,7]. Nous avons donc analysé la distribution de
BST2 dans ces compartiments par microscopie confocale, et défini l’impact de
l’expression de Vpu sur cette distribution. Nous observons qu’en absence de Vpu,
BST2 est localisée dans les VCC contenant les virons VIH-1, alors que la protéine
n’est plus associée à ces compartiments lorsque les cellules infectées expriment
Vpu. Par ailleurs, à l’aide du logiciel de reconstitution 3D IMARIS, nous avons
montré que la présence de Vpu réduit le volume de ces structures. En absence de
BST2, les VCC sont toujours présents, mais l’effet de Vpu sur leur volume n’est plus
visible. La présence de BST2 favorise donc la formation de grands VCC, mais n’est
pas indispensable à la formation de ces compartiments. Enfin, nous avons analysé le
volume des VCC dans des macrophages infectés par les virus mutés dans le domaine
transmembranaire, le motif de type dileucine, ou les deux sérines phosphorylables de
Vpu. L’analyse en microscopie confocale a révélé un rôle plus complexe de Vpu sur la
taille de ces compartiments. En effet, nos résultats suggèrent que Vpu contrôle la
taille de ces compartiments en excluant BST2 des VCC via
l’interaction directe entre les domaines transmembranaires des deux protéines, et en
agissant sur le trafic intracellulaire de BST2. Ils indiquent également que d’autres
facteurs cellulaires participeraient à la formation et au contrôle du volume des
VCC. |
Notre étude apporte de nouvelles informations sur le rôle de la protéine virale Vpu
et du facteur de restriction BST2 dans la séquestration intracellulaire des virions
néo-synthétisés dans les macrophages infectés par VIH-1. Nous montrons que le volume
des compartiments intracellulaires abritant les virions est contrôlé par Vpu. Cette
activité de Vpu requiert l’intégrité de son domaine transmembranaire, ainsi que
celle d’un motif de type dileucine et de deux sérines phosphorylées de son domaine
cytosolique. Ce processus dépend de la capacité de Vpu à diminuer la présence de
BST2 au site de bourgeonnement viral. Vpu réduit ainsi la quantité de virions
accumulés au site de bourgeonnement et séquestrés ultérieurement dans les VCC.
Ainsi, l’expression de Vpu limite l’expansion de ces compartiments. Par ailleurs,
notre étude souligne qu’à travers d’autres activités non identifiées, Vpu limite
l’enrichissement de BST2 dans les VCC. La présence de ces compartiments intracellulaires confère donc aux macrophages un
rôle de sanctuaire pour le virus VIH-1. Ce réservoir viral, sous-estimé pendant de
nombreuses années, est aujourd’hui au cœur de nombreuses recherches. Ainsi, une
étude récente montre que des macrophages présents dans les tissus de l’urètre de
patients sous traitement antirétroviral depuis plusieurs années possèdent des
compartiments intracellulaires contenant des virus réplicatifs qui sont
transmissibles à des cellules cibles après réactivation [12]. L’étude des mécanismes contrôlant la
formation et la persistance de ces compartiments dans les macrophages est donc un
enjeu majeur pour progresser dans l’éradication de ces sanctuaires viraux. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Le laboratoire est soutenu par l’ANRS et SIDACTION.
|
Footnotes |
1.
Tan
J
Sattentau
QJ
The HIV-1-containing macrophage compartment: a perfect cellular
niche? . Trends Microbiol.
2013; ; 21 :
:405.–412. 2.
Orenstein
JM
Meltzer
MS
Phipps
T
et al.
Cytoplasmic assembly and accumulation of human immunodeficiency
virus types 1 and 2 in recombinant human colony-stimulating factor-1-treated
human monocytes: an ultrastructural study . J
Virol.
1988; ; 62 :
:2578.–2586. 3.
Jouve
M
Sol-Foulon
N
Watson
S
et al.
HIV-1 buds and accumulates in nonacidic endosomes of
macrophages . Cell Host Microbe.
2007; ; 2 :
:85.–95. 4.
Deneka
M
Pelchen-Matthews
A
Byland
R
et al.
In macrophages, HIV-1 assembles into an intracellular plasma
membrane domain containing the tetraspanins CD81, CD9, and
CD53 . J Cell Biol.
2007; ; 177 :
:329.–341. 5.
Pelchen-Matthews
A
Kramer
B
Marsh
M
Infectious HIV-1 assembles in late endosomes in primary
macrophages . J Cell Biol.
2003; ; 162 :
:443.–455. 6.
Chu
H
Wang
JJ
Qi
M
et al.
Tetherin/BST-2 is essential for the formation of the
intracellular virus-containing compartment in HIV-infected
macrophages . Cell Host Microbe.
2012; ; 12 :
:360.–372. 7.
Giese
S
Marsh
M
Tetherin can restrict cell-free and cell-cell transmission of HIV
from primary macrophages to T cells . PLoS
Pathog.
2014; ; 10 :
:e1004189.. 8.
Neil
SJD
Zang
T
Bieniasz
PD
Tetherin inhibits retrovirus release and is antagonized by HIV-1
Vpu . Nature.
2008; ; 451 :
:425.–430. 9.
Van
Damme N
Goff
D
Katsura
C
et al.
The interferon-induced protein BST-2 restricts HIV-1 release and
is downregulated from the cell surface by the viral Vpu
protein . Cell Host Microbe.
2008; ; 3 :
:245.–252. 10.
Roy
N
Pacini
G
Berlioz-Torrent
C
et al.
Mechanisms underlying HIV-1 Vpu-mediated viral
egress . Front Microbiol.
2014; ; 5 : :177.. 11.
Leymarie
O
Lepont
L
Versapuech
M
et al.
Contribution of the cytoplasmic determinants of Vpu to the
expansion of virus-containing compartments in HIV-1-infected
macrophages . J Virol.
2019; ; 93 :
:e00020.–e00019. 12.
Ganor
Y
Real
F
Sennepin
A
et al.
HIV-1 reservoirs in urethral macrophages of patients under
suppressive antiretroviral therapy . Nat
Microbiol.
2019; ; 4 :
:633.–644. |