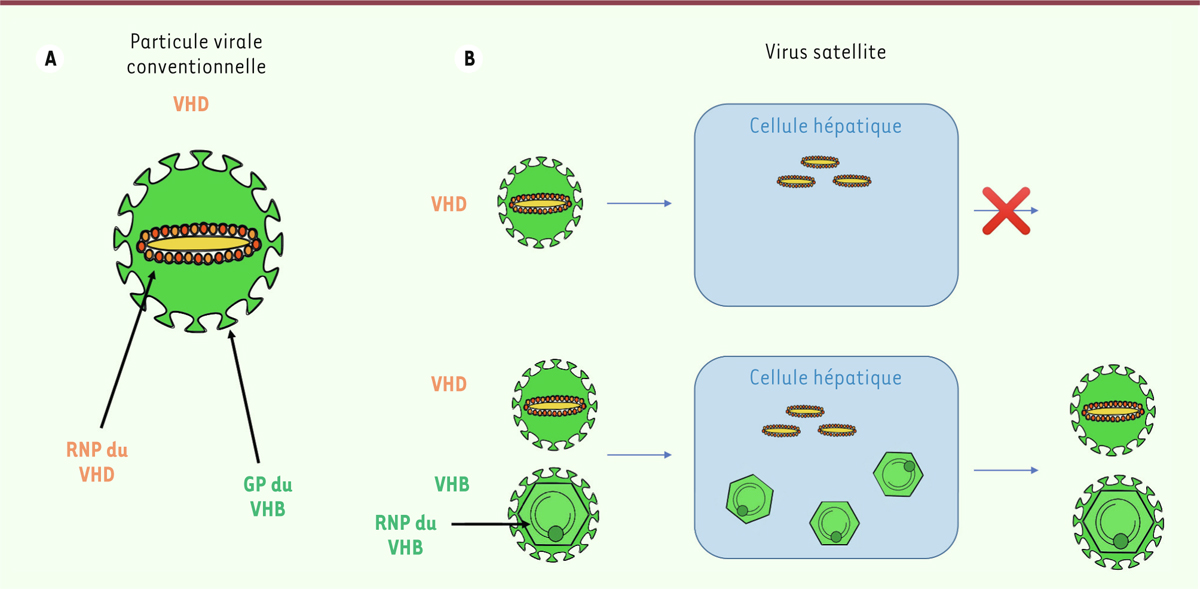
Le virus de l’hépatite Delta (VHD) a été découvert il y a 40 ans dans le foie de personnes infectées par le virus de l’hépatite B (VHB, de la famille des Hepadnaviridae). Parmi les 250 millions de personnes chroniquement infectées par VHB, 15 à 20 millions sont coinfectées par VHD [1]. La surinfection par VHD aggrave l’hépatite déjà causée par VHB, et augmente le risque de développer cirrhose et hépatocarcinome [2]. Du fait de son association avec VHB, VHD est connu en tant que virus « satellite » de VHB, ce qui signifie qu’il en est dépendant (Figure 1) [3]. La particule virale de VHD est formée d’un complexe ribonucléoprotéique constitué du génome viral à ARN associé aux deux formes structurelles de la protéine codée par VHD, S-HDAg et L-HDAg, et repose sur les glycoprotéines de surface de VHB pour l’assemblage des virions, leur enveloppement et leur transmission cellulaire (Figure 1A). Ainsi, pour que VHD puisse former sa particule virale et se disséminer, VHB doit être présent dans la même cellule. Lorsque VHB est absent, VHD reste capable de se répliquer et reste plusieurs semaines dans la cellule, mais il est incapable de se disséminer (Figure 1B) [2].
| Figure 1. Le virus de l’hépatite Delta (VHD), un virus dépendant du virus de l’hépatite
B (VHB). A. Composition de la particule virale
de VHD : complexe ribonucléoprotéique (RNP) de VHD et glycoprotéines (GP) de
surface de VHB. B. Dissémination de VHD. Son
assemblage, son enveloppement et sa sortie de la cellule infectée sont
dépendants de VHB, son virus « assistant » conventionnel. |
Cependant, l’idée que VHB est l’unique virus « assistant » utilisé par VHD a récemment été remise en cause. En effet, le génome et les protéines de VHD ont été détectés dans les glandes salivaires de patients atteints du syndrome de Sjögren (une maladie auto-immune systémique), alors que ni les séquences génomiques de VHB ni des anticorps anti-VHB n’y sont détectés [4]. De plus, des études du contenu génétique d’échantillons prélevés dans la nature (études de métagénomique) ont révélé la présence de séquences similaires à celles du génome de VHD chez d’autres espèces (serpents, oiseaux, poissons, amphibiens, termites, etc.) en l’absence de séquences génomiques de VHB ou d’autres hepadnavirus apparentés [5–8]. Enfin, des travaux expérimentaux récents de notre laboratoire ont montré que VHD est capable d’utiliser les glycoprotéines de surface de virus différents de VHB pour se disséminer in vitro et in vivo [9].
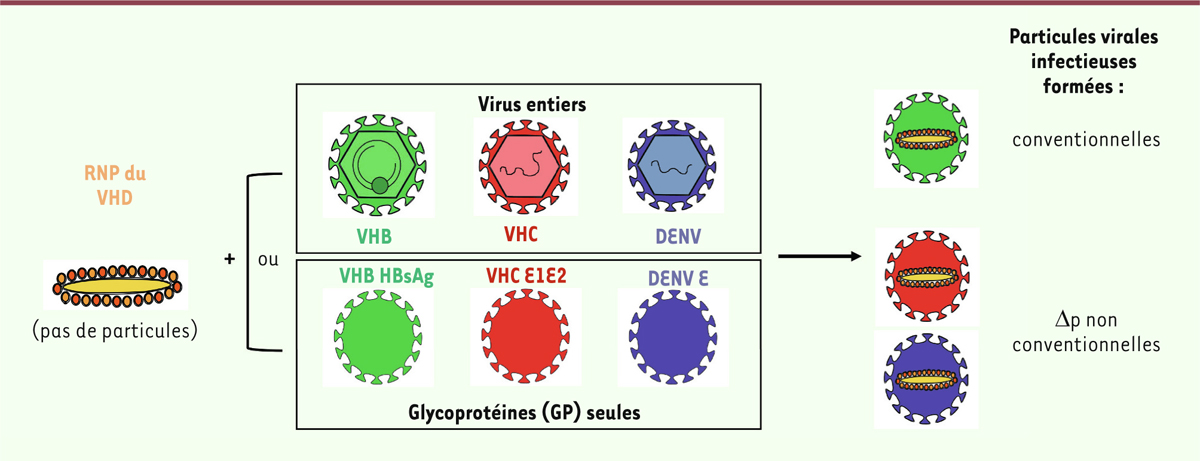
Dans des expériences de transfection, nous avons montré que des cellules coexprimant le génome réplicatif de VHD ainsi que les gènes des glycoprotéines de surface du virus de la stomatite vésiculaire (VSV) ou du virus de l’hépatite C (VHC) induisent la formation de particules virales qui sont détectées dans le milieu extracellulaire. Ces particules virales possèdent le complexe ribonucléoprotéique de VHD et les glycoprotéines de surface de VSV ou de VHC (Figure 2). Cette première expérience a ainsi démontré qu’il était possible d’induire la formation de particules virales « chimériques » de VHD (nommées ici « Δp » : VSV-Δp et VHC-Δp) avec des protéines de surface d’autres virus enveloppés que VHB. La production de ces Δp, non-conventionnelles, est surprenante puisqu’il n’avait jamais été montré auparavant que VHD pouvait utiliser d’autres glycoprotéines de surface que celles de VHB. Leur pouvoir infectieux a ensuite été vérifié en les mettant en contact avec différentes cellules, exprimant ou non les récepteurs de ces glycoprotéines de surface. Le génome de VHD ainsi que ses protéines S-HDAg et L-HDAg ont alors été détectés uniquement dans les cellules exprimant le récepteur approprié, indiquant que ces Δp sont capables d’entrer dans de nouvelles cellules, puis d’induire la réplication de VHD.
| Figure 2. Les différentes particules virales de VHD. VHD est capable de former des
particules virales avec les GP de VHB (particules conventionnelles) ou avec
les GP d’autres virus enveloppés tels que VHC, DENV, etc. (particules Dp non
conventionnelles). La présence du virus « assistant » entier, ou de ses GP
seules, dans des cellules répliquant VHD permet la formation des particules
virales de VHD. Ces particules sont infectieuses et capables d’induire la
réplication de VHD dans d’autres cellules. |
Afin de déterminer l’étendue des combinaisons possibles, nous avons exploré si des Δp pouvaient être produites avec des glycoprotéines de surface d’autres virus enveloppés, notamment celles du rétrovirus de la leucémie murine (MLV), du virus de l’immunodéficience humaine (VIH), du virus de la grippe (AIV), du virus de la chorioméningite lymphocytaire (LCMV), du métapneumovirus humain (HMPV), du virus de la Dengue (DENV), et du virus West Nile (WNV). Là encore, il s’est avéré possible de produire des Δp infectieuses avec les glycoprotéines de surface de LCMV, HMPV, DENV et WNV, mais cependant pas avec celles des autres virus susmentionnés, ce qui indique une certaine sélectivité des glycoprotéines de surface de virus enveloppés capables d’« assister » VHD.
Nous avons complété ces expériences en utilisant les virus « assistants » correspondants entiers, c’est à dire sous leurs formes réplicatives et transmissibles (Figure 2). Ainsi, à partir de cellules répliquant VHD et surinfectées par VHC ou DENV, nous avons détecté la sécrétion, dans le milieu extracellulaire, de particules virales VHC-Δp ou DENV-Δp infectieuses ainsi que des particules virales des virus assistants VHC ou DENV. Ce résultat indique que des particules virales chimériques infectieuses de VHD peuvent s’assembler dans des cellules coinfectées avec des virus réplicatifs autres que VHB, puis se disséminer et réinfecter d’autres cellules.
Enfin, nous avons cherché à savoir si les VHC-Δp étaient capables de se répliquer dans ce contexte de coinfection in vivo. Pour cela, des souris porteuses d’un foie humanisé ont été coinfectées et/ou surinfectées avec VHD et/ou VHC, et leur virémie a ensuite été suivie pendant plus de quatorze semaines. Des souris infectées seulement avec VHD conventionnel ou avec VHC ou encore coinfectées avec VHD et VHB ont été utilisées comme témoins. Étonnamment, lorsque les souris sont coinfectées avec les virus Δp et VHC, des particules virales VHD et VHC sont détectées dans leur sang pendant toute la durée de l’expérience, alors que les souris infectées par VHD seul n’ont pas de virémie persistante. Ce résultat montre que VHD est capable d’utiliser VHC comme virus assistant pour former des particules capables de se disséminer in vivo.
Nos résultats expérimentaux montrent que VHD est capable d’utiliser les glycoprotéines de surface de nombreux virus autres que VHB pour former des particules virales infectieuses qui peuvent se propager in vitro, mais aussi in vivo. Par ailleurs, la découverte récente de virus apparentés à VHD dans d’autres espèces animales ou dans l’espèce humaine en absence d’hepadnavirus associés corrobore ces résultats, et suggère que VHD appartient à un genre contenant plusieurs virus, les deltavirus, ce qui n’était pas connu. D’un point de vue évolutif, ces virus apparentés pourraient avoir entraîné la sélection de virus assistants variés pour se propager dans différentes espèces et tissus, ou pourraient eux-mêmes avoir été sélectionnés pour leur capacité à être assistés par des virus préexistants. Il est intéressant de noter que certains virus pathogènes (e.g., virus de la grippe et rétrovirus) ne semblent pas capables de propager VHD. Une explication possible implique une caractéristique commune à des virus assistants pourtant très différents comme le sont VHC, DENV, WNV, VSV et VHB : leur capacité à former des particules sous-virales, c’est-à-dire des vésicules possédant les glycoprotéines virales à leur surface mais sans nucléocapside à l’intérieur. Cette propriété partagée pourrait être l’une des raisons de l’utilisation possible de ces virus pour la dissémination de VHD. Les mécanismes d’assemblage des particules Δp non-conventionnelles restent à élucider pour valider cette hypothèse.
Ces découvertes soulèvent également des questions médicales. En effet, la co-infection par VHB et VHD entraîne une hépatite aggravée, avec une probabilité beaucoup plus forte de développer un hépatocarcinome ou des dysfonctionnements hépatiques [10]. Qu’en est-il d’éventuels effets néfastes d’une possible co-infection par VHD et d’autres virus ? Il importe donc désormais de tenter d’identifier des patients porteurs de VHD et d’un virus « assistant » autre que VHB (i.e., en l’absence, chez ces patients, des marqueurs de VHB), ce à quoi nous nous efforçons actuellement. Néanmoins, jusqu’à preuve du contraire, VHB est le virus assistant principal de VHD, tandis que d’autres virus assistants sont probablement plus rares, du moins dans l’espèce humaine, ce qui pourrait s’expliquer par des aspects de forte compatibilité entre VHD et VHB ou inversement d’incompatibilité immunitaires entre VHD et ces virus assistants. Par exemple, VHD est un fort inducteur de la production d’interféron de type I, auquel, à la différence de VHC, VHB est relativement insensible. D’autres études devront être menées pour comprendre les interactions directes ou indirectes entre VHD et les autres virus humains, mais également pour recueillir des données chez les patients afin d’anticiper la survenue de nouvelles maladies impliquant VHD, ou une aggravation possible de celles qui sont déjà connues.