| |
| Med Sci (Paris). 36(1): 77–79. doi: 10.1051/medsci/2019261.Vers un ciblage du TGF-β pour de futures
immunothérapies anti-cancéreuses plus efficaces Rayan Foughali1* and Julien C. Marie2** 1Master de cancérologie, ISPB, Université Claude Bernard Lyon
1, Lyon69008,
France 2Tumor escape resistance immunity
department, Cancer research center of Lyon,
Lyon69008,
France MeSH keywords: Animaux, Antinéoplasiques immunologiques, Humains, Immunothérapie, Thérapie moléculaire ciblée, Tumeurs, Traitements en cours d'évaluation, Facteur de croissance transformant bêta, Résultat thérapeutique, usage thérapeutique, méthodes, tendances, immunologie, thérapie |
Comprendre le rôle du système immunitaire dans le cancer : illustration par
l’effet immunosuppresseur du TGF-β Immunothérapies et cancer Le concept d’immunothérapie a été décrit pour la première fois en 1891 à la suite
des travaux du Professeur William Coley révélant que l’administration, dans la
tumeur, de streptocoques à des patients inopérables pouvait conduire à une
régression de la masse tumorale. Longtemps oublié voire critiqué, ce concept,
qui vise à utiliser le système immunitaire comme arme de défense contre les
tumeurs, a été revisité un siècle plus tard. La progression de nos connaissances
en immunologie, notamment sur l’identification des cellules effectrices clés
capables de tuer les tumeurs, que sont les lymphocytes T CD8 + et les
cellules natural killer (NK), et de leurs mécanismes
d’activation et de régulation, ont permis de développer des traitements
permettant une meilleure réponse de ces cellules effectrices contre les tumeurs.
La découverte, à la surface des lymphocytes T, de molécules fournissant un
signal répresseur de leur activation, telles que les molécules PD-1 et CTLA-4, a
conduit au développement d’anticorps neutralisant leur action. Aujourd’hui
utilisés en clinique dans le traitement de tumeurs solides, ces anticorps
connaissent un taux de succès variable. En effet, seule une fraction des
patients répond à ces traitements. Si 50 % des patients porteurs de mélanome
répondent à une combinaison anti-CTLA-4/PD-1, ce chiffre tombe à 20 % pour ceux
atteints de cancers du poumon, et à moins de 7 % pour les patientes atteintes de
cancer du sein [ 1]. Le TGF-β produit par les cellules cancéreuses et des cellules du
microenvironnement tumoral est un frein à l’action anti-tumorale du système
immunitaire Le succès en demi-teinte des immunothérapies actuelles s’explique, entre autres,
par l’existence de mécanismes d‘immunosuppression puissants, qui freinent la
réponse immunitaire anti-tumorale. Un des défis des prochaines années est donc
d’inactiver ces mécanismes, et notamment les plus immunosuppresseurs d’entre
eux. Parmi ces mécanismes, un polypeptide, le TGF-β ( transforming growth
factor b), attire l’attention des laboratoires de recherche et des
cliniciens. Les effets immunorégulateurs du TGF-β, connus depuis 1992, ainsi que
l’observation de l’activation massive du système immunitaire en absence de
TGF-β, font de cette molécule une potentielle cible thérapeutique [ 2]. Les principales
cellules cibles des effets immunosuppresseurs du TGF-β sont les lymphocytes T
[ 3, 4]. Le TGF-β réprime les lymphocytes
T effecteurs en inhibant leur prolifération, leur programme de différenciation
en cellules cytotoxiques et pro-inflammatoires, et donc leur capacité à éliminer
les cellules tumorales [ 4, 5]. Par ailleurs, le TGF-β favorise
le développement et la stabilisation des lymphocytes T régulateurs [ 6] qui répriment les
lymphocytes T effecteurs et dont la présence au sein des tumeurs est donc
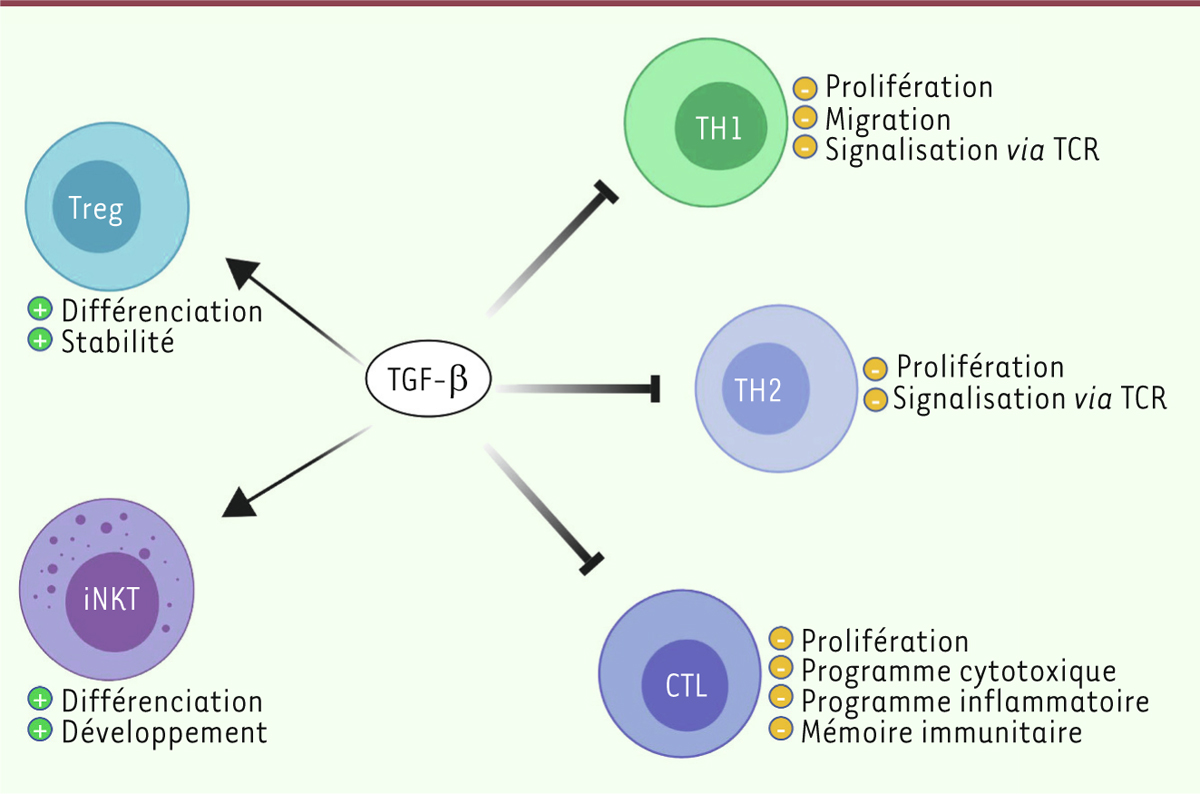
associée très souvent à un mauvais pronostic [ 7] (Figure 1).
 | Figure 1. Le TGF-β entraîne une diminution des processus
inflammatoires et une immunotolérance via
une activation de lymphocytes régulateurs tels que
les lymphocytes T régulateurs (Treg) et les
innate-like T cells (iNKT) (bien que ceux-ci puissent
avoir des effets pro-inflammatoires et anti-tumoraux) et une
inhibition de la prolifération et des fonctions effectrices
des lymphocytes T effecteurs tels que les lymphocytes
T helper 1 et 2 (TH1, TH2) et lymphocytes T
cytotoxiques CD8+ (CTL). |
Au sein de la masse tumorale, le TGF-β est produit par les cellules tumorales et
par des cellules de leur microenvironnement. Si le TGF-β produit directement par
la cellule tumorale semble être important dans la répression des lymphocytes T
effecteurs [8], les
cellules tumorales recrutent notamment des fibroblastes, appelés aussi
fibroblastes associés au cancer (cancer-associated-fibroblasts,
CAF) qui, par leur sécrétion de TGF-β, favoriseraient aussi un
microenvironnement tumoral immunosuppresseur [7]. Le TGF-β produit par les CAF contribue également à l’exclusion
des lymphocytes T hors du microenvironnement tumoral, et est donc un frein à
l’action des immunothérapies ciblant ces lymphocytes [7]. |
Cibler le TGF-β : effets potentiellement bénéfiques d’inhibiteurs L’utilisation de galunisertib chez la souris augmente l’activation des
lymphocytes T et réduit le nombre de métastases Compte tenu du puissant rôle immunosuppresseur du TGF-β sur les lymphocytes T,
plusieurs équipes de recherche ont testé des inhibiteurs de la signalisation
induite par le TGF-β, voire des neutralisateurs de ce polypeptide. Les travaux
récents de Tauriello et al. révèlent que le traitement de
souris par le galunisertib, un inhibiteur du récepteur du TGF-β, augmente
l’activation des lymphocytes T effecteurs dans la tumeur, et est suffisant pour
réduire le nombre de métastases du cancer du côlon au foie, sans toutefois
prolonger la survie des animaux [ 7]. La combinaison d’immunothérapies anti-PD1 et anti-TGF-β permet une meilleure
survie Les conclusions de deux études récentes s’accordent sur le fait que, chez l‘homme
comme chez la souris, les tumeurs avec une forte production de TGF-β sont
beaucoup moins sensibles aux immunothérapies par anticorps anti-PD-1 ou anti-
PDL-1. En effet, une analyse de tumeurs métastatiques urothéliales après une
immunothérapie anti-PDL1 montre que les patients qui ne répondent pas ou peu au
traitement présentent une forte signature génique de l’activation de la
signalisation par le TGF-β dans les lymphocytes T [ 9]. De même, chez la souris, les tumeurs
colo-rectales ou les carcinomes mammaires exprimant des taux élevés de TGF-β
sont réfractaires aux traitements anti-PD-1 ou anti-PDL-1 [ 7, 9]. Remarquablement,
l’association d’un traitement par un inhibiteur de la signalisation du TGF-β et
d’une immunothérapie anti-PD-1 augmente très nettement la survie des animaux
[ 7]. Si les auteurs de ces deux
travaux proposent que le TGF-β, par sa capacité à réprimer l’infiltrat
lymphocytaire au sein la tumeur, prévient l’action du traitement anti-PD-1 ou
anti-PDL-1, il est à noter que l’activation de lymphocytes T résultant de la
neutralisation des effets du TGF-β conduit également à une surexpression de la
molécule PD-1 à leur surface (Figure
2). Ainsi, le traitement anti-PD-1 prolongerait l’effet
activateur des inhibiteurs du TGF-β sur les lymphocytes T, assurant une réponse
immunitaire efficace à plus long terme et une meilleure survie des animaux.
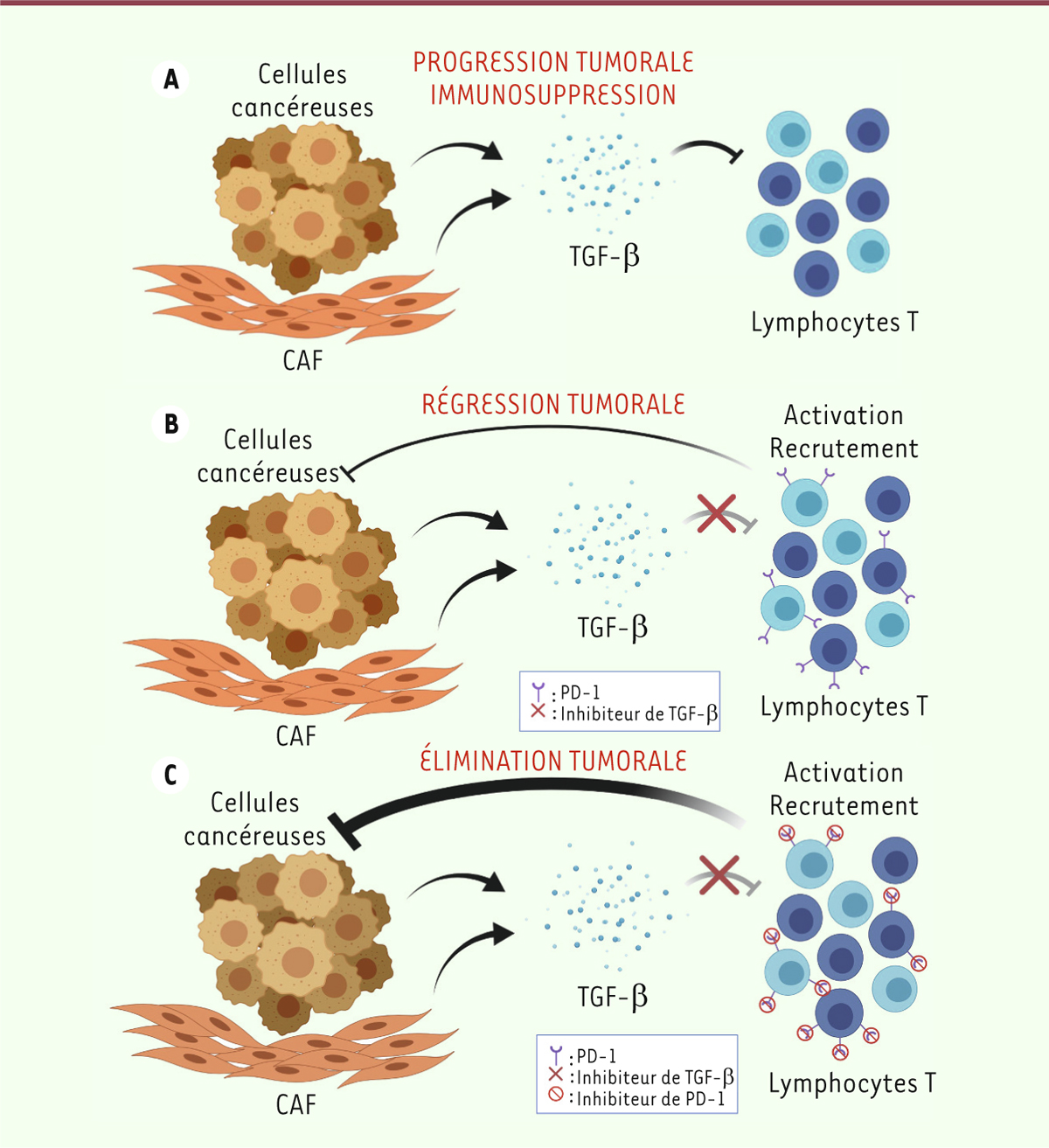
 | Figure 2. Schématisation de possibles immunothérapies contrant
l’immunosuppression induite par la production de TGF-β par la
tumeur. A. Les cellules cancéreuses
ainsi que les fibroblastes associés au cancer (CAF) sécrètent du
TGF-β en grande quantité. Sans traitement, les effets
immunosuppresseurs du TGF-β permettent à la tumeur de se développer
et de progresser. B. Avec un
inhibiteur de la signalisation du TGF-β tel que le galunisertib, la
réponse immunitaire anti-tumorale se met en place par le biais des
lymphocytes T, entraînant une régression de la masse tumorale. Les
LT activés expriment la molécule PD-1 qui, en se liant à ses ligands
PD-L1/PD-L2, réduit leur activité inflammatoire : la réponse
anti-tumorale est partielle. C. Avec
une combinaison d’inhibiteurs de TGF-β et de PD-1, l’inhibition des
lymphocytes T par PD-1 est levée, et la réponse anti-tumorale est
complète. |
Détourner les propriétés du système immunitaire n’est pas sans risque Les résultats de ces travaux suggèrent que l‘inhibition du TGF-β favorise la
réponse immunitaire anti-tumorale et augmente l‘efficacité des immunothérapies
existantes. Les essais cliniques de phase III utilisant des inhibiteurs du TGF-β
sont cependant encore en attente de résultats. De courtes expositions à ces
inhibiteurs chez l’animal ne semblent pas entraîner d’effets cytotoxiques
majeurs : une étude chez le rat montre qu’une prise de galunisertib pendant
trois mois est bien tolérée. Une exposition prolongée à des inhibiteurs de
TGF-β, cet acteur majeur de la réponse immunitaire, pourrait cependant entraîner
des effets indésirables graves d’auto-immunité ; dans cette même étude, une
exposition chronique de plus de 3 mois au galunisertib entraîne une toxicité
touchant de multiples organes [ 10]. |
Le futur du TGF-β dans la médecine personnalisée Il a été montré par Ozdemir et al. [11] que la génération de souris transgéniques
dépourvues de myofibroblastes dans l’adénocarcinome ductal pancréatique aboutit à
des tumeurs invasives et non-différenciées, ayant des propriétés hypoxiques
augmentées, un rapport lymphocytes T effecteurs / T régulateurs diminué, et une
augmentation d’expression de la protéine CTLA-4, ce qui réduit considérablement la
survie de ces animaux. Ces résultats, corroborés par une analyse chez des patients
atteints d’adénocarcinome ductal pancréatique et ne présentant que peu de
myofibroblastes dans leur tumeur, prouvent que cibler les CAF, qui sont les
principaux sécréteurs du TGF-β dans ce type de cancer, ne représente pas une cible
thérapeutique intéressante. De plus, il a été confirmé par plusieurs équipes qu’une
stratégie ciblant le TGF-β seul est peu efficace [7,9]. En revanche, l’inhibition du
TGF-β en combinaison avec d’autres thérapies pourrait représenter une stratégie
efficace contre différents types de cancers. Une médecine personnalisée s’appuyant
sur l’immunothérapie serait certes coûteuse, mais pourrait être la clé pour traiter
efficacement certaines tumeurs. Grâce notamment à l’essor de techniques de
séquençage à haut débit permettant de caractériser finement le profil moléculaire
des tumeurs, la médecine personnalisée en oncologie s’est beaucoup développée ces
dernières années. Elle est même devenue un standard de procédure dans un nombre
croissant de cancers : les altérations telles que l’amplification de ERBB2 (HER2)
dans le cancer du sein, les mutations de l’EGFR ou de KRAS/BRAF, respectivement dans
le cancer du poumon à petites-cellules et les cancers colo-rectaux, ou encore les
fusions BCR/ABL dans la leucémie myéloïde chronique, sont examinées de manière
routinière. L’analyse des signatures moléculaires de réponse des tumeurs aux immunothérapies
constitue également un défi en oncologie pour les prochaines années, pour la
recherche et pour le corps médical. Parmi ces immunothérapies, les inhibiteurs du
TGF-β pourraient jouer un rôle charnière [12]. Cependant, il faudrait que le TGF-β ait été identifié
préalablement comme un facteur clé du développement des cellules tumorales chez le
patient, car ce facteur de croissance n’est pas systématiquement impliqué dans
chaque type de cancer. Il faudrait également déduire quel traitement ou combinaison
de traitements serait le(la) plus efficace pour détruire les cellules cancéreuses,
et donc s’appuyer sur des données provenant d’une multitude d’études. Dans cette
optique, Bayin et al. ont d’ailleurs développé un modèle ex
vivo d’explant de gliome de haut grade afin de tester la réponse
patient-spécifique à une inhibition du TGF-β, ce modèle pouvant être étendu aux
combinaisons d’inhibiteurs [13]. Le ciblage du TGF-β pourrait également permettre d’affiner les
immunothérapies qui se révèlent parfois inefficaces dans certains types de cancers,
prouvant ainsi le potentiel de cette molécule dans la médecine personnalisée. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
1.
Nishino
M
Ramaiya
N
Hatabu
H
et al.
Monitoring immune-checkpoint blockade: response evaluation and
biomarker development . Nat Rev Clin Oncol.
2017; ; 14 :
:655.–658. 2.
Shull
M
Ormsby
I
Kier
A
et al.
Targeted disruption of the mouse transforming growth factor-β1
gene results in multifocal inflammatory disease .
Nature.
1992; ; 359 :
:693.–699. 3.
Li
M
Sanjabi
S
Flavell
R
Transforming growth factor-β controls development, homeostasis,
and tolerance of T cells by regulatory T cell-dependent and -independent
mechanisms . Immunity.
2006; ; 25 :
:455.–471. 4.
Marie
J
Liggitt
D
Rudensky
A
Cellular mechanisms of fatal early-onset autoimmunity in mice
with the T cell-specific targeting of transforming growth factor-β
receptor . Immunity.
2006; ; 25 :
:441.–454. 5.
Gorelik
L
Flavell
R
Immune-mediated eradication of tumors through the blockade of
transforming growth factor-β signaling in T cells .
Nat Med.
2001; ; 7 :
:1118.–1122. 6.
Sakaguchi
S
Yamaguchi
T
Nomura
T
et al.
Regulatory T cells and immune tolerance .
Cell.
2008; ; 133 :
:775.–787. 7.
Tauriello
DVF
Palomo-Ponce
S
Stork
D
et al.
TGFβ drives immune evasion in genetically reconstituted colon
cancer metastasis . Nature.
2018; ; 554 :
:538.–543. 8.
Courau
T
Nehar-Belaid
D
Florez
L
et al.
TGF-β and VEGF cooperatively control the immunotolerant tumor
environment and the efficacy of cancer immunotherapies .
JCI Insight.
2016; ; 1 : :e85974.. 9.
Mariathasan
S
Turley
SJ
Nickles
D
et al.
TGFβ attenuates tumour response to PD-L1 blockade by contributing
to exclusion of T cells . Nature.
2018; ; 554 :
:544.–548. 10.
Herbertz
S
Sawyer
JS
Stauber
AJ
et al.
Clinical development of galunisertib (LY2157299 monohydrate), a
small molecule inhibitor of transforming growth factor-beta signaling
pathway . Drug Des Dev Ther.
2015; ; 9 :
:4479.–4499. 11.
Özdemir
BC
Pentcheva-Hoang
T
Carstens
JL
et al.
Depletion of carcinoma-associated fibroblasts and fibrosis
induces immunosuppression and accelerates pancreas cancer with reduced
survival . Cancer Cell.
2014; ; 25 :
:719.–734. 12.
Dahmani
A
Delisle
J
TGF-β in T cell biology: implications for cancer
immunotherapy . Cancers.
2018; ; 10 : (6)
:194.. 13.
Bayin
N
Ma
L
Thomas
C
et al.
Patient-specific screening using high-grade glioma explants to
determine potential radiosensitization by a TGF-β small molecule
inhibitor . Neoplasia.
2016; ; 18 :
:795.–805. |