| |
| Med Sci (Paris). 36(1): 80–82. doi: 10.1051/medsci/2019262.Granulocytes neutrophiles et cancer Découverte d’un nouveau mécanisme de cytotoxicité cellulaire
et perspectives thérapeutiques Camille Victoor1* and Bertrand Dubois2** 1Master 1 cancer, module d’immunologie-virologie, université
de Lyon, université Claude Bernard Lyon 1, Lyon,
France 2Inserm 1052, CNRS 5286, centre Léon Bérard, centre de
recherche en cancérologie de Lyon, 28 rue Laennec, 69373Lyon cedex 08,
France MeSH keywords: Animaux, Antinéoplasiques immunologiques, Cytophagocytose, Humains, Immunité cellulaire, Immunothérapie adoptive, Tumeurs, Infiltration par les neutrophiles, Granulocytes neutrophiles, Traitements en cours d'évaluation, pharmacologie, usage thérapeutique, effets des médicaments et substances chimiques, physiologie, méthodes, tendances, immunologie, thérapie, transplantation |
Les cancers font partie des causes principales de mortalité. Des progrès scientifiques
ont permis de développer de nouvelles thérapies efficaces permettant une meilleure prise
en charge de ces maladies, notamment avec l’avènement de l’immunothérapie, qui vise à
utiliser notre propre système immunitaire afin d’induire/restaurer une réponse
antitumorale efficace et durable. Si les thérapies actuelles ciblent principalement les
lymphocytes T, il est vraisemblable que la modulation des cellules immunitaires innées
pourrait aussi entraîner un bénéfice thérapeutique. Parmi ces cellules, on trouve les
granulocytes neutrophiles, dont le rôle est clairement établi dans la lutte contre les
microorganismes pathogènes, mais reste controversé dans les cancers. |
Le rôle des granulocytes neutrophiles dans le cancer Ces cellules peuvent exercer des actions pro-tumorales ou anti-tumorales en fonction
du type de cancer et de son stade de développement [1]. Les actions anti-tumorales reposent
principalement sur leur capacité à tuer les cellules cancéreuses recouvertes
d’anticorps ciblant un antigène membranaire par un mécanisme de cytotoxicité
cellulaire (antibody-dependent cellular cytotoxicity, ou
ADCC) [1]. Cela a été mis
en évidence à la fois in vitro et in vivo à l’aide
de modèles impliquant entre autres le rituximab, un anticorps monoclonal
thérapeutique ciblant la molécule CD20 et utilisé pour le traitement des lymphomes B
[2]. L’ADCC repose sur l’engagement et l’activation de différents récepteurs de la région
constante (Fc) des immunoglobulines (Ig) sur les cellules à potentiel cytotoxique
que sont les cellules NK (natural killer), les macrophages, et les
granulocytes neutrophiles. Ces derniers ont cependant une efficacité d’ADCC
supérieure à celles des autres cellules et expriment à la fois des récepteurs pour
les IgG (RFcg) et les IgA (RFca). Si les IgA présentent une efficacité supérieure à
celle des IgG pour induire l’ADCC via les neutrophiles, elles ont
l’inconvénient d’avoir un temps de demi-vie très court. Des immunoglobulines
hybrides IgGA, développées par ingénierie moléculaire et combinant à la fois
l’efficacité des IgA pour l’ADCC dépendante des neutrophiles et la meilleure
stabilité des IgG, ont montré leur efficacité in vivo dans des
modèles précliniques tumoraux [3], et pourraient donc être utilisées pour de nouvelles thérapies. S’il est établi que la cytotoxicité via les cellules NK se fait par
l’intermédiaire de la libération de granules lytiques, et que celle
via les macrophages fait intervenir la phagocytose, le
mécanisme d’action cytotoxique des neutrophiles sur les cellules tumorales vient
d’être découvert et implique un mécanisme différent [4]. |
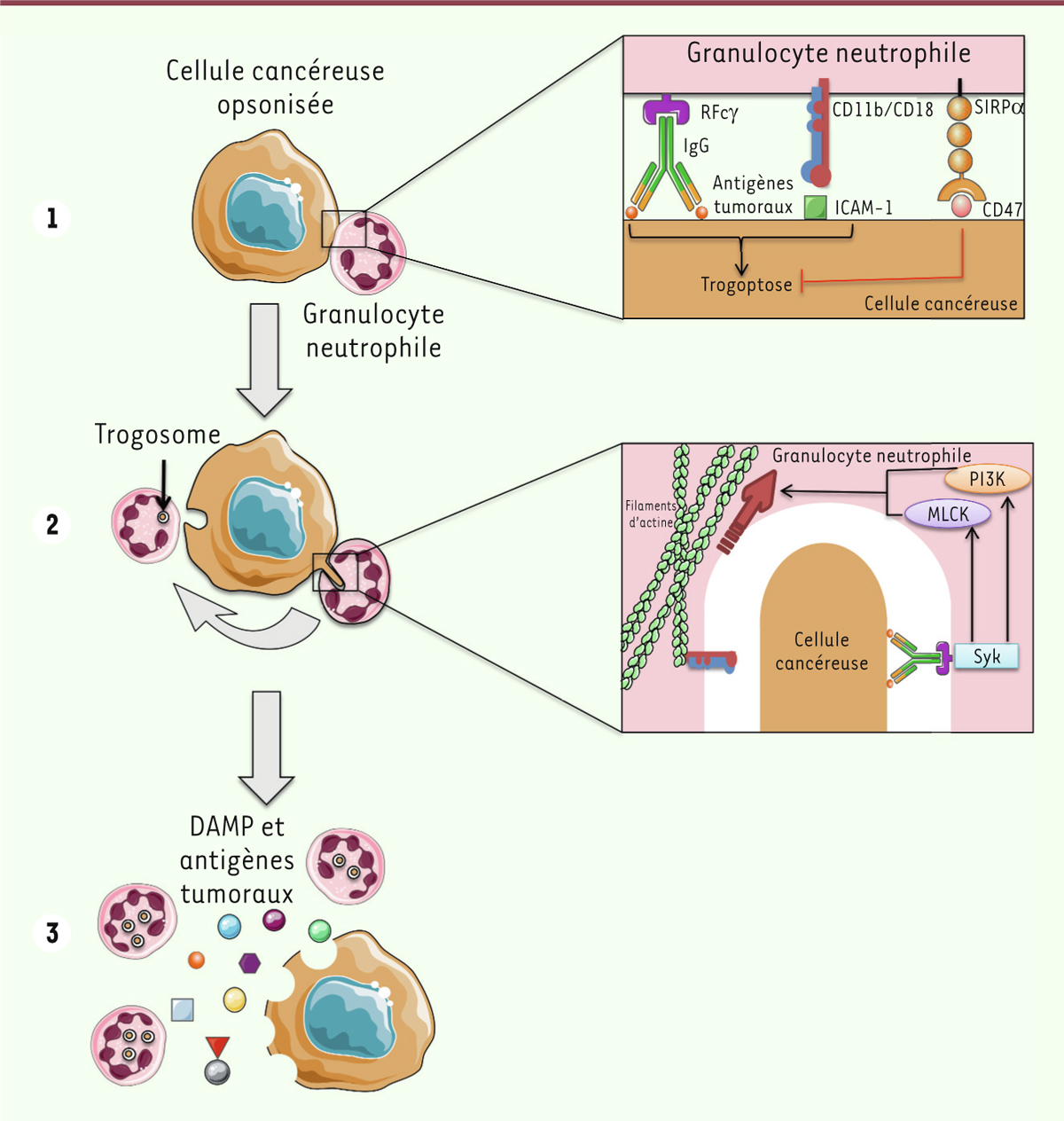
La cytotoxicité induite par les granulocytes neutrophiles implique un mécanisme
original : la trogoptose En utilisant un modèle ex vivo impliquant des polymorphonucléaires
(granulocytes) isolés de donneurs sains et de patients atteints de leucémie
lymphoïde chronique, Valgardsdottir et al. ont montré que les
granulocytes neutrophiles n’ont pas la capacité de phagocytose [5]. Par ailleurs, en utilisant des
neutrophiles de patients porteurs de mutations empêchant la dégranulation ou la
production de dérivés réactifs de l’oxygène par ces cellules, Matlung et
al. ont également montré que la capacité des neutrophiles à tuer des
cellules cancéreuses ne dépend pas non plus du relargage de granules lytiques ou de
la production de dérivés réactifs de l’oxygène et n‘implique pas un mécanisme
apoptotique [4] . La trogoptose, qu’est-ce que c’est ? La cytotoxicité induite par les neutrophiles implique un processus original
consistant en un transfert actif de matériel membranaire et cytoplasmique d’une
cellule donneuse (ici, la cellule cancéreuse opsonisée par des anticorps) vers
une cellule receveuse (ici, le granulocyte neutrophile) [ 6]. Étant donné que cette cytotoxicité est
due aux anticorps, on peut considérer qu’il s’agit d’une forme d’ADCC. Cette
ADCC particulière, restreinte aux neutrophiles, a été baptisée trogoptose, en
référence à la trogocytose, un processus d’échange de fragments de membranes
entre deux cellules. En premier lieu, l’engagement des RFcg des neutrophiles par
des anticorps opsonisant la cellule cancéreuse entraîne la formation d’une
synapse immunologique renforcée par l’interaction entre les intégrines
CD11b/CD18 et leur ligand ICAM-1 exprimé par la cellule cancéreuse. Cette
synapse déclenche, en aval des RFcg, une cascade de signalisation impliquant la
kinase Syk, la PI3K (phopshoinositol-3 kinase) et la MLCK
( myosin light-chain kinase), conduisant à un réarrangement
du cytosquelette et l’exercice d’une force suffisante pour arracher des
fragments de la membrane des cellules cancéreuses. Ces fragments sont ensuite
internalisés sous la forme d’un trogosome et détruits par les neutrophiles
(Figure 1).
 | Figure 1. Schéma récapitulatif des différentes étapes de la trogoptose.
1. Formation d’un conjugué
entre un granulocyte neutrophile et la cellule cancéreuse opsonisée
par des anticorps IgG. Ce processus implique l’intégrine CD11b/CD18,
et est inhibé par l’engagement de CD47 par SIRPa.
2. L’engagement sur le
neutrophile du RFcg par les IgG conduit à une cascade de
signalisation impliquant Syk, ainsi qu’à la contraction du réseau de
filaments d’actine entraînant l’arrachement de fragments de la
cellule cancéreuse et leur internalisation par le granulocyte
neutrophile sous la forme d’un trogosome.
3. L’accumulation de défauts
membranaires conduit à la mort lytique de la cellule cancéreuse et à
la libération d’antigènes tumoraux et d’alarmines susceptibles
d’induire une réponse immunitaire. |
Une « morsure » unique de la cellule cancéreuse n’est pas suffisante pour induire
la mort de cette dernière. La théorie actuelle est que l’augmentation de la
proportion d’évènements trogocytiques sur une même cellule entraîne une
accumulation de défauts au niveau de sa membrane, ce qui entraîne une mort par
nécroptose [4]. Cette mort lytique
s’accompagne de la libération d’antigènes tumoraux et de signaux de danger DAMP
(damage-associated molecular patterns) susceptibles
d’augmenter le recrutement des neutrophiles, d’activer les cellules
présentatrices d’antigènes, et d’induire des lymphocytes T effecteurs, et donc
une réponse anti-tumorale plus efficace [1] (Figure 1). La trogoptose existe-t-elle chez l’homme ? L’étude, par immunohistochimie et cytométrie en flux, de biopsies de patientes
atteintes d’un cancer du sein « HER2/neu positif » ayant répondu à une thérapie
néo-adjuvante par injection de trastuzumab (anticorps anti-HER2) a montré une
importante infiltration tumorale par des granulocytes neutrophiles, souvent au
contact des cellules tumorales et contenant, pour certains, des fragments de
membranes incluant des molécules HER2 [ 4].
Ces données suggèrent donc que les neutrophiles joueraient bien un rôle
anti-tumoral clé lors de l’injection d’anticorps thérapeutiques ciblant un
antigène tumoral, et que ce rôle implique un processus de trogoptose. |
Comment exploiter l’ADCC des granulocytes neutrophiles en thérapie ? Le rôle des neutrophiles en tant qu’effecteurs de l’ADCC reste à déterminer chez les
patients au cours de la progression tumorale, mais il est désormais établi que ces
cellules jouent un rôle clé dans les thérapies utilisant des anticorps ciblant des
antigènes tumoraux pour induire la mort des cellules tumorales [1]. Il est cependant important de noter qu’un
effet clinique optimal de ces anticorps nécessite souvent d’y associer une
chimiothérapie, source d’effets secondaires notables et d’une neutropénie [1]. Le potentiel thérapeutique des neutrophiles
pourrait donc être fortement limité par la chimiothérapie constituant le traitement
standard pour de nombreux cancers. Le ciblage des neutrophiles et l’optimisation de
leurs fonctions cytotoxiques dans la cadre d’immunothérapies apparaît comme une
piste d’avenir pour développer des traitements plus efficaces, qui permettraient
peut-être d’éviter la chimiothérapie et ses effets secondaires indésirables. Plusieurs pistes sont envisageables pour augmenter l’ADCC dépendante des
neutrophiles, telles qu’une augmentation du nombre total de neutrophiles circulants
en utilisant du G-CSF (granulocyte colony-stimulating factor), ou
encore une stimulation de l’expression des RFcg en combinant G-CSF et interféron-g
[1]. Il serait également intéressant
d’étudier le potentiel des IgA et des RFca pour induire la trogoptose, ce qui
permettrait alors d’utiliser des IgGA hybrides. De plus, l’interaction entre CD47, à la surface des cellules tumorales et SIRPα, sur
les granulocytes neutrophiles, pouvant avoir un effet inhibiteur sur le mécanisme de
la trogoptose, l’inhibition de cette interaction est une stratégie possible pour
potentialiser l’activité cytotoxique des neutrophiles (Figure 1). En effet, plusieurs études ont montré
que l’inhibition de l’interaction entre CD47 et SIRPa exprimé sur les cellules
myéloïdes optimise l’ADCC par ces dernières, à la fois in vivo et
in vitro [1] :
l’utilisation chez la souris de SSL6, une protéine dérivée de Staphylococcus
aureus connue pour bloquer l’interaction CD47/SIRPa [7], entraîne une importante diminution
des métastases hépatiques dans un modèle murin de mélanome. La déplétion de ces
souris en granulocytes neutrophiles conduit à une ré-augmentation du nombre des
métastases [4], indiquant que les neutrophiles
sont des cibles de choix pour de nouvelles thérapies, et que bloquer l’interaction
CD47/SIRPa pourrait contribuer à augmenter leur efficacité. |
Même s’il reste de nombreux aspects du processus de trogoptose à éclaircir,
l’identification récente de ce mécanisme dans l’action cytotoxique anti-tumorale des
granulocytes neutrophiles laisse entrevoir de réelles perspectives thérapeutiques
pour l’optimisation de l’efficacité des traitements actuels impliquant l’injection
d’anticorps monoclonaux ciblant les cellules tumorales, voire, à terme, pour
favoriser une action cytotoxique des anticorps produits de manière endogène chez les
patients atteints de cancer. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
1.
Treffers
LW,
Hiemstra
IH,
Kuijpers
TW, et al.
Neutrophils in cancer . Immunol
Rev.
2016;; 273 :
:312.–328. 2.
Hernandez-Ilizaliturri
FJ,
Jupudy
V,
Ostberg
J, et al.
Neutrophils contribute to the biological antitumor activity of
rituximab in a non-Hodgkin’s lymphoma severe combined immunodeficiency mouse
model . Clin Cancer Res.
2003;; 9 :
:5866.–73. 3.
Li
B
Xu
L
Tao
F
et al.
Simultaneous exposure to FcγR and FcαR on monocytes and
macrophages enhances antitumor activity in vivo .
Oncotarget.
2017; ; 8 :
:39356.–39366. 4.
Matlung
HL,
Babes
L,
Zhao
XW, et al.
Neutrophils kill antibody-opsonized cancer cells by
trogoptosis . Cell Reports.
2018;; 23 :
:3946.–59.e6. 5.
Valgardsdottir
R,
Cattaneo
I,
Klein
C, et al.,
Human neutrophils mediate trogocytosis rather than
phagocytosis of CLL B cells opsonized with anti-CD20
antibodies . Blood.
2017;; 129 :
:2636.–44. 6.
Joly
E,
Hudrisier
D. What is
trogocytosis and what is its purpose?
Nat Immunol.
2003;; 4 : :815.. 7.
Fevre
C,
Bestebroer
J,
Mebius
MM, et al.
Staphylococcus aureus proteins SSL6 and SElX interact with
neutrophil receptors as identified using secretome phage
display . Cell Microbiol.
2014;; 16 :
:1646.–65. |