| |
| Med Sci (Paris). 36(1): 83–86. doi: 10.1051/medsci/2019263.Des néo-antigènes non mutés, les TEIPP, comme nouvelles
cibles des immunothérapies du cancer Adrien Vouilloz1* and Laurent Serre2** 1Master 1 cancer, module d’immunologie-virologie, université
de Lyon, université Claude Bernard Lyon 1, Lyon,
France 2UMR Inserm 1052, CNRS 5286, centre Léon Bérard, centre de
recherche en cancérologie de Lyon, 28 rue Laennec69373Lyon cedex 08,
France MeSH keywords: Animaux, Présentation d'antigène, Antigènes néoplasiques, Déterminants antigéniques des lymphocytes T, Humains, Immunothérapie, Tumeurs, Fragments peptidiques, Traitements en cours d'évaluation, physiologie, composition chimique, immunologie, méthodes, tendances, thérapie |
Le cancer est aujourd’hui un des principaux enjeux de santé publique. Le développement de
traitements capables de guérir et de protéger durablement les patients est une priorité.
Actuellement, les principaux traitements sont la chimiothérapie, la radiothérapie, et
l’exérèse chirurgicale. Cependant, bien qu’en constant perfectionnement, ces thérapies
restent insuffisantes. De nombreux patients ne répondent pas au traitement ou rechutent
après une période de rémission. Parmi les nouvelles thérapies prometteuses, les
immunothérapies consistent à aider artificiellement le système immunitaire à combattre
la tumeur. Au cours de leur développement, les tumeurs mettent en place des mécanismes
d’inhibition de la réponse immunitaire. Certaines immunothérapies font intervenir des anticorps, qui bloquent ces signaux
inhibiteurs1. Ces thérapies sont très
efficaces, mais seulement chez un quart des patients traités, et l’activation
généralisée du système immunitaire des patients peut induire des effets secondaires
importants. Ainsi, d’importants efforts sont entrepris pour développer de nouvelles stratégies
d’immunothérapies spécifiques de la réponse immunitaire anti-cancéreuse. Cet objectif
peut être atteint grâce aux stratégies de vaccination ciblant des marqueurs spécifiques
des tumeurs, les néoantigènes (néoAg) [1–3]. |
Réponse immunitaire et notion d’antigène dans le contexte tumoral Le système immunitaire est constitué de plusieurs populations de cellules ayant
chacune des fonctions précises. Les cellules dendritiques (dendritic
cells, DC) sont chargées d’identifier les signaux de danger et de
déclencher une réponse immunitaire spécifique [4]. Les lymphocytes T (LT) sont des cellules
effectrices qui sont activées par les DC. Pour cela, les DC capturent des fragments
de cellules tumorales et en extraient des molécules appelées antigènes. Un antigène
est une molécule reconnue par le système immunitaire lors d’une réponse immunitaire,
et qui est capable de déclencher cette réponse immunitaire. Ces antigènes dits «
tumoraux » (AgT) sont ensuite dégradés en peptides, puis associés aux molécules du
complexe majeur d’histocompatibilité de classe I et II (CMH I et CMH II), qui sont
reconnus respectivement par les lymphocytes T CD8+ (LT8) et
CD4+(LT4). Suite à leur activation, les LT8 acquièrent des capacités
cytotoxiques et migrent dans la tumeur. Les cellules tumorales exprimant à leur
surface les mêmes complexes peptide-CMH I sont reconnues et éliminées par les LT8
spécifiques. De leur côté, les LT4 acquièrent des capacités de contrôle et
d’orientation de la réponse immunitaire. Ils peuvent ainsi amplifier la réponse des
autres cellules immunitaires ou à l’inverse, les inhiber en acquérant des fonctions
dites régulatrices. Les antigènes dits du « soi » sont produits par les cellules de l’organisme et sont
codés dans le génome de l’individu. à l’inverse, les antigènes du « non-soi » sont
reconnus par le système immunitaire qui va tenter de les éliminer. Au cours du
développement des LT dans le thymus, des mécanismes de sélection « positive » ou «
négative » permettent d’éliminer un maximum de LT spécifiques des antigènes du soi
afin de limiter le développement de maladies auto-immunes, tout en préservant les LT
spécifiques du non-soi. Les AgT peuvent être divisés en plusieurs catégories. Certains gènes codant des
protéines spécifiques du tissu d’origine de la tumeur, comme la protéine PMEL des
mélanocytes dans le mélanome, peuvent voir leur expression augmenter fortement dans
les tumeurs, ce qui peut induire une rupture de la tolérance au soi et une réponse
immunitaire contre ces antigènes. Les tumeurs peuvent également exprimer des gènes
qui ne sont normalement pas exprimés dans leur tissu d’origine ou qui ne sont
exprimés que lors du développement embryonnaire. La protéine NY-ESO-1, par exemple,
qui est exprimée durant le développement embryonnaire, dont l’expression est ensuite
restreinte au placenta lors de la grossesse et dans les cellules germinales à l’âge
adulte, est ré-exprimée par les cellules tumorales dans un très grand nombre de
cancers (neuroblastome, myélome, mélanome, sarcome, cancer de la vessie, cancer du
poumon, etc.) [1–5]. Dans le cas particulier des cancers
d’origine virale (papillomavirus, virus de l’hépatite C, etc.), des Ag T peuvent
dériver de protéines virales et être reconnus par les LT8, qui élimineront les
cellules infectées par le virus. Enfin, les néoAg dérivent de gènes mutés produisant
des protéines modifiées qui seront considérées par le système immunitaire comme
étant du soi. Récemment, les travaux de l’équipe de Thorbald van Hall ont permis
d’identifier une nouvelle catégorie de néoAg dérivant de gènes non mutés et dont
l’expression n’est pas nécessairement anormale, mais pour lesquels la présentation
par les molécules du CMH est dépendante de conditions très spécifiques [6]. |
Les TEIPP, origine et expression chez l’homme La présentation des Ag par les molécules du CMH I fait intervenir un ensemble de
mécanismes. Les peptides produits dans le cytoplasme par dégradation enzymatique
passent dans le réticulum endoplasmique (RE) grâce au complexe de protéines TAP
(transporter associated with antigen processing) [4–6]. Les
peptides peuvent alors subir une autre étape de dégradation enzymatique avant d’être
associés aux molécules du CMH I et exportés vers la surface de la cellule. Ce
processus de présentation est présent aussi bien dans les cellules immunitaires que
dans les tumeurs. Étant donné l’importance du complexe TAP dans le processus de
présentation d’antigène, de nombreuses tumeurs acquièrent une déficience en TAP pour
échapper au système immunitaire. Cette déficience entraîne une importante diminution
de l’expression en surface des molécules de CMH I permettant l’échappement de la
cellule tumorale à la surveillance du système immunitaire. Les travaux de l’équipe de Thorbald van Hall ont montré que, dans les cellules
déficientes pour le complexe TAP, les rares molécules de CMH I en surface de la
cellule pouvaient présenter un répertoire de peptides inédits et variés [6], alors que ces peptides ne sont pas présentés
dans une cellule exprimant normalement le complexe TAP. Ces peptides ont été nommés
TEIPP (T-cell epitopes associated with impaired peptide
processing). Les TEIPP sont produits à partir de diverses protéines,
non-mutées, associées à la membrane du RE, et dont un fragment est libéré dans la
lumière du RE suite à des processus de maturation comme le clivage d’une séquence
signal (Figure 1). Les TEIPP
identifiés dans cette étude proviennent de protéines apparemment sans point commun
(LRPAP1, SEP15, IL-12, IFI30, etc.). Les auteurs supposent que, dans des conditions
normales, les TEIPP ne sont produits qu’en très faibles quantités et se retrouvent
en proportion négligeable par rapport aux peptides fournis par l’activité du
complexe TAP. Ainsi, il n’y a que dans un contexte de déficience pour ce complexe
protéique, lorsqu’il n’y a que les TEIPP disponibles, que ces peptides peuvent être
associés aux molécules de CMH I et présentés à la surface des cellules. Étant donné
leur rareté, ces TEIPP ne sont potentiellement pas ou que peu présentés dans le
thymus. Ainsi, la tolérance immunitaire vis-à-vis de ces TEIPP est faible. Les
travaux de van Hall ont montré que, chez la souris, des LT8 spécifiques de TEIPP
pouvaient ralentir la croissance d’une tumeur déficiente en TAP. Plus récemment, la
même équipe a identifié 16 TEIPP à partir de données de protéome humain dérivées de
gènes de ménage [7]. Les
auteurs ont détecté une population de LT8 spécifique de chacun de ces 16 TEIPP à
partir du sang de donneurs sains. Les LT8 spécifiques de ces TEIPP sont
principalement dans un état naïf indiquant que ces TEIPP ne sont pas ou rarement
présentés chez les individus sains. Les auteurs se sont particulièrement intéressés
à la protéine ubiquitaire LRPAP1, une protéine chaperonne pour les protéines liées
aux récepteurs LDL. LRPAP1 est exprimée dans de nombreux types de cancer. à l’aide
de clones LT8 spécifiques de LRPAP1, ils ont confirmé que ceux-ci ne sont activés
que par des cellules déficientes en TAP, et que le blocage du CMH I sur les cellules
cibles empêche l’activation de ces LT8. LRPAP1 est exprimée dans différents tissus
de l’organisme, mais les cellules provenant de ces tissus n’activent pas les LT8
spécifiques de LRPAP1. Ces données suggèrent donc que LRPAP1 produit un TEIPP qui
n’est présenté en association avec le CMH I que par les cellules déficientes en
TAP.
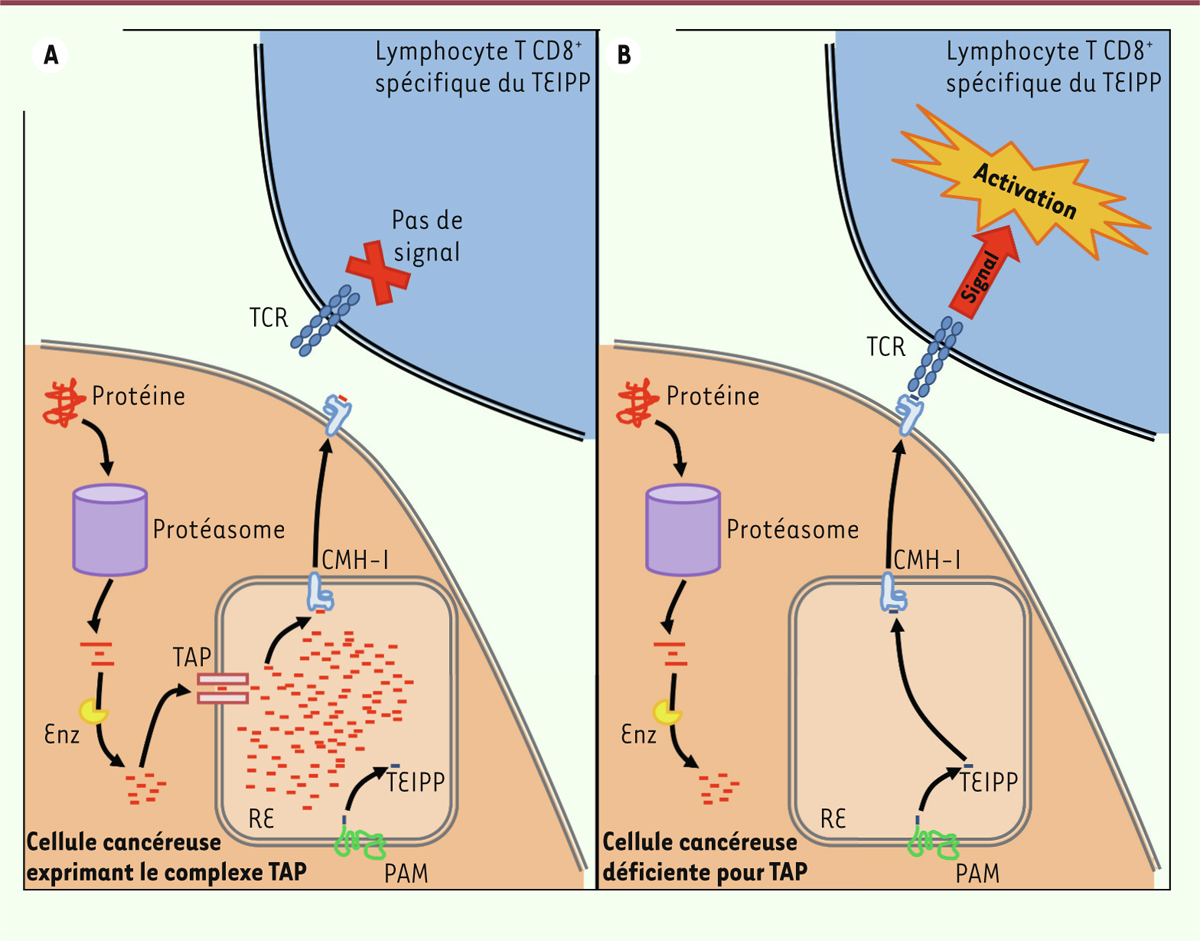
 | Figure 1. Représentation schématique de la voie de présentation des antigènes par
le CMH de classe I et de l’effet de la déficience en TAP dans une
cellule cancéreuse. A. Les protéines sont
dégradées par le protéasome et un ensemble de protéases (Enz) en
peptides, qui passent dans le réticulum endoplasmique (RE) en grande
quantité. Les peptides ainsi apportés sont chargés sur les molécules du
CMH I, puis exportés à la surface de la cellule cancéreuse. Les
lymphocytes T CD8+ spécifiques des TEIPP ne sont pas capables
de reconnaitre ces peptides via leur récepteur (TCR) et
ne sont donc pas activés. B. Dans les
cellules cancéreuses déficientes pour TAP, les peptides produits par le
protéasome et les protéases ne peuvent pas passer dans le RE. Les
protéines associées à la membrane du RE (PAM) libèrent des peptides
(TEIPP) dans la lumière du RE, peptides qui sont chargés sur les
molécules du CMH I et exportés à la surface de la cellule. Les
lymphocytes T CD8+ spécifiques des TEIPP reconnaissent leur
cible et s’activent en réponse au signal perçu. |
|
Potentiel thérapeutique et investigations futures La présence de LT spécifiques de TEIPP chez les donneurs sains suggère que ces TEIPP
ne sont pas ou que peu présentés lors de la sélection négative des LT dans le thymus
au cours du développement. Toutefois, les auteurs ont montré que les protéines à
l’origine des TEIPP étaient bien exprimées dans le thymus. Dans une étude
précédente, la même équipe avait montré, dans un modèle de souris déficientes en
TAP, que les LT spécifiques de TEIPP sont éliminés par sélection négative dans le
thymus [6]. Ces résultats renforcent
l’hypothèse selon laquelle l’absence de présentation des TEIPP dans les cellules
exprimant TAP est due à l’apport massif de peptides dans le RE par l’activité du
complexe TAP. La majorité des LT spécifiques de TEIPP identifiés dans cette étude
proviennent du répertoire naïf des donneurs, et n’ont donc pas rencontré leur Ag. De
plus, les donneurs ayant des LT spécifiques de TEIPP dans leur répertoire effecteur
ne présentent pas de signe d’auto-immunité. Ensemble, ces résultats suggèrent que
les cellules saines ayant une activité normale du complexe TAP ne sont pas reconnues
par les LT spécifiques de TEIPP. Chez les patients porteurs de tumeurs déficientes en TAP, la réaction immunitaire
spécifique de TEIPP est soit indétectable, soit inefficace pour éliminer la tumeur.
Les mécanismes immunosuppresseurs associés à une faible expression des TEIPP dans
les tumeurs pourraient empêcher l’activation de la réponse du système immunitaire
ciblant les TEIPP. Pour potentialiser cette réponse anti-tumorale, le groupe de Van
Hall propose d’utiliser les mêmes stratégies que celles déjà à l’étude pour les
néoAg provenant de protéines mutées. Ainsi, les auteurs proposent soit de mettre en
place une stratégie vaccinale chez le patient, soit d’extraire et d’amplifier les LT
spécifiques de TEIPP in vitro avant de les réinjecter au patient.
Dans une précédente publication, les auteurs ont déjà apporté la « preuve de concept
» de ces stratégies dans des modèles animaux [6], mais de nouvelles études seront nécessaires pour évaluer la sécurité
et l’efficacité de ces stratégies chez les patients. La déficience en TAP a été identifiée dans de nombreux cancers incluant des
carcinomes de nombreux organes, le mélanome, des cancers du système nerveux et du
système hématopoïétique [8].
Dans le cas du mélanome, environ 2 % des tumeurs présentent une mutation délétère
d’au moins un des gènes codant les protéines du complexe TAP. Beaucoup de tumeurs
présentent également une diminution de l’activité de ce complexe due à la répression
de l’expression de ces gènes par un mécanisme épigénétique. Ainsi, une stratégie
vaccinale fondée sur les TEIPP pourrait être utilisée chez de nombreux patients, y
compris ceux ne présentant pas de mutation dans ces gènes, mais chez lesquels leur
expression est réduite par d’autres mécanismes. Il faut noter que les auteurs ont restreint leur analyse des TEIPP à un allèle
particulier du CMH I, HLA-A*02:01 [7]. Bien
que cet allèle soit particulièrement fréquent dans la population, il existe de
nombreux autres allèles du gène HLA-A qui peuvent eux aussi être à l’origine d’une
spécificité de liaison des peptides correspondants. Par ailleurs, deux autres gènes
du CMH I, HLA-B et HLA-C, possèdent eux aussi un grand nombre d’allèles. De
nouvelles études sont donc nécessaires pour identifier les TEIPP associés à ces
allèles de CMH I afin de proposer une stratégie personnalisée de traitement pour
chaque patient en fonction de son haplotype. Les données de la littérature indiquent que lorsque les conditions favorables sont
réunies, le système immunitaire est le meilleur « prédateur » de la tumeur. Dans
cette optique, de nombreux essais cliniques en cours portant sur les
immunothérapies, seules ou en combinaison avec d’autres molécules, évaluent
l’efficacité de ces stratégies afin de mieux combattre les cancers. Au cours des
dernières années, d’importants efforts ont été faits pour la mise au point de
vaccins thérapeutiques à base de néoAg, notamment dans le mélanome, avec des
résultats encourageants [9–10].
L’utilisation des TEIPP pourrait venir en complément des néoAg identifiés chez le
patient afin de fournir un spectre plus large de réponses immunitaires, et ainsi
augmenter l’efficacité de ces stratégies. De plus, la vaccination par TEIPP, en
activant la réponse immunitaire spécifique, pourrait venir en complément de
l’utilisation des immunothérapies par anticorps bloquants, créant ainsi une synergie
entre les deux traitements. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Footnotes |
1.
Schumacher
TN
Schreiber
RD
Neoantigens in cancer immunotherapy .
Science.
2015; ; 348 :
:69.–74. 2.
Aldous
AR
Dong
JZ
Personalized neoantigen vaccines: a new approach to cancer
immunotherapy . Bio Med Chem.
2018; ; 26 :
:2842.–2849. 3.
Cohen
CJ
Gartner
JJ
Horovitz-Fried
M
et al.
Isolation of neoantigen-specific T cells from tumor and
peripheral lymphocytes . J Clin Invest.
2015; ; 125 :
:3981.–3991. 4.
Neefjes
J
Jongsma
MLM
Paul
P
et al.
Towards a systems understanding of MHC class I and MHC class II
antigen presentation . Nat Rev Imm.
2011; ; 11 :
:823.–836. 5.
Gros
A
Parkhurst
MR
Tran
E
et al.
Prospective identification of neoantigen-specific lymphocytes in
the peripheral blood of melanoma patients . Nat
Med.
2016; ; 22 :
:433.–438. 6.
Doorduijn
EM
Sluijter
M
Querido
BJ
et al.
TAP-independent self-peptides enhance T cell recognition of
immune-escaped tumors . J Clin Invest.
2016; ; 126 :
:784.–794. 7.
Marijt
KA
Blijleven
L
Verdegaal
EME
et al.
Identification of non-mutated neoantigens presented by
TAP-deficient tumors . J Exp Med.
2018; ; 215 :
:2325.–2337. 8.
Leone
P
Shin
EC
Perosa
F
et al.
MHC class I antigen processing and presenting machinery:
organization, function, and defects in tumor cells .
J Natl Cancer Inst.
2013; ; 105 :
:1172.–1187. 9.
Ott
PA
Hu
Z
Keskin
DB
et al.
An immunogenic personal neoantigen vaccine for patients with
melanoma . Nature.
2017; ; 547 :
:217.–221. 10.
Sahin
U
Derhovanessian
E
Miller
M
et al.
Personalized RNA mutanome vaccines mobilize poly-specific
therapeutic immunity against cancer . Nature.
2017; ; 547 :
:222.–226. |