| |
| Med Sci (Paris). 36(2): 106–108. doi: 10.1051/medsci/2020004.Un mécanisme inédit de détournement viro-induit de p53
dans le contexte de l’infection par les virus influenza Julia Dubois,1 Manuel Rosa-Calatrava,1 and Olivier Terrier1* 1Centre international de recherche en infectiologie (équipe
VirPath), Univ Lyon, Inserm U1111, Université Claude Bernard Lyon 1, CNRS
UMR5308, École normale supérieure de Lyon, F-69007Lyon,
France MeSH keywords: Animaux, Interactions hôte-pathogène, Humains, Grippe humaine, Orthomyxoviridae, Infections à Orthomyxoviridae, Liaison aux protéines, Protéine p53 suppresseur de tumeur, Protéines virales non structurales, physiologie, métabolisme, virologie, pathogénicité |
Rôle central joué par la protéine virale NS1 dans l’infection par les virus
influenza L’infection par les virus influenza, agents de la grippe, constitue un problème
majeur de santé publique, avec notamment un impact important sur les populations à
risque lors des épidémies saisonnières. De nombreuses équipes de recherche, dont la
nôtre, s’intéressent aux interactions entre ces virus et la cellule hôte afin de
mieux comprendre les mécanismes de l’infection et proposer de nouvelles stratégies
thérapeutiques. Contrairement à la plupart des autres virus à ARN, une partie du
cycle viral des virus influenza s’accomplit dans le compartiment nucléaire de la
cellule hôte, ce qui implique des interactions avec de nombreux facteurs cellulaires
au profit de la réplication virale. Les virus influenza ont notamment développé des
stratégies pour détourner la machinerie cellulaire d’épissage des transcrits
primaires, afin, d’une part, d’altérer la réponse de la cellule hôte à l’infection,
et, d’autre part, de permettre une expression optimale de certaines protéines
virales [1]. La protéine
virale non-structurale NS1 est un véritable « couteau suisse » permettant au virus
de moduler les réponses de l’hôte à l’infection, notamment la réponse interféron. Ce
rôle central de NS1 dans les interactions entre virus et cellule hôte s’exerce dans
plusieurs mécanismes cellulaires comme l’épissage, la maturation des ARNm, le
transfert nucléo-cytoplasmique des ARN, ou encore la traduction des ARNm, grâce à la
capacité de NS1 d’interagir avec de très nombreux partenaires cellulaires (plus de
cinquante) par ses domaines de liaison à l’ARN double-brin et aux protéines p85b,
RIG-I, ou CPSF4 [2]. CPSF4 est un composant du complexe CPSF (cleavage and polyadenylation
specificity factor), impliqué dans la dernière étape de maturation et
de poly-adénylation des ARNm, mais aussi dans le contrôle de leur épissage
alternatif. Dans le cas de l’infection par les virus influenza, il a été montré que
la liaison de NS1 à CPSF4 perturbe sa liaison aux pré-ARNm de la cellule hôte et
inhibe leur clivage à l’extrémité 3’ et leur poly-adénylation. Cette interaction
contribue ainsi au contrôle NS1-dépendant de l’expression des gènes de l’hôte, se
traduisant en particulier par l’inhibition de la réponse interféron [3]. La liaison de NS1 à CPSF4 pourrait
également affecter plus spécifiquement l’expression de certains gènes de l’hôte en
perturbant l’épissage alternatif de leurs ARNm. |
Interactions fonctionnelles entre virus influenza et le facteur de transcription
p53 La protéine régulatrice p53 est impliquée dans un grand nombre de phénomènes
cellulaires, comme le cycle cellulaire, l’apoptose ou la sénescence, ainsi que dans
la réponse immune et inflammatoire. Ce facteur de transcription impliqué dans
l’homéostasie cellulaire, et dont on a célébré récemment les 40 ans de la
découverte, a surtout été étudié en oncologie. Cependant, nous savons que la
protéine p53 est impliquée dans le contrôle des infections virales au sens large,
tous les virus, oncogènes ou non, ayant développé une palette de stratégies
différentes pour moduler ou détourner ses fonctions afin d’optimiser leur
réplication dans la cellule hôte [4]. Dans le cas des virus influenza, les travaux menés par notre équipe ont permis de
montrer qu’il existe de multiples interactions fonctionnelles entre ces virus et
p53. Les virus influenza sont ainsi capables de moduler l’expression endogène et
l’activité transcriptionnelle de p53 au cours de l’infection, contribuant à
maintenir un état cellulaire favorable à la réplication virale [5-7]. Dans ce modèle d’infection, la protéine multifonctionnelle
NS1 semble jouer un rôle majeur. Nous avons en effet montré que NS1 interagit
directement avec p53, et que cette interaction perturbe la liaison du facteur de
transcription aux régions promotrices de ses gènes cibles [5-7]. Cependant, le
mécanisme de la modulation de l’activité de p53 par NS1 n’était pas encore
entièrement compris. |
L’infection par les virus influenza modifie l’épissage du transcrit de
TP53 En plus de la forme canonique de p53 (aussi appelée p53α), le gène
TP53 code 12 isoformes distinctes grâce à la présence de
différents promoteurs, sites d’épissage, et sites d’initiation de la traduction. Ces
isoformes sont impliquées dans la régulation de p53α et les réponses biologiques qui
en dépendent. Nous avons montré que l’infection par les virus influenza modifiait
considérablement l’expression de ces isoformes, dont celles issues d’épissages
différents du transcrit primaire (p53b et p53g), et que cette modulation avait en
retour un impact important sur la réplication virale, ce qui révélait un niveau
supplémentaire de complexité dans les interactions entre virus influenza et p53
[8]. Plus récemment, afin
de mieux comprendre l’impact de l’infection sur l’épissage du transcrit de
TP53, nous avons utilisé une approche fondée sur l’utilisation
d’un minigène permettant d’étudier de manière spécifique l’exclusion ou la rétention
partielle de l’intron 9 du transcrit de TP53, à l’origine des
formes α, b et g [9]. Nous
avons ainsi pu montrer que l’infection favorisait la rétention de l’intron 9, donc
les isoformes b et g de la protéine, conformément à nos observations
précédentes. |
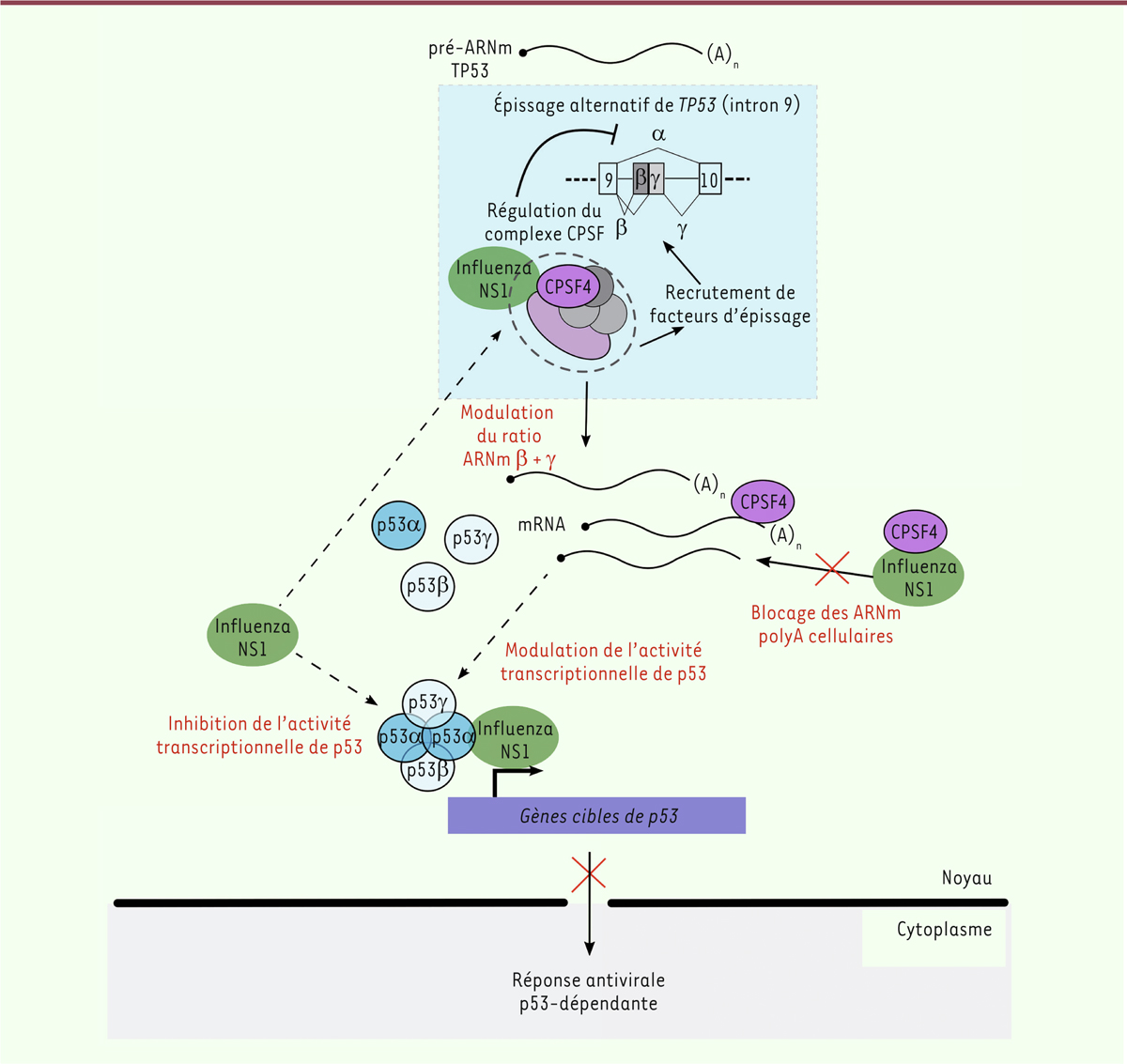
Interaction fonctionnelle entre NS1, CPSF4, et l’épissage du transcrit de TP53,
et son impact sur la réponse interféron de type I p53-dépendante Compte tenu de la contribution de la protéine virale NS1 dans la modulation de la
machinerie d’épissage, nous avons recherché si NS1 jouait un rôle dans la rétention
de l’intron 9 dans le transcrit de TP53. En utilisant un minigène,
nous avons montré que l’expression transitoire de NS1 avait le même effet sur la
rétention de l’intron 9 que l’infection virale. Cet effet n’était plus observé en
présence d’une protéine NS1 porteuse de mutations supprimant son interaction avec le
facteur CPSF4 [9]. Différentes expériences
utilisant des petits ARN inhibiteurs (si-RNA) de l’expression endogène de
CPSF4 ou de l’élimination de l’intron 9 au cours de l’épissage
du transcrit de TP53, mais aussi des virus influenza recombinants
dont la protéine NS1 mutée est incapable d’interagir avec CPSF4, nous ont ensuite
permis de préciser l’interaction fonctionnelle entre NS1, CPSF4, l’épissage du
transcrit de TP53, et l’activité transcriptionnelle de la protéine
p53. Ces expériences nous ont notamment permis de mettre en évidence le rôle du
facteur CPSF4 dans l’épissage du transcrit de TP53, un rôle qui
peut être modifié par l’interaction entre CPSF4 et NS1 lors de l’infection virale.
La modulation de l’épissage alternatif de ce transcrit se traduit par une
modification des quantités relatives des isoformes α, β et γ de la protéine p53,
donc de l’activité transcriptionnelle de cette protéine, que nous avons pu observer
pour plusieurs gènes cibles, dont MDM2 (Murine double
minute 2), BAX (Bcl-2–associated X),
et CDKN1A (Cyclin-dependent kinase inhibitor
1A/p21). Par ailleurs, le ciblage de l’expression des isoformes de p53
issues de l’épissage alternatif du transcrit à l’aide de petits ARN inhibiteurs
spécifiques se traduit par une forte diminution de la production du virus influenza,
ce qui plaide pour un rôle de p53b et p53g favorisant la réplication virale, en
accord avec nos observations précédentes. Nous avons également montré, dans le
contexte de l’infection virale, que le facteur CPSF4 joue un rôle antiviral
dépendant de p53, et que les isoformes p53b et p53g jouent un rôle majeur dans le
contrôle de la réponse interféron de type I passant par p53, CPSF4 étant
vraisemblablement impliqué dans cette boucle de régulation [9]. Un schéma synthétisant l’interaction fonctionnelle complexe
entre la protéine virale NS1 et les protéines cellulaires CPSF4 et p53 est présenté
dans la Figure 1. Nos
résultats indiquent que le rôle des différentes isoformes de p53, en particulier
celles issues de l’épissage alternatif du transcrit, dans le contrôle des infections
virales a jusqu’à présent été sous-estimé [10].
 | Figure 1. Modèle rendant compte de l’interaction fonctionnelle entre protéine
virale NS1, épissage du transcrit de TP53, et CPSF4. Lors de
l’infection, la protéine virale NS1 inhibe l’activité transcriptionnelle
de p53 en se liant à cette protéine, mais également en modulant
l’épissage du pré- ARNm de TP53, et en affectant la fonction du facteur
cellulaire CPSF4 dans l’épissage et la maturation des ARNm. En
conséquence, la modulation de la proportion relative des isoformes de
p53 a un impact sur l’activité transcriptionnelle de p53, notamment sur
la régulation de nombreux gènes impliqués dans la réponse
antivirale. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Les travaux de l’équipe ont bénéficié du soutien de l’université Claude Bernard Lyon
1. Julia Dubois a bénéficié d’une bourse de la région Auvergne-Rhône-Alpes (CMIRA
ExploRA’DOC) et du soutien du consulat général de France à Québec (Programme
Frontenac).
|
1. Dubois
J,
Terrier
O,
Rosa-Calatrava
M. Influenza viruses
and mRNA splicing: doing more with less .
MBio.
2014;; 5 :
:e00070.–14. 2. Marc
D. Influenza virus
non-structural protein NS1: interferon antagonism and
beyond . J Gen Virol.
2014;; 95 :
:2594.–611. 3. Nemeroff
ME,
Barabino
SM,
Li
Y, et al.
Influenza virus NS1 protein interacts with the cellular 30 kDa
subunit of CPSF and inhibits 3’ end formation of cellular
pre-mRNAs . Mol Cell.
1998;; 1 :
:991.–1000. 4. Aloni-Grinstein
R,
Charni-Natan
M,
Solomon
H,
Rotter
V. p53 and the viral
connection: back into the future . Cancers
(Basel).
2018;; 10 : pii :
:E178.. 5. Terrier
O,
Josset
L,
Textoris
J, et al.
Cellular transcriptional profiling in human lung epithelial cells
infected by different subtypes of influenza A viruses reveals an overall
down-regulation of the host p53 pathway . Virol
J.
2011;; 8 : :285.. 6. Terrier
O,
Diederichs
A,
Dubois
J, et al.
Influenza NS1 interacts with p53 and alters its binding to
p53-responsive genes, in a promoter-dependent manner .
FEBS Lett.
2013;; 587 :
:2965.–71. 7. Pizzorno
A,
Dubois
J,
Machado
D, et al.
Influenza A viruses alter the stability and antiviral
contribution of host E3-ubiquitin ligase Mdm2 during the time-course of
infection . Sci Rep.
2018;; 8 : :3746.. 8. Terrier
O,
Marcel
V,
Cartet
G, et al.
Influenza A viruses control expression of proviral human p53
isoforms p53β and D133p53α . J Virol.
2012;; 86 :
:8452.–60. 9. Dubois
J,
Traversier
A,
Julien
T, et al.
The nonstructural NS1 protein of influenza viruses modulates TP53
splicing through host factor CPSF4 . J Virol.
2019;; 93 : pii :
e02168–18.. 10. Terrier
O,
Bourdon
JC,
Rosa-Calatrava
M. p53 protein
isoforms: key regulators in the front line of pathogen
infections?
PLoS Pathog.
2013;; 9 :
:e1003246.. |