| |
| Med Sci (Paris). 36(2): 130–136. doi: 10.1051/medsci/2020009.Un marché d’échange de lipides Transport vectoriel du cholestérol par la protéine
OSBP Joëlle Bigay,1** Bruno Mesmin,1 and Bruno Antonny1* 1Institut de Pharmacologie Moléculaire et Cellulaire,
Université Côte d’Azur et CNRS, UMR 7275, 660 route des lucioles, 06560Valbonne,
France |

Vignette (Photo © Inserm - Isabelle Dugail). Bien qu’essentiel à nos cellules, le cholestérol a mauvaise réputation. On craint ses
excès dans l’alimentation et on espère que ses taux soient raisonnables dans nos
analyses sanguines, entendant qu’il existe un bon et un mauvais cholestérol. Cette
distinction correspond à différentes particules de transport du cholestérol dans le sang
: les lipoprotéines de basse densité (LDL) et les lipoprotéines de haute densité (HDL).
Les deux sont essentielles, mais l’excès de LDL peut conduire à des accumulations de
cholestérol sur la paroi des artères, un facteur de risque cardiovasculaire [1] (→).
(→) Voir la Synthèse de S. Morozova et al., m/s
n° 6-7, juin-juillet 2004, page 685
Nos cellules affrontent peu ou prou le même dilemme [2]. Certaines membranes cellulaires doivent avoir un
taux élevé de cholestérol, d’autres, au contraire, un taux bas. Ainsi, la fraction
moléculaire de cholestérol rapportée aux autres lipides des membranes, varie de 5-10 %
dans les membranes les plus pauvres, à 30-50 % dans les membranes les plus riches, soit
parfois autant de molécules de cholestérol que de tous les autres lipides. Ces
variations s’accompagnent d’autres différences marquées dans la composition lipidique
des organelles [3]. Globalement,
chaque organelle a une composition lipidique définie qui est essentielle à sa fonction
car déterminant les propriétés physiques de sa membrane, comme la déformabilité ou la
perméabilité. Ainsi, le taux élevé de cholestérol dans la membrane plasmique qui entoure
les cellules est important pour assurer son imperméabilité. Ces différences de composition demandent à nos cellules de nombreux mécanismes de
transport de cholestérol et un contrôle très strict de son taux [2]. Il existe plusieurs raisons à cela. D’abord, une grande part du
cholestérol de nos cellules vient de l’extérieur et pénètre par endocytose au niveau de
la membrane plasmique, en particulier via les récepteurs des LDL. Le
cholestérol peut également être synthétisé dans le réticulum endoplasmique (RE).
Cependant, cette organelle a un taux de cholestérol particulièrement bas. Dès lors, le
cholestérol, après qu’il ait été synthétisé, doit être transporté vers les membranes qui
en sont riches, en particulier la membrane plasmique. Notons enfin, que la majorité des
compartiments membranaires échangent du matériel protéique par l’intermédiaire de
vésicules de transport. Lorsque ces vésicules fusionnent avec un compartiment «
accepteur », elles apportent nécessairement leurs propres lipides provenant du
compartiment « donneur » à partir duquel elles se sont formées. Les transports
vésiculaires peuvent donc tendre à homogénéiser la composition lipidique des membranes
cellulaires. L’ensemble de ces considérations rend ainsi critique l’existence de
mécanismes de transport vectoriel où le cholestérol est transporté de façon dirigée d’un
compartiment à un autre et non dans le sens inverse. La Figure 1 montre les différentes
voies impliquées dans le transport du cholestérol ainsi que les protéines associées
[4]. Parmi les plus connues,
citons NPC1 et NPC2 (ou intracellular cholesterol transporter) qui
assurent l’export de cholestérol depuis les lysosomes. Ces protéines sont très étudiées
car elles sont mutées dans la maladie de Niemann-Pick type C (NPC), qui entraîne des
insuffisances hépatiques sévères ou des atteintes du système nerveux avec une forte
accumulation de cholestérol dans divers tissus.
 | Figure 1. Échange du cholestérol entre les différentes organelles. Ces voies de
transport sont très régulées, souvent coûteuses en énergie métabolique et
aboutissent à des gradients de concentration du cholestérol. Les principales
voies impliquées dans ce transport : 1. Voie de transport du cholestérol
néo-synthétisé (RE > TGN > PM) ; 2. Voie de l’endocytose avec
recyclage (PM > ERC > PM) ; 3. Voie de l’endocytose tardive (voie du
récepteur LDL) ; 4a, b. Voies de transformation du cholestérol (cholestéryl
ester au niveau RE > LD et oxystérols, acides biliaires via mitochondries
et peroxysomes). PM : plasma membrane ; RE : réticulum endoplasmique ; TGN :
trans Golgi network ; ERC : compartiment de recyclage ;
LE/Ly : endosome tardif/ lysosomes ; P : peroxysome ; M : mitochondrie ; N :
noyau ; LD : lipid droplet. |
Cette revue se concentre sur le mécanisme de transport du cholestérol intracellulaire par
la protéine OSBP (oxysterol-binding protein), protéine dont le rayon
d’action va du RE à l’appareil de Golgi, certains endosomes et aux lysosomes [4-6]. Mais l’intérêt des études sur OSBP est plus large car elles ont permis
des avancées importantes dans la biochimie et la biologie cellulaire des mécanismes du
transport lipidique en général. Les travaux sur OSBP ont en effet contribué à mieux
comprendre une caractéristique morphologique de nos organelles : les sites de contact
membranaires. Observés depuis longtemps en microscopie électronique, ces sites sont des
régions d’apposition entre deux organelles dans lesquelles leurs membranes respectives
sont séparées d’environ 20 nm et où s’effectuent des échanges spécifiques d’ions et de
lipides [5] (→).
(→) Voir la Nouvelle de T. Di Mattia et al., m/s n° 1, janvier
2019, page 23
Les études portant sur OSBP et sur Osh4, son homologue chez la levure, ont également
permis de comprendre les processus responsables de la direction du transport et
d’identifier la source d’énergie utilisée afin qu’un lipide soit transporté d’une
membrane A à une membrane B et non l’inverse. |
Organisation moléculaire d’OSBP : l’idée du pont transbordeur La forme humaine d’OSBP est constituée de 807 acides aminés qui forment 5 régions le
long de la séquence primaire de la protéine (Figure 2A), avec, successivement, une région sans structure
intrinsèque, un domaine d’homologie à la Pleckstrine (PH)1,, une région de dimérisation par enroulement
hélicoïdal (coiled-coil), une région contenant un motif appelé FFAT
(two phenylalanines in an acidic tract), et un domaine ORD
(OSBP-related domain) [4,6,8,9]. D’autres protéines présentent une telle organisation : les
ORP (pour OSBP-related proteins), une famille définie par OSBP, et
les protéines CERT (ceramide transport protein) et FAPP2
(four-phosphate-adaptor protein 2) qui transportent
respectivement le céramide et le glucosylcéramide [6]. En 2004, Tim Levine, remarquant l’organisation en domaines de ces protéines, proposa
un modèle que nous résumons ici par l’image du pont transbordeur (Figure 2B). Ce modèle repose sur la
découverte des capacités d’interaction respectives du domaine PH et du motif FFAT
[6]. Les domaines PH d’OSBP, de CERT et de
FAPP2, ont la particularité d’interagir spécifiquement avec la partie
trans de l’appareil de Golgi, appelée TGN (trans-Golgi
network). Cette interaction est due à la reconnaissance de deux
molécules concentrées sur cette organelle : la protéine Arf(ADP-ribosylation
factor)1-GTP et le lipide PI4P (phosphatidylinositol 4-phosphate), une
forme phosphorylée du phosphatidylinositol. Le motif FFAT permet une interaction
spécifique avec les protéines transmembranaires VAP (vesicle-associated
membrane protein-associated proteins)-A et VAP-B exclusivement
présentes dans le RE [7].
Levine proposa que la présence conjointe d’un domaine PH et d’un motif FFAT permet
aux protéines de type OSBP, FAPP2 ou CERT de servir de pont entre la membrane du RE
et celle du TGN. Ces protéines possèdent dans leur partie C-terminale un domaine
capable d’extraire des lipides. Ce domaine pourrait donc transférer des lipides
entre les deux membranes jointes par le domaine PH et le motif FFAT. Le modèle
proposait ainsi une double fonction : la formation d’un site de contact membranaire
RE-TGN et le transfert de lipide.
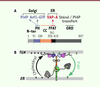 | Figure 2. Organisation structurale et activités biochimiques d’OSBP.
A. La séquence d’OSBP se divise en
5 régions : une région non structurée (N-Ter), un domaine
Plekstrin homology (PH), une région de dimérisation
(coiled-coil), un motif FFAT (two
phenylalanines in an acidic trak), et un domaine ORD
(OSBP-related domain).
B. Sur le modèle d’un pont
transbordeur, OSBP connecte deux membranes et échange cholestérol et
PI4P entre les deux membranes apposées. |
En 2013, nous avons montré la pertinence de ce modèle par des expériences où étaient
comparées différentes constructions d’OSBP, soit dans des cellules soit sur des
membranes artificielles [8]. La Figure 3A présente l’une de ces
expériences. Une construction contenant le domaine PH et le motif FFAT est ajoutée à
un mélange de deux liposomes. Le « donneur » contient un analogue fluorescent du
cholestérol ainsi que la protéine VAP ; l’« accepteur » contient, lui, la protéine
Arf1-GTP. « Donneur » et « accepteur » imitent ainsi respectivement les membranes du
RE et du TGN. La construction PH-FFAT provoque l’attachement des liposomes entre
eux. Dans une autre expérience (Figure
3B), OSBP catalyse très efficacement le transport du stérol
du « donneur » vers l’« accepteur », et ce transport est facilité par la présence
conjointe de VAP-A sur le « donneur » et d’Arf1-GTP sur l’« accepteur ». Ces
expériences ont ainsi apporté la démonstration des deux activités biochimiques
d’OSBP : le pontage membranaire et le transfert de cholestérol.
 | Figure 3. Mise en évidence des activités de pontage membranaire et de transfert
lipidique d’OSBP. A. Suivi au cours du
temps par diffusion quasi élastique de la lumière de l’assemblage de
liposomes par le fragment PH-FFAT d’OSBP.
B. Suivi au cours du temps par FRET
(fluorescence resonance energy transfer) de
l’échange d’un analogue fluorescent du cholestérol entre deux
populations de liposomes par OSBP. La capacité de pontage d’OSBP et son
activité de transfert de stérol dépendent de la présence de VapA et
Arf1-GTP, respectivement sur les liposomes donneurs La (mimant le
réticulum endoplasmique) et sur les liposomes accepteurs Lb (mimant le
TGN). |
|
Le transport rétrograde et l’hydrolyse du PI4P assurent la direction du transfert
de cholestérol Dans la reconstitution précédente, le stérol est transféré des liposomes « donneurs »
aux liposomes « accepteurs » parce qu’il est concentré dans les premiers et absent
dans les seconds. Il s’équilibre donc entre les deux populations de liposomes et il
n’y a pas besoin d’apport d’énergie extérieure. Mais dans la cellule, OSBP doit
transporter le stérol des membranes du RE vers le TGN, c’est-à-dire d’un
compartiment pauvre à un compartiment riche en stérol. Il doit en quelque sorte
remonter la pente du gradient. Quand OSBP est inhibé par une molécule naturelle
(comme les ORPphilines), le flux de cholestérol vers le TGN est fortement diminué
[9]. Comment s’effectue la décision du
sens du transport du cholestérol ? L’énergie chimique nécessaire au transport vectoriel du stérol du réticulum vers le
TGN est fournie par un autre lipide, le PI4P. Les expériences clés permettant
d’identifier le PI4P comme source d’énergie furent d’abord réalisées sur Osh4,
l’homologue d’OSBP chez la levure [10]. Osh4 peut transporter non seulement du stérol entre membranes mais
également du PI4P. Ce fut une grande surprise car les deux lipides sont très
différents. Néanmoins, l’analyse de la structure d’Osh4 révèle clairement que le
site hydrophobe de la protéine peut reconnaître spécifiquement soit un stérol soit
un PI4P. Le PI4P est synthétisé dans le TGN par la PI4-kinase IIIb et est hydrolysé dans le RE
par la phosphoinositide phosphatase Sac1. Lorsqu’OSBP dépose sur le TGN une molécule
de stérol, celle-ci aura peu de probabilité d’être ré-extraite, car en compétition
avec le PI4P qui y est abondant. Lorsque, en retour, le PI4P est déplacé du TGN vers
le RE, il rencontre alors la protéine Sac1 et est hydrolysé. L’irréversibilité de
l’hydrolyse fait que seul un nouveau cholestérol pourra être à nouveau extrait du
RE. Le couplage entre transport antérograde du stérol et transport rétrograde du
PI4P a été démontré expérimentalement, de même que l’avantage de l’hydrolyse du PI4P
pour rendre le cycle irréversible [8,9,11]. Transporter un cholestérol d’un point A à
un point B « coûte » donc un PI4P, qui, lui, sera transporté en sens inverse puis
hydrolysé. |
Les ORPphilines, des molécules naturelles aux propriétés anticancéreuses,
inhibent OSBP Les expériences que nous avons décrites furent essentiellement réalisées en utilisant
des systèmes purifiés ou en sur-exprimant OSBP et ses partenaires dans des cellules.
La question suivante fut donc de valider ce modèle sur la protéine endogène de
cellules. En 2011, il fut découvert qu’OSBP était la cible d’une famille de molécules
naturelles appelées ORPphilines (Figure
4A). Cette famille comprend des molécules assez variées mais
qui présentent toutes des cycles ayant une ressemblance plus ou moins prononcée avec
celui du cholestérol [12].
Pourquoi s’intéresser à cette famille ? Parce que les ORPphilines provoquent la mort
d’un ensemble de lignées cancéreuses, dont la diversité n’avait jamais été observée
précédemment, suggérant que les ORPphilines avaient une même cible et que celle-ci
était différente des cibles connues d’autres molécules anticancéreuses. Ceci est
important à considérer puisque ces cibles communes ouvrent de nouveaux angles
d’attaque contre les cellules cancéreuses. Par chromatographie d’affinité, afin
d’identifier le partenaire moléculaire des ORPphilines, puis par des mesures
réalisées dans des systèmes cellulaires, les auteurs ont ainsi montré que les
ORPphilines avaient pour cible OSBP, mais également une protéine voisine, ORP4
(oxysterol-binding protein-related protein 4) [12]. Depuis, la recherche sur les ORPphilines
s’est amplifiée, avec pour objectif ultime une application clinique de ces
molécules.
 | Figure 4. Principaux inhibiteurs d’OSBP. A.
ORPphilines Osw1 et Schweinfurthine. B.
Anti-viraux T-00127-HEV2 et itraconazole. |
Une question reste néanmoins ouverte : quel processus unit OSBP et certaines lignées
cancéreuses ? OSBP est une protéine ubiquitaire essentielle dès les stades précoces
du développement. D’où la question de savoir si l’effet des ORPphilines que l’on
observe repose uniquement sur une action sur OSBP. Reste que la découverte des
ORPphilines permet aux biologistes de mieux étudier et comprendre la fonction d’OSBP
dans la cellule, grâce à des expériences simples dans lesquelles l’activité d’OSBP
peut être bloquée à volonté par ces molécules [9]. L’ORPphiline OSW-12,, est un composé isolé de la
plante Ornithogalum saundersiae. De forte affinité pour OSBP (10
nM), elle inhibe à la fois le transfert de stérol et le transfert de PI4P par OSBP
in vitro en agissant sur le domaine ORD (OSBP-related
domain) [9]. Dans la cellule,
OSW-1 induit une relocalisation très rapide d’OSBP et de VAP-A au niveau du TGN
indiquant la stabilisation de sites de contacts RE/TGN. L’utilisation d’un analogue
fluorescent du cholestérol afin de visualiser sa répartition dans les cellules,
révèle qu’OSW-1 provoque la concentration de cet analogue dans les gouttelettes
lipidiques provenant du RE au détriment de son efflux vers le TGN. La quantification
de ces variations suggère qu’OSBP est responsable d’environ la moitié du flux de
cholestérol entre les deux organelles. L’inhibition d’OSBP a des répercussions plus
globales sur les membranes lipidiques de nombreux compartiments. En effet, un autre
effet spectaculaire de l’inhibition d’OSBP par OSW-1 est la rapide augmentation du
PI4P au niveau de l’appareil de Golgi [9]. Une
dizaine de minutes après l’addition d’OSW-1 à la cellule, la concentration de PI4P,
détectée par une sonde fluorescente ou mesurée par lipidomique, est multipliée
d’environ deux fois, suggérant qu’à l’état stationnaire OSBP endogène consomme 50 %
du PI4P cellulaire. OSBP semble donc bien agir comme une pompe à lipide qui consomme
une grande partie du PI4P intracellulaire, et que l’on peut qualifier « d’ATP
lipidique », pour transporter le cholestérol intracellulaire [13]. |
Détournement du cycle d’OSBP par des virus Des molécules ayant une activité antivirale (Figure 4B) ont été utilisées en raison de leur effet sur
OSBP. Elles ont permis de révéler l’implication d’OSBP dans le cycle de réplication
de nombreux virus à ARN positif (Hépatite C, Poliovirus, Entérovirus, Rhinovirus)
[14]
(→).
(→) Voir la Nouvelle de M. Rakoto-Andrianarivelo et al.,
m/s mai 2008, page 452
Ces virus se multiplient dans les cellules au sein des membranes, à l’interface
RE-Golgi. À ce niveau, ils détournent sélectivement des facteurs de l’hôte afin de
générer des réseaux tubulovésiculaires dont la composition protéique et lipidique
est unique [15]. Ces
structures, nouvelles, qualifiées d’usines de réplication (RO, pour
replication organelles ou replication
factories), sont particulièrement enrichies en cholestérol et en PI4P
et, dans de nombreux cas, sont pourvues d’une double enveloppe membranaire. Pour ces
virus, l’un des rôles du PI4P est de stabiliser l’ancrage du complexe ARN polymérase
au niveau des RO pour favoriser la synthèse de l’ARN viral. OSBP, qui contrôle
autant le cholestérol que le PI4P, est enrichi au niveau de ces organelles de
réplication. Dans le cas du rhinovirus, par exemple, l’échange cholestérol-PI4P par
OSBP est important pour sa réplication [16]. OSBP a ainsi été identifié comme étant une cible directe
de plusieurs nouvelles molécules à action antivirale [17]. Pour certaines, nous avons pu montrer que
leur action reposait sur l’inhibition des activités de transfert de lipides,
confirmant qu’OSBP est bien impliqué dans le cycle du virus ciblé [18-20]. Toutefois, l’espoir anticipé que ces
nouvelles drogues puissent un jour éradiquer des fléaux tels que la poliomyélite,
est assombri par des découvertes récentes qui indiquent que ces virus sont capables
de muter et de modifier leur cycle afin de les rendre indépendants de la voie
PI4P/OSBP, développant ainsi une résistance à ces drogues [20]. |
Les protéines ORP : variations sur un même thème L’étude d’OSBP a contribué à une meilleure compréhension des sites de contact
membranaires en fournissant un modèle général du fonctionnement des protéines de la
famille ORP. Pourtant, des variations, tant pour le mode de pontage membranaire que
pour les lipides échangés, existent entre les protéines de cette famille. De nombreuses protéines ORP sont impliquées dans le transport du cholestérol, mais
certaines, comme Osh (OSBP homologue) 6 et 7, ORP 5, 8 et 10 (et probablement ORP11)
utilisent le PI4P comme monnaie d’échange pour transporter la phosphatidylsérine
[21-23]. À l’instar du cholestérol, la
phosphatidylsérine doit être activement transportée car ce lipide présente un fort
gradient intracellulaire : elle est abondante à la membrane plasmique et rare dans
le RE [3]. Les modes d’ancrage des ORP aux
organelles montrent également certaines différences par rapport à ceux d’OSBP.
Ainsi, ORP5 et ORP8 n’ont pas de motif FFAT mais possèdent un segment
transmembranaire C-terminal ancré dans le RE [4]. Leur domaine PH interagit avec la membrane plasmique et non avec le
TGN. Dans certains cas (ORP2,5,8), la monnaie d’échange pour délivrer un lipide à la
membrane cible pourrait être un phosphoinositide autre que le PI4P, tel le
phosphatidylinositol 4,5-bisphosphate (PI(4,5)P2) qui est enrichi dans la
membrane plasmique [24,25], ou le
phosphatidylinositol 3,4-bisphosphate (PI(3,4)P2), pour ORP1L, sur la
membrane des endosomes tardifs [26]. Très récemment, une activité d’échange entre cholestérol et PI4P
par OSBP a été décrite entre le TGN et les endosomes de recyclage, en absence de la
protéine VAP-A, mais sous le contrôle d’un complexe Rab11/RELCH [27]. La similitude ou la divergence de
ces modes d’interaction restent donc à explorer. D’une façon générale, l’inventaire des sites de contact impliquant différents ORP et
les lipides échangés est encore loin d’être complet et constitue une branche très
active de la biologie cellulaire. Certains sites de contact sont occupés par
plusieurs transporteurs lipidiques (LTP, lipid transfer proteins)
permettant un transfert coordonné de différentes classes de lipides, notamment entre
le RE et le TGN [23,28] ou entre le RE et la membrane plasmique
[29]. |
Rôle physiologique des protéines ORP Quels sont les contextes physiologiques pour lesquels une activité de transfert ou
d’échange de lipides par les protéines ORP est important ? Dans le cas de voies de signalisation aboutissant à la brusque hydrolyse du
PI(4,5)P2, un système de transporteurs LTP permet d’échanger l’acide
phosphatidique produit à la membrane plasmique avec un phosphatidylinositol du RE
afin de permettre la régénération du PI(4,5)P2 à la membrane plasmique
pour d’autres cycles de transduction [29-31]. Des travaux récents montrent qu’OSBP peut transférer du cholestérol du RE vers la
membrane externe des lysosomes. Ce transport contrebalance la sortie du cholestérol
de ces organelles par le système de transporteurs NPC1/2 [32]. Dans la maladie de Niemann-Pick de type C,
le dysfonctionnement des NPC et l’apport de cholestérol par OSBP a pour effet
d’activer la voie mTORC1 (mammalian target of rapamycin complex 1)
qui contrôle positivement la croissance cellulaire et négativement l’autophagie.
Inhiber OSBP permet de contrecarrer cet excès de cholestérol et d’éviter
l’activation non contrôlée de mTORC1. À la surface des endosomes tardifs, ORP1L (oxysterol-binding protein-related
protein 1L) change de conformation en fonction du taux de cholestérol,
ce qui contrôle sa liaison à VAP-A ou à la protéine RILP (Rab-interacting
lysosomal protein), qui permet le déplacement des endosomes par des
moteurs moléculaires. ORP1L apparaît donc comme un senseur de cholestérol servant à
positionner des organelles dans la cellule en fonction de leur richesse en
cholestérol [33]. OSBP a été également caractérisée pour être une plateforme d’interaction pour deux
protéines phosphatases (HePTP [haematopoietic protein tyrosine
phosphatase] et PP2A [protein phosphatase 2A])
contrôlant ainsi l’activité de la kinase ERK (extracellular signal-regulated
kinase) et la voie de signalisation des MAP Kinases
(mitogen-activated protein kinases) en fonction du taux de
cholestérol [34]. OSBP lié
à un stérol peut aussi interagir avec la kinase JAK2 (Janus kinase
2), permettant la liaison puis l’activation de la protéine STAT3
(signal transducer and activator of transcription 3). Par cette
activation, STAT3 régule le niveau de profiline-1, une protéine impliquée dans la
différenciation cellulaire via son action sur l’actine [35]. Ainsi, OSBP peut
intervenir sur les voies de croissance et de différenciation cellulaire en agissant
comme senseur du cholestérol cellulaire. Notons qu’OSBP est, elle-même, contrôlée
par un mécanisme de phosphorylation : la PKD-1 (phosphoinositide-dependent
kinase 1) phosphoryle en effet OSBP sur la sérine en position 240,
entraînant son inactivation, sa localisation au niveau de l’appareil de Golgi, qui
se fragmente alors [36,37]. La régulation par phosphorylation n’est pas réservée à OSBP. Ainsi la phosphorylation
de ORP3 renforce son association avec VAP-A : les complexes ORP3-VAP-A ainsi formés
stimulent la signalisation impliquant R-Ras [38]. Enfin, ORP9L, substrat de la PDK-2, est un régulateur
négatif de la phosphorylation d’Akt (protéine kinase B) [39].
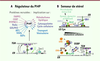 | Figure 5. Fonctions des ORP. A. Par son activité
d’échange cholestérol/PI4P, OSBP contrôle le niveau de PI4P à la surface
du TGN, permettant une régulation coordonnée de diverses voies
cellulaires. B. Régulation de fonctions
cellulaires selon le taux de stérol cellulaire par les ORP. En haut,
exemple du contrôle de l’interaction entre endosomes tardifs (LE/Ly),
complexe (Rab7/RILP/ p150Glued) et microtubules selon la charge en
stérol d’ORP1L. En bas, exemple de la régulation de l’état de
phosphorylation de ERK par le complexe OSBP/ Cholestérol/HePTP/PP2A. |
|
Les travaux récents portant sur la protéine OSBP ont apporté de nouveaux concepts en
biologie cellulaire et ont permis de répondre à certaines questions : comment former
un pont physique entre deux organelles, un site de contact membranaire, et comment
transporter vectoriellement un lipide d’une organelle à une autre. Ces découvertes
permettent de mieux comprendre l’homéostasie des membranes cellulaires, en
particulier les mécanismes par lesquels nos organelles maintiennent une composition
lipidique constante malgré les incessants échanges de matériels vésiculaires. Les
recherches sur OBSP et d’autres protéines apparentées apportent des pistes nouvelles
pour comprendre et combattre certaines infections virales, certaines formes de
cancer, ou certaines maladies génétiques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Footnotes |
1.
Morozova
S
,
Suc-Royer
I
,
Auwerx
J
. Modulateurs du métabolisme du cholestérol et
avenir du traitement de l’athérosclérose . Med Sci
(Paris).
2004; ; 20 :
:685.–690. 2.
Goldstein
JL
,
DeBose-Boyd
RA
,
Brown
MS
. Protein sensors for membrane
sterols . Cell.
2006; ; 124 :
:35.–46. 3.
Bigay
J
,
Antonny
B
. Curvature, lipid packing, and electrostatics of
membrane organelles: defining cellular territories in determining
specificity . Dev Cell.
2012; ; 23 :
:886.–895. 4.
Luo
J
,
Jiang
LY
,
Yang
H
, et al.
Intracellular Cholesterol Transport by Sterol Transfer Proteins
at Membrane Contact Sites . Trends Biochem
Sci.
2019; ; 44 :
:273.–292. 5.
Di Mattia
T
,
Tomasetto
C
,
Alpy
F
. MOSPD2, un connecteur
inter-organites . Med Sci (Paris).
2019; ; 35 :
:23.–25. 6.
Levine
TP
. Short-range intracellular trafficking of small
molecules across endoplasmic reticulum junctions .
Trends Cell Biol.
2004; ; 14 :
:483.–490. 7.
Loewen
CJR
,
Roy
A
,
Levine
TP
. A conserved RE targeting motif in three families
of lipid binding proteins and in Opi1p binds VAP .
EMBO J.
2003; ; 22 :
:2025.–2035. 8.
Mesmin
B
,
Bigay
J
,
Moser von Filseck
J
, et al.
A four-step cycle driven by PI(4)P hydrolysis directs
sterol/PI(4)P exchange by the RE-Golgi tether OSBP .
Cell.
2013; ; 155 :
:830.–843. 9.
Mesmin
B
,
Bigay
J
,
Polidori
J
, et al.
Sterol transfer, PI4P consumption, and control of membrane lipid
order by endogenous OSBP . EMBO J.
2017; ; 36 :
:3156.–3174. 10.
de Saint-Jean
M
,
Delfosse
V
,
Douguet
D
, et al.
Osh4p exchanges sterols for phosphatidylinositol 4-phosphate
between lipid bilayers . J Cell Biol.
2011; ; 195 :
:965.–978. 11.
Moser von Filseck
J
,
Vanni
S
,
Mesmin
B
, et al.
A phosphatidylinositol-4-phosphate powered exchange mechanism to
create a lipid gradient between membranes . Nat
Commun.
2015; ; 6 : :6671.. 12.
Burgett
AWG
,
Poulsen
TB
,
Wangkanont
K
, et al.
Natural products reveal cancer cell dependence on
oxysterol-binding proteins . Nat Chem Biol.
2011; ; 7 :
:639.–647. 13.
Antonny
B
,
Bigay
J
,
Mesmin
B
. The oxysterol-binding protein cycle: burning off
PI(4)P to transport cholesterol . Annu Rev
Biochem.
2018; ; 87 :
:809.–837. 14.
Rakoto-Andrianarivelo
M
,
Jegouic
S
,
Bessaud
M
, et al.
Poliovirus et entérovirus C, même espèce, même tribu
virale . Med Sci (Paris).
2008; ; 24 :
:452.–453. 15.
Van der Schaar
HM
,
Dorobantu
CM
,
Albulescu
L
, et al.
Fat(al) attraction: picornaviruses usurp lipid transfer at
membrane contact sites to create replication organelles .
Trends Microbiol.
2016; ; 24 :
:535.–546. 16.
Roulin
PS
,
Lötzerich
M
,
Torta
F
, et al.
Rhinovirus uses a phosphatidylinositol 4-phosphate/cholesterol
counter-current for the formation of replication compartments at the
RE-Golgi interface . Cell Host Microbe.
2014; ; 16 :
:677.–690. 17.
Arita
M.
Phosphatidylinositol-4 kinase III beta and oxysterol-binding
protein accumulate unesterified cholesterol on poliovirus-induced membrane
structure . Microbiol Immunol.
2014; ; 58 :
:239.–256. 18.
Strating
JRPM
,
van der Linden
L
,
Albulescu
L
, et al.
Itraconazole inhibits enterovirus replication by targeting the
oxysterol-binding protein . Cell Rep.
2015; ; 10 :
:600.–615. 19.
Albulescu
L
,
Bigay
J
,
Biswas
B
, et al.
Uncovering oxysterol-binding protein (OSBP) as a target of the
anti-enteroviral compound TTP-8307 . Antiviral
Res.
2017; ; 140 :
:37.–44. 20.
Arita
M
,
Bigay
J
. Poliovirus evolution toward Independence from the
phosphatidylinositol-4 kinase III β/oxysterol-binding protein family I
pathway . ACS Infect Dis.
2019; ; 5 :
:962.–973. 21.
Moser von Filseck
J
Cˇ opicˇ
A,
Delfosse
V, et al.
Intracellular transport. Phosphatidylserine transport by ORP/Osh
proteins is driven by phosphatidylinositol 4-phosphate .
Science.
2015; ; 349 :
:432.–436. 22.
Chung
J
,
Torta
F
,
Masai
K
, et al.
Intracellular transport. PI4P/phosphatidylserine countertransport
at ORP5- and ORP8-mediated RE-plasma membrane contacts .
Science.
2015; ; 349 :
:428.–432. 23.
Venditti
R
,
Rega
LR
,
Masone
MC
, et al.
Molecular determinants of RE-Golgi contacts identified through a
new FRET-FLIM system . J Cell Biol.
2019; ; 218 :
:1055.–1065. 24.
Ghai
R
,
Du
X
,
Wang
H
, et al.
ORP5 and ORP8 bind phosphatidylinositol-4, 5-biphosphate
(PtdIns(4,5)P 2) and regulate its level at the plasma
membrane . Nat Commun.
2017; ; 8 : :757.. 25.
Wang
H
,
Ma
Q
,
Qi
Y
, et al.
ORP2 delivers cholesterol to the plasma membrane in exchange for
phosphatidylinositol 4, 5-bisphosphate (PI(4,5)P2) .
Mol Cell.
2018; ; 73 :
:458.–473. 26.
Dong
J
,
Du
X
,
Wang
H
, et al.
Allosteric enhancement of ORP1-mediated cholesterol transport by
PI(4,5)P2/PI(3,4)P2 . Nat Commun.
2019; ; 10 : :829.. 27.
Sobajima
T
,
Yoshimura
S-I
,
Maeda
T
, et al.
The Rab11-binding protein RELCH/KIAA1468 controls intracellular
cholesterol distribution . J Cell Biol.
2018; ; 217 :
:1777.–1796. 28.
Hanada
K.
Lipid transfer proteins rectify inter-organelle flux and
accurately deliver lipids at membrane contact sites .
J Lipid Res.
2018; ; 59 :
:1341.–1366. 29.
Saheki
Y
,
Bian
X
,
Schauder
CM
, et al.
Control of plasma membrane lipid homeostasis by the extended
synaptotagmins . Nat Cell Biol.
2016; ; 18 :
:504.–515. 30.
Kim
YJ
,
Guzman-Hernandez
ML
,
Wisniewski
E
, et al.
Phosphatidylinositol-phosphatidic acid exchange by Nir2 at RE-PM
contact sites maintains phosphoinositide signaling
competence . Dev Cell.
2015; ; 33 :
:549.–561. 31.
Chang
CL
,
Liou
J
. Phosphatidylinositol 4,5-bisphosphate homeostasis
regulated by Nir2 and Nir3 proteins at endoplasmic reticulum-plasma membrane
junctions . J Biol Chem.
2015; ; 290 :
:14289.–14301. 32.
Lim
C-Y
,
Davis
OB
,
Shin
HR
, et al.
RE-lysosome contacts enable cholesterol sensing by mTORC1 and
drive aberrant growth signalling in Niemann-Pick type C .
Nat Cell Biol.
2019; ; 21 :
:1206.–1218. 33.
Rocha
N
,
Kuijl
C
,
van der Kant
R
, et al.
Cholesterol sensor ORP1L contacts the RE protein VAP to control
Rab7-RILP-p150 Glued and late endosome positioning .
J Cell Biol.
2009; ; 185 :
:1209.–1225. 34.
Wang
PY
,
Weng
J
,
Anderson
RGW
. OSBP is a cholesterol-regulated scaffolding
protein in control of ERK 1/2 activation .
Science.
2005; ; 307 :
:1472.–1476. 35.
Romeo
GR
,
Kazlauskas
A
. Oxysterol and diabetes activate STAT3 and control
endothelial expression of profilin-1 via OSBP1 . J
Biol Chem.
2008; ; 283 :
:9595.–9605. 36.
Amako
Y
,
Syed
GH
,
Siddiqui
A
. Protein kinase D negatively regulates hepatitis C
virus secretion through phosphorylation of oxysterol-binding protein and
ceramide transfer protein . J Biol Chem.
2011; ; 286 :
:11265.–11274. 37.
Nhek
S
,
Ngo
M
,
Yang
X
, et al.
Regulation of oxysterol-binding protein Golgi localization
through protein kinase D-mediated phosphorylation .
Mol Biol Cell.
2010; ; 21 :
:2327.–2337. 38.
Weber-Boyvat
M
,
Kentala
H
,
Peränen
J
, et al.
Ligand-dependent localization and function of ORP-VAP complexes
at membrane contact sites . Cell Mol Life
Sci.
2015; ; 72 :
:1967.–1987. 39.
Lessmann
E
,
Ngo
M
,
Leitges
M
, et al.
Oxysterol-binding protein-related protein (ORP) 9 is a PDK-2
substrate and regulates Akt phosphorylation . Cell
Signal.
2007; ; 19 :
:384.–392. |