| |
| Med Sci (Paris). 36(2): 137–140. doi: 10.1051/medsci/2020010.Amyotrophie spinale infantile De la découverte du gène à la thérapie génique Martine Barkats1* 1Groupe Biothérapies des maladies du motoneurone, Centre de
Recherche en Myologie, Sorbonne Université - UMRS974 Inserm - Institut de
Myologie, Faculté de Médecine, 105 boulevard de l’Hôpital,
75013Paris,
France |

Vignette (Photo © Inserm - Michel Fardeau). Le ZolgenSMA® est un produit de thérapie génique développé par une société de
biotechnologie et rachetée par un grand laboratoire pharmaceutique pour le traitement de
l’amyotrophie spinale (SMA) atteignant les enfants avant l’âge de deux ans. Ce
traitement de thérapie génique a reçu l’autorisation de mise sur le marché par la FDA
(Food and Drug Administration) le 24 mai 2019, portant cette
technologie à un niveau sans précédent pour les maladies neuromusculaires. Précédemment, le Glybera® indiqué pour le traitement par thérapie génique de patients
atteints de déficience en lipoprotéine et sujets à de graves pancréatites, avait lui
aussi reçu l’autorisation de mise sur le marché par l’EMA (European Medicine
Agency) en 2012. Cependant cette maladie étant trop rare, la demande était
très faible et a mené à l’expiration de l’autorisation de la FDA en 2017. |
Bien que classée parmi les « maladies rares », l’incidence de la SMA atteint 1
naissance sur 10 000 aux États-Unis et jusqu’à 2 naissances sur 10 000 par an en
France, se situant dans la fourchette haute des pays européens [1]. En France, environ 120 nouveaux cas
sont découverts chaque année, et on recense environ 1 500 malades, tous types
confondus. La SMA constitue ainsi la deuxième maladie la plus fréquente parmi les
maladies neuromusculaires de l’enfant (derrière la myopathie de Duchenne), sans
aucun traitement efficace jusqu’à présent [2]. La SMA est une maladie autosomique récessive affectant les motoneurones de la moelle
épinière mais également d’autres organes, tels que le cœur, le foie ou les muscles
squelettiques, menant à l’atrophie progressive des muscles, l’hypotonie et la
faiblesse musculaire progressive et à la mort par arrêt respiratoire à l’âge de 6
mois dans les cas les plus sévères, correspondant au type 1 de la maladie1 qui représente environ 60 % de l’ensemble des
cas de SMA, quelque soit le type [3]. Le gène responsable de la SMA a été identifié en 1995 sur le chromosome 5 et a été
nommé survival of motor neurons ou Smn [4]. Deux copies de ce gène sont
localisées sur le même chromosome, le gène télomérique SMN1 et le
gène centromérique SMN2. La SMA est provoquée par l’altération
homozygote du gène SMN1 dans les cellules (délétion, conversion ou
mutation) empêchant la production de la protéine Smn déficiente [5]. Le second gène,
SMN2, tronqué au niveau de l’exon 7, ne permet pas de compenser
l’absence de protéine Smn dans les cellules. Néanmoins, le nombre de copies du gène
SMN2 variant selon les patients, ce dernier mécanisme peut contrôler la sévérité de
la maladie par l’expression d’une quantité variable de faibles niveaux de protéine
Smn fonctionnelle [6]. |
Au vu du caractère monogénique et récessif de la maladie, l’introduction du gène
SMN1 dans les cellules des patients atteints de SMA est apparue
une approche particulièrement intéressante rendue possible par la thérapie génique
que nous avons développée il y a une dizaine d’années. En effet, nous avons
découvert en 2007 qu’après une simple injection par voie intraveineuse, le virus
associé à l’adénovirus (AAV) de sérotype 9 sous forme double brin ou «
self-complementary » (scAAV9) [7] possédait la capacité remarquable et
spécifique de traverser la barrière hémato-encéphalique et de pénétrer ainsi dans
les cellules du système nerveux central (neurones et astrocytes) pour y introduire
un gène thérapeutique produisant durablement la protéine correspondante chez la
souris et le chat [8]. Nous avons utilisé cette approche pour le traitement de la SMA en construisant un
vecteur scAAV9 contenant une ou plusieurs copies du gène SMN1
(AAV9-SMN) [9] et en
l’injectant par voie intraveineuse (veine temporale) un jour après la naissance à
des souris modèle de SMA (souris SMN2+/+ ; Smn−/− ; SMNΔ7
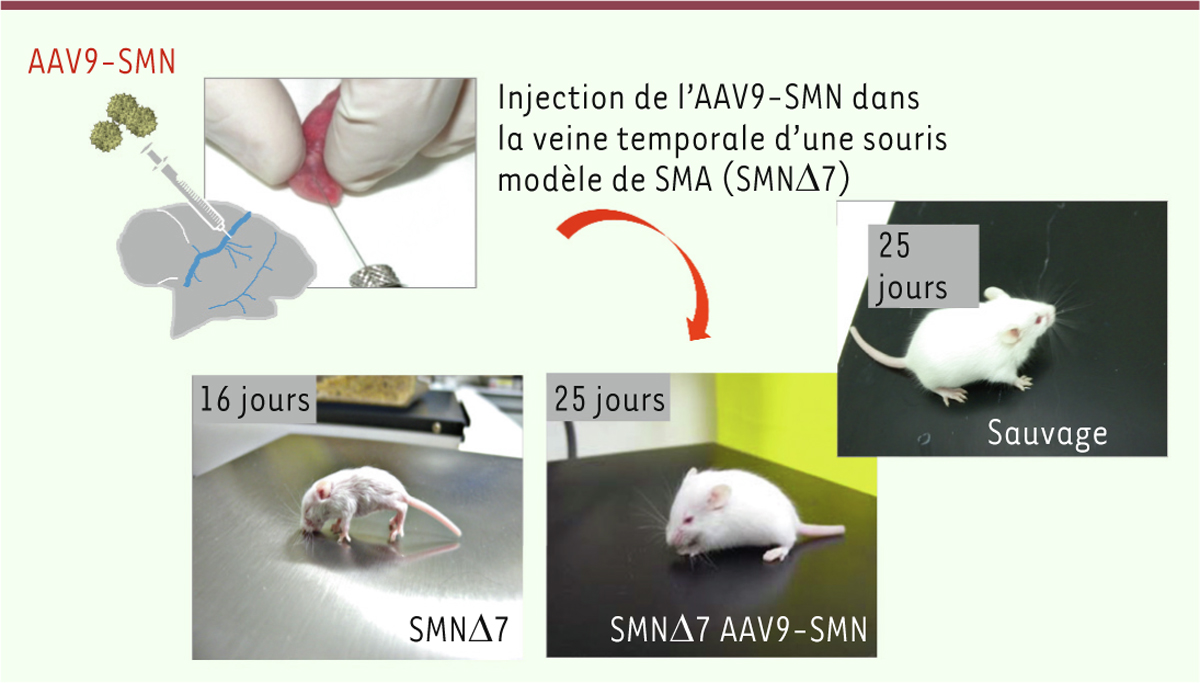
transfectées avec une construction de SMM dépourvu de l’exon 7) [10] (Figure 1). Cette thérapie génique a permis
d’augmenter significativement la survie de ces souris SMA, passant de 14 jours en
l’absence de traitement à une médiane de 199 jours. Sans traitement, aucune souris
SMA n’a en effet dépassé l’âge de 16 jours alors que les souris ayant reçu
l’AAV9-SMN survécurent jusqu’à 340 jours. Le poids des souris traitées, 2 à 3 jours
après leur naissance, était également significativement plus élevé que celui des
souris non traitées.
 | Figure 1. Un vecteur AAV9 contenant le gène SMN1 (AAV9-SMN) a été injecté par voie
intraveineuse (veine temporale) un jour après leur naissance à des
souris modèle de SMA. Cette thérapie génique a permis d’augmenter
significativement la survie des souris SMA, celle-ci passant de 14 jours
à une médiane de 199 jours. Le poids des souris traitées était également
significativement plus élevé que celui des souris sauvages 2 à 3 jours
après la naissance. Étonnamment, l’apparence et l’activité spontanée des
souris traitées par l’AAV9-SMN étaient identiques à celles de souris
sauvages. |
L’apparence et l’activité spontanée des souris traitées par l’AAV9-SMN étaient
identiques à celles de souris sauvages (Figure
1), l’unique différence entre ces souris étant l’apparition
d’une nécrose inexpliquée au niveau des oreilles et de la queue des souris traitées.
Une cataracte a également été observée à partir de 210 jours chez les souris
traitées les plus âgées. La quantité de protéine Smn produite dans différents tissus (y compris la moelle
épinière et les muscles) a montré une importante augmentation chez les souris SMA
traitées par l’AAV9 par rapport à celle mesurée chez des souris sauvages ou des
souris SMA non traitées. Environ 50 % de motoneurones (en moyenne) (et jusqu’à 78 %
chez une souris) exprimaient SMN dans la moelle épinière des souris
traitées [9] (Figure 2).
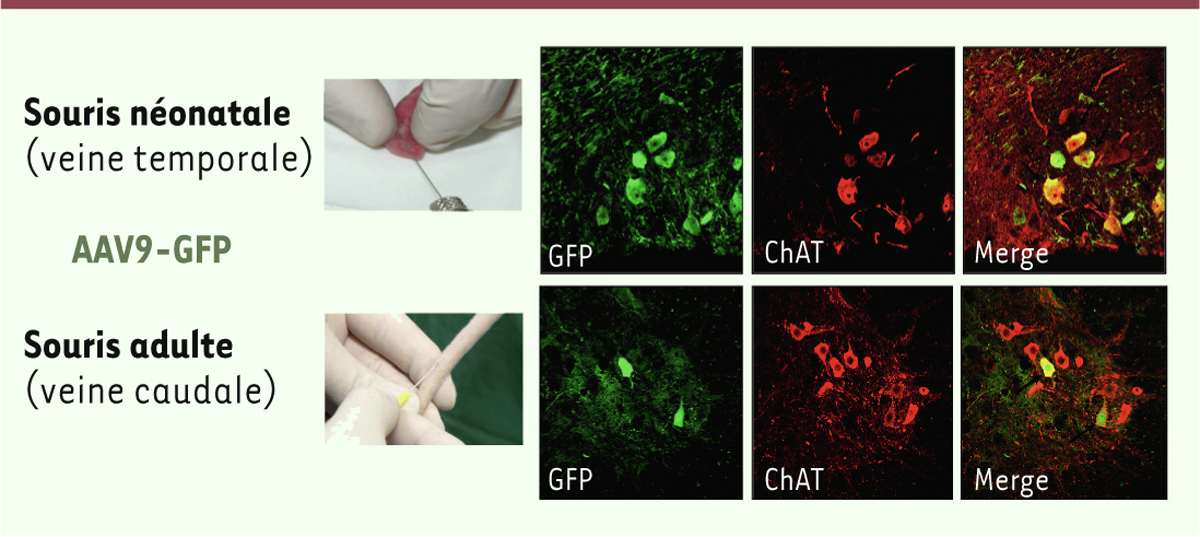
 | Figure 2.Un AAV9 exprimant la protéine fluorescente GFP (AAV9-GFP) a été injecté
dans la veine temporale chez la souris nouveau-née, et dans la veine
caudale chez la souris adulte. Les photographies illustrent la présence
de motoneurones fluorescents dans la moelle épinière des animaux.
Barkats M. PCT/ EP2008/063297 GENETHON/CNRS (Oct. 5, 2007) (d’après
[ 8]). |
Ces études pionnières réalisées chez la souris ont donc montré qu’une simple
injection intraveineuse d’un AAV9 permettait le transfert de gène dans les
motoneurones, malgré la présence de la barrière hémato-encéphalique [8]. Cette technique de thérapie génique a permis
de réduire considérablement la pathologie dans un modèle de souris SMA [9]. L’ensemble de ces études précliniques qui
ont permis une avancée biologique majeure, a été en partie réalisée à Généthon, une
structure créée grâce aux opérations caritatives du Téléthon. Ils ont été résumés
dans un brevet d’invention déposé en 2007 [11], bien avant qu’une équipe américaine dirigée par Brian
Kaspar au Nationwide hospital (Ohio state
university, Colombus) ne décrivent des résultats similaires dans la
revue Nature Biotechnology en 2009 et en 2010 [12,13]. Ces études précliniques offraient la possibilité de porter l’injection systémique de
l’AAV9-SMN en clinique, en particulier pour les patients atteints de la forme
pédiatrique de la SMA (SMA Type 1). Il était néanmoins nécessaire, avant cette
application à l’homme, de montrer l’efficacité du ciblage dans le système nerveux
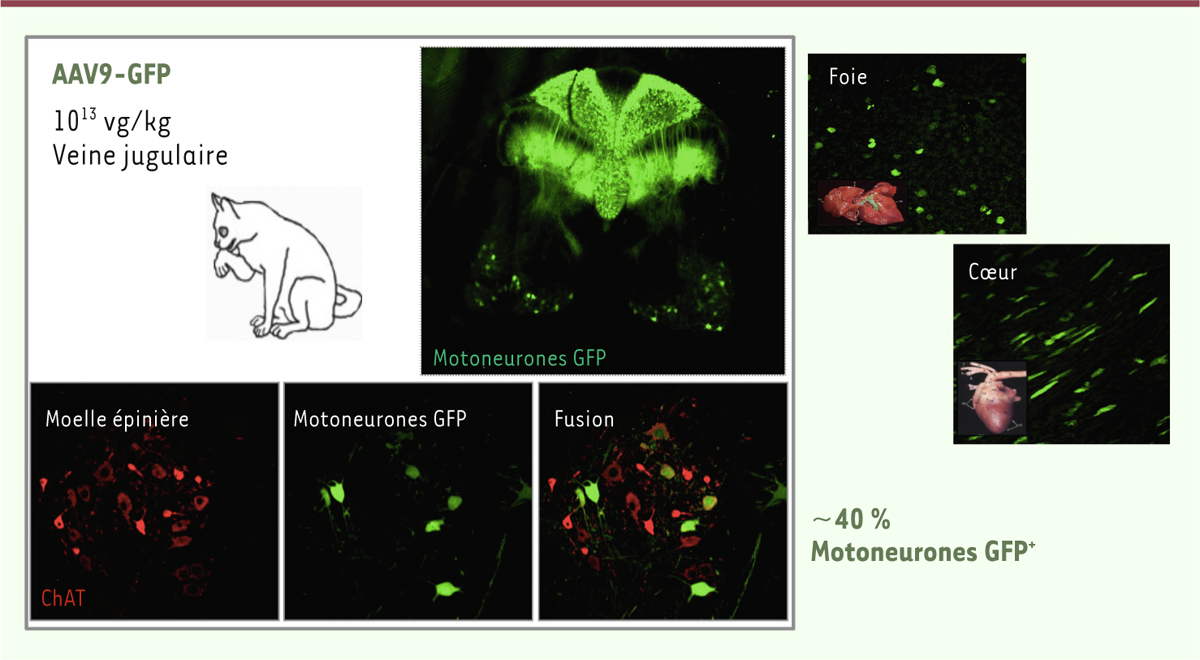
central d’un animal de grande taille. Nous avons choisi le chat comme modèle [8] (Figure
3), contrairement à Kaspar et Samulski qui réalisèrent
ensuite ces expériences sur des primates non-humains [14,15].
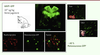 | Figure 3.Ciblage efficace du système nerveux central chez le chat ayant reçu à la
naissance une injection intraveineuse d’un AAV9-GFP. Les photographies
illustrent la présence de nombreux motoneurones fluorescents dans la
moelle épinière. La protéine fluorescente GFP a été détectée également
dans les cellules gliales du cerveau, dans les neurones du ganglion de
la racine dorsale, ainsi que dans les muscles squelettiques et d’autres
organes périphériques, tels que le coeur, le foie, ou les intestins.
Barkats M. PCT/ EP2008/063297 GENETHON/CNRS (Oct. 5, 2007) (d’après
[ 8, 12]). |
Un AAV9 exprimant le gène codant la protéine fluorescente GFP (green
fluorescent protein) (AAV-GFP) a été administré à la naissance, par
voie intraveineuse. L’analyse de la moelle épinière des chats ainsi traités a révélé
la présence de nombreux motoneurones fluorescents, preuve de la présence de la GFP
dans ces cellules. La GFP a également été détectée dans les cellules gliales du
cerveau, dans les neurones du ganglion de la racine dorsale, ainsi que dans les
muscles squelettiques et d’autres organes périphériques, tels que le cœur, le foie,
ou les intestins [8, 14]. L’équipe du Dr Samulski, en utilisant des macaques Rhésus
âgés de 3 à 4 ans, a également montré que l’administration de doses plus faibles
d’AAV9-GFP cible préférentiellement les cellules gliales, plutôt que les neurones,
et montrent un tropisme important des organes périphériques [15]. L’ensemble de ces résultats était donc prometteur pour le passage en clinique de
l’injection systémique de l’AAV9-SMN chez les patients atteints de SMA de type
1. |
Le groupe de Kaspar a décidé de tester cette thérapie expérimentale en clinique chez
des enfants atteints de SMA de type 1, en dépit des forts risques estimés. Dans ce
but, il a créé une compagnie pharmaceutique afin de développer l’AAV-SMN ZolgenSMA®.
Les résultats de phase I, en accord avec ceux de phase III, ont montré avec un recul
de 4 ans, une augmentation très significative de la survie et des fonctions motrices
des patients après une seule injection de ZolgenSMA® dans une veine du bras ou de la
jambe2. Cette firme de biotechnologie a ensuite été rachetée par un grand laboratoire
pharmaceutique, et a annoncé le 24 mai 2019 que la FDA avait accepté la mise sur le
marché du ZolgenSMA® pour le traitement d’enfants atteints de SMA, âgés de près de 2
ans, incluant des enfants pré-symptomatiques. Les résultats ont atteint des niveaux
d’amélioration jamais obtenus dans l’histoire de la maladie, les enfants traités
pouvant s’asseoir, parler, avaler et quelques-uns, marcher. Après des années sans
issue thérapeutique, le ZolgenSMA® est donc le premier et l’unique produit de
thérapie génique approuvé par la FDA pour le traitement de la SMA. Il constitue une
révolution médicale pour les enfants atteints de cette maladie. Comme tout
médicament, l’injection de ZolgenSMA® s’accompagne cependant d’effets secondaires
plus ou moins importants, le plus sérieux étant l’augmentation des enzymes
hépatiques, ce qui pourrait causer d’importants dommages au foie des enfants
traités. Il est donc vital d’associer l’administration de corticostéroïdes à
l’injection de ZolgenSMA®. Ce médicament a une valeur de 2,125 millions de dollars (pour une seule prise) (soit
près de 1,9 million d’euros). Il est donc actuellement le médicament le plus cher au
monde, ce qui a déclenché une polémique, ce coût étant considéré comme abusif [16]. |
Nos travaux, qui représentent une avancée biologique majeure pour le traitement de la
SMA (et d’autres maladies du système nerveux) ont permis, chez la souris modèle de
SMA, la correction du gène anormal, y compris chez le gros animal. Ces travaux ont
ensuite été exploités par une jeune start-up américaine, qui a
développé ZolgenSMA® et effectué un premier essai clinique chez des enfants
souffrant de SMA de type 1, la forme la plus grave de cette maladie. Cet essai
clinique de phase I a montré des résultats extrêmement encourageants, les 15
patients traités étant toujours vivants à l’âge de 4 ans. Sur les 12 patients ayant
reçu une forte dose de ZolgenSMA®, la plupart peuvent s’asseoir sans assistance, se
nourrir et parler, et certains peuvent marcher de façon indépendante. En conclusion,
chez des patients atteints de SMA type 1, une seule infusion intraveineuse d’un AAV9
contenant le gène codant la protéine SMN a augmenté significativement la durée de
vie et entrainé une fonction motrice bien meilleure que dans des cohortes
historiques. D’autres études seront cependant nécessaires pour confirmer
l’efficacité et l’innocuité à très long terme de cette première thérapie. |
L’auteure déclare n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Footnotes |
1.
Verhaart
IEC
,
Robertson
A
,
Wilson
IJ
, et al.
Prevalence, incidence and carrier frequency of 5q-linked spinal
muscular atrophy : a literature review . Orphanet J
Rare Dis.
2017; ; 12 : :124.. 2.
Roberts
DF
,
Chavez
J
,
Court
SD
. The genetic component in child
mortality . Arch Dis Child.
1970; ; 45 :
:33.–38. 3.
Kolb
SJ
,
Kissel
JT
. 2011, Spinal muscular atrophy: a timely
review . Arch Neurol.
2011; ; 68 : (8)
:979.–984. 4.
Lefebvre
S
,
Burglen
L
,
Reboullet
S
, et al.
Identification and characterization of a spinal muscular
atrophy-determining gene . Cell.
1995; ; 80 :
:155.–165. 5.
Monani
UR
. Spinal muscular atrophy: a deficiency in a
ubiquitous protein; a motor neuron-specific disease .
Neuron.
2005; ; 48 :
:885.–896. 6.
Mailman
MD
,
Heinz
JW
,
Papp
AC
, et al.
Molecular analysis of spinal muscular atrophy and modification of
the phenotype by SMN2 . Genet Med.
2002; ; 4 :
:20.–26. 7.
McCarty
DM
. Self-complementary AAV vectors; advances and
applications . Mol Ther.
2008; ; 16 :
:1648.–1656. 8.
Duque
S
,
Joussemet
B
,
Riviere
C
, et al.
Intravenous administration of self-complementary AAV9 enables
transgene delivery to adult motor neurons . Mol
Ther.
2009; ; 17 :
:1187.–1196. 9.
Dominguez
E
,
Marais
T
,
Chatauret
N
, et al.
Intravenous scAAV9 delivery of a codon-optimized SMN1 sequence
rescues SMA mice . Hum Mol Genet.
2011; ; 20 :
:681.–693. 10.
Le
TT
,
Butchbach
LT
,
Zhang
ME
, et al.
SMNDelta7, the major product of the centromeric survival motor
neuron (SMN2) gene, extends survival in mice with spinal muscular atrophy
and associates with full-length SMN . Hum Mol
Genet.
2005; ; 14 :
:845.–857. 11. Barkats
M. Widespread gene delivery
to motor neurons using peripheral injection of AAV vectors (US2019153474
(A1) . May 10.,
2007. 12.
Foust
KD
,
Nurre
E
,
Montgomery
CL
, et al.
Intravascular AAV9 preferentially targets neonatal neurons and
adult astrocytes . Nat Biotechnol.
2009; ; 27 :
:59.–65. 13.
Foust
KD
,
Wang
X
,
McGovern
VL
, et al.
Rescue of the spinal muscular atrophy phenotype in a mouse model
by early postnatal delivery of SMN . Nat
Biotechnol.
2010; ; 28 :
:271.–274. 14. Bevan
AK,
Duque
S,
Foust
KD, et al.
Systemic gene delivery in large species for targeting spinal
cord, brain, and peripheral tissues for pediatric disorders .
Mol Ther.
2011;; 19 ( :
:1971.–80. 15.
Gray
SJ
,
Matagne
V
,
Bachaboina
L
, et al.
Preclinical differences of intravascular AAV9 delivery to neurons
and glia: a comparative study of adult mice and nonhuman
primates . Mol Ther.
2011; ; 19 :
:1058.–1069. |