| |
| Med Sci (Paris). 36(2): 141–146. doi: 10.1051/medsci/2020011.Thérapies géniques de l’amyotrophie spinale
infantile Un morceau d’histoire de la médecine Serge Braun1* 1AFM-Téléthon, 1 rue de l’Internationale,
BP59, 91002Évry,
France |

Vignette (Photo © Inserm - E223). Au lendemain du premier Téléthon de décembre 1987, 150 familles de malades atteints
d’amyotrophie spinale infantile (SMA) se réunissaient à l’initiative de l’AFM pour un
évènement fondateur. La SMA fait partie des milliers de maladies rares (80 % d’origine
génétique) dont le poids socio-économique était complètement ignoré. On sait aujourd’hui
que 350 millions de personnes dans le monde présentent une maladie rare [1], soit la 3e cause de
mortalité, davantage que le diabète et les maladies infectieuses réunies. À cette
époque, peu de laboratoires académiques (et encore moins privés) ne pouvaient se
permettre le risque de consacrer les 10 ans requis le plus souvent pour l’identification
de gènes responsables de maladies. L’initiative Human Genome Project
des NIH (National Institutes of Health) piétinait et seule une petite
poignée de gènes présentant des anomalies ayant des conséquences pathologiques était
connue. Cette réunion des familles SMA était le prélude à la constitution d’une banque de tissus
et d’ADN de maladies rares (la plus importante en Europe) et de la création en 1990 de
Généthon, laboratoire unique en son genre, dédié à la cartographie du génome, mettant en
œuvre pour la première fois des robots conçus spécifiquement à cet effet. À peine deux
ans plus tard, Généthon publiait ce qui sera pendant 10 ans les publications
scientifiques les plus citées au monde : les cartes physiques et génétiques du génome
humain [2, 3]. Les sondes d’ADN générées ont été mises à disposition des laboratoires de biologie
moléculaire du monde entier, offrant à la génétique des maladies rares un formidable
accélérateur de la découverte des gènes humains. Ces outils ont été mis à profit par
l’équipe de Judith Melki et Suzie Lefèbvre (Unité de Recherches sur les Handicaps
Génétiques de l’Enfant, Institut Necker, Hôpital des Enfants Malades), leur permettant
de restreindre progressivement le locus pathologique jusqu’à identifier le gène
SMN (survival of motor neuron) et ses versions
centromérique et télomérique [4].
L’amyotrophie spinale avait enfin une cible génétique clairement démontrée. De l’autre
côté de l’Atlantique, un biochimiste, Gideon Dreyfuss (Université de Pennsylvanie),
travaillait sur un complexe protéique impliqué dans l’épissage de l’ARN et qui
comprenait précisément la protéine SMN [5]. Lorsqu’il prit connaissance de la publication de Suzie Lefèbvre, il
comprit que la protéine qu’il étudiait était à l’origine de la SMA et il décida de
réorienter ses recherches sur les mécanismes moléculaires sous-jacents de la maladie,
devenue pour lui un modèle idéal de décryptage de la régulation de la transcription et
de la traduction de l’ARN. Soutenu alors par l’AFM-Téléthon, tout comme Judith Melki et
Suzie Lefèbvre, il publia une série de travaux essentiels autant pour la recherche
fondamentale que pour la compréhension de la SMA, démontrant que les perturbations de
l’expression de gènes de la synapse neuro-musculaire pouvaient expliquer la sensibilité
particulière des neurones moteurs dans le processus pathologique [6]. |
Une communauté d’équipes de recherche européennes et américaines entreprit un long
travail de décorticage des mécanismes moléculaires de la maladie, appuyés sur de
nombreux modèles cellulaires et animaux : drosophile, xénope, poisson zèbre,
nématodes, souris avec au moins 60 modèles génétiques différents, porc). On sait
aujourd’hui que la maladie est due à un défaut de production de la protéine SMN1. La
mutation homozygote est létale. Seul Homo sapiens, pas même les
primates non-humains, porte une version centromérique appelée SMN2,
susceptible de compenser partiellement SMN1 muté.
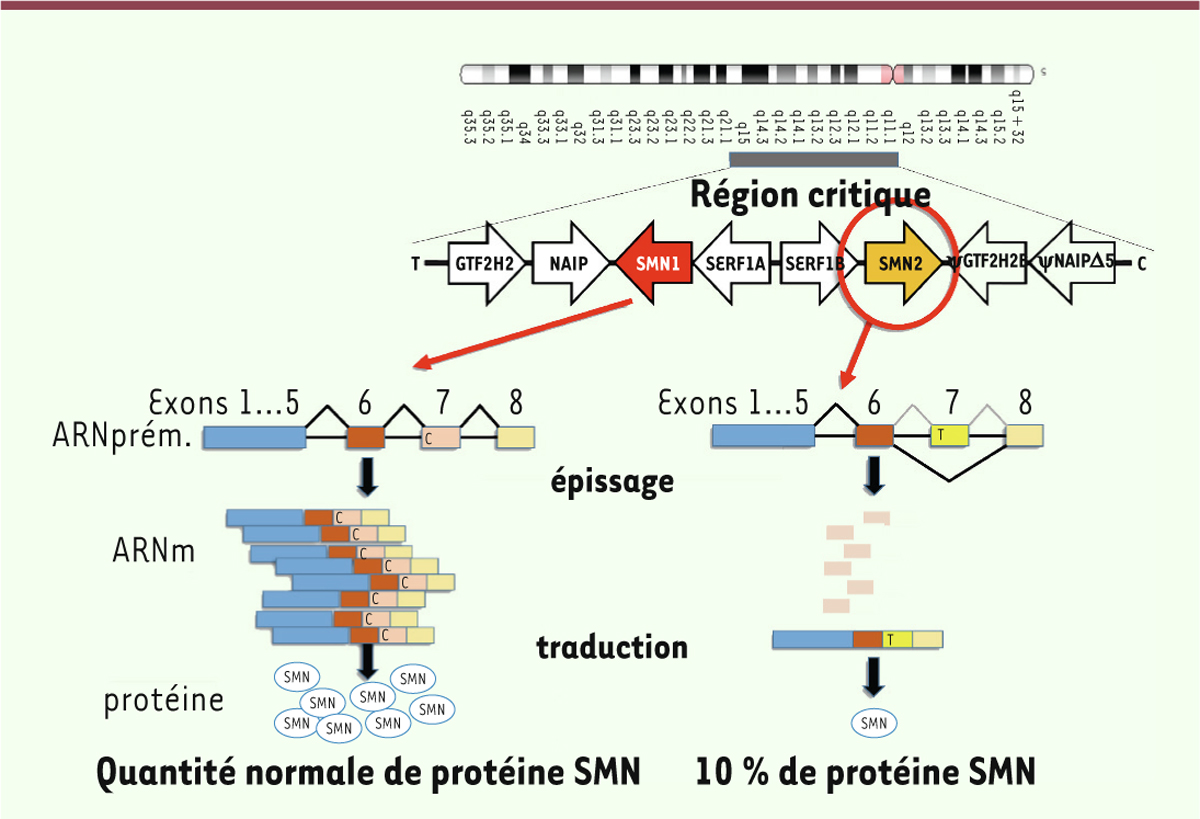
SMN2 possède une substitution C→T dans l’exon 7, rendant moins
efficace l’épissage et la stabilité de l’ARN messager de SMN et par voie de
conséquence une production environ 10 fois moindre de protéine SMN, elle-même
instable (Figure 1). Il existe
une relation inverse entre le nombre de copies de SMN2 et la
sévérité de la maladie (létalité in utero avec 0 copie de
SMN2, phénotype de sévérité décroissante avec le nombre de
copies de SMN2 - jusqu’à 8 copies dénombrées). Cette corrélation
est modulée par des gènes « modificateurs » plus ou moins négatifs tels que
NAIP (neuronal apoptosis inhibitor),
GTF2H2A (general transcription factor IIH,
p44), SERF1A (small EDRK-rich factor 1A,
H4F5) ou protecteurs (comme celui codant la plastine 3) ou des variants
rares de SMN2 tels que la mutation c.859G>C dans l’exon 7 qui
rétablit l’épissage de SMN2. L’élucidation précise de ce mécanisme
de compensation partielle par SMN2 a permis la mise au point d’une
stratégie de réintroduction de l’exon 7 de SMN2 par des
oligonucléotides antisens. Le plus efficace est un morpholino1 de 15 mers ciblant ISS-N1 (intronic splicing silencer
N1), un site intronique inhibiteur de l’épissage. Il augmente
l’inclusion de l’exon 7 de SMN2 en empêchant de manière stérique la
liaison de hnRNP A1 (heterogeneous nuclear ribonucleoprotein A1)
aux deux motifs cibles de la région, et en induisant des réarrangements structuraux
secondaires réduisant des interactions inhibitrices à distance au sein de l’intron 7
(voir pour revue [7]). Douze
ans après la découverte du site intronique inhibiteur, la FDA (Food and Drug
Administration) américaine approuvait le 23 décembre 2016, le premier
traitement de la SMA, le Spinraza™ (nusinersen), un ARN antisens
développé par une société de biotechnologie en partenariat avec une autre société de
biotechnologie.
 | Figure 1. Perte de la protéine SMN1 partiellement compensée par SMN2. Région
critique du chromosome 5 comportant la version télomérique
(SMN1) et centromérique (SMN2) du
gène SMN. La substitution CT conduit à un diminution de copies d’ARN
messager (ARNm) de SMN2 consécutivement à un défaut
d’épissage de l’ARN prémessager, sautant l’exon 7 et conduisant à un
ARNm instable et une quantité de protéine SMN insuffisante. T :
orientation télomérique. C : orientation centromérique. |
À ce jour, plus de 8 400 malades (enfants comme adultes) ont été traités (pour
certains depuis plus de 6 ans) avec ce produit disponible dans plus de 40 pays.
L’antisens est administré par voie intrathécale2 et nécessite des administrations répétées (une montée en charge
trimestrielle la première année, suivie de délivrances quadrimestrielles ensuite).
Plus de 300 dossiers de malades (présentant les types 1 [sévère] à 3 [légère] de la
maladie) ont été réunis à l’occasion de deux études randomisées en double-aveugle
contre placébo (ENDEAR et CHERISH). Elles ont montré un rapport bénéfice-risque
favorable du traitement (mais sans négliger des atteintes rénales et hématologiques
nécessitant une surveillance particulière). Les bénéfices cliniques sont d’amplitude
variable. Ils se traduisent par une amélioration ou une stabilisation de la fonction
motrice à long terme. Les effets cliniques sont d’autant plus marqués que le
traitement est appliqué tôt. Cela s’explique par l’histoire naturelle de la maladie
: les neurones moteurs ne pouvant se régénérer à partir d’une population souche
inexistante et en tous cas non active, le déficit moteur s’accentue au fur et à
mesure de leur dégénérescence. Même si une amélioration peut être observée (que l’on
peut théoriquement relier à une augmentation de la neuritogénèse des motoneurones
restants), celle-ci restera dépendante de la proportion de motoneurones encore
disponibles. Le traitement post-symptomatique apporte un bénéfice réel d’inflexion
du cours de la maladie sans cependant l’inverser complètement [8, 9]. Ces observations renforcent l’intérêt de
traiter le plus tôt possible, en particulier les SMA de type 1, toutes mortelles à
brève échéance ; idéalement, dès la naissance. Une étude de phase II (NURTURE)
réalisée chez 25 nourrissons génotypés type 1 ou 2 (2 ou 3 copies de
SMN2), traités par le Spinraza™ à un stade «
pré-symptomatique » (avant l’âge de 6 semaines), montre que tous les participants de
l’étude étaient toujours en vie 25 mois après l’initiation du traitement, sans
recours à une assistance respiratoire permanente, et présentaient une amélioration
continue de leur état avec notamment la possibilité de s’asseoir et de marcher sans
assistance. Sans le traitement, la plupart de ces malades seraient soit décédés,
soit dépendants d’une assistance respiratoire (en moyenne avant l’âge de 13,5 mois)
[10] |
Une loterie controversée Le 17 décembre 2019, était annoncée la mise en place d’un programme d’accès
gratuit (Global Managed Access Program) au Zolgensma®, la
thérapie génique autorisée aux États-Unis pour l’amyotrophie spinale et en
cours d’examen en Europe et au Japon. Dans l’attente de sa
commercialisation, le laboratoire et sa filiale américaine qui le produisent
prévoient de mettre gratuitement à disposition, à compter du 2 janvier 2020
(premières livraisons en février), 100 doses de thérapie génique pour les
bébés de moins de deux ans dans les pays qui n’ont pas encore aujourd’hui
d’autorisation de mise sur le marché (hors États-Unis donc) ou de programme
d’accès anticipé. Une autre première dans un dossier déjà prolifique : cette
mise à disposition se fera par tirage au sort des bébés de moins de deux ans
éligibles à la thérapie génique dont les dossiers médicaux auront été
adressés au laboratoire par leurs médecins. Très concrètement, les
dispositions affichées prévoient que 1) seuls les médecins de centres de
référence appliquant les « meilleurs standards de prise en charge » peuvent
soumettre leurs patients, 2) les centres habilités devront être équipés et
expérimentés pour la délivrance de telles thérapies géniques, 3) les
critères d’éligibilité des malades sont calqués sur ceux qui ont été établis
dans le cadre du dossier de mise sur le marché de la Food and drug
administration (FDA) ou de l’essai européen STRIVE EU. Les cliniciens sont
partagés sur des critères plus précis (0 copie de SMN1 et 2 ou 3 copies de
SMN2 ? priorité donnée aux malades présymptomatiques ?). Les pays doivent
avoir approuvé l’importation du ZolgenSma® sur leur territoire. Ainsi,
toutes les deux semaines, 4 patients seront tirés au sort parmi les patients
éligibles mettant en compétition plusieurs milliers d’enfants à travers le
monde (ce qui revient à donner accès au traitement à 1 ou 2 enfants par
pays). Ce programme est assujetti aux réglementations nationales en matière
de santé. Ainsi, il ne concerne pas la France qui bénéficie du régime
particulier des autorisations temporaires d’utilisation (ATU), offrant
l’accès (et le remboursement) de traitements dans l’attente de leur
commercialisation (il a déjà permis à 7 bébés français de recevoir le
traitement sous ATU nominative aux CHU de Toulouse, Necker et
Strasbourg. Les bioéthiciens sont très partagés sur une telle mesure qui peut s’assimiler
à une forme de roulette russe pour des enfants. Les associations de malades
condamnent dans leur majorité ce principe de loterie. Des initiatives
individuelles appuyées sur des cagnottes participatives (par exemple en
Belgique, la famille de la petite Pia qui a récolté les 2 millions d’euros
nécessaires à son traitement) ne permettent pas non plus de répondre aux
besoins des milliers de malades concernés. Il est clair que les difficultés de production ont concouru à cette
situation. La firme pharmaceutique explique que, du fait de contraintes de
fabrication, elle se concentre sur la fourniture de traitements aux pays où
le médicament est approuvé (ou en attente d’approbation). Il possède une
installation américaine autorisée (et qui fournira les cinquante premières
doses de ce programme d’accès gratuit) et deux usines devraient entrer en
service en 2020. Deux nouvelles usines sont actuellement en cours de
construction pour un début de production en 2021. Il n’est pas certain
qu’elles seront en mesure de couvrir les besoins. La controverse alimente le dossier déjà très nébuleux des coulisses de la
fixation du prix des médicaments innovants et du risque de plus en plus
marqué d’impasse économique et éthique d’une telle politique, que seule une
rupture technologique de la bioproduction permettra de résoudre.
|
Outre les incertitudes qui pèsent sur le risque de toxicité liée à un traitement
chronique, on peut considérer que la pharmacocinétique d’un antisens administré sous
forme de bolus très espacés n’est pas optimale du point de vue de la cinétique
d’action. De plus, la surexpression de SMN2 n’est peut-être pas de
nature à compenser totalement l’absence d’expression de SMN1. Cet
antisens, administré par voie intrathécale (nécessaire pour obtenir des
concentrations thérapeutiques dans la moelle épinière) exclut de fait la correction
de tissus périphériques potentiellement impliqués dans la maladie, en particulier
les muscles squelettiques [11]. Son administration est délicate et parfois impossible pour les
malades ayant subi une arthrodèse3 destinée à
soutenir la colonne vertébrale. Dans ce contexte, une thérapie génique par transfert
du gène SMN1, à visée systémique et par une prise unique, apparaît
une alternative logique. |
La thérapie par AAV et ZolgenSMA ™De manière quasi-concomitante à la découverte du gène SMN, Généthon
opérait une mue stratégique décisive, pour devenir une biotech à but non-lucratif,
dédiée à la thérapie génique des maladies rares. L’une des deux technologies de
transfert de gène privilégiée dans ce laboratoire repose sur les virus AAV (virus
associés à l’adénovirus). C’est ainsi que l’équipe dirigée par Martine Barkats
(Inserm, directrice d’équipe à Généthon-Évry puis à l’Institut de Myologie-Paris)
réalisa les travaux pionniers démontrant l’efficacité de l’AAV9 sous forme double
brin (scAAV9) administré par voie intraveineuse dans un modèle murin de la SMA
[12, 18] (→).
(→) Voir la Synthèse de M. Barkats, page 137 de ce numéro
En 2009, après que Martine Barkats eut, pendant près de 18 mois, tenté vainement de
publier ses travaux dans la prestigieuse revue Nature
Biotechnology, cette même revue publiait ceux de l’équipe américaine
dirigée par Brian Kaspar décrivant des résultats similaires, mais sur un nombre
d’animaux et une durée de suivi moins étoffés [13]. Brian Kaspar fonda alors une société de
biotechnologie avec l’aide de Jerry Mendell, un clinicien pionnier de la thérapie
génique neuromusculaire, et développa un scAAV9-SMN délivré par voie systémique chez
les malades SMA de type 1. La société leva sur le marché américain les centaines de
millions de dollars de capitaux nécessaires et, en moins de 5 ans, le produit (le
ZolgenSMA™) obtint de la FDA l’autorisation de mise sur le marché en
mai 2019. Quelques semaines auparavant, cette firme de biotechnologie était rachetée
par un géant pharmaceutique pour 8,7 milliards de dollars (soit environ 7,8
milliards d’euros), juste après que la firme de biotechnologie eut régularisé la
situation de propriété intellectuelle, sous forme de contrat de licence auprès de
Généthon qui possède 2 des 5 brevets clés qui encadrent ce produit [18]. Le ZolgenSMA™ est autorisé pour le traitement d’enfants atteints de SMA
âgés de moins de 2 ans et pesant moins de 13,6 kg. Ceci inclut de fait les enfants «
pré-symptomatiques ». Cette avancée est majeure, d’autant qu’il s’agit du premier
médicament de thérapie génique administré par voie systémique, toutes maladies
confondues, et du premier médicament de thérapie génique pour une maladie
neuromusculaire. La FDA avait délivré une autorisation pour les malades « mutés dans
le gène SMN1 », ce qui, potentiellement pourrait englober
l’ensemble des patients SMA. La restriction aux tout jeunes malades pourrait
s’expliquer, d’une part par le fait que le développement clinique a été réalisé sur
une population restreinte d’enfants de moins de 7 mois, mais aussi par le modèle
économique et les difficultés de production d’un tel vecteur ; les deux aspects
pouvant être partiellement liés. |
ZolgenSMA ™, une question de coût Le prix très élevé du ZolgenSMA™ revendiqué (1,9 million d’euros pour une
dose) s’appuie sur une série d’arguments et de calculs qui font débat (voir par
exemple [14]). Un des
critères repose sur l’économie réalisée en quelques années par rapport au coût du
Spinraza™ d’environ 400 000 dollars par an et par patient. On peut
s’interroger sur une tendance pernicieuse d’inflation des prix qui
s’auto-entretiendrait (le prix du Spinraza™ est-il lui-même déjà justifié
?). Les rachats d’entreprises biotechnologiques parfois mono-produit (ce qui était
le cas de la firme de biotechnologie ayant développé le ZolgenSMA® à l’origine) à
coup de milliards ne contribuent-ils pas à renchérir les coûts d’amortissement du
médicament commercialisé ? La question du remboursement de traitements aussi onéreux
est d’ores et déjà posée. Elle véhicule intrinsèquement un risque avéré d’inégalité
d’accès pour les malades, y compris du fait des politiques de remboursement
saucissonnées par sous-groupes de malades et très différentes d’un pays à l’autre
(certains pays refusent même de rembourser ces deux traitements). Elle vient aussi
télescoper le principe de l’Autorisation temporaire d’utilisation (ATU) en France
qui permet aux malades d’accéder au traitement tout de suite après une autorisation
de mise sur le marché (AMM) et avant même que les conditions de remboursement soient
définies. C’est même la soutenabilité des dépenses liées aux médicaments innovants
qui est en cause. Une part non-négligeable du prix du ZolgenSMA™ tient aussi à son coût de
production. La dose de vecteur utilisée (2x1014
vector genomes [vg] par kg) requiert au moins plusieurs centaines
de litres de production par des lignées cellulaires en fermenteur. On comprend
rapidement l’impossibilité de répondre aux besoins théoriques de traitement de
15 000 malades pour les seuls pays occidentaux (plusieurs millions de litres !),
même en multipliant les surfaces de production. À titre comparatif, la quantité de
particules virales à produire pour ce médicament est 1 milliard de fois supérieure à
celle de vaccins viraux pour lesquels on parle déjà de pénurie ! L’EMA, l’Agence
européenne du Médicament, qui examine la demande d’AMM européenne du
ZolgenSMA™, a questionné la société pharmaceutique à propos de la
bioproduction du médicament. Il est donc devenu indispensable d’améliorer d’au moins
un facteur 100 les rendements de production de cette thérapie génique. Cela ne peut
pas se faire sans la mise au point de technologies de rupture concernant chaque
étape du procédé, mais peut-être même la mise en œuvre de procédés de production
complètement originaux. C’est un défi majeur pour la thérapie génique au sens large,
alors que la FDA anticipe une mise sur le marché de 40 nouveaux médicaments de
thérapie génique d’ici 2022 et s’adressant potentiellement à des millions de
malades4. Le défi est aussi de s’assurer
une indépendance sanitaire nationale. Comme dans d’autres domaines de l’innovation
médicale, la France a été en pointe pour faire émerger ces thérapeutiques et, faute
de moyens notamment financiers, elle voit ses avancées exploitées par des acteurs
étrangers dont les fruits (les médicaments sur le marché) vont nous revenir à des
conditions économiques qui en compromettent l’accès. Les acteurs publics comme
privés n’ayant pas pris la mesure des progrès rapides de la thérapie génique ont
malheureusement manqué l’opportunité d’asseoir une filière industrielle porteuse.
Mais il est encore temps ; l’innovation en bioproduction représente donc une seconde
chance à saisir. |
D’autres défis sont à surmonter. S’il faut adapter la pratique médicale en prenant en
compte les nouveaux phénotypes des patients traités et positionner ces traitements
dans la meilleure fenêtre d’efficacité thérapeutique, il convient aussi, pour un
maximum d’efficacité, de traiter avant que la maladie ne se soit déclarée. C’est ce
que tendent à montrer les données collectées aussi bien avec le Spinraza™
qu’avec le ZolgenSMA™ [15]. Cela repose donc sur un dépistage systématique de la population dès
la naissance. Celui-ci nécessite un test génétique ciblé sur le locus
SMN. Des programmes pilotes de dépistage néonatal de
l’amyotrophie spinale sont déjà à l’œuvre aux États-Unis, à Taiwan, en Belgique, en
Allemagne, et en Italie ; d’autres sont en préparation en Espagne et dans d’autres
états européens. Les autorités françaises peinent à prendre cette décision. D’autres stratégies thérapeutiques sont activement étudiées. La plus avancée (au
stade des essais de phase III) est le Risdiplam, une molécule pharmacologique
simple, capable, comme les antisens mais sans leurs effets secondaires, de provoquer
la réintroduction de l’exon7 de SMN2. Un autre avantage par rapport
aux antisens est le fait qu’elle s’administre par voie orale, et ce, de manière
quotidienne [16]. D’autres
stratégies visant l’ARN ou la protéine SMN ou des mécanismes non-spécifiques de
neuroprotection font aussi l’objet d’essais cliniques dans la SMA. On peut imaginer
à terme une optimisation du bénéfice clinique par la combinaison de certaines de ces
thérapeutiques (Figure 2).
Dans tous les cas, il sera necessaire d’être attentif aux effets toxiques potentiels
de ces nouvelles thérapies.
 | Figure 2.Principe de la combinaison de thérapeutiques de la SMA et du moment et de
la durée optimales de traitement. La protéine SMN est nécessaire au
développement et à la survie des neurones moteurs. La dépendance
vis-à-vis de SMN peut se manifester dès la période in utero. Si,
idéalement, le traitement devrait être initié durant la période de
gestation, il est important qu’il soit entrepris au plus tôt dès le
diagnostic, voire même à la suite d’un dépistage systématique à la
naissance. JNM : jonction neuro-musculaire (modifié de [ 17]). |
|
La SMA constitue un exemple d’une démarche logique qui a conduit de l’élucidation du
mécanisme génétique de la maladie à deux stratégies thérapeutiques innovantes de
substitution par une séquence ADN codante ou de modulation pharmacologique de
l’épissage de l’ARN. Les preuves de concept objectivées par les bénéfices cliniques
spectaculaires obtenus ouvrent des perspectives cliniques élargies à bien d’autres
applications médicales. Il est frappant aussi de constater que ce continuum
scientifique qui a abouti à ces avancées majeures a été assuré par une association
de malades engagée sans faiblir sur le terrain de l’innovation de rupture. Sans
négliger la recherche de mécanismes physiopathologiques encore à préciser et de
raffinements des thérapies, les défis immédiats sont désormais à la fois industriels
et socio-économiques. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Footnotes |
1. Nguengang
Wakap
S,
Lambert
DM,
Olry
A, et al.
Estimating cumulative point prevalence of rare diseases: analysis
of the Orphanet database . Eur J Genet.
2019; Sep 16. doi: 10.1038/s41431-019-0508-0.. 2.
Weissenbach
J
,
Gyapay
G
,
Dib
C
, et al.
A second-generation linkage map of the human
genome . Nature.
1992; ; 359 :
:794.–801. 3.
Cohen
D
,
Chumakov
I
,
Weissenbach
J
. A first-generation physical map of the human
genome . Nature.
1993; ; 366 :
:698.–701. 4.
Lefebvre
S
,
Bürglen
L
,
Reboullet
S
, et al.
Identification and characterization of a spinal muscular
atrophy-determining gene . Cell.
1995; ; 80 :
:155.–165. 5.
Liu
Q
,
Dreyfuss
G
. A novel nuclear structure containing the survival
of motor neurons protein . EMBO J.
1996; ; 15 :
:3555.–3565. 6.
Zhang
Z
,
Pinto
AM
,
Wan
L
, et al.
Dysregulation of synaptogenesis genes antecedes motor neuron
pathology in spinal muscular atrophy . Proc Natl Acad
Sci USA.
2013; ; 110 :
:19348.–19353. 7.
Ottesen
EW
. ISS-N1 makes the first FDA-approved drug for
spinal muscular atrophy . Transl Neurosci.
2017; ; 8 :
:1.–6. 8.
Darras
BT
,
Chiriboga
CA
,
Iannaccone
ST
, et al.
Nusinersen in later-onset spinal muscular atrophy: long-term
results from the phase 1/2 studies .
Neurology.
2019; ; 92 :
:e2492.–e2506. 9.
Finkel
R
,
Chiriboga
C
,
Vajsar
J
, et al.
Treatment of infantile-onset spinal muscular atrophy with
nusinersen: a phase 2, open-label, dose-escalation study .
Lancet.
2016; ; 388 :
:3017.–3026. 10.
De Vivo
DC
,
Bertini
E
,
Swoboda
KJ
, et al.
Nusinersen initiated in infants during the presymptomatic stage
of spinal muscular atrophy: Interim efficacy and safety results from the
Phase 2 NURTURE study . Neuromuscul Disord.
2019; ; S0960–8966 :
:31127.–31127. 11.
Guettier-Sigrist
S
,
Coupin
G
,
Braun
S
, et al.
On the possible role of muscle in the pathogenesis of spinal
muscular atrophy . Fundam Clin Pharmacol.
2001; ; 15 :
:31.–40. 12.
Dominguez
E
,
Marais
T
,
Chatauret
N
, et al.
Intravenous scAAV9 delivery of a codon-optimized SMN1 sequence
rescues SMA mice . Hum Mol Genet.
2011; ; 20 :
:681.–693. 13.
Foust
KD
,
Nurre
E
,
Montgomery
CL
, et al.
Intravascular AAV9 preferentially targets neonatal neurons and
adult astrocytes . Nat Biotechnol.
2009; ; 27 :
:59.–65. 15.
Dangouloff
T
,
Servais
L
. Clinical evidence supporting early treatment of
patients with spinal muscular atrophy: current perspectives .
Ther Clin Risk Manag.
2019; ; 15 :
:1153.–1161. 16.
Poirier
A
,
Weetall
M
,
Heinig
K
, et al.
Risdiplam distributes and increases SMN protein in both the
central nervous system and peripheral organs .
Pharmacol Res Perspect.
2018; ; 6 : :e00447.. 17.
Bowerman
M
,
Becker
CG
,
Yáñez-Muñoz
RJ
, et al.
Therapeutic strategies for spinal muscular atrophy: SMN and
beyond . Dis Model Mech.
2017; ; 10 :
:943.–954. 18. Barkats
M. SMA : de la
découverte du gène à la thérapie génique . Med Sci
(Paris).
2020;; 36 :
:137.–40. |