| |
| Med Sci (Paris). 36(2): 153–159. doi: 10.1051/medsci/2019264.Les tests génétiques en libre accès Régulation par le marché, ou régulation médicale
? Henri Jautrou1* 1LISST-Cers (UMR 5193), Université Toulouse II, UFR Sciences
Espaces et Sociétés, Département de Sociologie, 31058Toulouse Cedex 9,
France |

Vignette (Photo © Inserm/Aviesan). Les tests génétiques en accès libre (ou auto-tests) sont vendus (notamment sur Internet)
en l’absence de prescription médicale et d’accompagnement par un professionnel de santé
lors de l’accès aux résultats1. Ils sont
progressivement sortis du monde de l’expertise (le domaine de la recherche clinique où
seuls des généticiens présidaient à leur développement et à leur administration au sein
d’un service clinique) où ils étaient cantonnés, en diversifiant leur modalité d’accès
ainsi que leur contenu [1, 2]. Le caractère « innovant » de
ces dispositifs se joue sur de nombreuses dimensions, ce qui multiplie les sources de
débat, voire de controverse. Le libre accès à ces tests, par exemple, va à l’encontre de
certaines législations nationales ou fédérales, ou n’a pas été anticipé par les
autorités de régulation, ce qui fait ressortir l’existence de situations qui, proches de
vides juridiques, évitent aux entreprises qui ont le statut de laboratoire d’avoir à
effectuer des demandes de certification pour mettre leurs tests sur les marchés [3-5]. Alors que, aux États-Unis comme en Europe, les
autorités de régulation sont en train de mettre fin à cette situation de « vide
juridique », cela ne règle pas la question du libre accès. Or avec l’avènement de la
génomique, le contenu des tests s’est fortement diversifié au détriment de leur
validité clinique et utilité clinique. Ces
dernières se révèlent faibles voire nulles [6] (→).
(→) Voir la Chronique génomique de B. Jordan, m/s n° 3, mars
2012, page 325
Cette diversification, qui constitue un autre exemple du caractère « innovant » du
marché2, repose sur le développement de tests
de prédispositions pour des maladies multifactorielles (cancers, maladie de Parkinson,
etc.), et pour toutes sortes de caractéristiques physiologiques ou comportementales. Le
calcul des risques (ou prédispositions) est construit sur la base
d’importants choix épistémiques, ce qui entraîne des différences entre les résultats
délivrés d’une entreprise à l’autre (par exemple, en fonction des caractéristiques de la
maladie que l’on cherche à tester, le choix de la population de référence peut se faire
autour de différences homme/femme, ou de différences d’âge) [7, 8] (→).
(→) Voir le Forum de P. Ducournau et al., m/s n°
1, janvier 2011, page 95
Les scientifiques liés à l’industrie (dont le biologiste généticien Craig Venter [9]) (→) soulignent par
ailleurs les limites de la génétique [8]. Les
produits les plus élaborés prennent en compte de très nombreux marqueurs génétiques et
sont sujets à évolution, en fonction des analyses relatées dans la littérature
scientifique, ou réalisées par les entreprises elles-mêmes. Le libre accès étend ainsi
le domaine d’application des tests au-delà de la clinique, en diminuant toutefois leur
pertinence médicale (par exemple, le ciblage de « patients » asymptomatiques par un test
initialement dédié à des patients symptomatiques) [10] (→).
(→) Voir la Chronique génomique de B. Jordan, m/s n° 11, novembre
2008, page 325
(→) Voir la Chronique génomique de B. Jordan, m/s n° 12, décembre
2015, page 1137
En réponse aux faibles validité et utilité cliniques
des tests, certaines entreprises arguent qu’il ne s’agit pas de dispositifs médicaux,
mais de dispositifs informationnels ayant une utilité personnelle
(relative à des « styles de vie » : comportement alimentaire, etc.). L’incertitude
inhérente à ce dernier concept (qui est nouveau, et non issu du monde clinique) explique
en partie pourquoi ces dispositifs ne sont pas intégrés dans le système de santé. Depuis leur apparition non régulée, à la fin des années 1990, jusqu’à l’apparition d’un
marché officiel via les premières certifications délivrées en 2015 à
l’échelle fédérale aux États-Unis, une vingtaine d’années auront été nécessaires pour
parachever la sortie de ces tests génétiques de la « clinique ». Qu’en est-il de la régulation de ces produits au statut médical ambigu ? Nous étudierons
cette question à travers deux prismes, celui du marché lui-même, puis celui du nouveau
Règlement européen sur les DIV (diagnostics in vitro)3 qui, lors de son entrée en vigueur en 2022, mettra
un terme aux vides juridiques précédemment évoqués, tout en permettant les ventes en
libre accès via des certifications. Nous n’évoquerons pas les
certifications délivrées en Europe à partir de 2014, étant donné qu’elles relèvent de
législations nationales qui seront remplacées par le nouveau Règlement (certaines
d’entre elles jouent sur les « vides juridiques » que nous avons évoqués, et qui seront
comblés en 2022). |
Une régulation « par le marché »… L’aspect hautement compétitif du marché des tests génétiques reflète ses dimensions
innovantes. L’étude que nous avons réalisée [1, 2] se concentre sur les tests
dédiés à la santé (maladies, pharmacologie), à la physiologie, aux performances et
aux comportements, et exclut ceux dédiés à la filiation ou à « l’ancestralité ». Ce marché est extrêmement dynamique. S’il est en pleine expansion, à en juger par le
nombre annuel d’entreprises qui arrivent sur le marché (i.e. via
une offre qui comprend a minima un type d’auto-test), il est aussi
extrêmement volatil (Tableau
I), un fait que d’autres auteurs avaient repérés dès 2010 [11]. Les entreprises cessent
massivement leur offre et sont, dans l’ensemble, éphémères (moins de cinq ans), ou
entrent dans des processus de fusion-acquisition (parfois en série). Ce
renouvellement important est typique des marchés encore jeunes et hautement
concurrentiels [12].
Tableau I.
|
2000 |
2001 |
2002 |
2003 |
2004 |
2005 |
2006 |
2007 |
2008 |
2009 |
2010 |
2011 |
2012 |
n.d |
Total |
| Apparition d’offres |
1 |
1 |
2 |
6 |
6 |
3 |
7 |
19 |
16 |
22 |
14 |
14 |
17 |
2 |
130 |
|
| Disparition d’offres |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
3 |
5 |
7 |
8 |
10 |
7 |
3 |
44 |
Distribution des entreprises en fonction de la date d’apparition ou de
disparition de leur offre d’auto-tests. nd : non disponible (concerne
toutefois des apparitions ultérieures à 2008 et antérieures à 2013). |
Aux-États-Unis, la montée en puissance de la régulation, à partir de 20134, a mis fin à nombre d’offres, ce qui ne
s’oppose pas, dans l’absolu, à un renouveau du marché. Pour l’heure, seule 23andMe a
obtenu des certifications aux États-Unis comme dans certains pays européens.
Outre-atlantique, l’entreprise obtient progressivement des certifications pour de
nouveaux tests (ce qui reste encore limité par rapport au grand nombre de maladies
considérées par son offre jusqu’en 2013), notamment en raison de sa capacité à
démontrer que les utilisateurs comprennent les limites des produits (les
certifications précisent que les tests n’établissent pas de diagnostic et qu’ils ne
peuvent donner lieu à des prises de décisions cliniques). L’évolution des produits s’est également accompagnée d’une « guerre des prix ». Les
offres les plus complètes sont maintenant vendues moins de 200 dollars (environ 182
euros), alors que les offres de lancement étaient initialement fixées autour de
1 000 dollars (environ 913 euros) (pour des produits de surcroît moins complets). La
remontée des tarifs de 23andMe (fixés auparavant à 99 dollars (environ 90 euros) fin
2011, et maintenant à 179 dollars (environ 163 euros) pourrait être due à une baisse
de la concurrence (voire à une situation proche du « monopole »). L’entreprise a
d’ailleurs été accusée de vendre ses tests à perte afin d’éliminer ses
concurrents5 [13] (→).
(→) Voir l’Éditorial de B. Jordan, m/s n° 3, mars 2014, page
227
Dans tous les cas, alors que les vides juridiques précédemment évoqués sont en train
d’être comblés6,, 23andMe a fait bon usage d’une
« temporalité juridique », c’est-à-dire que cette entreprise a su créer une
importante base de données à partir d’un prix très bas sur une offre non régulée et
drainant un large public (i.e. offre réunissant un très grand
nombre de maladies). Elle sait par ailleurs jouer sur des ambigüités juridiques
puisque, en France par exemple, où la vente libre est formellement interdite, elle
vend des « données [génétiques] brutes » (via ses tests
d’ancestralité), ce qui laisse la possibilité aux utilisateurs d’accéder à des
analyses de santé, indirectement via des logiciels conçus par
d’autres entreprises. Cette stratégie avait été adoptée en 2013 aux États-Unis,
lorsque la FDA avait sommé l’entreprise de cesser ses ventes [13, 14]. Dans tous les cas, 23andMe, qui détient une réelle capacité de
communication en raison de ses liens avec de grands acteurs des TIC (technologies de
l’information et de la communication), est très présente dans l’espace numérique
(par exemple, elle créée des buzz médiatiques autour de ses offres ponctuelles7,), et fait par ailleurs valoir sa compétitivité
en jouant sur des termes que même la communauté académique ne relève pas8. Enfin, le marché est en cours de structuration, ce qui est logique étant donné que
l’industrie scientifique se développe via des réseaux
inter-organisationnels étendus (un phénomène qui a permis, dans les années 1990, à
des entreprises du marché des sciences de la vie de devenir « dominantes ») [15]. Cette structuration se
joue dans plusieurs dimensions : sectorielle ou disciplinaire, avec les partenariats
scientifiques ou techniques (informatique, pharmacologie, optique, etc.),
professionnelle, avec la médecine (recherche biomédicale et vente de «
portefeuille de clients », distribution via
des médecins internes ou externes aux entreprises et spécialisés ou non en
génétique, etc.), marketing, avec les distributeurs (depuis la distribution médicale
jusqu’à la distribution numérique et la grande distribution), commerciale, avec les
partenariats économiques ou la valorisation de la recherche (co-développement de
produits très divers, depuis la médecine jusqu’au « bien-être »), financière, avec
les investisseurs, etc. Les partenariats économiques peuvent d’ailleurs conférer une
nouvelle « identité » aux entreprises d’auto-tests. L’entreprise 23andMe, qui a de
réelles compétences en informatique en raison de ses liens avec de grands acteurs
des TIC, acquiert ainsi certaines caractéristiques des acteurs pharmaceutiques
(via le partage des coûts de développement de médicaments et
des profits9,). Son profil se rapproche
maintenant de celui de deCODE Genetics, l’une de ses anciennes
concurrentes qui a cessé ses offres en libre accès en 2009, à la suite de sa
faillite. À titre indicatif, la comparaison, via deux schémas, des
liens respectivement financiers ([2], p. 248)
et commerciaux ([2], p. 249) développés par
les principales entreprises américaines d’auto-tests montre que celles qui sont les
plus interconnectées sur le plan financier, le sont également sur le plan commercial
(et collaboratif). Le modèle des chaînes interdépendantes
(chain-linked model) développé par des économistes, identifie
d’ailleurs l’existence de boucles rétroactives et permanentes entre la recherche et
le marché [16,17], et convient bien pour
décrire le modèle économique de certaines des entreprises du marché des auto-tests.
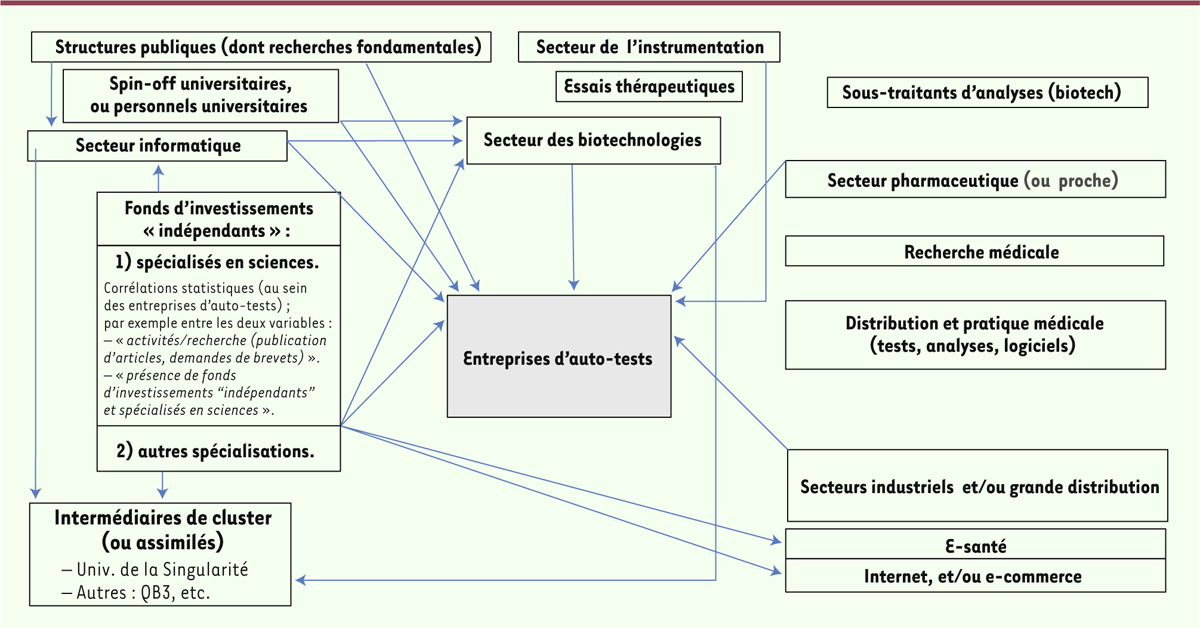
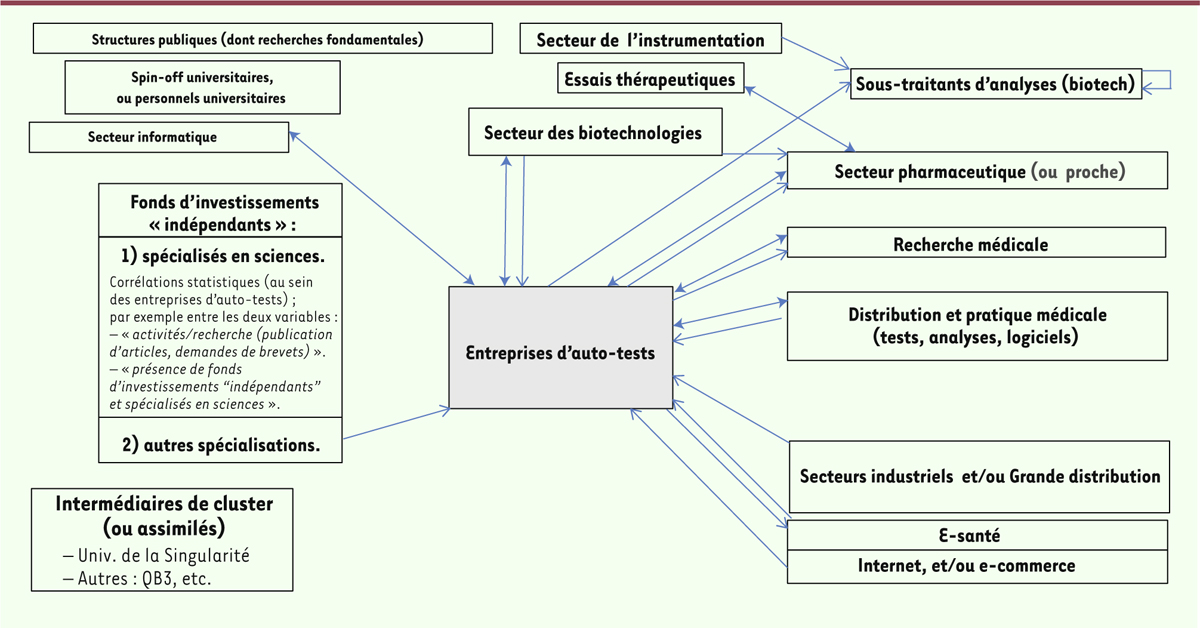
La simplification de ces schémas (Figures
1 et 2) fait ressortir la double activité de ces entreprises, qui, d’un
côté, intégrent l’apport financier de grands acteurs scientifiques, et qui, de
l’autre, développent des partenariats scientifiques avec eux, tout en collectant en
parallèle une palette très large de données, via des collaborations
avec des acteurs extrêmement variés (voire en les rachetant, comme dans le cas du
rachat, par 23andMe, de l’acteur de e-santé CureTogether).
 | Figure 1. Liens financiers des entreprises d’auto-tests (principalement
américaines). Ces dernières sont représentées par la zone grisée. Le
sens des flèches correspond à celui des investissements (principalement
monétaires). |
 | Figure 2. Liens commerciaux des entreprises d’auto-tests (principalement
américaines). Ces dernières sont représentées par la zone grisée. Le
sens des flèches « pleines » correspond à celui des flux monétaires
(achats de produits, de services, etc., voire rachat de la structure).
Les flèches en pointillés (et ici à double sens) concernent des
partenariats économiques ou des collaborations scientifiques (fondées le
plus souvent sur des liens commerciaux). |
En d’autres termes, les entreprises qui domineront à la fois le marché médical et
celui des auto-tests seront en partie sélectionnées par des logiques de marché
(concurrence, concentration, etc.). Deux points sont ainsi à noter :
-
L’argument marketing, qui est mis en avant par 23andMe, à savoir que la
collecte de données issues des « consommateurs » est réalisée avec une
finalité liée à la recherche, n’est pas une information fausse, mais
partielle. Ces données ont peu d’intérêt en elles-mêmes, c’est-à-dire en
l’absence d’une collecte « totale » qui draine des données issues d’une
réelle pratique médicale (généralistes et généticiens), pratique qui
accède non seulement au corps des « patients » (et aux données
inhérentes), mais aussi au corps de patients atteints de pathologies.
Utilisé dans la littérature académique, le concept de « marché biface »
[18] rend
ainsi invisible le modèle économique que développe des entreprises ayant
des compétences en TIC (ou NTIC, N pour nouvelles). L’information ne
circule donc pas uniquement en « C-to-B »
(consumer-to-business), mais également en « B-to-B
» (business-to-business) à partir de généralistes par
exemple [2] (Figure 2). Ces derniers
contribuent ainsi à transformer la structure de la profession médicale,
et notamment de la « clinique » (auparavant seule détentrice de ce type
de données) [2].
-
Les médecins généralistes (et les patients) seront amenés à jouer un rôle
plus important qu’auparavant dans la collecte de données liées aux
traitements thérapeutiques (collecte qui, là encore, peut être assurée
en partie via les NTIC) (Figure 2). Outre l’interrogation
induite par le statut des médicaments dits « off label
» [2], les essais
cliniques deviennent, avec l’avènement des NTIC, moins dépendants de la
clinique « académique ». Comme le souligne un rapport de l’Académie des
Sciences, de l’Ingénierie et de la Médecine, le contexte des essais
cliniques est celui d’une pénurie de patients et de médecins (notamment
les généralistes) que des outils électroniques « facile à
utiliser » (user-friendly) contribueront à
combler [19].
La diversité des NTIC (outils de communication, de gestion de données,
de formation continue, etc.) apparaît donc être un élément facilitateur
de l’enrôlement des patients et des médecins.
|
… ou une régulation par la profession médicale ? Comme mentionné précédemment, le nouveau Règlement européen sur les DIV légifère sur
les tests génétiques vendus en libre accès. En 2012, le projet de Règlement
indiquait que « l’énorme progrès technique et scientifique » lié
aux biotechnologies se double du fait que « les pays de l’UE interprètent et
implémentent les règles actuelles de manières différentes »10. La première mouture du Règlement a été
élaborée par la Commission Européenne, puis a fait des navettes entre le Parlement
Européen et le Conseil de l’Union Européenne. En ce qui concerne les auto-tests,
deux options se présentaient [20]. Alors que le Parlement Européen mettait l’accent sur l’encadrement
professionnel des tests, ce qui correspond au modèle médical traditionnel
(prescription, et interdiction de la publicité pour les produits médicaux), le
Conseil de l’Union Européenne s’orientait vers une régulation plutôt portée sur les
tests en eux-mêmes (qualité scientifique et clinique, exactitude des arguments
publicitaires, etc.), que ce soit quant à leur évaluation avant la mise sur le
marché ou leur surveillance consécutive. Le texte final a été adopté en 2017, et entrera en vigueur en 2022. Dans l’ensemble,
c’est l’approche proposée par le Conseil qui a été finalement adoptée. Les
dispositifs destinés à l’analyse de la génétique humaine relèvent de la classe C
(sur une échelle allant jusqu’à la classe D pour les dispositifs les plus risqués),
ce qui impose une évaluation de leur qualité (sécurité, performances, etc.) ainsi
qu’un plan de surveillance après commercialisation. À l’image de ce qu’imposent les
certifications américaines délivrées à 23andMe, les fabricants auront l’obligation
de stipuler les limites de leurs produits (par exemple leurs faibles validité et
utilité cliniques) et ne devront pas induire en erreur l’utilisateur ou le patient
(publicité, informations sur le produit, dénomination du produit, mode d’emploi), au
regard du but, de la sécurité et de la performance du dispositif. Les tests
certifiés seront répertoriés par un système d’identification unique au sein d’une
base de données (Eudamed) qui rendra publique les informations inhérentes aux tests
(y compris des informations sur les organismes notifiés,
c’est-à-dire les comités d’experts qui délivrent les certificats et qui ne seront
pas nécessairement composés de médecins11),
dans un langage intelligible pour l’acheteur (ce qui comprend une traduction dans la
langue officielle du pays de vente). Le nouveau Règlement fixe également des
pré-requis en matière de distribution (déclaration du statut juridique du fabricant
et des distributeurs, etc.). Il réduira donc le manque d’information sur la qualité
et la traçabilité des tests génétiques, des défauts majeurs ayant en effet été
soulignés par les plus hautes instances (européennes [21] comme américaines [22]) (→).
(→) Voir la Chronique géomique de B. Jordan, m/s n° 1,
janvier 2011, page 103
Nos propres recherches sur l’e-marché des auto-tests ont d’ailleurs buté sur
plusieurs points relatifs à la traçabilité des entreprises (domiciliation dans des
paradis fiscaux et « éthiques », distributeurs rarement déclarés comme tels, statut
de laboratoire d’analyses parfois revendiqué sans justification administrative,
absence d’indication sur le registre de commerce national dans lequel est déclarée
l’entreprise, etc.) [1,2]. De même, une étude du marché via les « prix
» (et les produits) suggère fortement l’existence de liens entre certaines
entreprises. Dans tous les cas, l’Internet favorise clairement l’absence de
renseignements et les entorses aux régulations (normes de qualité et processus de
certification des tests ou des laboratoires producteurs, interdiction de ventes sans
prescription médicale, etc.). Si ce point est commun au marché du médicament, le
marché de la génétique est spécifique de par le traitement des données personnelles
et identifiantes (ce qui, pour autant, peut intégrer des données cliniques liées à
la pharmacologie), puis leur possible revente à des tierces parties (éventuellement
après anonymisation). Les données génétiques sont d’ailleurs prises en compte, en
tant que telles, par le RGPD (Règlement général sur la protection des données)12. Entré en vigueur en 2018, ce nouveau
règlement européen permet le traitement des données de santé relatives à une «
personne identifiée ou identifiable », sous réserve d’obtenir
le « consentement explicite » (sur la finalité et le cadre
d’utilisation des données) de la personne concernée. Les États membres européens
restent par contre libres de fixer des principes plus stricts dans leur législation
nationale (tant que cela respecte les principes du RGPD). En ce qui concerne la
valorisation économique des données génétiques, par exemple, elle est rendue
difficile en France (alors qu’elle est possible aux États-Unis) pour l’instant,
entre autres de par la spécificité du régime juridique dont elle relève [23] (→).
(→) Voir le Forum de H.C. Stoeklé et al.,
m/s n° 12, décembre 2018, page 1100
Toutefois, en matière de régulation professionnelle (et, en l’occurrence, médicale)
sur les DIV, l’option proposée par le Parlement européen n’est pas tout à fait
éludée étant donné que l’obligation, ou non, d’une prescription médicale relève de
chaque législation nationale. Certains auteurs ont souligné que l’option avancée par
le Parlement était problématique de par l’absence d’expertise chez certains profils
de médecins, et qu’elle risquait de faire l’impasse sur l’évaluation des tests
(validité et utilité clinique) et d’être non proportionnée aux différents types de
tests (certains présentant plus de risques que d’autres) [20]. Outre que cette dernière analyse est peu viable dans les
systèmes faisant une part importante à la régulation professionnelle (tel le cas de
la France où les médecins et les laboratoires doivent être spécifiquement
accrédités, et les tests évidemment certifiés), il conviendrait de la réinterroger à
partir d’éléments empiriques, maintenant que le Règlement croise les deux options,
ce qui implique, pour rappel, que les fabricants stipuleront les limites de leurs
produits (aux États-Unis, la certification accordée à 23andMe pour ses tests
pharmacogénétiques mentionnent d’ailleurs que ce type d’informations minore le
risque d’interprétations erronées par des professionnels de santé). Le constat d’un
manque de compétence médicale avait d’ailleurs amené des auteurs à définir la
catégorie des « auto-tests » non pas sur le principe d’une présence médicale, mais
sur le fait que les produits soient situés en dehors du système de santé [24]. Enfin, il reste à voir dans quelles limites le corps médical s’intéressera à la
question de la revente de données (a fortiori dans le contexte de
l’entrée en vigueur du RGPD où, comme nous l’avons vu, même les législations
nationales ne sont pas nécessairement stabilisées), et de quelle façon il attirera
l’attention des patients sur ce point (à titre de comparaison, avec les auto-tests,
les certifications américaines ne précisent rien sur ce point). D’ailleurs,
l’efficacité du régime juridique instauré par le RGPD est déjà contestée en ce
qu’elle n’assurerait pas une protection technique et juridique suffisante [25]. Dans tous les cas, il
est probable que l’aspect innovant des Big Data, qui est souligné
par nombre de textes, induira des effets dont l’intensité est difficile à prévoir.
Par exemple, le transfert des données vers une « entreprise » hors Union européenne
dans le cadre d’une fusion-acquisition est maintenant pris en compte13, et implique de recueillir un nouveau
consentement « spécifique au transfert », soit vraisemblablement «
quelques années plus tard [après le premier consentement] »
([27], p. 8). Cette
exigence, qui est liée à la nécessité d’obtenir un consentement éclairé (entre
autres sur les circonstances spécifiques du transfert), vise à « garantir un
certain contrôle des utilisateurs et une certaine transparence pour la personne
concernée » (a fortiori lorsque les « données
seront transférées vers un pays qui n’offre pas une protection adéquate et
qu’aucune garantie appropriée visant à protéger les données n’est mise en
œuvre »). Il reste ainsi à étudier ce que signifie, en termes
d’investissement cognitif, ce type de consentement « à rebours », qu’il soit signé
par un internaute seul ou accompagné d’un médecin (qui ne sera peut-être plus celui
d’origine, et pas forcément habitué aux questions liées à la génétique, et a
fortiori aux auto-tests). |
La vente sans prescription médicale, ainsi que la possible absence d’un médecin dans
les comités européens d’évaluation (des tests génétiques), confèrent aux auto-tests
l’aspect d’une « médecine sans médecin ». Le développement du marché des tests
génétiques a par ailleurs un impact au sein même de la profession médicale, puisque
les médecins généralistes ont dorénavant accès à un grand nombre de tests, là où
traditionnellement les cliniciens généticiens étaient les seuls détenteurs du marché
de la génétique (autrement dits étaient les « seuls maîtres à bord »). Cet
élargissement aux médecins généralistes, qui s’accompagne de la constitution de
grandes bases de données génétiques et cliniques, intensifie non seulement la
recherche en génétique, mais également la recherche en pharmacologie. Les faibles
validité et une utilité cliniques des tests prédictifs ne sont donc pas
incompatibles avec un développement du savoir médical. Si ces tests sont
potentiellement le signe d’un affaiblissement de la médecine (perte de l’exclusivité
médicale que représente l’obligation d’une prescription), ils engendrent dans tous
les cas une reconfiguration intra-professionnelle (via une clinique
académique qui perd une partie de son rôle central, et une médecine générale dont la
présence dans le processus de production des connaissances est accrue). Cette
reconfiguration est impulsée par des acteurs qui sont pris dans des logiques de
marché (concurrence, concentration, etc.), et qui cherchent à développer aussi bien
le marché du libre accès que le marché médical sur un plan génétique et
pharmacologique. L’absence de prescription médicale lors de la vente des auto-tests,
qui est permise par le nouveau Règlement européen sur les DIV (en fonction toutefois
de choix nationaux), ne signifie pas qu’aucune régulation médicale n’interviendra, à
long terme, sur ce marché. En effet, les entreprises qui domineront le marché du
libre accès seront celles qui auront la capacité d’établir, en parallèle, des liens
avec le marché médical. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Mes remerciements vont aux relecteurs de médecine/sciences, à Emmanuelle Rial-Sebag
pour sa relecture (Inserm, UMR 1027), ainsi qu’à Gauthier Chassang (Inserm, UMR
1027) pour son aide précieuse au sujet du RGPD. L’article est en partie extrait
d’une thèse financé par l’IReSP, dans le cadre du projet de recherche porté par
Pascal Ducournau (« Tests génétiques en accès libre sur Internet : ressorts,
développements et conséquences d’une offre en émergence », appel à projets :
Services de santé - Politiques publiques et santé 2009). La thèse a également
bénéficié d’une bourse de mobilité internationale attribuée par le Réseau des Jeunes
Chercheurs Santé et Société (financement MIRE).
|
Footnotes |
1. Jautrou
H,
Bès
MP. Les tests
génétiques en accès libre (2000–2012) : une innovation sanitaire régulée par
le marché ? In: Valat
B, ed. Les marchés de la
santé en France et en Europe (XIXe-XXe
siècle) . Toulouse: :
Presses Universitaires du Midi; ,
2020. 2.
Jautrou
H.
Les tests génétiques vendus en libre accès sur l’Internet : une
médicalisation sans médecin ?
Thèse de doctorat de sociologie.,
Toulouse: : Université Jean
Jaurès; , 2016. 3. Wrick
KL. Markets research.
Direct-to-consumer genetic testing: business prospects in the United
States . Cambridge: :
Cambridge Healthtech Institute; ,
2009. 4. GPPC . Survey of
direct-to-consumer testing statutes and regulations. Genetics and public
policy center . Berman Institute of Bioethics and
Johns Hopkins University; ,
2007. 5. Borry
P, vann
Hellemondt
RE,
Sprumont
D, et al.
Legislation on direct-to-consumer genetic testing in seven
European countries . Eur J Hum Genet.
2012;; 20 :
:715.–21. 6.
Jordan
B.
Les tests génétiques grand public ont-ils une utilité clinique
? . Med Sci (Paris).
2012; ; 28 :
:325.–328. 7.
Ducournau
P
,
Gourraud
PA
,
Rial-Sebbag
E
, et al.
Tests génétiques en accès libre sur Internet : stratégies
commerciales et enjeux éthiques et sociétaux . Med
Sci (Paris).
2011; ; 27 :
:95.–102. 8.
Ng
PC
,
Murray
SS
,
Levy
S
, et al.
An agenda for personalized medicine .
Nature.
2009; ; 461 :
:724.–726. 9.
Jordan
B.
Craig Venter et son exome . Med Sci
(Paris).
2008; ; 24 :
:989.–990. 10.
Jordan
B.
Dépistage du cancer : les promesses illusoires de Pathway
Genomics . Med Sci (Paris).
2015; ; 31 :
:1137.–1139. 11.
Borry
P
,
Cornel
MC
,
Howard
HC
. Where are you going, where have you been: a
recent history of the direct-to-consumer genetic testing
market . J Community Genet.
2010; ; 1 :
:101.–106. 12.
Klepper
S.
Industry life cycles. Ind Corp .
Change.
1997; ; 6 :
:145.–181. 13.
Jordan
B.
Grandes manœuvres autour des profils génétiques en libre
accès . Med Sci (Paris).
2014; ; 30 :
:227.–228. 14.
Saukko
PM
. Shifting metaphors in direct-to-consumer genetic
testing: from genes as information to genes as big data .
New Genet Soc.
2017; ; 36 :
:296.–313. 15.
Powell
WW
,
Koput
KW
,
White
DR
, et al.
Network dynamics and field evolution: the growth of
interorganizational collaboration in the life sciences .
Am J Sociol.
2005; ; 110 :
:1132.–1205. 16. Kline
SJ,
Rosenberg
N. An overview of
innovation . In: Landau
R,
Rosenberg
N, eds. National academy of
engineering. The positive sum strategy: harnessing technology for economic
growth . Washington DC: :
National Academy Press; , 1986 :
:275.–305. 17.
Cooke
P.
,
Atkinson
P
,
Glasner
P
,
Lock
M
. State, markets and networks in bioeconomy
knowledge value chains . Handbook of genetics and
society: mapping the new genomic era . London-New
York: : Routledge; ,
2009: :163.–180. 18.
Stoeklé
HC
,
Mamzer-Bruneel
MF
,
Vogt
G
, et al.
23andMe: a new two-sided data-banking market
model . BMC Med Ethics.
2016; ; 17 : :11.. 19. Committee on cancer clinical trials
and the NCI cooperative group program, board on health care
services-Institute of medicine . A national cancer
clinical trials system for the 21st century: reinvigorating the
NCI cooperative group program . In:
Nass
SJ,
Moses
HL,
Mendelsohn
J, eds. Washington
DC: : National Academic
Press; , 2010 : :298.
p. 20.
Kalokairinou
L
,
Howard
HC
,
Borry
P
. Current developments in the regulation of
direct-to-consumer genetic testing in Europe . Med
Law Int.
2015; ; 15 :
:97.–123. 21.
Hennen
L
,
Sauter
A
,
Van den Cruyce
E
. Direct to consumer genetic testing study .
Brussels: : Parlement
européen; , 2008. 22.
Jordan
B.
Les tests génétiques grand public en caméra
cachée . Med Sci (Paris).
2011; ; 27 :
:103.–106. 23.
Stoeklé
HC
,
Forster
N
,
Turrini
M
, et al.
La propriété des données génétiques : de la donnée à
l’information . Med Sci (Paris).
2018; ; 34 :
:1100.–1104. 24.
Borry
P
,
Henneman
L
,
Lakeman
P
, et al.
Preconceptional genetic carrier testing and the commercial offer
directly-to-consumers . Hum Reprod Oxf Engl.
2011; ; 26 :
:972.–977. 25.
Bourcier
D
,
De Filippi
P
. Vers un droit collectif sur les données de
santé . Rev Droit Sanit Soc RDSS Dalloz Rev.
2018; ; 3 :
:444.–456. 26.
Howard
HC
,
Borry
P
. Is there a doctor in the house? The presence of
physicians in the direct-to-consumer genetic testing
context . J Community Genet.
2012; ; 3 :
:105.–112. 27. EBPB . Guidelines
2/2018 on derogations of article 49 under regulation 2016/679 .
European Data Protection Board; ,
2018. |