| |
| Med Sci (Paris). 36(2): 174–176. doi: 10.1051/medsci/2020018.La protéine Fe-S NfuA, un nouvel acteur essentiel dans
la virulence de Pseudomonas aeruginosa Agathe Blanchard,1* Caroline Gora,1** and Marie-Pierre Golinelli-Cohen2*** 1M1 Biologie Santé, Université Paris-Saclay,
91405Orsay,
France 2Université Paris-Saclay, CNRS, Institut de Chimie des
Substances Naturelles, UPR2301, 91198Gif-sur-Yvette,
France MeSH keywords: Régulation de l'expression des gènes bactériens, Humains, Ferrosulfoprotéines, Thérapie moléculaire ciblée, Infections à Pseudomonas, Pseudomonas aeruginosa, Stress physiologique, Virulence, Facteurs de virulence, génétique, physiologie, méthodes, tendances, thérapie, pathogénicité |
Pseudomonas aeruginosa est une bactérie gram négatif responsable
d’environ 10 à 15 % des infections nosocomiales. Elle affecte tout particulièrement les
patients atteints de mucoviscidose ou immunodéprimés, avec un taux élevé de morbidité.
Présentant de nombreuses résistances aux antibiotiques, P. aeruginosa
est aujourd’hui encore un problème majeur de santé publique et nécessite de nouvelles
thérapies de manière urgente [1]
(→).
(→) Voir la Synthèse de F. Barbier et M. Wolff, m/s n° 11,
novembre 2010, page 960
P. aeruginosa possède un large génome qui code de nombreuses protéines
régulatrices qui constituent des senseurs pour les signaux
environnementaux et contrôlent l’expression des facteurs de virulence et de résistance
pour lui permettre de survivre à des environnements divers [2]. Lors de l’infection de l’hôte, la bactérie subit
par exemple un stress oxydatif pouvant affecter sa survie s’il n’est pas neutralisé. Depuis quelques années, de nombreux arguments plaident en faveur d’une implication des
protéines à centre Fe-S (fer-soufre) dans la virulence de diverses bactéries pathogènes
[3] (→).
(→) Voir la Nouvelle de A. Carreaux et al., m/s
n°6-7, juin-juillet 2017, page 603
Chez les bactéries, comme dans tous les organismes, les protéines Fe-S sont impliquées
dans de nombreuses voies cellulaires essentielles, dont la respiration ou le maintien de
l’intégrité génomique. Récemment, Romsang et al. [4] se sont intéressés à la protéine
d’échafaudage NfuA nécessaire à la maturation des centres Fe-S des protéines en
condition de stress oxydatif ou de carence en fer. Sa fonction chez P.
aeruginosa est peu connue à ce jour. Cependant, sa mutation sensibilise la
bactérie aux antibiotiques de type fluoroquinolones en condition d’aérobie. Ainsi, la
protéine NfuA permettrait le maintien de la croissance et de la virulence de P.
aeruginosa dans différentes conditions de stress (stress oxydant,
anaérobie, carence en fer). |
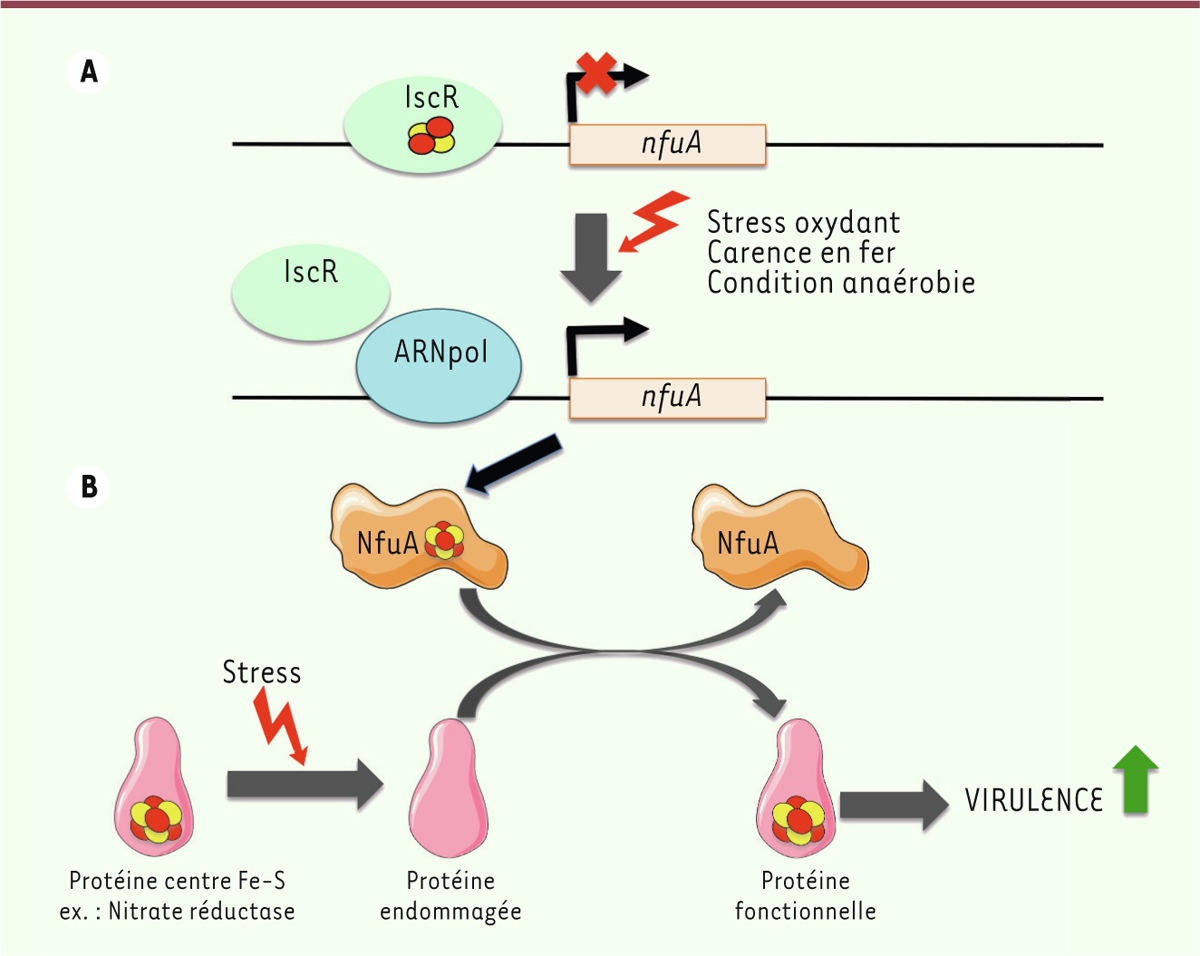
Mécanisme de répression de nfuA par IscR En condition de stress, l’expression des protéines impliquées dans la protection de
la bactérie est fréquemment induite. Les auteurs ont donc étudié, dans un premier
temps, le niveau d’expression du gène nfuA en mesurant les
quantités d’ARNm par RT-qPCR dans des conditions de stress oxydant ou de carence en
fer. Ainsi, le niveau d’expression du gène est augmenté selon un profil comparable à
celui des gènes régulés par la protéine Fe-S IscR, un régulateur transcriptionnel de
l’expression de gènes impliqués dans la biogenèse des centres Fe-S [5]. Afin de vérifier l’importance d’IscR
dans la régulation de l’expression de nfuA, son gène a été délété
dans la bactérie. Il est alors apparu que l’expression de nfuA
était plus élevée mais non affectée par un stress. Ainsi, IscR est un répresseur
transcriptionnel de l’expression de nfuA mais, en condition de
stress, cette répression est levée. Typiquement, IscR se lie spécifiquement à une séquence consensus localisée près du
promoteur de ses gènes cibles. Par des expériences d’extension d’amorce à partir
d’ARNm purifiés, les auteurs ont pu localiser le promoteur de nfuA
et l’analyse de séquences en amont de ce dernier a permis d’identifier un site
potentiel de liaison d’IscR. Puis, une expérience de retard sur gel a révélé qu’IscR
se lie spécifiquement et directement en amont du promoteur de nfuA,
sur un site chevauchant partiellement le motif consensus -35 (-35 Box) sur lequel se
fixe l’ARN polymérase. Même si l’importance du centre Fe-S d’IscR dans cette liaison
n’est pas encore démontrée, les auteurs proposent qu’en condition de stress oxydant
affectant le centre Fe-S d’IscR, la liaison de ce dernier au promoteur de
nfuA diminuerait, ce qui favoriserait l’interaction de l’ARN
polymérase avec ce même promoteur et lèverait la répression de l’expression de
nfuA (Figure 1).
 | Figure 1. Régulation du gène nfuA et des fonctions de NfuA lors d’un stress. (A) En
condition basale, le gène nfuA est réprimé par la protéine Fe-S IscR qui
se fixe en aval de son promoteur en masquant le motif de liaison de
l’ARN polymérase. Celle-ci ne peut alors plus se fixer sur le promoteur
du gène, ce qui inhibe la transcription de NfuA. Sous l’effet d’un
stress (oxydant, carence en fer), le centre Fe-S d’IscR (représenté par
des sphères rouges et jaunes) est dégradé et IscR ne se lie plus à l’ADN
ce qui lève l’inhibition du gène nfuA. L’ARN polymérase peut ainsi se
fixer et induire la transcription du gène. (B) La protéine NfuA ainsi
synthétisée assemble alors un centre Fe-S qui peut être transféré à une
protéine cible comme la nitrate réductase, dont le centre Fe-S aurait
été dégradé par un stress. |
|
NfuA dans la réponse au stress Les auteurs se sont ensuite intéressés aux rôles cellulaires de la protéine NfuA.
Après avoir démontré l’implication de la protéine dans la maturation de certaines
protéines Fe-S, ils se sont focalisés sur son implication dans la réponse au stress.
Tout d’abord, en évaluant la viabilité de la bactérie par culture sur boîte de
Pétri, ils ont montré que la déplétion du gène nfuA rend la
bactérie plus sensible à différentes conditions qui affectent l’intégrité des
centres Fe-S (carence en fer, présence de métaux toxiques comme le cuivre ou le
cobalt). Dans un second temps, ils se sont intéressés aux résidus cystényl conservés
dans les deux domaines fonctionnels de la protéine, à savoir les domaines ATC
(impliqué dans la reconnaissance de la protéine cible) et Nfu (directement impliqué
dans la coordination du centre Fe-S de NfuA). Par mutagenèse dirigée de ces résidus,
ils ont alors montré que les cystéines du domaine Nfu sont essentielles à la
fonction de la protéine dans la protection contre le stress. Ce dernier résultat est
compatible avec le modèle selon lequel NfuA assemble un centre Fe-S qui est ensuite
transféré à des protéines cibles pour réparer leurs centres Fe-S endommagés par un
stress afin de maintenir la viabilité cellulaire (Figure 1). |
Implication de NfuA dans la virulence de la bactérie en anaérobie Les auteurs se sont finalement intéressés à l’implication de NfuA dans la croissance
anaérobie et la virulence de P. aeruginosa. Des tests de croissance
ont permis de montrer que la déplétion en NfuA ou de l’expression d’une forme
tronquée de son domaine essentiel Nfu, ou encore la surexpression d’IscR qui réprime
nfuA, ralentit la croissance de la bactérie uniquement en
condition d’anaérobie. Cet effet est encore plus drastique lorsque le milieu de
culture est additionné de nitrate, condition de culture qui requiert une enzyme de
dénitrification fonctionnelle, la nitrate réductase. Or, cette dernière possède un
centre Fe-S. Les auteurs ont alors constaté que l’activité de la nitrate réductase
est réduite dans une souche déplétée pour le gène codant NfuA et que l’addition de
nitrate induit l’expression de nfuA dans une souche sauvage. La
protéine NfuA, dont l’expression est régulée par le nitrate, est donc essentielle
pour la croissance anaérobie de P. aeruginosa et pour l’activité de
la nitrate réductase. De plus, la déplétion de nfuA de P.
aeruginosa conduit à une baisse très forte de sa virulence dans un
organisme hôte modèle (Caenorhabditis elegans). |
NfuA, nouvelle cible thérapeutique pour lutter contre P. aeruginosa ? NfuA est produite lors d’un stress oxydatif, une carence en fer ou en condition
anaérobie à la suite de la levée de l’inhibition induite par IscR. Elle est capable
d’assembler un centre Fe-S et, pour remplacer les centres Fe-S endommagés, de le
transférer à des protéines cibles essentielles comme la nitrate réductase
(Figure 1). NfuA joue
ainsi un rôle primordial dans la résistance de P. aeruginosa au
stress oxydatif et dans sa croissance en anaérobie, résistance
cruciale pour sa survie et sa virulence lors de l’infection. Ainsi, comme cela a été
observé pour d’autres bactéries pathogènes telles que Staphyloccocus
aureus [6],
Mycobacterium tuberculosis [7] (→) et Salmonella
enterica [3], les protéines Fe-S
comme NfuA apparaissent comme de nouvelles cibles thérapeutiques afin de lutter
contre des bactéries pathogènes pour l’homme. Une des options thérapeutiques serait
de cibler les centres Fe-S de ces protéines par l’utilisation de molécules générant
du stress oxydant.
(→) Voir la Nouvelle de J. Guitton et al.,
m/s n° 6-7, juin-juillet 2018, page 612
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
1. Barbier
F,
Wolff
M. Pseudomonas
aeruginosa prise en flagrant délit de casse !
Med Sci (Paris).
2010; ; 26 :
:960.–8. 2. Faure
E,
Kwong
K,
Nguyen
D. Pseudomonas
aeruginosa in chronic lung infections: how to adapt within the
host?
Front Immunol.
2018; ; 9 : :2416.. 3. Carreaux
A, de Champs
de Saint-Leger
S,
Kouidri
Y, et al.
Contrôle de la virulence de Salmonella enterica par la machinerie
de biogenèse des centres Fe-S . Med Sci
(Paris).
2017; ; 33 :
:603.–6. 4. Romsang
A,
Duang-Nkern
J,
Saninjuk
K, et al.
Pseudomonas aeruginosa nfuA: gene regulation and its
physiological roles in sustaining growth under stress and anaerobic
conditions and maintaining bacterial virulence . PLoS
One.
2018; ; 13 :
:e0202151.. 5. Santos
JA,
Pereira
PJ,
Macedo-Ribeiro
S. What a difference
a cluster makes: the multifaceted roles of IscR in gene regulation and DNA
recognition . Biochim Biophys Acta.
2015; ; 1854 :
:1101.–12. 6. Choby
JE,
Mike
LA,
Mashruwala
AA, et al.
A smallmolecule inhibitor of iron-sulfur cluster assembly
uncovers a link between virulence regulation and metabolism in
Staphylococcus aureus . Cell Chem Biol.
2016; ; 23 :
:1351.–1361. 7. Guitton
J,
Bekara
M,
Golinelli-Cohen
MP. Les protéines
Fe-S Wbl, de nouvelles cibles thérapeutiques pour lutter contre la
tuberculose . Med Sci (Paris).
2018; ; 34 :
:612.–4. |