| |
| Med Sci (Paris). 36(2): 176–179. doi: 10.1051/medsci/2020019.Cellules cancéreuses, cellules étoilées et rigidité du
milieu extracellulaire Le cercle vicieux du développement des métastases
hépatiques Molène Docq1* and Boris Julien2** 1M1 Biologie Santé, Université Paris-Saclay,
91405Orsay,
France. 2Institut Curie, U1021/UMR3347, Université
Paris-Saclay, 91405Orsay,
France. MeSH keywords: Animaux, Phénomènes biomécaniques, Matrice extracellulaire, Espace extracellulaire, Cellules étoilées du foie, Humains, Foie, Tumeurs du foie, Cellules souches tumorales, Niche de cellules souches, Microenvironnement tumoral, physiologie, anatomopathologie, cytologie, secondaire |
Le foie est un organe propice au développement des métastases de nombreux cancers. Cette
funeste propriété est la conséquence d’une série d’interactions entre les cellules
tumorales et le microenvironnement hépatique aboutissant à la constitution d’une niche
favorable à leur implantation et à leur développement [1]. Les cellules stellaires hépatiques (HSC) jouent
un rôle primordial dans ces interactions. Elles ont pour rôle physiologique de soutenir
les cellules du parenchyme dans leurs fonctions et de stocker la vitamine A. Mais à la
suite de lésions hépatiques, elles sont activées en myofibroblastes (MF) qui participent
alors à la réparation tissulaire en remodelant la matrice extracellulaire (MEC) et
produisent un ensemble de médiateurs agissant sur les autres cellules ou de manière
endocrine. Or, les cellules tumorales détournent ces propriétés à leur avantage en
activant les HSC en MF qui déposent massivement de la MEC et contribuent alors à la
constitution d’une niche favorable au développement métastatique [2, 3] (Figure 1). Il est
désormais bien établi que la rigidité de la MEC, qui dépend de sa quantité et de sa
composition, promeut la croissance tumorale qui, elle-même, exerce une pression
mécanique sur son environnement [4]. Cependant, les mécanismes de rétrocontrôle qu’exercerait la rigidité du
milieu extracellulaire sur les HSC sont encore à élucider. Dans un article récent, Dou
et al. ont montré que la rigidité de l’environnement des HSC
favorisent leurs propriétés pro-tumorales selon une boucle d’amplification
mécanosensible impliquant l’histone acétyltransférase p300 [5].
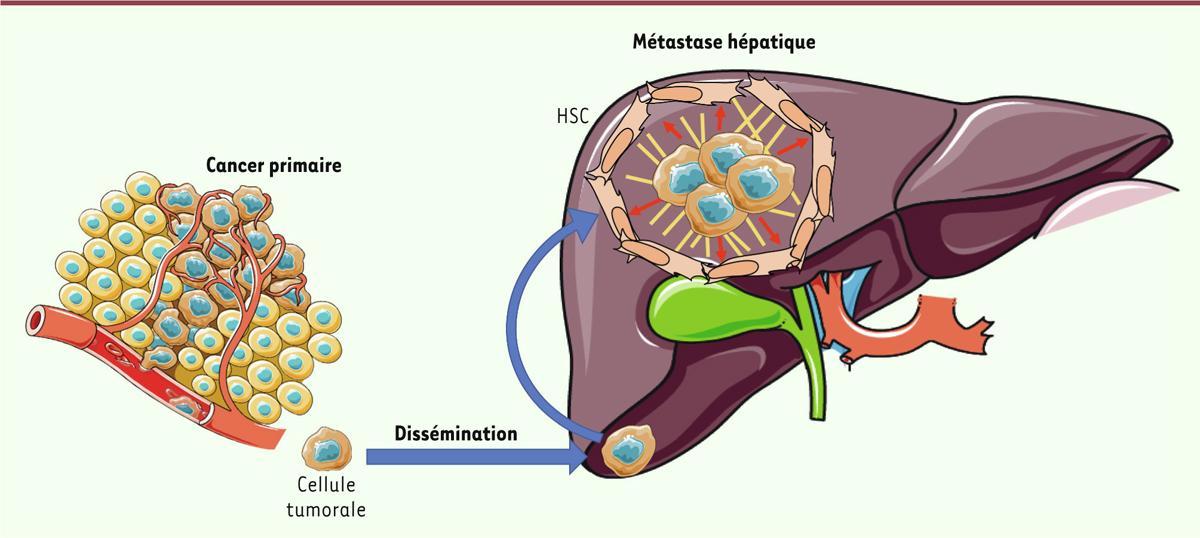
 | Figure 1. Les étapes à l’origine du développement d’une métastase hépatique. Les
cellules tumorales sont susceptibles de s’échapper de la tumeur primaire et
de se disséminer dans l’organisme. Le foie est un organe privilégié de leur
implantation. Les cellules tumorales y recrutent et y exploitent les
propriétés des cellules du micro-environnement hépatique, telles que les
cellules stellaires hépatiques (HSC) qui se différencient alors en
myofibroblastes et contribuent à la mise en place d’un environnement rigide
(traits jaunes) dont le stress mécanique (flèches rouges) favorise le
développement d’une métastase (cette figure a été créée en utilisant les
modèles « Servier Medical Art » -https://smart.servier.com). |
|
Plus l’environnement est rigide, plus les HSC s’activent : rôle de la
signalisation RhoA/Akt/p300 Pour mettre en évidence le lien entre rigidité environnementale et activation des
HSC, les auteurs ont cultivé des HSC (cultures de cellules primaires murines et
humaines et de lignées humaines) sur des hydrogels de polyacrylamide de rigidité
croissante. Ils ont observé que plus le milieu est rigide, plus les HSC expriment
l’α-SMA (α-smooth muscle actin) et le CTGF (connective
tissue growth factor), deux marqueurs de différenciation
myofibroblastique. Cette activation s’accompagne d’une translocation dans le noyau
de l’histone acétyltransférase p300, qui régule de nombreux gènes impliqués dans la
prolifération, l’apoptose et la différenciation cellulaire, en acétylant les
histones et les facteurs de transcription [6]. Il a notamment été montré que lors de la sclérodermie,
pathologie provoquant une accumulation excessive de matrice dans les tissus, p300
contrôle la synthèse par les fibroblastes du collagène de type I, principal facteur
de rigidité matricielle [7].
Dou et al. ont montré que l’invalidation du gène codant p300 par
des techniques moléculaires ainsi que l’inhibition pharmacologique de la fonction de
la protéine, réduisent l’effet de la rigidité sur l’expression de l’α-SMA dans des
cultures primaires de HSC [5]. Ils mettent
ainsi en évidence pour la première fois l’implication de p300 dans l’activation des
HSC par la rigidité de leur environnement. La translocation de p300 dans le noyau, où se situent ses substrats, dépend de
modifications post-transcriptionnelles, telles que la phosphorylation. Selon les
auteurs, deux protéines impliquées dans la transduction du signal mécanique
conduisent à la translocation de p300 : la petite protéine G RhoA (Ras
homolog gene family, member A), un des relais de la signalisation
intracellulaire des intégrines, et la protéine kinase AKT (protéine kinase B). Par
des jeux d’inhibition et d’activation de ces protéines (inhibiteurs pharmacologiques
de RhoA et AKT, surexpression de RhoA constitutivement activée ou de p300 mutée sur
son site de phosphorylation par Akt) en utilisant leur modèle de culture en gel de
polyacrylamide, les auteurs ont caractérisé finement les différentes étapes de cette
signalisation (Figure 2): la
rigidité du milieu active RhoA qui stimule alors la phosphorylation de Akt ; ainsi
activée, Akt phosphoryle p300, ce qui inhibe sa dégradation par le protéasome et
favorise sa translocation dans le noyau où p300 exerce son activité biologique.
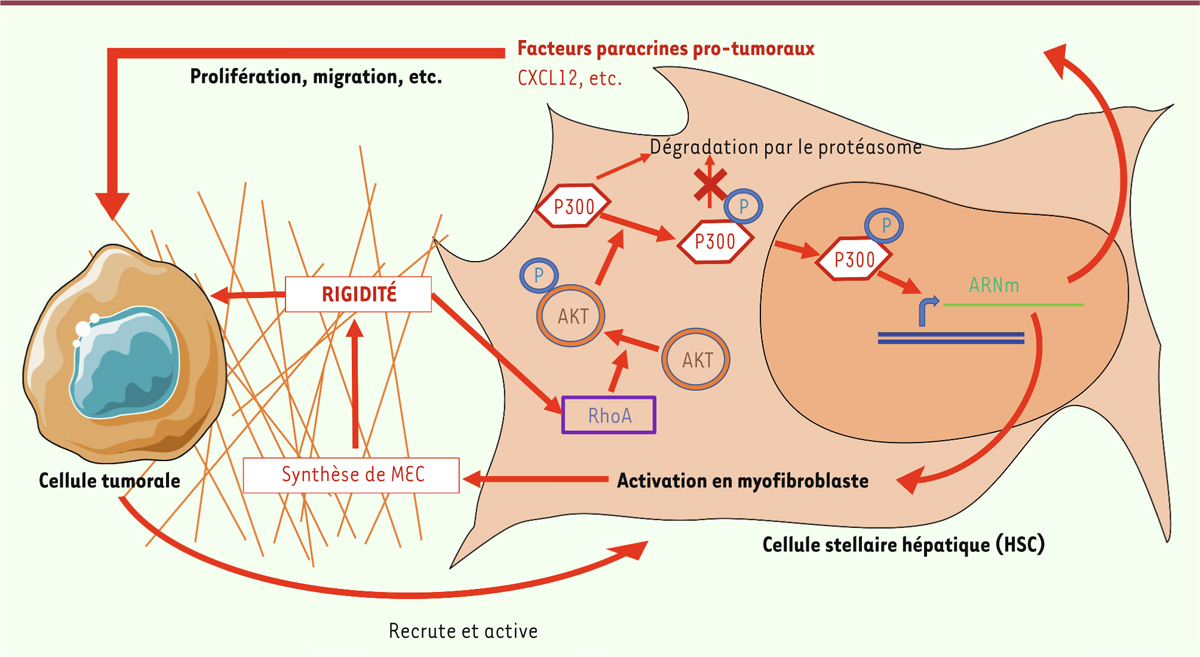
 | Figure 2. Boucle d’amplification mécanosensible p300-dépendante favorisant le
développement tumoral. La rigidité de l’environnement péritumoral est
issue de l’action combinée de la croissance de la tumeur et de
l’accumulation de matrice extracellulaire (MEC, traits oranges). Cette
rigidité influence la biologie des cellules stellaires hépatiques (HSC)
selon une boucle d’amplification mécanosensible dans laquelle p300 est
relocalisée dans le noyau une fois phosphorylée par AKT, elle-même
activée par RhoA. Ceci aboutit à la différenciation des HSC en
myofibroblastes qui produisent de la matrice extracellulaire, et à
l’expression de facteurs, tels CXCL12, favorisant la croissance des
tumeurs (cette figure a été créée en utilisant les modèles Servier
Medical Art - https://smart.servier.com). |
|
L’axe rigidité/p300 : voie pro-tumorale et pro-métastatique dans les MFs associés
aux tumeurs Cette voie de signalisation ayant été mise en évidence ex vivo, une
question s’impose : est-elle pertinente in vivo ? Pour répondre à
cette question, les auteurs ont utilisé un modèle de souris Col1A1Cre/P300loxP
présentant une invalidation du gène codant p300 spécifiquement dans les MF (Col1A1
est une protéine principalement exprimée dans les cellules fibrogéniques). Ils ont
montré qu’en absence de p300 dans les MF, l’injection de cellules cancéreuses
colorectales humaines génère moins de métastases hépatiques que dans des souris
sauvages et que les MF associés à ces métastases étaient moins activés. Cette
démonstration du lien entre cet axe mécanosensible et le développement tumoral est
renforcée par l’utilisation de modèles murins de co-implantation sous-cutanée de
cellules cancéreuses colorectales humaines avec des milieux conditionnés de HSC
ayant été cultivées dans des conditions de rigidités différentes et exprimant ou non
p300. Les milieux conditionnés de HSC cultivées sur un support rigide favorisent
beaucoup plus le développement des tumeurs que ceux de cellules cultivées sur un
support lâche, mais cette différence est perdue si les HSC sont déficientes pour
p300. Ainsi, les auteurs ont émis l’hypothèse que les HSC produisent des facteurs
pro-tumoraux et pro-métastatiques, dont la sécrétion est potentialisée par l’axe
p300-rigidité. Afin d’identifier les facteurs pro-tumoraux associés à l’activation des HSC, les
auteurs ont comparé par RNA-seq (séquençage des transcrits) les ARNm des HSC
cultivées sur support rigide ou lâche. Ils ont mis en évidence que l’axe
rigidité-p300 module l’expression de nombreux gènes impliqués dans la
différenciation en MF, mais aussi de gènes codant des médiateurs intercellulaires
pro-tumoraux, tels le CTGF (connective tissue growth factor) ou la
chimiokine CXCL12 (C-X-C motif chemokine 12), connue pour réguler
l’implantation des métastases dans le foie [8]. En présence d’un milieu rigide, l’expression protéique de
CXCL12 est augmentée dans les MF et les histones de son promoteur sont acétylées,
comme le démontrent des expériences d’immunoprécipitation des histones acétylées
suivies de l’identification du promoteur de CXCL12 par qPCR. Ces observations
renforcent encore la démonstration du lien entre l’activation des HSC en MF induite
par la rigidité du support et l’histone acétylase p300. |
p300 et HSC : au-delà de la prise en charge des métastases hépatiques Dou et al. ont montré pour la première fois que la rigidité du
milieu extracellulaire induit la différenciation des cellules stellaires hépatiques
en myofibroblastes selon une boucle d’amplification mécanosensible mettant en jeu
p300 et ses partenaires AKT et RhoA [5]. Cette
activation mécanique des HSC qui dépend de p300 contribue à l’implantation et au
développement de métastases dans le foie (Figure 2). Plusieurs de leurs résultats suggèrent que cette
démonstration pourrait être validée en pathologie humaine. D’une part, leurs
observations ex vivo ont été effectuées sur des HSC humaines.
D’autre part, dans des biopsies de patients ayant des métastases hépatiques de
cancers colorectaux, le stroma tumoral, qui est riche en myofibroblastes, est plus
rigide que les tissus environnants et surexprime p300. Ce co-facteur de
transcription pourrait donc être l’objet d’un ciblage thérapeutique visant à
diminuer les propriétés pro-métastatiques du microenvironnement hépatique.
Néanmoins, cette découverte pourrait avoir des retombées plus larges. En effet, Dou
et al. ont également montré dans ces travaux que p300 régulait
aussi la fibrose hépatique dont le stade ultime, la cirrhose, est responsable d’une
mortalité importante (environ 10 000 morts par an en France) [5]. De plus, les MF sont la principale source des fibroblastes
associés au cancer (CAF) dans le foie [3]. Or
les CAF sont présents dans le stroma de la plupart des tumeurs solides et favorisent
leur développement notamment en provoquant un stress mécanique [9]. Ainsi, l’axe
rigidité/p300/activation des cellules fibrogéniques mis en évidence par Dou
et al participerait au développement de différents types de
cancers associés à l’activation de MF et au dépôt de MEC. Le profil d’expression de
p300 et ses effets pléïotropes exposeraient cependant un patient traité avec un
inhibiteur à de nombreux effets secondaires. Il serait donc nécessaire d’envisager
un ciblage des cellules fibrogéniques, ce qui constitue un défi scientifique et
médical depuis de nombreuses années [10]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
1.
Vidal-Vanaclocha
F.
The prometastatic microenvironment of the liver .
Cancer Microenviron.
2008; ; 1 :
:113.–129. 2.
Lu
P
,
Weaver
VM
,
Werb
Z
. The extracellular matrix: a dynamic niche in
cancer progression . J Cell Biol.
2011; ; 96 :
:395.–406. 3.
Kang
N
,
Gores
GJ
,
Shah
VH
. Hepatic stellate cells: partners in crime for
liver metastases? . Hepatology.
2011; ; 54 :
:707.–713. 4.
Schrader
J
,
Gordon-Walker
TT
,
Aucott
RL
, et al.
Matrix stiffness modulates proliferation, chemotherapeutic
response, and dormancy in hepatocellular carcinoma cells .
Hepatology.
2011; ; 53 :
:1192.–1205. 5.
Dou
C
,
Liu
Z
,
Tu
K
, et al.
P300 Acetyltransferase mediates stiffness-induced activation of
hepatic stellate cells Into tumor-promoting myofibroblasts .
Gastroenterology.
2018; ; 154 : (2209–21)
:e14.. 6.
Chan
HM
,
La Thangue
NB
. p300/CBP proteins: HATs for transcriptional
bridges and scaffolds . J Cell Sci.
2001; ; 114 :
:2363.–2373. 7.
Ghosh
AK
,
Bhattacharyya
S
,
Lafyatis
R
, et al.
p300 is elevated in systemic sclerosis and its expression is
positively regulated by TGF-β: epigenetic feed-forward amplification of
fibrosis . J Invest Dermatol.
2013; ; 133 :
:1302.–1310. 8.
Sakai
N
,
Yoshidome
H
,
Shida
T
, et al.
CXCR4/CXCL12 expression profile is associated with tumor
microenvironment and clinical outcome of liver metastases of colorectal
cancer . Clin Exp Metastasis.
2012; ; 29 :
:101.–110. 9.
Nissen
NI
,
Karsdal
M
,
Willumsen
N
. Collagens and cancer associated fibroblasts in
the reactive stroma and its relation to cancer biology .
J Exp Clin Cancer Res.
2019; ; 38 : :115.. 10.
Beljaars
L
,
Meijer
DK
,
Poelstra
K
. Targeting hepatic stellate cells for
cell-specific treatment of liver fibrosis . Front
Biosci.
2002; ; 7 :
:e214.–e222. |