2-
Tendances séculaires de l'âge de la puberté
La puberté représente une étape importante de la maturité. Elle met en œuvre des modifications corporelles, physiologiques et psychologiques. La croissance durant la puberté représente 15 à 20 % de la taille atteinte à l'âge adulte. Les liens entre l'évolution séculaire de la taille adulte et celle de l'âge de la puberté ont été largement étudiés ces dernières années. Différents facteurs génétiques et environnementaux ont été explorés dans leurs relations avec l'âge du développement pubertaire.
Développement pubertaire
La puberté correspond à l'activation de la fonction hypothalamo-hypophyso-gonadique, aboutissant au développement complet des caractères sexuels, à l'acquisition de la taille définitive, de la fonction de reproduction et de la fertilité. Les différents stades du développement pubertaire sont cotés de 1 (stade prébubère) à 5 (stade adulte) selon la classification de Tanner portant sur les caractères sexuels secondaires (tableau 2.I

).
Tableau 2.I Classification de Tanner des stades de développement pubertaire
|
Stades de développement pubertaire
|
|
Pilosité pubienne garçons et filles
|
|
P1 Absence de pilosité
|
|
P2 Quelques poils longs sur le pubis
|
|
P3 Pilosité pubienne au dessus de la symphyse
|
|
P4 Pilosité pubienne fournie
|
|
P5 La pilosité s'étend à la racine des cuisses et s'allonge vers l'ombilic chez le garçon
|
|
Développement mammaire
|
|
S1 ou B1 Absence de développement mammaire
|
|
S2 ou B2 Petit bourgeon mammaire avec élargissement de l'aréole
|
|
S3 ou B3 La glande mammaire dépasse la surface de l'aréole
|
|
S4 ou B4 Développement maximum du sein (apparition d'un sillon sous-mammaire), saillie de l'aréole et du mamelon sur la glande
|
|
S5 ou B5 Aspects adulte, disparition de la saillie de l'aréole
|
|
Développement des organes génitaux externes du garçon
|
|
G1 Testicules et verge de taille infantile
|
|
G2 Augmentation du volume testiculaire de 4 à 6 ml (L 25 à 30 mm)
|
|
G3 Continuation de l'accroissement testiculaire de 6 à 12 ml (L 30-40 mm), accroissement de la verge
|
|
G4 Accroissement testiculaire de 12 à 16 ml (L 40-50 mm) et de la verge
|
|
G5 Morphologie adulte
|
Chez la fille
La première manifestation pubertaire est le développement des glandes mammaires. Dans les pays occidentaux, ce développement commence en moyenne à partir de 10,5/11 ans (voir plus loin les variations observées). Le développement de la pilosité pubienne et axillaire survient en général après le stade S2, de même que les modifications de la vulve. La ménarche survient en moyenne entre 2 ans et 2,5 ans après le stade S2, mais le délai est variable d'un individu à l'autre et d'autant plus bref que la puberté est tardive (tableau 2.II

). Leur date de survenue est considérée comme physiologique entre 10 et 15,5 ans. La maturation osseuse est sous la dépendance des stéroïdes sexuels, d'où une certaine concordance entre l'âge osseux de 11 ans (10 à 12 ans) correspondant à l'apparition du sésamoïde du pouce et le début de la puberté chez la fille (B2). Il existe cependant une grande variabilité dans la concordance entre maturation pubertaire clinique et vitesse de croissance pubertaire (Coste et coll., 2002

).
Tableau 2.II Normes traditionnellement utilisées pour la puberté chez la fille (d'après Marshall et Tanner, 1969)
|
Stades
|
Âges (ans)
|
Stades
|
Âges (ans)
|
|
S2
|
11,5 ± 1,1
|
P2
|
11,6 ± 1,2
|
|
S3
|
12,1 ± 1,1
|
P3
|
12,3 ± 1,1
|
|
S4
|
13,1 ± 1,1
|
P4
|
12,9 ± 1,1
|
|
S5
|
15,3 ± 1,7
|
P5
|
14,4 ± 1,2
|
|
Ménarche
|
13,5 ± 1,1
| | |
Chez le garçon
Le premier signe de puberté est l'augmentation du volume testiculaire qui se produit en moyenne vers l'âge de 12-13 ans (tableau 2.III

). Les autres signes de maturation pubertaires sont le développement de la pilosité pubienne et axillaire, l'augmentation de la taille de la verge.
De même, l'apparition du sésamoïde du pouce correspond à un âge osseux de 13 ans et concorde approximativement avec le début de la puberté chez le garçon.
Tableau 2.III Normes traditionnellement utilisées pour la puberté chez le garçon (d'après Marshall et Tanner, 1970)
|
Stades
|
Âges (ans)
|
Stades
|
Âges (ans)
|
|
G2
|
11,6 ± 1,1
|
P2
|
13,4 ± 1,1
|
|
G3
|
12,9 ± 1,1
|
P3
|
13,9 ± 1,0
|
|
G4
|
13,8 ± 1,0
|
P4
|
14,4 ± 1,1
|
|
G5
|
14,9 ± 1,7
|
P5
|
15,2 ± 1,1
|
Âges du développement pubertaire normal
L'estimation de l'âge moyen de la puberté dans une population pose différents problèmes méthodologiques : type de recueil des données (questionnement, inspection visuelle, palpation), stade considéré. De plus, l'activation biologique de l'axe gonadotrope n'est jamais documentée dans les études et les signes pubertaires sont donc une mesure subrogée de cette activation. L'évaluation des stades de Tanner peut être réalisée par auto-appréciation ou par le médecin, ce qui constitue une approche plus sûre bien qu'il existe d'importantes variations inter-observateurs (Hergenroeder et coll., 1999

).
Les études menées aux États-Unis rapportent un âge moyen de survenue des premières règles (ménarche) vers 12,8 ans (Mac Mahon, 1973

; Tanner et Davies, 1985

). Une étude américaine récente réalisée auprès de 17 000 filles (
Academy of pediatrics-pediatric research in office settings, 1997) donne un âge moyen du stade B2 (thélarche) de 10 ans chez les filles blanches (ménarche : 12,8 ans) et de 8,9 ans chez les filles noires (ménarche : 12,1 ans). Ces valeurs sont très significativement plus basses que celles utilisées traditionnellement et dérivant des données de Marshall et Tanner. Cependant, cette étude présente un biais méthodologique : le développement mammaire a été évalué visuellement, alors que la palpation est nécessaire pour distinguer entre tissus adipeux et mammaire, ce qui a pu conduire à une surestimation du développement mammaire. Dans la grande étude du
National Health and Nutrition Examination Survey (Nhanes III, 1997

) l'âge médian du stade B2 est de 9,7 ans (10,4 ans pour les filles blanches et 9,5 ans pour les filles noires). L'étude
Bogalusa Heart Study (Wattigney et coll., 1999

) rapporte sur une cohorte de 1 082 filles un âge moyen des premières règles de 11,4 et 11,5 ans (africaines-américaines et blanches-américaines).
En Europe, l'âge des premières règles varie entre 12 ans en Italie et 13,5 ans en Allemagne (Borneman et coll., 1995

; Engelhard et coll., 1995). En France, cet âge moyen est de 12,6 ans (de la Rochebrochard, 1999).
Chez les garçons, différentes études américaines et européennes s'accordent sur un âge moyen de 11,6 ans pour le stade G2 (Marshall et Tanner, 1970

; Largo et Prader, 1983

; Lindgren, 1996

; Mul et coll., 2001

). L'étude de la cohorte Nhanes III trouve un âge médian de 9,7 ans pour ce même paramètre (Herman-Giddens et coll., 2001

). Un biais lié à l'estimation visuelle sans palpation est évoqué pour expliquer ces différences entre études (Parent et coll., 2003

).
La distribution normale (courbe de Gauss) de l'âge de la puberté conduit à définir la limite normale de l'âge de la puberté comme égal à la moyenne ± 2 écarts-types. En Europe, la plupart considèrent comme précoce un stade B2 survenant avant 8 ans chez les filles et un stade G2 survenant avant 9 ans chez les garçons (Klein, 1999

; Lebreton et Bourguignon, 2000). La définition de ces limites est très importante dans la perspective d'interventions thérapeutiques lors d'un développement précoce anormal. Cependant, le seul écart aux normes ne définit pas la pathologie mais appelle une évaluation biologique (stéroïdes sexuels, gonadotrophines...) et radiologique (échographie pelvienne, IRM hypophysaire) (Tauber, 2002

).
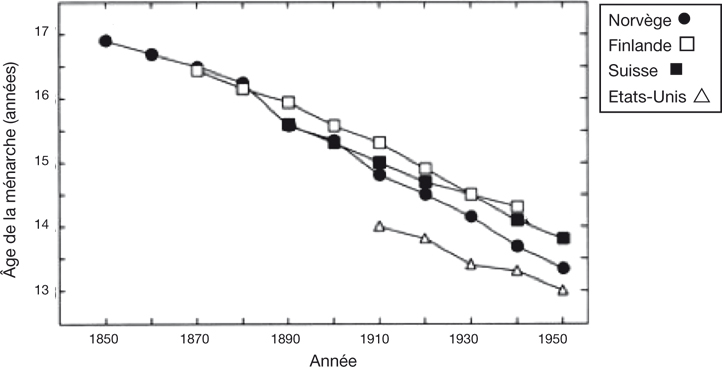
Évolution séculaire de l'âge de la puberté
Entre le milieu du XIX
e siècle et le milieu du XX
e siècle, l'âge moyen des premières règles a particulièrement diminué, passant de 17 ans à 14 ans aux États-Unis et dans plusieurs pays de l'Europe de l'ouest (Zacharias et Wurtman, 1969

; Eveleth, 1978

; van Wieringen, 1978 ; Wyshak et Frisch, 1982

; Eveleth et Tanner, 1990

; Grumbach et Styne, 1998

). La courbe de cette évolution varie d'un pays à l'autre : une diminution de 0,3 ans par décennie a été calculée pour les données norvégiennes et finlandaises (Eveleth, 1978

; Wyshak et Frisch, 1982

; Eveleth et Tanner, 1990

) et dans les études prospectives américaines (Zacharias et Wurtman, 1969

; Wyshak et Frisch, 1982

) ; en France, la diminution est de 0,175 ans par décennie (Ducros et Pasquet, 1978

) (figure 2.1

).
Il faut noter l'existence d'un gradient Nord-Sud au XIX
e siècle avec un âge de ménarche plus bas dans les pays du sud de l'Europe (France) que dans les pays du nord (Scandinavie) (Ducros et Pasquet, 1978

; van Wieringen, 1978 ; Wyshak et Frisch, 1982

).
Les études réalisées après 1960 donnent des résultats moins uniformes quant à l'évolution de l'âge de la puberté qui varie d'un pays à l'autre. Globalement, il semble que cette évolution séculaire tende à se stabiliser, voire à s'arrêter. En Grande-Bretagne, Suède et Belgique, une petite augmentation de l'âge de la ménarche est observée (+0,14, +0,05, +0,03 année par décennie, Vercauteren et Susanne, 1985

; Lindgren et coll., 1990 ; Dann et Roberts, 1993

). Aux États-Unis, Danemark, Finlande, Pays-Bas, Russie, France et Grèce, l'évolution reste négative (-0,12 ans par décennie) mais modérée (Rimpelä et Rimpelä, 1993

; Dubrova et coll., 1995

; Helm et Grolund, 1998

; Papadimitriou et coll., 1999

; Fredriks et coll., 2000

; de Muinck et Mul, 2001

; Sultan et coll., 2001

; Anderson et coll., 2003

; Chumlea et coll., 2003

). Une diminution lente est observée (-0,14 an par décennie) à Hong-Kong, au Venezuela et au Cameroun (Huen et coll., 1997

; Pasquet et coll., 1999

). En Espagne, la diminution reste marquée au cours des années 1990 (-0,22 an par décennie, Marrodan et coll., 2000

). Dans certains pays, la diminution est aussi importante qu'elle l'était dans les pays occidentaux avant 1960, c'est le cas en Inde, Chine, Bulgarie (Singh et Malhotra, 1988

; Bodzsar et Susanne, 1998

; Graham et coll., 1999

).
Ces évolutions sont en réalité en concordance avec l'évolution des conditions de vie dans les différents pays. L'évolution séculaire de l'âge des premières règles serait associée à l'élévation de l'indice de masse corporelle (Anderson et coll., 2003

). Plusieurs auteurs notent que des variations au sein de sous-groupes de population vivant dans des conditions socioéconomiques différentes peuvent ne pas être visibles dans les données globales de la population (Eveleth, 1978

; Eveleth et Tanner, 1990

; Olesen et coll., 2000

). Cependant, la variabilité de l'âge pubertaire (ménarche) au sein d'une population ne suit pas toujours la même évolution séculaire que la diminution de l'âge de la puberté, ce qui suppose qu'elle n'est pas influencée par les mêmes facteurs ou qu'elle l'est différemment (Zacharias et Wurtman, 1969

; Graham et coll., 1999

).
D'autres études se sont intéressées à l'évolution séculaire de marqueurs tels que le développement mammaire (filles) ou des organes génitaux (garçons). En Suède et en Grande-Bretagne, le développement mammaire est plus précoce en 1980 que dans les années 1960 ou 1970 (de Muinck et Mul, 2001

). Au Danemark, l'âge moyen de la poussée de développement mammaire passe de 10,6 ans en 1964 à 11,2 ans en 1990-1991 (Mau et coll., 2002

). On n'observe pas en Europe, la diminution de l'âge d'apparition du stade B2 observée aux États-Unis (Herman-Giddens et coll., 1997

; Nhanes III, 1997

). Chez les garçons, l'âge du stade G2 a augmenté au cours des dernières décennies aux Pays-Bas et a diminué en Suède (de Muinck et Mul, 2001

). Ces données soulignent d'une part l'existence de variations d'un pays à l'autre et d'autre part montrent l'importance du marqueur utilisé pour évaluer l'évolution de l'âge de la puberté (ménarche, stade de Tanner).
Facteurs impliqués dans les variations de l'âge pubertaire
Les études épidémiologiques ont tenté d'isoler différents facteurs corrélés avec des variations de l'âge de la puberté, essentiellement chez les filles.
Conditions socioéconomiques
Les filles vivant dans des milieux dits « privilégiés » au sein de pays en voie de développement (Asie, Afrique, Amérique du sud) ont un âge moyen de la ménarche comparable à celui des filles des pays occidentaux du pourtour méditerranéen mais différent de celui des filles vivant dans les mêmes pays dans des conditions moins privilégiées (Parent et coll., 2003

). Le « tempo » de la puberté est parfois différent d'un pays à l'autre, l'âge du stade B2 varie pour un âge de ménarche IDEntique par exemple entre Hong-Kong et la Grèce (Huen et coll., 1997

; Papadimitriou et coll., 1999

).
Par ailleurs, les études sur les enfants migrants ou adoptés dans des pays étrangers montrent des résultats hétérogènes selon le pays d'origine. Dans une étude Belge, le pourcentage de filles originaires de Colombie, Inde, Sri-Lanka, présentant une puberté précoce est élevé mais ce n'est pas le cas pour les filles d'Éthiopie ou des Philippines (Krstevska-Konstantinova et coll., 2001

). Au Danemark, le risque de puberté précoce est 15 à 20 fois plus élevé après adoption internationale que chez les enfants autochtones (Teilmann et coll., 2006

).
Facteurs génétiques
Les études réalisées avec des jumeaux indiquent que 70 % à 80 % de la variance de l'âge de la puberté peuvent être expliquées par des facteurs génétiques (Fischbein, 1977

; Treloar et Martin, 1990

; Meyer et coll., 1991

; Kaprio et coll., 1995

; Chumlea et coll., 2003

).
Bien que de nombreux composants de l'axe gonadotrope aient été IDEntifiés en physiologie et en pathologie (gènes impliqués dans les hypogonadismes centraux par exemple), les variants géniques impliqués dans la variabilité de la puberté ne sont pas identifiés. Plusieurs études ont fait état de liaison avec des régions génétiques, mais aucun gène n'a été clairement identifié (Guo et coll., 2006

a et b ; Rothenbuhler et coll., 2006

; Zhao et coll., 2007

).
Nutrition
Une relation entre le poids corporel et l'âge de survenue de la puberté a été suggérée depuis longtemps par Frisch et Revelle (1970

, 1971

). Par ailleurs, le cycle menstruel requiert un minimum de 22 % de masse grasse dans la composition corporelle. Cependant, les déterminants nutritionnels du cycle ovarien peuvent être différents de ceux du contrôle du
timing pubertaire. Les filles qui ont une puberté précoce sont plus souvent obèses que les filles qui ont une puberté tardive (Stark et coll., 1989

), alors que l'inverse est observé chez les garçons (Wang, 2002

). Un indice de masse corporelle élevé dès 36 mois est associé avec une puberté précoce chez les filles américaines (Lee et coll., 2007

). De nombreuses études indiquent l'influence de l'indice de masse corporelle (IMC) dans l'enfance sur la date de survenue de la puberté. Par exemple, dans l'étude de la
Bogalusa heart study, les filles dont l'IMC était au dessus de la médiane avaient en moyenne leurs premières règles un an plus tôt que celles dont l'IMC était plus bas (Freedman et coll., 2002

). De même, dans l'étude longitudinale menée en Australie par Sloboda, l'IMC à 8 ans était un fort prédicteur de la survenue des premières règles et les filles dont l'IMC était supérieur à la médiane avaient en moyenne leurs premières règles 0,4 année avant l'autre moitié de la population (Sloboda et coll., 2007

).
La relation entre statut nutritionnel et les variations de l'âge de la puberté est significative, mais d'autres facteurs interagissent, notamment ethniques et génétiques (Parent et coll., 2003

).
Croissance précoce
Le poids de naissance et la croissance précoce sont des facteurs importants du déterminisme de la puberté. Les enfants nés petits pour l'âge gestationnel et dont le rattrapage statural est rapide tendent à avoir une puberté plus précoce que ceux qui sont nés avec un poids de naissance élevé. Par exemple, dans l'étude d'Adair qui porte sur une population de Philippins relativement défavorisés, il y avait une différence de 6 mois dans l'âge des premières règles entre les enfants nés grands et maigres (masse grasse faible) et ceux nés petits et lourds (masse grasse élevée) (Adair, 2001

). De même dans l'étude de Sloboda, les enfants les plus maigres à la naissance avaient en moyenne des premières règles plus précoces de quelques mois (0,3 années en moyenne) (Sloboda et coll., 2007

). La croissance précoce (vitesse de rattrapage chez les enfants nés petits pour l'âge gestationnel) a été également reliée à l'âge de la puberté (Adair, 2001

).
Stress
Des situations d'adversité physique et psychologique comme en temps de guerre entraînent un retard pubertaire et un renversement de la tendance séculaire comme observé en Croatie et en Bosnie (Tahirovié, 1998

; Preberg et Bralic, 2000

). Un entraînement sportif intensif induit aussi une puberté retardée (Theintz et coll., 1989

; Georgopoulos et coll., 1999

). Cependant, d'autres situations de stress induisent une puberté précoce (immigration, adoption, attachement parental insecure). La différence d'impact des composants de la situation de stress suggère une hétérogénéité de la réponse neuroendocrine à ces différents facteurs (Pacak et Palkovits, 2001

).
Exposition à des produits chimiques de type perturbateurs endocriniens
Une relation entre l'exposition fœtale et périnatale à des produits chimiques perturbateurs endocriniens (pesticide DDT mesuré dans le sérum sanguin d'enfants immigrés) et puberté précoce a été observée (Krstevska-Konstantinova et coll., 2001

). De nombreuses études ont porté sur ce sujet, mais il est difficile d'isoler les agents chimiques présents dans l'environnement pour connaître leurs effets respectifs sur le système endocrinien (Parent et coll., 2003

).
Autres facteurs
D'autres facteurs telles que les conditions de luminosité et climatiques ont fait l'objet d'hypothèses mais nécessitent de nouvelles études pour conclure (Parent et coll., 2003

). De même, des liens entre puberté précoce et cancer du sein, ou encore entre puberté précoce ou retardée et taille corporelle adulte, résultats scolaires, relation avec les pairs... ont aussi fait l'objet de recherches (Karlberg, 2002

).
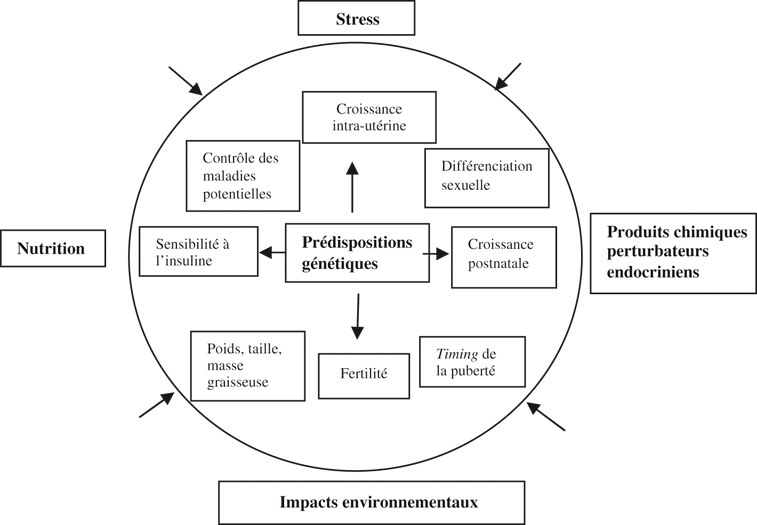
Au total, l'âge de la puberté est un processus physiologique complexe soumis à tout un spectre de facteurs en intercorrélation (figure 2.2

).
En conclusion,
la variabilité de l'âge moyen de la puberté d'un pays à l'autre est relativement réduite et ne dépasse pas un an dans les pays occidentaux. La nutrition et l'épidémie d'obésité sont un facteur essentiel de la variation de l'âge de la puberté dans ces mêmes pays. L'évolution séculaire montre une diminution particulièrement importante de l'âge des premières règles dans la plupart des pays occidentaux. Elle est actuellement nettement moins marquée qu'avant 1960. En revanche, la variabilité interindividuelle peut atteindre 4-5 ans et dépend de facteurs génétiques et environnementaux.
Bibliographie
[1] adair ls. Size at birth predicts age at menarche.
Pediatrics. 2001;
107:E59

[2] anderson se,
dallai ge,
must a. Relative weight and race influence average age at menarche: results from two nationally representative surveys of US girls studied 25 years apart.
Pediatrics. 2003;
111:844
-850

[3] bodzsar eb,
susanne c. Secular growth change in Europe.
Budapest:Eötvö University Press;
1998.

[4] borneman m,
vienna a,
tommaseo m,
capucci e. Menarcheal age and environmental factors in a sample from the province of Rome.
Acta Med Auxol. 1995;
27:97
-104

[5] chumlea wc,
schubert cm,
roche af,
kulin he,
lee pa. Age at menarche and racial comparisons in US girls.
Pediatrics. 2003;
111:110
-113

[6] coste j,
ecosse e,
lesage c,
chaussain jl,
carel jc. Evaluation of adolescent statural growth in health and disease: reliability of assessment from height measurement series and development of an automated algorithm.
Horm Res. 2002;
58:105
-14

[7] dann tc,
roberts de. Menarcheal age in University of Warwick young women.
J Biosoc Sci. 1993;
25:531
-538

[8] de la rochebrochard e. Les âges à la puberté des filles et des garçons en France.
Population. 1999;
54:933
-962

[9] de muinck keizer-schrama smpf,
mul d. Trends in pubertal development in Europe.
Hum Reprod Update. 2001;
7:287
-291

[10] dubrova ye,
kurbatova ol,
kholod on,
prokhorovskaya vd. Secular growth trend in two generations of the Russian population.
Hum Biol. 1995;
67:755
-767

[11] ducros a,
pasquet p. Evolution de l’âge d’apparition des premières règles (ménarche) en France.
Biometrie Humaine. 1978;
13:35
-43

[12] engelhardt l,
willers b,
pelz l. Sexual maturation in East German girls.
Acta Paediatr. 1995;
84:1362
-1365

[13] eveleth pb. Population differences in growth: environmental and genetic factors.
In: falkner f, tanner jm, editors.
Human growth.
New York:Plenum Press;
1978.
p. 373
-394

[14] eveleth pb,
tanner jm. Worldwide variation in human growth. 2nd ed.
Cambridge, UK:Cambridge University Press;
1990.

[15] fischbein s. Intra-pair similarity in physical growth of monozygotic and of dizygotic twins during puberty.
Ann Hum Biol. 1977;
4:417
-430

[16] fredriks am,
van buuren s,
burgmeijer rj,
meulmeester jf,
beuker rj. Continuing positive secular growth change in the Netherlands 1955-1997.
Pediatrics. 2000;
47:316
-323

[17] freedman ds,
khan lk,
serdula mk,
dietz wh,
srinivasan sr,
berenson gs. Relation of age at menarche to race, time period, and anthropometric dimensions: the Bogalusa Heart Study.
Pediatrics. 2002;
110:e43

[18] frisch re,
revelle r. Height and weight at menarche and hypothesis of critical body weights and adolescent events.
Science. 1970;
169:397
-399

[19] frisch re,
revelle r. Height and weight at menarche and hypothesis of menarche.
Arch Dis Child. 1971;
46:695
-701

[20] georgopoulos n,
markou k,
theodoropoulou a,
paraskevopoulou p,
varaki l. Growth and pubertal development in elite female rhythmic gymnasts.
J Clin Endocrinol Metab. 1999;
84:4525
-4530

[21] graham mj,
larsen u,
xu x. Secular trend in age at menarche in China: a case study of two rural counties in Anhui Province.
J Biosoc Sci. 1999;
31:257
-267

[22] grumbach mm,
styne dm. Puberty: ontogeny, neuroendocrinology, physiology, and disorders.
In: wilson jd, foster dw, kronenberg hm, larsen pr, editors.
Williams’ textbook of endocrinology..
9th ed..
Philadelphia:WB Saunders Co;
1998.
p. 1509
-1625

[23] guo y,
shen h,
xiao p,
xiong dh,
yang tl. Genomewide linkage scan for quantitative trait loci underlying variation in age at menarche.
J Clin Endocrinol Metab. 2006a;
91:1009
-1014

[24] guo y,
xiong dh,
yang tl,
guo yf,
recker rr,
deng hw. Polymorphisms of estrogen-biosynthesis genes CYP17 and CYP19 may influence age at menarche: a genetic association study in Caucasian females.
Hum Mol Genet. 2006b;
15:2401
-2418

[25] helm p,
grolund l. A halt in the secular trend towards earlier menarche in Denmark.
Acta Obstet Gynecol Scand. 1998;
77:198
-200

[26] hergenroeder ac,
hill rb,
wong ww,
sangi-haghpeykar h,
taylor w. Validity of self-assessment of pubertal maturation in African-American and European-American adolescents.
J Adolesc Health. 1999;
24:201
-205

[27] herman-giddens me,
slora ej,
wasserman rc,
bourdony cj,
bhapkar mv. Secondary sexual characteristics and menses in young girls seen in office practice: a study front the Pediatric Research in Office Settings network.
Pediatrics. 1997;
99:505
-512

[28] herman-giddens me,
wang l,
koch g. Secondary sexual characteristics in boys. Estimates from the National Health and Examination Survey III, 1988-1994.
Arch Pediatr Adolesc Med. 2001;
155:1022
-1028

[29] huen kf,
leung ss,
lau jt,
cheung ay,
leung nk,
chiu mc. Secular trend in the sexual maturation of Southern Chinese girls.
Acta Paediatr. 1997;
86:1121
-1124

[30] kaprio j,
rimpela a,
winter t,
viken rj,
rimpela m,
rose rj. Common genetic influences on BMI and age at menarche.
Hum Biol. 1995;
67:739
-753

[31] karlberg j. Secular trends in pubertal development.
Horm Res. 2002;
57:19
-30

[32] klein ko. Precocious puberty: who has it? Who should be treated?.
J Clin Endocrinol Metab. 1999;
84:411
-414

[33] krstevska-konstantinova m,
chartier c,
craen m,
du caju m,
heinrichs c. Sexual precocity after immigration from developing countries to Belgium: evidence of previous exposure to organochlorine pesticides.
Hum Reprod. 2001;
16:1020
-1026

[34] largo rh,
prader a. Pubertal development in Swiss boys.
Helv Paediat Acta. 1983;
8:211
-228

[35] lebrethon mc,
bourguignon jp. Management of central isocentral precocity: diagnosis, treatment, outcome.
Curr Opin Pediatr. 2000;
12:394
-399

[36] lee jm,
appugliese d,
kaciroti n,
corwyn rf,
bradley rh,
lumeng c. Weight status in young girls and the onset of puberty.
Pediatrics. 2007;
119:624
-630

[37] lindgren g. Pubertal stages 1980 of Stockholm schoolchildren.
Acta Paediatr. 1996;
85:1365
-1367

[38] lindgren gw,
degerfors il,
fredriksson a,
loukili a,
mannerfeldt r. Menarche 1990 in Stockholm schoolgirls.
Acta Paediatr Scand. 1991;
80:953
-955

[39] mac mahon b. Age at menarche United States, DHEW pub, no. (HRA) 74-1615.
Natl Health Surv. 1973;
:133

[40] marrodan md,
mesa ms,
arechiga j,
perez-magdaleno a. Trend in menarcheal age in Spain: rural and urban comparison during e recent period.
Ann Hum Biol. 2000;
27:313
-319

[41] marshall wa,
tanner jm. Variations in pattern of pubertal changes in girls.
Arch Dis Child. 1969;
44:291
-303

[42] marshall wa,
tanner jm. Variations in the pattern of pubertal changes in boys.
Arch Dis Child. 1970;
46:13
-23

[43] mau c,
main km,
hertel t,
holm k,
mosfeldt-laursen e. No apparent secular change in age at puberty in Danish girls 1964-1991.
Horm Res. 2002;
58:84 (Abstract)

[44] meyer jm,
eaves lj,
heath ac,
martin ng. Estimating genetic influences on the age-at-menarche: a survival analysis approach.
Am J Med Genet. 1991;
39:148
-154

[45] mul d,
fredriks m,
van buuren s,
oosdijk w,
verloove-vanhorick sp,
wit jm. Pubertal developement in the Netherlands 1965-1997.
Pediatr Res. 2001;
50:479
-486

[46] nhanes iii. NHANES III Reference manuals and reports (CD-ROM). Analytic and reporting guidelines: the Third National Health and Nutrition Examination Survey (1988-94).
Hyattsville, MD:National Center for Health Statistics, Centers for Disease Control and Prevention;
1997.

[47] olesen aw,
jeune b,
boldsen jl. A continuous decline in menarcheal age in Denmark.
Ann Hum Biol. 2000;
27:377
-386

[48] pacak k,
palkovits m. Stressor specificity of central neuroendocrine responses: implication for stress-related disorders.
Endocr Rev. 2001;
22:502
-548

[49] papadimitriou a,
gousia e,
pitaouli e,
tapaki g,
philippidis p. Age at menarche in Greek girls.
Ann Hum Biol. 1999;
26:175
-177

[50] parent as,
teilmann g,
juul a,
skakkebaek ne,
toppari j,
bourguignon jp. The timing of normal puberty and the age limits of sexual precocity: variations around the world, secular trends, and changes after migration.
Endocrine Reviews. 2003;
24:668
-693

[51] pasquet p,
biyong am,
rikong-adie h,
befidi-mengue r,
garba mt,
froment a. Age at menarche and urbanization in Cameroon: current status and secular trends.
Ann Hum Biol. 1999;
26:89
-97

[52] preberg z,
bralic i. Changes in menarcheal age in girls exposed to war conditions.
Am J Hum Biol. 2000;
12:503
-508

[53] rimpelä ah,
rimpelä mk. Towards an equal distribution of health? Socioeconomic and regional differences of the secular trend of the age at menarche in Finland from 1979 to 1989.
Acta Paediatr. 1993;
82:87
-90

[54] rothenbuhler a,
fradin d,
heath s,
lefevre h,
bouvattier c. Weight-adjusted genome scan analysis for mapping quantitative trait Loci for menarchal age.
J Clin Endocrinol Metab. 2006;
91:3534
-3537

[55] singh sp,
malhotra p. Secular shift in menarcheal age of Patiala (India) schoolgirls between 1974 and 1986.
Ann Hum Biol. 1988;
15:77
-80

[56] sloboda dm,
hart r,
doherty da,
pennell ce,
hickey m. Age at menarche: Influences of prenatal and postnatal growth.
J Clin Endocrinol Metab. 2007;
92:46
-50

[57] stark o,
peckham cs,
moynihan c. Weight and age at menarche.
Arch Dis Child. 1989;
64:383
-387

[58] sultan c,
paris f,
jeandel c,
attal g,
lombroso s,
dumas r. L’âge de la puberté et de la ménarche.
Rev Int Pediat. 2001;
32:9
-10

[59] tahirovié hf. Menarchal age and the stress of war: an example from Bosnia.
Eur J Pediatr. 1998;
157:978
-980

[60] tanner jm,
davies psw. Clinical longitudinal standards for height and height velocity for North American children.
J Pediatr. 1985;
107:317
-329

[61] tauber m. Âge normal de la puberté et explorations endocriniennes.
Arch Pédiatr. 2002;
9:229
-230

[62] teilmann g,
pedersen cb,
skakkebaek ne,
jensen tk. Increased risk of precocious puberty in internationally adopted children in Denmark.
Pediatrics. 2006;
118:e391
-399

[63] theintz ge,
howald h,
allemann y,
sizonenko pc. Growth and pubertal development of young female gymnasts and swimmers: a correlation with parental data.
Int J Sports med. 1989;
10:87
-91

[64] treloar sa,
martin ng. Age at menarche as a fitness trait: nonadditive genetic variance detected in a large twin sample.
Am J Hum Genet. 1990;
47:137
-148

[65] van wieringen jc. Secular growth changes.
In: falkner f, tanner jm, editors.
Human growth.
New York:Plenum Press;
1978.
p. 445
-473

[66] vercauteren m,
susanne c. The secular trend of height and menarche in Belgium: are there any signs of a future stop?.
Eur J Pediatr. 1985;
144:306
-309

[67] wang y. Is obesity associated with early sexual maturation? A comparison of the association in American boysvs girls.
Pediatrics. 2002;
110:903
-910

[68] wattigney wa,
srinivasan sr,
chen w,
greenlund kj,
berenson gs. Secular trend of earlier onset of menarche with increasing obesity in black and white girls: the Bogalusa Heart study.
Ethn Dis. 1999;
9:181
-189

[69] wyshak g,
frisch re. Evidence for a secular trend in age of menarche.
N Engl J Med. 1982;
306:1033
-1035

[70] zacharias l,
wurtman rj. Age at menarche. Genetic and environmental influences.
N Engl J Med. 1969;
280:868
-875

[71] zhao j,
xiong dh,
guo y,
yang tl,
recker rr,
deng hw. Polymorphism in the insulin-like growth factor 1 gene is associated with age at menarche in caucasian females.
Hum Reprod. 2007 Mar 21;
: (Epub ahead of print)

 ).
). ). Leur date de survenue est considérée comme physiologique entre 10 et 15,5 ans. La maturation osseuse est sous la dépendance des stéroïdes sexuels, d'où une certaine concordance entre l'âge osseux de 11 ans (10 à 12 ans) correspondant à l'apparition du sésamoïde du pouce et le début de la puberté chez la fille (B2). Il existe cependant une grande variabilité dans la concordance entre maturation pubertaire clinique et vitesse de croissance pubertaire (Coste et coll., 2002
). Leur date de survenue est considérée comme physiologique entre 10 et 15,5 ans. La maturation osseuse est sous la dépendance des stéroïdes sexuels, d'où une certaine concordance entre l'âge osseux de 11 ans (10 à 12 ans) correspondant à l'apparition du sésamoïde du pouce et le début de la puberté chez la fille (B2). Il existe cependant une grande variabilité dans la concordance entre maturation pubertaire clinique et vitesse de croissance pubertaire (Coste et coll., 2002 ).
). ). Les autres signes de maturation pubertaires sont le développement de la pilosité pubienne et axillaire, l'augmentation de la taille de la verge.
). Les autres signes de maturation pubertaires sont le développement de la pilosité pubienne et axillaire, l'augmentation de la taille de la verge. ).
). ; Tanner et Davies, 1985
; Tanner et Davies, 1985 ). Une étude américaine récente réalisée auprès de 17 000 filles (Academy of pediatrics-pediatric research in office settings, 1997) donne un âge moyen du stade B2 (thélarche) de 10 ans chez les filles blanches (ménarche : 12,8 ans) et de 8,9 ans chez les filles noires (ménarche : 12,1 ans). Ces valeurs sont très significativement plus basses que celles utilisées traditionnellement et dérivant des données de Marshall et Tanner. Cependant, cette étude présente un biais méthodologique : le développement mammaire a été évalué visuellement, alors que la palpation est nécessaire pour distinguer entre tissus adipeux et mammaire, ce qui a pu conduire à une surestimation du développement mammaire. Dans la grande étude du National Health and Nutrition Examination Survey (Nhanes III, 1997
). Une étude américaine récente réalisée auprès de 17 000 filles (Academy of pediatrics-pediatric research in office settings, 1997) donne un âge moyen du stade B2 (thélarche) de 10 ans chez les filles blanches (ménarche : 12,8 ans) et de 8,9 ans chez les filles noires (ménarche : 12,1 ans). Ces valeurs sont très significativement plus basses que celles utilisées traditionnellement et dérivant des données de Marshall et Tanner. Cependant, cette étude présente un biais méthodologique : le développement mammaire a été évalué visuellement, alors que la palpation est nécessaire pour distinguer entre tissus adipeux et mammaire, ce qui a pu conduire à une surestimation du développement mammaire. Dans la grande étude du National Health and Nutrition Examination Survey (Nhanes III, 1997 ) l'âge médian du stade B2 est de 9,7 ans (10,4 ans pour les filles blanches et 9,5 ans pour les filles noires). L'étude Bogalusa Heart Study (Wattigney et coll., 1999
) l'âge médian du stade B2 est de 9,7 ans (10,4 ans pour les filles blanches et 9,5 ans pour les filles noires). L'étude Bogalusa Heart Study (Wattigney et coll., 1999 ) rapporte sur une cohorte de 1 082 filles un âge moyen des premières règles de 11,4 et 11,5 ans (africaines-américaines et blanches-américaines).
) rapporte sur une cohorte de 1 082 filles un âge moyen des premières règles de 11,4 et 11,5 ans (africaines-américaines et blanches-américaines). ; Engelhard et coll., 1995). En France, cet âge moyen est de 12,6 ans (de la Rochebrochard, 1999).
; Engelhard et coll., 1995). En France, cet âge moyen est de 12,6 ans (de la Rochebrochard, 1999). ; Largo et Prader, 1983
; Largo et Prader, 1983 ; Lindgren, 1996
; Lindgren, 1996 ; Mul et coll., 2001
; Mul et coll., 2001 ). L'étude de la cohorte Nhanes III trouve un âge médian de 9,7 ans pour ce même paramètre (Herman-Giddens et coll., 2001
). L'étude de la cohorte Nhanes III trouve un âge médian de 9,7 ans pour ce même paramètre (Herman-Giddens et coll., 2001 ). Un biais lié à l'estimation visuelle sans palpation est évoqué pour expliquer ces différences entre études (Parent et coll., 2003
). Un biais lié à l'estimation visuelle sans palpation est évoqué pour expliquer ces différences entre études (Parent et coll., 2003 ).
). ; Lebreton et Bourguignon, 2000). La définition de ces limites est très importante dans la perspective d'interventions thérapeutiques lors d'un développement précoce anormal. Cependant, le seul écart aux normes ne définit pas la pathologie mais appelle une évaluation biologique (stéroïdes sexuels, gonadotrophines...) et radiologique (échographie pelvienne, IRM hypophysaire) (Tauber, 2002
; Lebreton et Bourguignon, 2000). La définition de ces limites est très importante dans la perspective d'interventions thérapeutiques lors d'un développement précoce anormal. Cependant, le seul écart aux normes ne définit pas la pathologie mais appelle une évaluation biologique (stéroïdes sexuels, gonadotrophines...) et radiologique (échographie pelvienne, IRM hypophysaire) (Tauber, 2002 ).
). ; Eveleth, 1978
; Eveleth, 1978 ; van Wieringen, 1978 ; Wyshak et Frisch, 1982
; van Wieringen, 1978 ; Wyshak et Frisch, 1982 ; Eveleth et Tanner, 1990
; Eveleth et Tanner, 1990 ; Grumbach et Styne, 1998
; Grumbach et Styne, 1998 ). La courbe de cette évolution varie d'un pays à l'autre : une diminution de 0,3 ans par décennie a été calculée pour les données norvégiennes et finlandaises (Eveleth, 1978
). La courbe de cette évolution varie d'un pays à l'autre : une diminution de 0,3 ans par décennie a été calculée pour les données norvégiennes et finlandaises (Eveleth, 1978 ; Wyshak et Frisch, 1982
; Wyshak et Frisch, 1982 ; Eveleth et Tanner, 1990
; Eveleth et Tanner, 1990 ) et dans les études prospectives américaines (Zacharias et Wurtman, 1969
) et dans les études prospectives américaines (Zacharias et Wurtman, 1969 ; Wyshak et Frisch, 1982
; Wyshak et Frisch, 1982 ) ; en France, la diminution est de 0,175 ans par décennie (Ducros et Pasquet, 1978
) ; en France, la diminution est de 0,175 ans par décennie (Ducros et Pasquet, 1978 ) (figure 2.1
) (figure 2.1 ).
). ; van Wieringen, 1978 ; Wyshak et Frisch, 1982
; van Wieringen, 1978 ; Wyshak et Frisch, 1982 ).
). ; Lindgren et coll., 1990 ; Dann et Roberts, 1993
; Lindgren et coll., 1990 ; Dann et Roberts, 1993 ). Aux États-Unis, Danemark, Finlande, Pays-Bas, Russie, France et Grèce, l'évolution reste négative (-0,12 ans par décennie) mais modérée (Rimpelä et Rimpelä, 1993
). Aux États-Unis, Danemark, Finlande, Pays-Bas, Russie, France et Grèce, l'évolution reste négative (-0,12 ans par décennie) mais modérée (Rimpelä et Rimpelä, 1993 ; Dubrova et coll., 1995
; Dubrova et coll., 1995 ; Helm et Grolund, 1998
; Helm et Grolund, 1998 ; Papadimitriou et coll., 1999
; Papadimitriou et coll., 1999 ; Fredriks et coll., 2000
; Fredriks et coll., 2000 ; de Muinck et Mul, 2001
; de Muinck et Mul, 2001 ; Sultan et coll., 2001
; Sultan et coll., 2001 ; Anderson et coll., 2003
; Anderson et coll., 2003 ; Chumlea et coll., 2003
; Chumlea et coll., 2003 ). Une diminution lente est observée (-0,14 an par décennie) à Hong-Kong, au Venezuela et au Cameroun (Huen et coll., 1997
). Une diminution lente est observée (-0,14 an par décennie) à Hong-Kong, au Venezuela et au Cameroun (Huen et coll., 1997 ; Pasquet et coll., 1999
; Pasquet et coll., 1999 ). En Espagne, la diminution reste marquée au cours des années 1990 (-0,22 an par décennie, Marrodan et coll., 2000
). En Espagne, la diminution reste marquée au cours des années 1990 (-0,22 an par décennie, Marrodan et coll., 2000 ). Dans certains pays, la diminution est aussi importante qu'elle l'était dans les pays occidentaux avant 1960, c'est le cas en Inde, Chine, Bulgarie (Singh et Malhotra, 1988
). Dans certains pays, la diminution est aussi importante qu'elle l'était dans les pays occidentaux avant 1960, c'est le cas en Inde, Chine, Bulgarie (Singh et Malhotra, 1988 ; Bodzsar et Susanne, 1998
; Bodzsar et Susanne, 1998 ; Graham et coll., 1999
; Graham et coll., 1999 ).
). ). Plusieurs auteurs notent que des variations au sein de sous-groupes de population vivant dans des conditions socioéconomiques différentes peuvent ne pas être visibles dans les données globales de la population (Eveleth, 1978
). Plusieurs auteurs notent que des variations au sein de sous-groupes de population vivant dans des conditions socioéconomiques différentes peuvent ne pas être visibles dans les données globales de la population (Eveleth, 1978 ; Eveleth et Tanner, 1990
; Eveleth et Tanner, 1990 ; Olesen et coll., 2000
; Olesen et coll., 2000 ). Cependant, la variabilité de l'âge pubertaire (ménarche) au sein d'une population ne suit pas toujours la même évolution séculaire que la diminution de l'âge de la puberté, ce qui suppose qu'elle n'est pas influencée par les mêmes facteurs ou qu'elle l'est différemment (Zacharias et Wurtman, 1969
). Cependant, la variabilité de l'âge pubertaire (ménarche) au sein d'une population ne suit pas toujours la même évolution séculaire que la diminution de l'âge de la puberté, ce qui suppose qu'elle n'est pas influencée par les mêmes facteurs ou qu'elle l'est différemment (Zacharias et Wurtman, 1969 ; Graham et coll., 1999
; Graham et coll., 1999 ).
). ). Au Danemark, l'âge moyen de la poussée de développement mammaire passe de 10,6 ans en 1964 à 11,2 ans en 1990-1991 (Mau et coll., 2002
). Au Danemark, l'âge moyen de la poussée de développement mammaire passe de 10,6 ans en 1964 à 11,2 ans en 1990-1991 (Mau et coll., 2002 ). On n'observe pas en Europe, la diminution de l'âge d'apparition du stade B2 observée aux États-Unis (Herman-Giddens et coll., 1997
). On n'observe pas en Europe, la diminution de l'âge d'apparition du stade B2 observée aux États-Unis (Herman-Giddens et coll., 1997 ; Nhanes III, 1997
; Nhanes III, 1997 ). Chez les garçons, l'âge du stade G2 a augmenté au cours des dernières décennies aux Pays-Bas et a diminué en Suède (de Muinck et Mul, 2001
). Chez les garçons, l'âge du stade G2 a augmenté au cours des dernières décennies aux Pays-Bas et a diminué en Suède (de Muinck et Mul, 2001 ). Ces données soulignent d'une part l'existence de variations d'un pays à l'autre et d'autre part montrent l'importance du marqueur utilisé pour évaluer l'évolution de l'âge de la puberté (ménarche, stade de Tanner).
). Ces données soulignent d'une part l'existence de variations d'un pays à l'autre et d'autre part montrent l'importance du marqueur utilisé pour évaluer l'évolution de l'âge de la puberté (ménarche, stade de Tanner). ). Le « tempo » de la puberté est parfois différent d'un pays à l'autre, l'âge du stade B2 varie pour un âge de ménarche IDEntique par exemple entre Hong-Kong et la Grèce (Huen et coll., 1997
). Le « tempo » de la puberté est parfois différent d'un pays à l'autre, l'âge du stade B2 varie pour un âge de ménarche IDEntique par exemple entre Hong-Kong et la Grèce (Huen et coll., 1997 ; Papadimitriou et coll., 1999
; Papadimitriou et coll., 1999 ).
). ). Au Danemark, le risque de puberté précoce est 15 à 20 fois plus élevé après adoption internationale que chez les enfants autochtones (Teilmann et coll., 2006
). Au Danemark, le risque de puberté précoce est 15 à 20 fois plus élevé après adoption internationale que chez les enfants autochtones (Teilmann et coll., 2006 ).
). ; Treloar et Martin, 1990
; Treloar et Martin, 1990 ; Meyer et coll., 1991
; Meyer et coll., 1991 ; Kaprio et coll., 1995
; Kaprio et coll., 1995 ; Chumlea et coll., 2003
; Chumlea et coll., 2003 ).
). a et b ; Rothenbuhler et coll., 2006
a et b ; Rothenbuhler et coll., 2006 ; Zhao et coll., 2007
; Zhao et coll., 2007 ).
). , 1971
, 1971 ). Par ailleurs, le cycle menstruel requiert un minimum de 22 % de masse grasse dans la composition corporelle. Cependant, les déterminants nutritionnels du cycle ovarien peuvent être différents de ceux du contrôle du timing pubertaire. Les filles qui ont une puberté précoce sont plus souvent obèses que les filles qui ont une puberté tardive (Stark et coll., 1989
). Par ailleurs, le cycle menstruel requiert un minimum de 22 % de masse grasse dans la composition corporelle. Cependant, les déterminants nutritionnels du cycle ovarien peuvent être différents de ceux du contrôle du timing pubertaire. Les filles qui ont une puberté précoce sont plus souvent obèses que les filles qui ont une puberté tardive (Stark et coll., 1989 ), alors que l'inverse est observé chez les garçons (Wang, 2002
), alors que l'inverse est observé chez les garçons (Wang, 2002 ). Un indice de masse corporelle élevé dès 36 mois est associé avec une puberté précoce chez les filles américaines (Lee et coll., 2007
). Un indice de masse corporelle élevé dès 36 mois est associé avec une puberté précoce chez les filles américaines (Lee et coll., 2007 ). De nombreuses études indiquent l'influence de l'indice de masse corporelle (IMC) dans l'enfance sur la date de survenue de la puberté. Par exemple, dans l'étude de la Bogalusa heart study, les filles dont l'IMC était au dessus de la médiane avaient en moyenne leurs premières règles un an plus tôt que celles dont l'IMC était plus bas (Freedman et coll., 2002
). De nombreuses études indiquent l'influence de l'indice de masse corporelle (IMC) dans l'enfance sur la date de survenue de la puberté. Par exemple, dans l'étude de la Bogalusa heart study, les filles dont l'IMC était au dessus de la médiane avaient en moyenne leurs premières règles un an plus tôt que celles dont l'IMC était plus bas (Freedman et coll., 2002 ). De même, dans l'étude longitudinale menée en Australie par Sloboda, l'IMC à 8 ans était un fort prédicteur de la survenue des premières règles et les filles dont l'IMC était supérieur à la médiane avaient en moyenne leurs premières règles 0,4 année avant l'autre moitié de la population (Sloboda et coll., 2007
). De même, dans l'étude longitudinale menée en Australie par Sloboda, l'IMC à 8 ans était un fort prédicteur de la survenue des premières règles et les filles dont l'IMC était supérieur à la médiane avaient en moyenne leurs premières règles 0,4 année avant l'autre moitié de la population (Sloboda et coll., 2007 ).
).  ).
). ). De même dans l'étude de Sloboda, les enfants les plus maigres à la naissance avaient en moyenne des premières règles plus précoces de quelques mois (0,3 années en moyenne) (Sloboda et coll., 2007
). De même dans l'étude de Sloboda, les enfants les plus maigres à la naissance avaient en moyenne des premières règles plus précoces de quelques mois (0,3 années en moyenne) (Sloboda et coll., 2007 ). La croissance précoce (vitesse de rattrapage chez les enfants nés petits pour l'âge gestationnel) a été également reliée à l'âge de la puberté (Adair, 2001
). La croissance précoce (vitesse de rattrapage chez les enfants nés petits pour l'âge gestationnel) a été également reliée à l'âge de la puberté (Adair, 2001 ).
). ; Preberg et Bralic, 2000
; Preberg et Bralic, 2000 ). Un entraînement sportif intensif induit aussi une puberté retardée (Theintz et coll., 1989
). Un entraînement sportif intensif induit aussi une puberté retardée (Theintz et coll., 1989 ; Georgopoulos et coll., 1999
; Georgopoulos et coll., 1999 ). Cependant, d'autres situations de stress induisent une puberté précoce (immigration, adoption, attachement parental insecure). La différence d'impact des composants de la situation de stress suggère une hétérogénéité de la réponse neuroendocrine à ces différents facteurs (Pacak et Palkovits, 2001
). Cependant, d'autres situations de stress induisent une puberté précoce (immigration, adoption, attachement parental insecure). La différence d'impact des composants de la situation de stress suggère une hétérogénéité de la réponse neuroendocrine à ces différents facteurs (Pacak et Palkovits, 2001 ).
). ). De nombreuses études ont porté sur ce sujet, mais il est difficile d'isoler les agents chimiques présents dans l'environnement pour connaître leurs effets respectifs sur le système endocrinien (Parent et coll., 2003
). De nombreuses études ont porté sur ce sujet, mais il est difficile d'isoler les agents chimiques présents dans l'environnement pour connaître leurs effets respectifs sur le système endocrinien (Parent et coll., 2003 ).
). ). De même, des liens entre puberté précoce et cancer du sein, ou encore entre puberté précoce ou retardée et taille corporelle adulte, résultats scolaires, relation avec les pairs... ont aussi fait l'objet de recherches (Karlberg, 2002
). De même, des liens entre puberté précoce et cancer du sein, ou encore entre puberté précoce ou retardée et taille corporelle adulte, résultats scolaires, relation avec les pairs... ont aussi fait l'objet de recherches (Karlberg, 2002 ).
). ).
).