| |
| Med Sci (Paris). 36(3): 197–200. doi: 10.1051/medsci/2020039.La macro-architecture en lobules du tissu adipeux
humain définit des niches influençant le devenir des cellules
progénitrices Nathalie Boulet1 and Jean Galitzky1* 1Inserm UMR 1048, équipe 1, Institut des maladies
métaboliques et cardiovasculaires (I2MC), Université de
Toulouse, BP84225, 31432Toulouse Cedex 4,
France MeSH keywords: Tissu adipeux, Animaux, Différenciation cellulaire, Microenvironnement cellulaire, Humains, Hyperplasie, Graisse intra-abdominale, Souris, Obésité, Niche de cellules souches, Cellules souches, Graisse sous-cutanée, anatomie et histologie, cytologie, anatomopathologie, physiologie |
Les tissus adipeux jouent un rôle primordial dans la gestion des réserves énergétiques de
l’organisme en assurant, grâce aux adipocytes, le stockage et la libération des lipides.
Les tissus adipeux sont localisés dans des dépôts anatomiques principalement
sous-cutanés (Sc) et viscéraux (Vs). Chez l’homme, la répartition corporelle de ces
dépôts est déterminante pour la santé : un développement excessif de tissu adipeux Vs,
qui caractérise l’obésité « centrale », est en effet associé à un risque élevé de
développer des complications cardio-métaboliques [1]. Les mécanismes cellulaires et moléculaires de cette association
restent cependant à déterminer. Le concept d’« expansibilité » des dépôts adipeux
développé par Vidal Puig postule qu’un défaut de mise en réserve des lipides en excès
dans le tissu adipeux Sc conduit à leur accumulation dans les organes métaboliquement
actifs tels que le muscle, le foie et le pancréas [2]. Ces dépôts ectopiques sont toxiques et
contribuent à la résistance à l’insuline. En parallèle, l’hypothèse portale propose que
l’activité élevée de libération des acides gras du tissu adipeux Vs dans le sang expose
le foie à de fortes quantités de lipides arrivant par la veine porte, ce qui conduit à
une résistance hépatique à l’insuline [3]. La capacité des dépôts adipeux à gérer les lipides en excès apparaît
donc déterminante. L’hypertrophie1, et
l’hyperplasie2 adipocytaire sont les deux
mécanismes qui permettent d’augmenter la capacité de stockage d’un dépôt adipeux.
L’augmentation de la quantité de triglycérides dans la vacuole lipidique des adipocytes
conduit à leur hypertrophie, dont la limite dépend des contraintes physiques liées à la
matrice extracellulaire qui les entoure [4]. L’augmentation du nombre d’adipocytes provient de la différenciation en
adipocytes de cellules progénitrices présentes dans les dépôts (adipogenèse). Nos études
ont montré que les cellules progénitrices du tissu adipeux Sc humain qui ont la capacité
de se différencier en adipocytes in vitro sont caractérisées par
l’expression du marqueur de surface CD34 et l’absence des marqueurs CD45 et CD31 [5]. Ces cellules ont aussi la
capacité d’exprimer des marqueurs des myofibroblastes, dont αSMA (smooth muscle
actin), lorsqu’elles sont stimulées par TGFβ (transforming growth
factor b) in vitro [6]. Plus récemment, nous avons mis en évidence, à l’aide des
marqueurs membranaires MSCA1 (mesenchymal stem cell antigen 1 ou
phosphatase alcaline tissulaire non-spécifique) et CD271 (ou NGFR/p75NTR, récepteur du
facteur de croissance neurale NGF), que la population native des cellules progénitrices
humaines est constituée d’au moins trois sous-populations [7], ce qui soulève plusieurs questions. Ces
sous-populations représentent-elles des cellules avec des potentialités de
différenciation différentes ou correspondent-elles à des états distincts au cours de la
différenciation adipocytaire ou myofibroblastique ? Les dépôts adipeux Sc et Vs
possèdent-ils des sous-populations équivalentes de cellules progénitrices ? Enfin, cette
hétérogénéité des progéniteurs est-elle liée à des localisations particulières
définissant des niches spécifiques ? Notre étude, réalisée par des approches de tri cellulaire, de cytométrie en flux,
d’imagerie en trois dimensions sur des territoires adipeux appariés Sc et Vs
(omentum3) d’individus de poids normal ou
obèses, a révélé l’hétérogénéité fonctionnelle de ces sous-populations de progéniteurs
associée à une organisation spatiale particulière dans les dépôts adipeux [8]. Ces caractéristiques pourraient
expliquer les disparités observées entre développement excessif des masses grasses, leur
localisation, et le risque cardio-métabolique. |
Des sous-populations de cellules progénitrices avec des potentialités et des
origines distinctes Des approches de tri cellulaire réalisé sur des cellules natives révèlent
qu’indépendamment du dépôt adipeux, la sous-population de cellules exprimant MSCA1
(MSCA1+) représente les progéniteurs les plus engagés dans la voie
adipogénique. En effet, les analyses de données de séquençage d’ARN (Ampliseq)
montrent que les progéniteurs MSCA1+ ont un enrichissement en transcrits
des gènes impliqués dans les voies du métabolisme adipocytaire, et une capacité
adipogénique élevée en comparaison avec les autres sous-types, tandis que les
cellules qui n’expriment pas MSCA1 et expriment CD271
(MSCA1-/CD271+) présentent un enrichissement en transcrits
des gènes impliqués dans les voies de signalisation activées par le TGFβ et dans la
fibrose. In vitro, en présence de TGFβ, les progéniteurs
MSCA1-/CD271+ présentent un fort potentiel
myofibroblastique, caractérisé par l’expression de marqueurs tels que αSMA,
l’inhibine βA (INHBA) et le facteur de transcription GLI1 (glioma-associated
oncogene homolog 1), et par la synthèse de collagènes. De plus, nos
résultats suggèrent que le récepteur CD271, marqueur des progéniteurs des
myofibroblastes, est également, avec son ligand NGF, un acteur de la différenciation
myofibroblastique induite par le TGFβ (Figure
1). Ainsi, les deux sous-populations de cellules identifiées
par l’expression, soit de MSCA1, soit de CD271, représentent respectivement des
progéniteurs adipogéniques et myofibroblastiques.
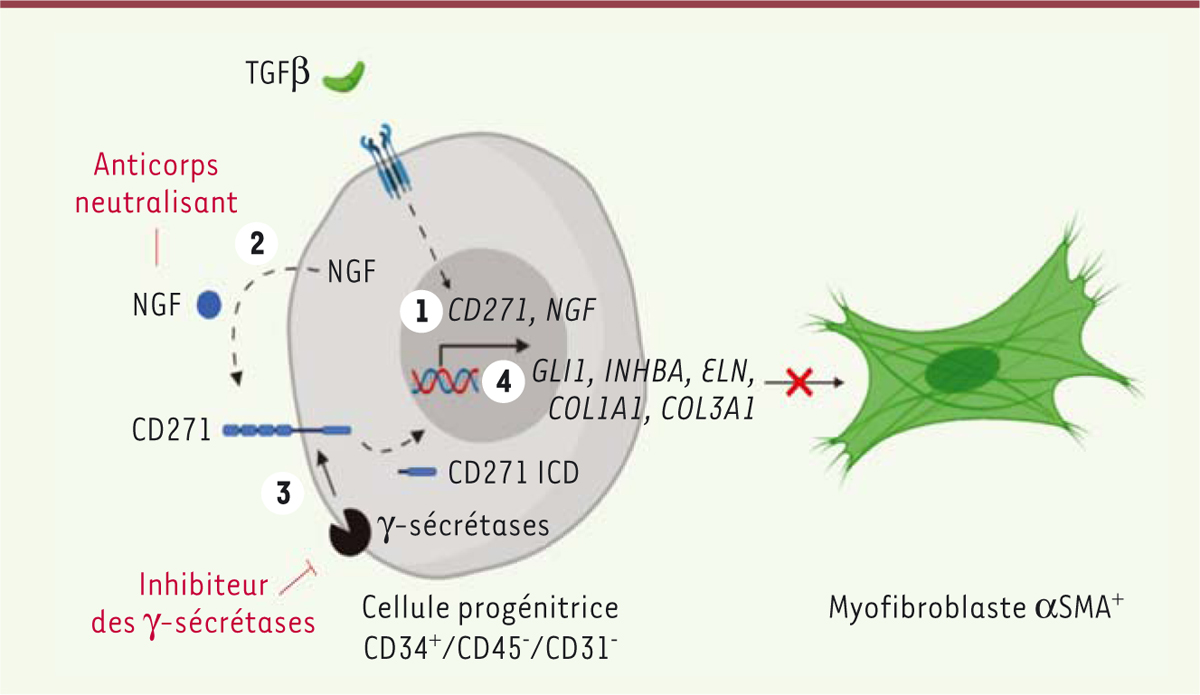
 | Figure 1. Rôle de l’axe CD271/NGF dans la différenciation myofibroblastique. En
réponse au TGFβ, les expressions de CD271 et de son ligand NGF
augmentent ① dans les cellules progénitrices
CD34+/CD45-/CD31-. NGF active son
récepteur CD271 ② et induit le clivage de ce dernier par les complexes
γ-sécrétases ③. La libération de la partie intracellulaire
(intracellular domain, ICD) de CD271 conduit à
l’expression de marqueurs myofibroblastiques ④ (GLI1,
INHBA, ELN,
COL1A1, COL3A1, αSMA). La
différenciation myofibroblastique peut être inhibée par un anticorps
anti-NGF neutralisant ainsi que par un inhibiteur des complexes
γ-sécrétases. |
L’analyse transcriptomique de la sous-population de cellules n’exprimant ni MSCA1 ni
CD271 (MSCA1-/CD271-) indique un enrichissement en transcrits
de gènes impliqués dans la pluripotence des cellules souches embryonnaires, tels que
CD24, décrit comme identifiant les progéniteurs adipocytaires
murins les plus immatures [9]. Il reste à confirmer si ces cellules sont les précurseurs des
sous-populations MSCA1-/CD271+ et MSCA1+. Bien que
ce sous-type cellulaire semble correspondre aux cellules les plus immatures dans les
deux dépôts, il a une origine développementale différente selon la localisation
adipeuse. En effet, les cellules MSCA1-/CD271- du tissu
adipeux Vs présentent un enrichissement en transcrits épithéliaux et mésothéliaux
(gènes WT1, LRRN4, MSLN, gènes de
kératines), qui n’est pas retrouvé dans celles du tissu adipeux Sc. |
Modulations différentes de ces sous-populations cellulaires avec l’obésité selon
le territoire Par des approches de cytométrie en flux réalisées sur des dépôts Sc et Vs appariés
chez des individus de poids normal et chez des individus obèses, nous avons pu
montrer que les sous-populations de cellules progénitrices ne sont pas réparties de
manière similaire selon la localisation tissulaire et selon le statut d’obésité. En
effet, le tissu adipeux Sc d’individus de poids normal contient majoritairement des
progéniteurs MSCA1-/CD271-, alors que leur tissu adipeux Vs
est principalement composé de progéniteurs MSCA1-/CD271+. Chez
les individus obèses, le nombre de progéniteurs MSCA1+ est augmenté d’un
facteur 10 (en moyenne) et celui des progéniteurs
MSCA1-/CD271+ d’un facteur 3 dans le tissu adipeux Sc,
alors que le nombre de progéniteurs de chacun des trois sous-types reste inchangé
dans le tissu adipeux Vs. Enfin, les progéniteurs isolés du tissu adipeux Sc de
patients obèses ont une potentialité adipogénique plus élevée et myofibroblastique
plus faible que ceux du tissu adipeux Vs. L’ensemble de ces résultats suggère que
les progéniteurs du tissu adipeux Sc s’orientent préférentiellement vers la voie
adipogénique avec le développement excessif de la masse grasse dans l’obésité, alors
que ceux du tissu adipeux Vs s’engagent préférentiellement vers la voie
myofibroblastique. Ainsi, les capacités d’hyperplasie adipocytaire du tissu adipeux
Vs seraient limitées et pourraient contribuer aux risques cardio-métaboliques
associés à l’obésité centrale. |
Caractérisation histologique des lobules des tissus adipeux Sc et Vs chez le
sujet obèse Le tissu adipeux humain est organisé en lobules, qui représentent les unités
structurales de ce tissu. Cependant la composition matricielle et l’organisation
cellulaire de cette unité structurale du lobule, ainsi que les différences
potentielles entre les dépôts n’ont pas fait l’objet d’études approfondies. Nos
travaux sur la macro-architecture de tissus adipeux Sc et Vs d’individus obèses ont
révélé que les lobules du tissu adipeux Sc sont de plus grande taille que ceux du
tissu adipeux Vs, et que leur structure matricielle est moins dense. En effet, nous
avons montré, par imagerie 3D, la présence de deux compartiments matriciels : le
stroma (tissu conjonctif situé à l’intérieur du lobule) et les septa
inter-lobulaires (membranes de tissu conjonctif entourant les lobules). Les septa
des lobules du tissu adipeux Vs sont plus denses et contiennent des fibres de
collagène et d’élastine de diamètre plus important et plus rectilignes que ceux des
lobules du tissu adipeux Sc. La faible densité des septa des lobules du tissu
adipeux Sc est associée à une répartition des diamètres adipocytaires en faveur des
petits (nouvellement formés) et des gros (hypertrophiés) adipocytes. |
Niches des cellules progénitrices du tissu adipeux Les deux compartiments matriciels, septa et stroma, délimitent ainsi deux niches de
cellules progénitrices. Nos analyses en cytométrie en flux après dissection des deux
compartiments des lobules montrent que les progéniteurs MSCA1+ ont une
localisation préférentielle dans le stroma, alors que les progéniteurs
MSCA1-/CD271- sont plus nombreux dans les septa. Les
progéniteurs myofibroblastiques MSCA1-/CD271+, quant à eux,
sont présents dans les deux compartiments. L’imagerie sur lobule entier confirme la
présence de cellules progénitrices dans les deux compartiments. De plus, elle
renforce les conclusions de l’analyse transcriptomique en montrant, pour les
progéniteurs des septa des lobules du tissu adipeux Vs, une forme et une
organisation distinctes qui rappellent celles des cellules épithéliales et
mésothéliales. Ainsi, le lobule du tissu adipeux Sc des individus obèses possède un fort potentiel
d’accroissement de taille, avec des septa peu denses et un stroma hypertrophique et
hyperplasique riche en progéniteurs MSCA1+. A l’inverse, le lobule du
tissu adipeux Vs des individus obèses présente un faible potentiel adipogénique et
un fort potentiel myofibroblastique porté par les cellules
MSCA1-/CD271+ et probablement impliqué dans le dépôt plus
important de matrice extracellulaire dans les septa, limitant ainsi la capacité
d’hypertrophie des adipocytes. Ces différences pourraient être dues à l’origine
épithéliale/mésothéliale des progéniteurs MSCA1-/CD271-
présents dans les septa des lobules du tissu adipeux Vs (Figure 2).
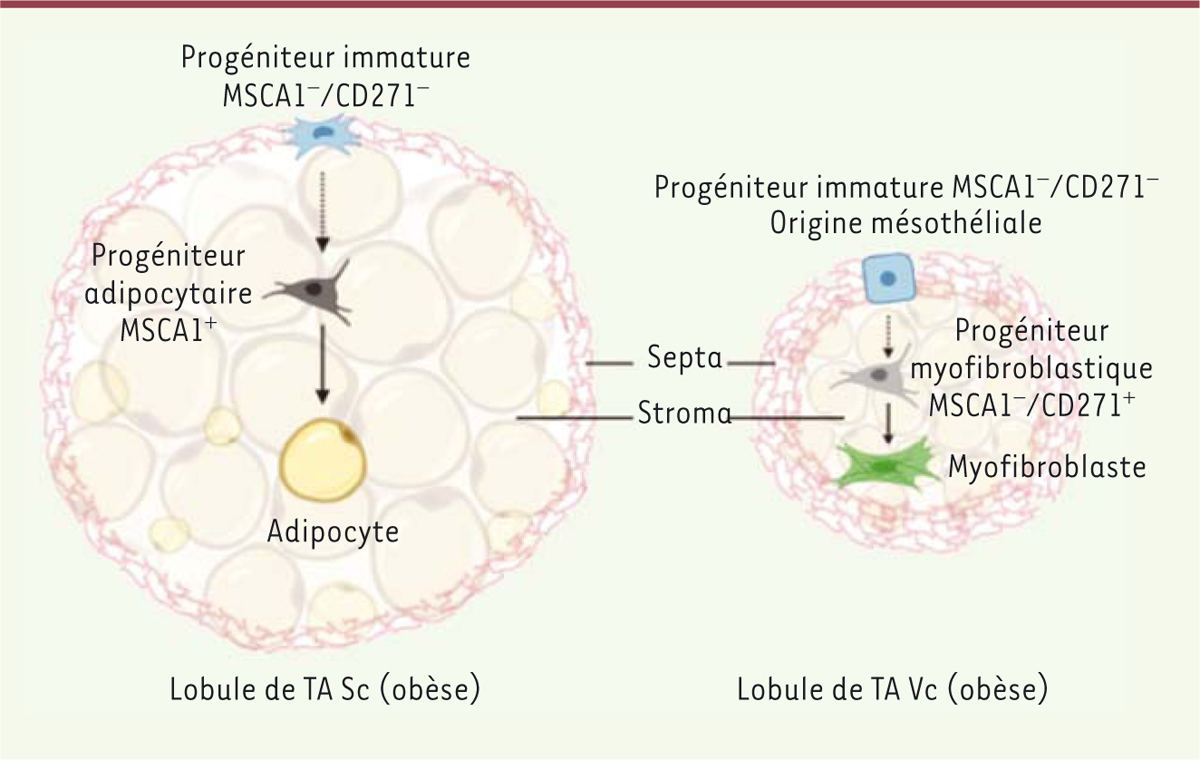
 | Figure 2. Hétérogénéité des lobules des tissus adipeux sous-cutané et viscéral chez
l’individu obèse. Les lobules de tissu adipeux sont recouverts d’une
membrane de tissu conjonctif, le septa, et contiennent les adipocytes
dans le stroma. Le tissu adipeux viscéral (Vs) présente des lobules plus
petits que le tissu adipeux sous-cutané (Sc), un septum plus dense qui
contient des progéniteurs immatures MSCA1-/CD271-
d’origine mésothéliale, et de nombreux progéniteurs myofibroblastiques
MSCA1-/CD271+. Le tissu adipeux Sc contient
dans son stroma davantage de petits et de gros adipocytes, ainsi que de
progéniteurs adipocytaires MSCA1+ que le tissu adipeux Vs,
et, dans ses septa, des progéniteurs immatures
MSCA1-/CD271-, dont l’origine reste à
déterminer. |
|
Notre étude a révélé l’importance de l’organisation particulière en lobules des
tissus adipeux humains. Récemment, des travaux menés chez la souris ont montré que
les cellules immatures du tissu adipeux Sc sont présentes dans une zone riche en
matrice extracellulaire qui s’apparente aux septa des lobules adipeux humains [10]. Ces cellules observées
dans une niche similaire et qui expriment des marqueurs communs aux progéniteurs
MSCA1-/CD271- humains que nous avons identifiés, sont à
l’origine de deux sous-populations de progéniteurs aux potentiels adipogéniques
distincts. Bien que la hiérarchie précise des sous-types de progéniteurs reste à
déterminer chez l’homme, il est tentant de penser que les progéniteurs
MSCA1-/CD271- humains pourraient constituer la population
cellulaire la plus immature. La caractérisation des signaux, liés à la niche, qui
les orientent vers les voies de différenciation adipogénique et myofibroblastique
devrait permettre d’identifier de nouvelles cibles thérapeutiques afin de diminuer
les risques cardio-métaboliques associés à l’obésité centrale. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Les travaux du groupe Cellules de la fraction stroma-vasculaire des tissus adipeux,
de l’UMR 1048, ont bénéficié du soutien financier de l’Inserm, de la société Clarins
et du programme Aviesan en partenariat avec la société Sanofi.
|
Footnotes |
1.
Tchernof
A,
Despres
JP. Pathophysiology
of human visceral obesity: an update . Physiol
Rev.
2013; ; 93 :
:359.–404. 2.
Gray
SL,
Vidal-Puig
AJ. Adipose tissue
expandability in the maintenance of metabolic homeostasis .
Nutr Rev.
2007; ; 65 :
:S7.–12. 3.
Bjorntorp
P.. Portal adipose
tissue as a generator of risk factors for cardiovascular disease and
diabetes . Arteriosclerosis.
1990; ; 10 :
:493.–496. 4.
Reggio
S,
Rouault
C,
Poitou
C, et al.
Increased basement membrane components in adipose tissue during
obesity: links with TGFbeta and metabolic phenotypes .
J Clin Endocrinol Metab.
2016; ; 101 :
:2578.–2587. 5.
Sengenes
C,
Lolmede
K,
Zakaroff-Girard
A, et al.
Preadipocytes in the human subcutaneous adipose tissue display
distinct features from the adult mesenchymal and hematopoietic stem
cells . J Cell Physiol.
2005; ; 205 :
:114.–122. 6.
Bourlier
V,
Sengenes
C,
Zakaroff-Girard
A, et al.
TGFb family members are key mediators in the induction of
myofibroblast phenotype of human adipose tissue progenitor cells by
macrophages . PLoS One.
2012; ; 7 : :e31274.. 7.
Esteve
D,
Boulet
N,
Volat
F, et al.
Human white and brite adipogenesis is supported by MSCA1 and is
impaired by immune cells . Stem Cells.
2015; ; 33 :
:1277.–1291. 8.
Esteve
D,
Boulet
N,
Belles
C, et al.
Lobular architecture of human adipose tissue defines the niche
and fate of progenitor cells . Nat Commun.
2019; ; 10 : :2549.. 9.
Berry
R,
Rodeheffer
MS. Characterization
of the adipocyte cellular lineage in vivo . Nat Cell
Biol.
2013; ; 15 :
:302.–308. 10.
Merrick
D,
Sakers
A,
Irgebay
Z, et al.
Identification of a mesenchymal progenitor cell hierarchy in
adipose tissue . Science.
2019; ; 364 : :6438.. |