Antioxydants et cancer du poumon
Une supplémentation en molécules antioxydantes, telles que la N-acétylcystéine
(NAC), est souvent prescrite dans les maladies respiratoires chroniques comme la
bronchopneumopathie chronique obstructive (BPCO), du fait de leurs propriétés
mucolytiques, antioxydantes, et anti-inflammatoires [
1]. Le bénéfice clinique de ces traitements
reste cependant à démontrer. Un bénéfice attendu des antioxydants est leur
capacité à diminuer le risque de cancer, en diminuant les dommages à l’ADN et
les mutations induites par les espèces réactives de l’oxygène [
1]. Cependant, plusieurs études cliniques
montrent à l’inverse que les antioxydants augmentent le risque de certains
cancers, dont le cancer du poumon [
3,
4]. Une étude récente suggère en outre que les antioxydants pourraient
être nocifs dans la progression du cancer du poumon. Chez des souris porteuses
d’une mutation du gène
Ras et développant un cancer du poumon,
le traitement par NAC ou la vitamine E accélère la croissance tumorale, bien
qu’il réduise, comme attendu, le stress oxydant et les dommages à l’ADN. L’un
des mécanismes évoqués serait une diminution de l’activité de la protéine p53
associée à la suppression du stress oxydant [
5].
Une limitation de ces études tient au modèle murin de cancer pulmonaire induit
par la mutation du gène Ras, qui permet d’étudier l’impact des
antioxydants sur la progression tumorale, mais pas sur l’initiation du cancer.
Ainsi, l’effet potentiel des antioxydants, en particulier NAC, sur l’induction
tumorale et l’émergence du cancer pulmonaire restait inconnu. Cette question est
pourtant d’un grand intérêt clinique du fait de la prescription courante de NAC
chez les patients bronchitiques et fumeurs atteints ou non de BPCO, et à risque
de développer un cancer du poumon.
Stress oxydant et sénescence cellulaire : application au poumon
Le stress oxydant, tel que celui provoqué par la fumée de cigarette, est un
inducteur de sénescence cellulaire [
6,
2]. Or celle-ci est habituellement considérée comme une protection
contre le cancer [
7]. En
effet, l’activation des protéines onco-suppressives p53, p21, ou p16 est une
étape clé de l’engagement des cellules dans le processus de sénescence. Ainsi,
la sénescence en réponse à un stress ponctuel, tel qu’un stress oncogénique,
protège de l’initiation tumorale en stoppant la prolifération des cellules et en
favorisant leur élimination par le système immunitaire. Néanmoins la sénescence
chronique, telle que celle survenant au cours du vieillissement ou celle induite
par la fumée de cigarette, pourrait avoir des effets pro-tumoraux, notamment
via le phénotype sécrétoire des cellules sénescentes
(
senescence-associated secretory phenotype, SASP). Surtout,
on sait qu’un échappement à la sénescence, tel que celui induit par
l’inactivation des protéines onco-suppressives p53, p21 ou p16, favorise
l’émergence de cancers chez la souris, et est associé à la plupart des cancers
chez l’homme [
7]. Pour la plupart des
cellules, l’inactivation de p53, en contournant le processus de sénescence,
conduit à la mort cellulaire du fait du raccourcissement excessif des télomères
et de l’instabilité génomique qui en résulte [
7]. Cependant, certaines de ces cellules peuvent survivre et croître
de façon monoclonale en cas de réexpression de la télomérase (85 % des cas) ou
de mise en place de mécanismes alternatifs (15 % des cas) protégeant les
extrémités des chromosomes. Ces cellules, échappant ainsi à la sénescence et
ayant franchi une étape d’instabilité génétique avec de possibles mutations de
l’ADN sur des gènes clés, sont particulièrement susceptibles de se transformer
en cellules tumorales. Ce mécanisme s’applique au cancer du poumon puisque, dans
la grande majorité des cas, l’émergence de ce cancer est associée à une ou
plusieurs mutations spécifiques du gène codant p53, avec perte de la fonction de
cette protéine.
Stress oxydant et facteur de transcription JunD
Le facteur de transcription JunD joue un rôle clé dans la réponse au stress
oxydant en contrôlant l’expression des gènes impliqués dans la production
d’enzymes antioxydantes. Des cellules privées de JunD deviennent rapidement
sénescentes
in vitro, conjointement à l’activation de p53 et à
la production d’espèces réactives de l’oxygène [
8]. Par ailleurs, une diminution de
l’expression de JunD a été observée dans les cancers du poumon, pour la plupart
associés à une mutation inactivatrice de p53, suggérant un rôle de JunD dans ces
cancers (base de données Oncomine). Il a également été montré que la
surexpression de JunD inhibe en partie la transformation cellulaire induite par
Ras. Nous avons montré que les deux facteurs de transcription contrôlant
l’activité antioxydante, JunD et NRF2 (
nuclear factor
erythroid-2-related factor 2), avaient des niveaux d’expression
très faibles dans les poumons des patients atteints de BPCO en comparaison avec
les poumons de sujets témoins. Ces observations nous ont donc incités à étudier
des souris déficientes pour le gène
JunD ainsi que des souris
témoins âgées afin d’évaluer le lien de causalité entre stress oxydant,
sénescence cellulaire, et altérations pulmonaires [
9].
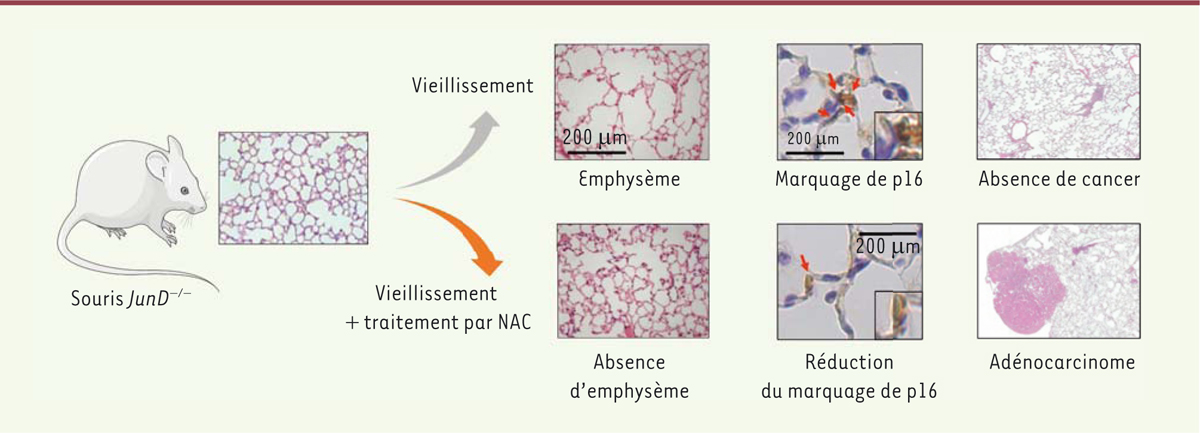
Le traitement continu de souris JunD-/- et de souris témoins,
jeunes et âgées, par NAC protège de la sénescence et de l’emphysème pulmonaire,
mais induit l’émergence d’un cancer pulmonaire
Pour évaluer plus spécifiquement le rôle du stress oxydant, les souris
JunD-/- ont été comparées à des souris
témoins
JunD+/+ et traitées de façon continue par
NAC depuis la naissance, puis étudiées à l’âge de 4 mois et entre 12 et 24 mois
[
9]. Notre hypothèse était que les
souris
JunD-/-, exposées naturellement au stress
oxydant, seraient plus susceptibles de développer, au cours du vieillissement,
des altérations pulmonaires telles que celles observées dans la bronchite
chronique et la BPCO. Les résultats ont validé cette hypothèse en montrant la
présence, chez les souris
JunD-/-, d’un emphysème
pulmonaire associé à de nombreuses cellules épithéliales alvéolaires et
vasculaires sénescentes. Comme attendu, le traitement chronique par NAC réduit
le nombre de cellules sénescentes ainsi que la sévérité de l’emphysème
(Figure 1).
Cependant, la moitié des souris
JunD-/- traitées par
NAC présentent un adénocarcinome pulmonaire après l’âge de 12 mois, tandis
qu’aucune des 14 souris
JunD-/- traitées par le
solvant n’est atteinte de cancer, même à l’âge de 24 mois. Par ailleurs, 13 %
des souris témoins (
JunD+/+) traitées par NAC
présentent également un adénocarcinome pulmonaire à l’âge de 18 mois [
9]
(Figure 1).
 | Figure 1. L’administration continue de N-acétylcystéine (NAC) à des souris
JunD-/- atténue leur emphysème pulmonaire mais
augmente la fréquence du cancer du poumon. |
Un traitement de long cours par NAC chez des souris mutantes privées du facteur
de transcription JunD a donc un effet protecteur sur la constitution de
l’emphysème pulmonaire, mais il favorise l’émergence d’un cancer du poumon chez
ces souris, ainsi que chez des souris témoins qui synthétisent normalement JunD.
Nos résultats indiquant que NAC contribue à l’induction du cancer du poumon
constituent donc un solide argument en faveur d’un rôle carcinogène des
antioxydants en situation de stress oxydant induit par le vieillissement et
majoré par l’invalidation du gène JunD.
Mécanismes envisagés, l’échappement à la sénescence induite par les
antioxydants
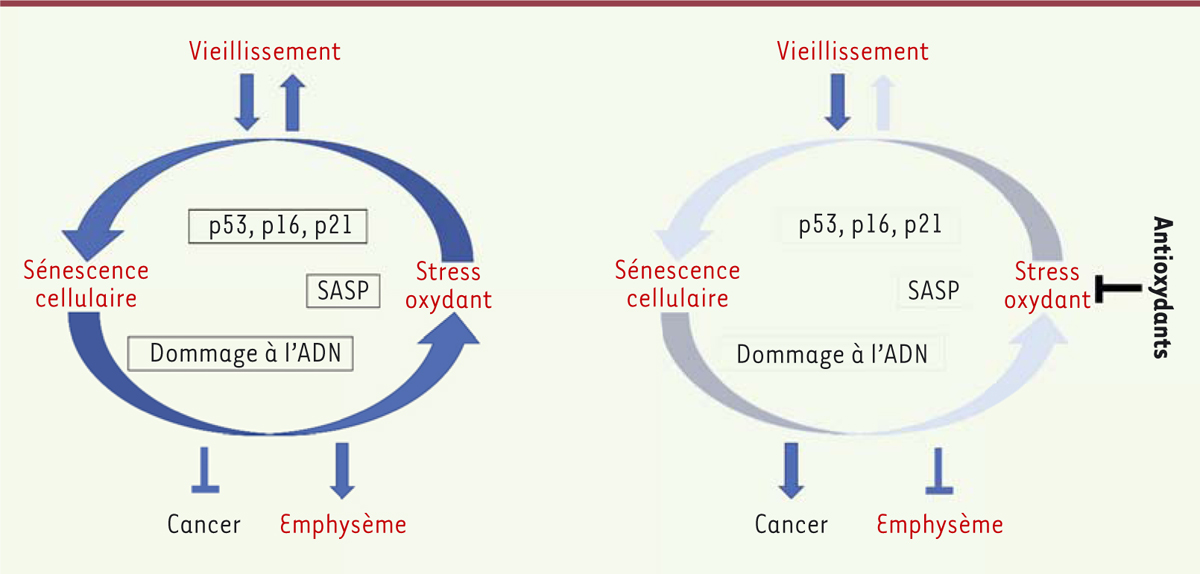
Notre hypothèse est que le vieillissement, combiné à l’absence de JunD, conduit à
une accentuation des phénomènes de sénescence cellulaire, aboutissant à un état
d’équilibre entre, d’une part, ce qui protège du cancer (activation de p53, p16,
arrêt du cycle cellulaire, etc.) et, d’autre part, ce qui favorise le cancer
(éléments du SASP, inflammation, instabilité du génome). Un traitement par NAC
pourrait rompre cet équilibre en réduisant l’expression de p53 et en favorisant
l’échappement à la sénescence cellulaire
(Figure 2).
 | Figure 2. Mécanisme proposé pour expliquer l’effet néfaste d’un traitement par
antioxydants sur le risque de survenue d’un cancer du poumon. |
Pour tester cette hypothèse, nous avons utilisé des fibroblastes embryonnaires de
souris, dans lesquels nous avons inhibé la synthèse de JunD au moyen de petits
ARN inhibiteurs spécifiques (siRNA). En effet, des résultats préliminaires
obtenus en cultivant des cellules vasculaires pulmonaires de souris
JunD-/- ont montré que celles-ci deviennent
rapidement sénescentes in vitro, même lorsqu’elles sont
traitées par NAC, ce qui empêchait de les utiliser pour cette étude [1]. Nous avons montré que la déplétion de
JunD dans les fibroblastes embryonnaires de souris induit un arrêt de croissance
et l’entrée en sénescence de ces cellules, et que cet effet est largement inhibé
par NAC. Le traitement par NAC (ou d’autres antioxydants tels que la vitamine E)
protège donc contre la sénescence cellulaire induite par la suppression de JunD
et augmente la prolifération des cellules. Néanmoins, ce modèle expérimental ne
nous a pas permis de mettre en évidence une transformation des cellules, ce qui
indique que d’autres altérations nécessaires à la transformation sont survenues
chez les souris JunD-/- âgées traitées par NAC qui
développent un cancer du poumon.
En résumé, nous montrons qu’un traitement antioxydant par NAC favorise non
seulement la progression, mais également la formation du cancer du poumon, et
que cet effet potentiel chez des souris âgées est amplifié en cas de blocage de
la synthèse de JunD, un facteur de transcription régulant la synthèse de
protéines à activité antioxydante, dont la production est fortement diminuée
dans les poumons d’individus atteints d’une bronchopathie chronique [9]. Une question essentielle concerne
l’implication possible de ces observations dans le cas d’un stress oxydant
chronique, tel que celui induit par la fumée de cigarette. Cette question est
d’un grand intérêt clinique compte tenu de l’utilité discutée d’un traitement
par NAC chez des sujets fumeurs, bronchitiques chroniques, ou porteurs d’une
BPCO, à risque de développer un cancer pulmonaire. En effet, nous avons montré
le rôle majeur joué par la sénescence cellulaire dans la pathogenèse de maladies
pulmonaires telles que la BPCO [10]. Les poumons de ces patients sont le siège d’une
accumulation de cellules sénescentes, génératrice d’emphysème, de fibrose, et
d’inflammation pulmonaire. Bloquer la sénescence cellulaire représente donc une
réelle option thérapeutique, qui fait actuellement l’objet d’une intense
activité de recherche. L’utilisation des antioxydants est souvent citée comme
l’une des approches thérapeutiques possibles. Nos résultats, à l’inverse,
suggèrent que le traitement par les antioxydants peut être nocif, et serait donc
à proscrire, dans ces maladies.