Les cellules perçoivent leur microenvironnement grâce à des signaux solubles, des récepteurs, mais aussi des facteurs physiques et mécaniques, tels que la rigidité de la matrice extracellulaire, l’adhérence confinée, ou encore les forces de cisaillement de la lymphe et du sang sur les cellules endothéliales des vaisseaux. Ainsi, la plupart des cellules sont en permanence soumises à des stimulus mécaniques, qui sont traduits en signaux biochimiques par un processus appelé mécanotransduction. La mécanotransduction contrôle de nombreux aspects de la vie cellulaire, notamment la croissance, la forme ou la différenciation des cellules [1]. Des réponses cellulaires anormales aux contraintes mécaniques externes et internes sont associées à certaines maladies (e.g., maladies cardiaques, myopathies, cancer) [2]. Si les dix dernières années ont vu s’accroître considérablement le nombre d’études sur les forces mécaniques en biologie, les mécanismes qui permettent d’intégrer la détection de ces forces (mécanoréception) à la mécanotransduction restent mal compris.
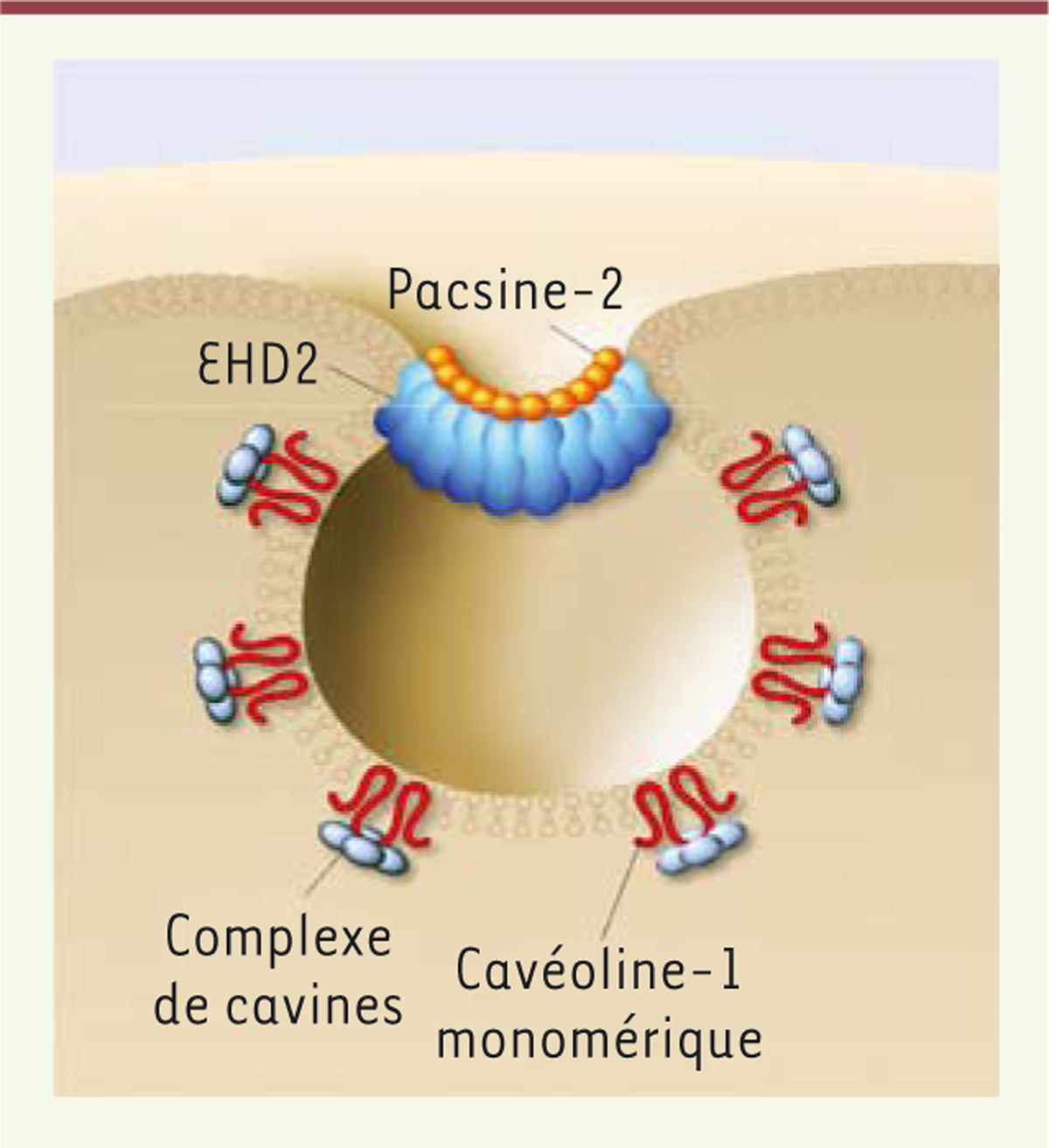
Les cavéoles sont des petites (60-80 nm) invaginations caractéristiques de la membrane plasmique en forme de bulbe, qui ont été découvertes en microscopie électronique il y a plus de soixante ans par Georges Palade [3] (Figure 1). Elles sont produites par l’association d’oligomères d’une protéine transmembranaire, la cavéoline-1 (Cav1, leur principal composant structural), et sont stabilisées par l’assemblage de trois cavines cytoplasmiques (cavine-1, -2 et -3) formant un manteau polyédrique autour de leur bulbe [4, 5]. Les protéines pacsin2 (protein kinase C and casein kinase substrate in neurons 2)/syndapine-II et EHD2 (Eps-15 homology domain-containing protein 2) sont également associées aux cavéoles. Pacsin2, qui contient un domaine BAR (Bin, Amphiphysin, Rvs) permettant la liaison aux courbures membranaires, est colocalisée partiellement avec les cavéoles et participe à leur morphogenèse. Quant à EHD2, une ATPase capable de se lier à la membrane plasmique et d’induire la tubulation et la scission membranaires, elle est localisée au niveau du cou de l’invagination cavéolaire et assure la stabilité des cavéoles dans la membrane plasmique (Figure 1).
| Figure 1. La cavéole. Les oligomères de cavéoline-1, en s’associant à la membrane
plasmique, la déforment en une petite invagination cavéolaire de 60-80 nm.
Le complexe cytosolique de cavines interagit avec la cavéoline-1 membranaire
pour stabiliser la forme définitive des cavéoles. Au niveau du cou de la
structure, EHD2 et pacsine-2 participent également à la morphogenèse de la
cavéole. |
En 2011, nous avons découvert une fonction nouvelle des cavéoles dans la mécanoréception et la mécanoprotection des cellules. Sous l’effet d’une augmentation de la tension de la membrane plasmique produite par le gonflement ou l’étirement mécanique des cellules, les cavéoles s’aplatissent immédiatement pour fournir une surface membranaire supplémentaire et empêcher ainsi la rupture [6]. Plusieurs processus induits par le désassemblage mécanique des cavéoles restent cependant à comprendre. Nous avons cherché 1) à déterminer si le désassemblage mécanique des cavéoles est associé à une fonction de mécanotransduction, 2) à identifier les protéines impliquées dans cette mécanotransduction, et 3) à définir la fonction des protéines identifiées dans la mécanoréception par les cavéoles. Deux protéines cavéolaires, cavine-1 et EHD2, contiennent un motif de localisation nucléaire (nuclear localization signal, NLS), ce qui leur confère la possibilité de réaliser la navette entre le noyau cellulaire et le cytoplasme [7, 8]. De plus, l’impact du stress mécanique sur la translocation nucléaire de ces protéines, et son rôle potentiel dans la mécanotransduction par les cavéoles, ont été étudiés.
Par différentes techniques d’imagerie et de biochimie, nous avons d’abord confirmé qu’en l’absence de stress mécanique, EHD2 et cavine-1 sont localisées à la membrane plasmique. En revanche, en présence d’un stress mécanique (choc osmotique, étirement cellulaire), une relocalisation d’EHD2 dans le noyau est observée, alors que la localisation de la cavine-1 n’est pas modifiée. Nous avons également analysé la dynamique de la translocation nucléaire d’EHD2 dans des cellules vivantes en 3D en utilisant la microscopie « à feuilles de lumière en réseau ». Il est alors apparu qu’au cours du désassemblage mécanique des cavéoles, la quantité d’EHD2 nucléaire augmente rapidement, et qu’inversement, la suppression du stress mécanique s’accompagne d’une diminution de la quantité d’EHD2 dans le noyau ; le réservoir de cavéoles à la membrane plasmique est alors rapidement reconstitué. Ces observations indiquaient que désassemblage et réassemblage des cavéoles de la membrane plasmique sont étroitement associés à la translocation nucléaire d’EHD2 [9].
Nous avons alors recherché si des modifications post-traductionnelles de EHD2 étaient associées à sa libération mécanique des cavéoles. En effet, EHD2 peut être sumoylée par SUMO-1 (modification semblable à l’ubiquitination) [8], la sumoylation des protéines étant associée à leur transport nucléo-cytoplasmique et à la réponse des cellules à différents stress, y compris à un stress osmotique chez les plantes [10]. L’interaction entre EHD2 et SUMO a été explorée par la technique PLA (proximity ligation assay), qui permet de détecter par immunofluorescence les interactions protéine-protéine, ainsi que par des expériences de sumoylation de EHD2. Nous avons alors montré qu’un stress mécanique induit la sumoylation de EHD2 et, grâce à l’utilisation de mutants de sumoylation, que cette sumoylation est essentielle pour sa translocation dans le noyau [9].
Pour déterminer le rôle de la translocation nucléaire de EHD2, les transcriptomes de cellules privées d’EHD2 (en utilisant un petit ARN inhibiteur spécifique) et de cellules témoins ont été ensuite analysés, en présence ou en l’absence d’un stress mécanique. Nous avons ainsi montré que l’enrichissement de plusieurs ensembles de transcrits codant des protéines impliquées dans différentes voies de signalisation, en présence d’un stress mécanique, était conditionné par la présence d’EHD2.
Nous avons également mesuré les quantités d’ARNm codant des protéines cavéolaires en présence et en l’absence d’une contrainte mécanique appliquée aux cellules, et montré que le stress mécanique provoque une diminution significative du nombre de ces ARNm. Cette répression adaptative de la transcription dépend de la présence d’EHD2 et de l’activité de ses deux partenaires KLF7 (facteur 7 de type Krüppel) et MOKA (modulateur de l’activité de KLF7) [8, 9].
La microscopie de fluorescence « par réflexion totale interne » (ou microscopie à onde évanescente) nous a ensuite permis d’analyser le rôle d’EHD2 dans la dynamique des cavéoles, et nous avons constaté que si la perte d’EHD2 ne perturbe pas le désassemblage des cavéoles provoqué par un stress mécanique, elle entraîne cependant un défaut du réassemblage des cavéoles lors du retour aux conditions basales. En mesurant la tension membranaire par la technique de « traction par attache », nous avons montré que la présence d’EHD2 est nécessaire au maintien, dans la membrane plasmique, d’un réservoir fonctionnel de cavéoles qui amortit les variations de tension membranaire lors de contraintes mécaniques [9].
Un faible niveau d’expression d’EHD2 a été rapporté dans plusieurs tumeurs cancéreuses solides [11, 12]. L’étape suivante était donc de déterminer si cette faible expression d’EHD2 était également associée à des défauts de stabilisation des cavéoles et de translocation nucléaire de cette protéine. Nous avons analysé la dynamique des cavéoles dans deux lignées cellulaires de cancer du sein, Hs578T et MDA-MB-436, sélectionnées pour leur forte et très faible production d’EHD2, respectivement. En exerçant une contrainte mécanique sur la membrane plasmique de ces cellules, nous avons observé une diminution rapide du nombre de cavéoles à la surface des cellules Hs578T (forte expression d’EHD2), mais pas des cellules MDA-MB-436 (faible expression de EHD2). Nous avons également montré que ce défaut de mécanoréception par les cavéoles dans les cellules MDA-MB-436 était associé à des défauts de régulation transcriptionnelle de gènes codant des protéines constituantes des cavéoles. L’analyse de ces lignées cellulaires par microscopie électronique « à réplique de métal » a montré une multitude de cavéoles invaginées, en accord avec l’expression forte de Cav1 et EHD2, dans les cellules Hs578T, tandis que les cellules MDA-MB-436, quasi dépourvues d’EHD2, possédaient très peu de cavéoles, voire aucune. L’expression forcée d’EHD2 dans ces cellules est d’ailleurs suffisante pour reconstituer un réservoir de cavéoles dans la membrane plasmique. Nos résultats indiquent que l’absence de cavéoles dans les cellules cancéreuses dépourvues d’EHD2 pourrait être une conséquence de l’impossibilité de stabiliser leur réservoir de cavéoles dans un environnement mécanique changeant au sein de la masse tumorale [9].
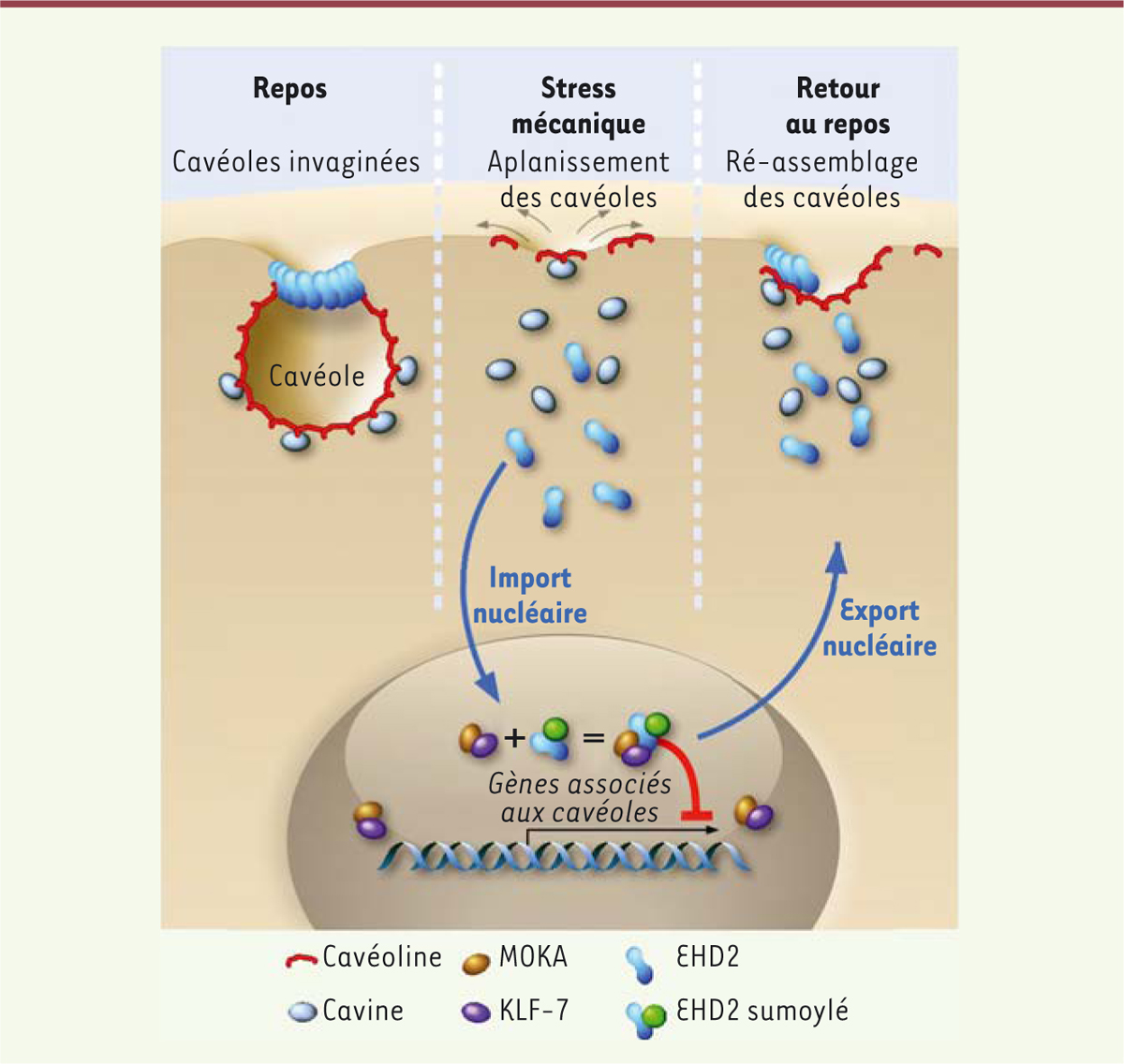
En conclusion, nos résultats montrent, pour la première fois, l’existence d’une mécanotransduction dépendante des cavéoles, et définissent EHD2 comme un acteur central de ce processus en reliant le désassemblage du réservoir de cavéoles à la régulation de la transcription des gènes en présence d’une contrainte mécanique exercée sur la membrane plasmique (Figure 2) [9].
| Figure 2. EHD2 est un acteur central de la mécanotransduction par les cavéoles. Sous
l’effet d’une contrainte mécanique, les cavéoles s’aplanissent afin
d’assurer l’homéostasie de la tension membranaire de la cellule. Cela
entraîne la libération de la cavéoline, des cavines, et d’EHD2. EHD2 est
alors SUMOylée et transférée au noyau, où il contrôle la transcription de
gènes par interaction avec le complexe transcriptionnel MOKA et KLF-7. Lors
du relâchement des contraintes, EHD2 quitte le noyau et retourne à la
membrane plasmique pour stabiliser de nouveau le réservoir de cavéoles. |