| |
| Med Sci (Paris). 36(3): 212–215. doi: 10.1051/medsci/2020034.Cocaïne en « dents de scie
» Modéliser une consommation pathologique de drogue chez le
rat Florence Allain1* and Anne-Noël Samaha1** 1Département de pharmacologie et de physiologie, Groupe de
recherche sur le système nerveux central, Faculté de médecine, Université de
Montréal, Montréal,
QC, H3C
3J7, Canada MeSH keywords: Administration par voie orale, Animaux, Comportement toxicomaniaque, Comportement animal, Cocaïne, Troubles liés à la cocaïne, Infographie, Modèles animaux de maladie humaine, Humains, Rats, anatomopathologie, psychologie, administration et posologie |
Consommer une drogue ne signifie pas nécessairement être toxicomane et même avec un usage
répété, la consommation de drogue peut rester récréative et contrôlée. À l’inverse,
quand un individu perd le contrôle de sa consommation, cette dernière est qualifiée de
pathologique, et un trouble d’utilisation de substance peut alors être diagnostiqué
(nous parlerons de toxicomanie ou d’addiction).
Dissocier une consommation récréative de drogue d’une consommation pathologique est
primordial pour comprendre comment la toxicomanie se développe, et ainsi mieux la
traiter. Pour faire cette dissociation, les signes symptomatiques d’une consommation
compulsive et pathologique de drogue sont répertoriés dans le manuel diagnostique et
statistique des troubles mentaux (DSM-5) de l’Association américaine psychiatrique
[1]. Ces signes incluent une
motivation excessive à obtenir et consommer la drogue, consommer en dépit des
conséquences négatives, une vulnérabilité à la rechute après abstinence, et autres. Pour
modéliser la toxicomanie en laboratoire, ces mêmes signes sont recherchés chez des
animaux à qui l’on permet de consommer volontairement de la drogue [2]. En dépit de plusieurs années de recherche, l’addiction à la cocaïne est, encore
aujourd’hui, un trouble pour lequel il n’existe aucun traitement pharmacologique
approuvé. Ceci peut être dû au fait que les modèles animaux sur lesquels les cibles
thérapeutiques sont identifiées et les traitements testés ne représentent pas toujours
une consommation pathologique de cocaïne cliniquement pertinente. Afin d’augmenter la
valeur translationnelle des modèles animaux à la condition clinique, il est important
d’observer chez eux les comportements symptomatiques d’une consommation pathologique de
cocaïne telle que mesurée chez l’être humain. Dans cette Nouvelle, nous décrivons
certains modèles animaux utilisés pour étudier l’addiction à la cocaïne, et tout
spécifiquement des modèles qui s’inspirent des schémas de consommation de cette drogue
qui sont observées chez l’être humain. |
Consommation pathologique de cocaïne chez l’être humain Plusieurs facteurs peuvent accélérer ou retarder le développement d’une addiction
à la cocaïne. Les facteurs les plus étudiés incluent des variables individuelles
(génétique, biologie) et environnementales. Cependant, au-delà de ces facteurs,
la voie d’administration de cette drogue peut aussi être décisive. La cocaïne
peut en effet être consommée de diverses façons. Elle peut être mâchée,
insufflée, fumée ou encore injectée. Selon la voie d’administration privilégiée
par les consommateurs, la pharmacocinétique de la drogue varie. Elle réfère aux
taux de cocaïne qui circulent dans le sang et dans les organes cibles (dont le
cerveau) en fonction du temps. Par exemple, selon la voie utilisée, le temps
d’arrivée de la drogue au cerveau varie. L’inhalation et l’injection par voie
intraveineuse sont les deux voies de consommation les plus rapides : elles
transmettent la cocaïne au cerveau en quelques secondes. L’effet de la cocaïne
est donc très rapide, intense et bref avec ces méthodes d’administration. La
consommation de cocaïne par ces voies dites rapides est
associée à un plus grand risque d’addiction, en comparaison avec l’utilisation
des voies orale ou intranasale, dites plus lentes [ 3]. Avec le développement
de la toxicomanie, il a été remarqué que les consommateurs passaient d’une voie
plus lente d’administration de la cocaïne à une voie plus rapide [ 3]. Au-delà de la vitesse d’arrivée au
cerveau, la voie et le schéma de consommation déterminent aussi la fréquence à
laquelle les concentrations de drogue fluctuent dans l’organisme. Ainsi, avec
les années d’expérience de consommation, il semblerait qu’un schéma typique de
consommation se dessine, avec des périodes de consommations intenses espacées de
pauses [ 4]. Cette
consommation intermittente de cocaïne favoriserait la formation de pics rapides
de drogue au cerveau, en « dents de scie », caractéristiques
d’une consommation expérimentée et pathologique de drogue [ 4]. Or, jusqu’à tout récemment, les modèles animaux de
consommation de cocaïne ne reflétaient pas cette intermittence, favorisant
plutôt une consommation continue qui produit des taux élevés et soutenus de la
drogue dans le cerveau. Nous verrons que chez le rat, ces différents profils
cinétiques (intermittent versus continu) déterminent le risque
de développer des comportements de consommation caractéristiques de la
toxicomanie. De l’humain au rat et vice versa Consommer une drogue est un acte volontaire. Cela peut se modéliser, chez le rat,
par l’auto-administration de drogue par voie intraveineuse [ 5]. Dans ce type d’expériences, des
rats sont implantés avec un cathéter dans la veine jugulaire [ 6] et, après récupération de la
chirurgie, ils sont placés dans des cages opérantes où leur cathéter est relié à
une seringue remplie de drogue. Lorsque le rat émet une réponse opérante (comme
appuyer sur un levier), il peut recevoir une injection de drogue par voie
intraveineuse. Dans ce contexte, les rats mais aussi d’autres animaux de
laboratoire consomment volontairement presque toutes les drogues consommées par
l’être humain, dont la cocaïne. Pour modéliser les voies rapides et plus lentes
d’administration de cocaïne, il est possible d’ajuster la vitesse d’injection de
drogue par voie intraveineuse durant la session d’auto-administration. Pour
modéliser les voies rapides (intraveineuse et fumée), les rats
s’auto-administrent des injections infusées en seulement 5 secondes (rats 5s).
Pour les voies plus lentes (orale et intranasale), les rats s’auto-administrent
des injections infusées en 90 secondes ou plus (rats 90s). La dose de cocaïne
pour une injection infusée aux deux vitesses est la même, seule la durée de
l’injection est modifiée. Pour modéliser la consommation intermittente de cocaïne en «
dents de scie » qui est observée chez les cocaïnomanes les
plus expérimentés [4], le levier est
rétractable. Il est présenté aux rats pendant de courtes périodes (5 à 6
minutes) séparées par des pauses plus longues (25 à 26 minutes). Grâce à cette
stratégie, les rats consomment la drogue par intermittence, ce qui mène à la
formation de pics de drogue dans le cerveau (Figure 1) [7–11]. La manipulation de ces deux variables
pharmacocinétiques de la cocaïne (vitesse d’administration de la cocaïne et
fréquence d’administration - pics de drogue dans le cerveau) est critique pour
modéliser chez le rat une consommation pathologique de drogue cliniquement
pertinente [12], dans
le but d’augmenter la valeur translationnelle des modèles animaux à la condition
clinique.
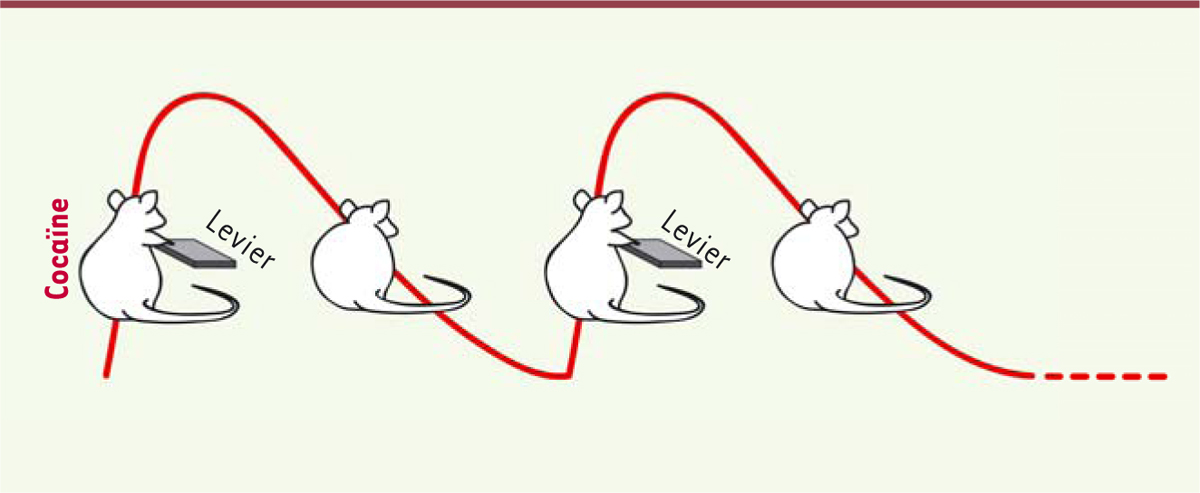
 | Figure 1.Pour modéliser des pics de cocaïne au cerveau pendant une session
d’auto-administration de drogue chez le rat, l’accès au levier est
intermittent. La session peut durer 5 à 6 heures par jour. Pendant
de courtes périodes de 5-6 minutes, le levier est présent, et les
rats peuvent appuyer dessus autant de fois qu’ils le souhaitent pour
s’auto-administrer de la drogue. Les niveaux de cocaïne dans le
cerveau augmentent, ce qui correspond à la phase ascendante du pic
de drogue (courbe rouge). Le levier est ensuite rétracté pendant une
plus longue période de 25-26 minutes – temps suffisant pour
permettre la diminution des niveaux de drogue dans le cerveau [ 10]. Il
s’agit alors de la phase descendante du pic de cocaïne dans le
cerveau. Cette succession, présence/absence du levier est répétée
plusieurs fois pendant une session d’auto-administration de cocaïne
pour promouvoir plusieurs pics de cocaïne dans le cerveau. |
Des pics rapides de cocaïne dans le cerveau chez le rat augmentent le
potentiel addictif de la drogue Selon un schéma d’auto-administration intermittente de cocaïne, bien que les rats
5s et 90s consomment la même quantité de drogue dans le temps, les rats 5s
développent une motivation excessive pour la drogue et sont également plus
vulnérables à la rechute après abstinence, comparativement aux rats 90s [ 8, 13]. Ces résultats montrent que des pics
rapides de drogue dans le cerveau sont très à risque pour le développement de la
toxicomanie. L’idée de forcer une consommation intermittente de cocaïne chez le
rat reste nouvelle et est fondée sur l’observation que chez les usagers de
cocaïne, la consommation est intermittente [ 4, 11]. Cependant, depuis
maintenant plus de deux décennies, le modèle qui prédomine dans la littérature
est un modèle qui permet un accès continu à la drogue pendant plusieurs heures
(6 heures ou plus) par jour [ 14]. Lors d’un accès continu à la cocaïne, les niveaux de drogue
dans le cerveau restent élevés pendant toute la session d’auto-administration de
drogue [ 7, 11], ce qui ne reflète vraisemblablement pas la réalité clinique
[ 4]. Par ailleurs, des rats avec un
accès continu à la cocaïne consomment beaucoup plus de drogue que des rats qui
ont un accès intermittent à la drogue (jusqu’à 8 fois plus), mais les
comportements symptomatiques d’un trouble d’usage de la cocaïne sont d’autant
plus présents chez les rats intermittents [ 2, 7, 11, 15- 18]
(Figure 2). Cela
suggère qu’une consommation intermittente de cocaïne est particulièrement
efficace pour induire des signes comportementaux pertinents pour l’addiction.
Quand l’accès à la cocaïne est continu, les rats doivent consommer la drogue
plusieurs heures par jour (6 heures ou plus) pour démontrer les signes
caractéristiques de toxicomanie décrits plus haut, alors que si l’accès à la
drogue est intermittent, 2 heures par jour suffisent [ 9, 14]. Il semble même que seuls trois jours d’exposition à un protocole
d’auto-administration intermittente de cocaïne suffisent à instaurer des
changements neurobiologiques pertinents pour la toxicomanie [ 21].
 | Figure 2.Les rats avec un accès intermittent (versus continu) à la cocaïne
durant chaque session d’auto-administration prennent moins de
drogue, mais montrent plus de motivation à consommer. A. Estimation
des niveaux de cocaïne dans le cerveau à l’aide d’un modèle
mathématique à deux compartiments [ 10, 19]. Quand l’accès à la cocaïne est continu pendant une
session de 6 heures, les niveaux de cocaïne dans le cerveau
augmentent au début de la session pour rester élevés jusqu’à la fin
(courbe noire). Par opposition, quand l’accès à la cocaïne est
intermittent, les niveaux de cocaïne dans le cerveau fluctuent
pendant la session (courbe rouge). B.À travers 10 sessions de 6 heures, les rats « continus »
consomment beaucoup plus de drogue que les rats « intermittents ».
Les rats « continus » augmentent leur consommation au fur et à
mesure des sessions alors que les rats « intermittents » conservent
une consommation stable dans le temps (dans cette étude, le nombre
d’injections de cocaïne disponible par session était limité par
l’expérimentatrice chez les rats « intermittents »).
* p < 0.05, versus session
1. C. À la suite des 10 sessions d’accès intermittent ou continu à
la cocaïne, la motivation des animaux pour obtenir la cocaïne a été
testée sous ratio progressif. Sous un tel ratio, le nombre d’appuis
sur le levier pour obtenir l’injection suivante de cocaïne augmente
exponentiellement [ 20]. Quand l’effort requis pour obtenir une injection de
cocaïne devient trop exigeant pour les animaux, ils cessent alors
d’appuyer sur le levier et n’atteignent pas le ratio suivant. Le
dernier ratio atteint avant abandon de la tâche est appelé point de
rupture et est un indice de la motivation des animaux pour la
drogue. Bien que les rats « intermittents » aient consommé 8 fois
moins de cocaïne que les rats « continus », ils sont devenus plus
motivés pour obtenir la drogue – un symptôme de la toxicomanie.
%
p < 0.05, interaction positive Groupe x Dose de
cocaïne. #
p < 0.05, « intermittents »
versus « continus ». Ces données sont adaptées
de [ 7]. |
Ces données sont novatrices puisqu’elles remettent en cause l’idée que consommer
beaucoup de cocaïne est nécessaire au développement de la toxicomanie. En effet,
ceci n’est pas toujours le cas et le schéma de consommation de drogue (formation
de pics rapides de drogue dans le cerveau, en « dents de scie
») peut s’avérer plus critique que la quantité consommée dans la transition vers
la toxicomanie. Ainsi, contrer ces pics de cocaïne dans le cerveau pourrait être une stratégie
intéressante tant pour prévenir le développement de la toxicomanie (en utilisant
par exemple une voie d’administration de la drogue plus lente) que pour la
traiter (en évaluant par exemple l’efficacité de traitements de substitution
pour l’addiction à la cocaïne) [22, 23]. |
Générer une consommation pathologique de drogue cliniquement pertinente chez le rat
(en les exposant, par exemple, à des pics de cocaïne au cerveau) est la première
étape en recherche fondamentale sur la toxicomanie. La deuxième étape sera
d’inverser ces comportements symptomatiques d’une consommation pathologique de
drogue dans ces modèles animaux. La toxicomanie est un trouble complexe et
uniquement humain. Cependant, certains comportements de consommation représentatifs
de ce trouble peuvent être mesurés chez l’animal de laboratoire. Les modèles animaux
fondés sur des caractéristiques de consommation fidèles à ce qui est observé chez
l’être humain pourraient accélérer la découverte de traitements pharmacologiques
pour le trouble d’utilisation de la cocaïne. |
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
1.
APA . DSM-V. Diagnostic and statistical manual of mental
disorders . Washington: :
American Psychiatric Association;
2013. 2.
Kawa
AB,
Allain
F,
Robinson
TE,
Samaha
AN. The transition
to cocaine addiction: the importance of pharmacokinetics for preclinical
models . Psychopharmacology (Berl).
2019; ; 236 : 3.
Hatsukami
DK,
Fischman
MW. Crack cocaine
and cocaine hydrochloride. Are the differences myth or
reality? . JAMA.
1996; ; 276 :
:1580.–1588. 4.
Beveridge
TJR,
Wray
P,
Brewer
A, et al.
Analyzing human cocaine use patterns to inform animal addiction
model development . Palm Springs, CA :
College on Problems of Drug Dependence Annual
Meeting, 2012
(abstracts).. 5.
Weeks
JR. Experimental
morphine addiction: method for automatic intravenous injections in
unrestrained rats . Science.
1962; ; 138 :
:143.–144. 6.
Samaha
AN,
Minogianis
EA,
Nachar
W. Cues paired with
either rapid or slower self-administered cocaine injections acquire similar
conditioned rewarding properties . PLoS One.
2011; ; 6 : :e26481.. 7.
Allain
F,
Bouayad-Gervais
K,
Samaha
AN. High and
escalating levels of cocaine intake are dissociable from subsequent
incentive motivation for the drug in rats .
Psychopharmacology (Berl).
2018; ; 235 :
:317.–328. 8.
Allain
F,
Roberts
DC,
Levesque
D,
Samaha
AN. Intermittent
intake of rapid cocaine injections promotes robust psychomotor
sensitization, increased incentive motivation for the drug and mGlu2/3
receptor dysregulation . Neuropharmacology.
2017; ; 117 :
:227.–237. 9.
Allain
F,
Samaha
AN. Revisiting
long-access versus short-access cocaine self-administration in rats:
intermittent intake promotes addiction symptoms independent of session
length . Addict Biol.
2018; ; 24 :
:641.–651. 10.
Zimmer
BA,
Dobrin
CV,
Roberts
DC. Brain-cocaine
concentrations determine the dose self-administered by rats on a novel
behaviorally dependent dosing schedule .
Neuropsychopharmacology.
2011; ; 36 :
:2741.–2749. 11.
Zimmer
BA,
Oleson
EB,
Roberts
DC. The motivation
to self-administer is increased after a history of spiking brain levels of
cocaine . Neuropsychopharmacology.
2012; ; 37 :
:1901.–1910. 12.
Allain
F,
Minogianis
EA,
Roberts
DC,
Samaha
AN. How fast and how
often: The pharmacokinetics of drug use are decisive in
addiction . Neurosci Biobehav Rev.
2015; ; 56 :
:166.–179. 13.
Gueye
AB,
Allain
F,
Samaha
AN. Intermittent
intake of rapid cocaine injections promotes the risk of relapse and
increases mesocorticolimbic BDNF levels during abstinence .
Neuropsychopharmacology.
2019; ; 44 :
:1027.–1035. 14.
Ahmed
SH,
Koob
GF. Transition from
moderate to excessive drug intake: change in hedonic set
point . Science.
1998; ; 282 :
:298.–300. 15.
James
MH,
Stopper
CM,
Zimmer
BA, et al.
Increased number and activity of a lateral subpopulation of
hypothalamic orexin/hypocretin neurons underlies the expression of an
addicted state in rats . Biol Psychiatry.
2019; ; 85 :
:925.–935. 16.
Kawa
AB,
Bentzley
BS,
Robinson
TE. Less is more:
prolonged intermittent access cocaine self-administration produces
incentive-sensitization and addiction-like behavior .
Psychopharmacology (Berl).
2016; ; 233 :
:3587.–3602. 17.
Kawa
AB,
Valenta
AC,
Kennedy
RT,
Robinson
TE. Incentive and
dopamine sensitization produced by intermittent but not long access cocaine
self-administration . Eur J Neurosci.
2019; ; 50 :
:2663.–2682. 18.
Kawa
AB,
Robinson
TE. Sex differences
in incentive-sensitization produced by intermittent access cocaine
self-administration . Psychopharmacology
(Berl).
2019; ; 236 :
:625.–639. 19.
Pan
HT,
Menacherry
S,
Justice
JB, Jr..
Differences in the pharmacokinetics of cocaine in naive and
cocaine-experienced rats . J Neurochem.
1991; ; 56 :
:1299.–1306. 20.
Richardson
NR,
Roberts
DC. Progressive
ratio schedules in drug self-administration studies in rats: a method to
evaluate reinforcing efficacy . J Neurosci
Methods.
1996; ; 66 :
:1.–11. 21.
Calipari
ES,
Siciliano
CA,
Zimmer
BA,
Jones
SR. Brief
intermittent cocaine self-administration and abstinence sensitizes cocaine
effects on the dopamine transporter and increases drug
seeking . Neuropsychopharmacology.
2015; ; 40 :
:728.–735. 22.
Chiodo
KA,
Lack
CM,
Roberts
DC. Cocaine
self-administration reinforced on a progressive ratio schedule decreases
with continuous D-amphetamine treatment in rats .
Psychopharmacology (Berl).
2008; ; 200 :
:465.–473. 23.
Chiodo
KA,
Roberts
DC. Decreased
reinforcing effects of cocaine following 2 weeks of continuous D-amphetamine
treatment in rats . Psychopharmacology
(Berl).
2009; ; 206 :
:447.–456. |