| |
| Med Sci (Paris). 36(3): 218–221. doi: 10.1051/medsci/2020036.Comment le stress précoce altère le comportement à
l’âge adulte Anne Teissier1,2,3* and Patricia Gaspar1,2,3** 1Institut du Fer à Moulin, Inserm UMRS 839 /Sorbonne
Université, Paris, France 2Institut de Psychiatrie et Neurosciences de Paris, Inserm
UMRS 1266, Paris, France 3Institut du Cerveau et de la Moelle épinière, CHU
Pitié-Salpêtrière, 75013Paris,
France MeSH keywords: Adulte, Expériences défavorables de l'enfance, Âge de début, Comportement, Enfant, Maltraitance des enfants, Développement de l'enfant, Émotions, Femelle, Humains, Mâle, Troubles mentaux, Gaine de myéline, Cortex préfrontal, Récidive, Stress psychologique, statistiques et données numériques, physiologie, psychologie, épidémiologie, étiologie, anatomopathologie, métabolisme, croissance et développement, complications |
L’environnement dans lequel un enfant grandit joue un rôle crucial dans le développement
de son cerveau et l’établissement d’un équilibre psychique. On sait, grâce à de
nombreuses études épidémiologiques, que l’exposition à des traumatismes pendant
l’enfance (notamment par négligence émotionnelle ou physique, ou par des abus
émotionnels, physiques, ou sexuels) augmente le risque de développer des troubles
psychiques tels qu’un état anxieux ou dépressif, et constitue un facteur aggravant pour
des maladies psychiatriques comme la bipolarité ou la schizophrénie [1]. On estime que 30 % du risque de maladie
psychiatrique est imputable aux traumatismes de l’enfance [2], ce qui fait de leur prévention un enjeu
important de santé publique. Les mécanismes biologiques impliqués restent mal compris. L’étude des cerveaux de sujets
adultes ayant été exposés à un stress pendant l’enfance a permis d’identifier des
altérations de l’activité corticale et de la substance blanche, notamment dans le cortex
préfrontal, une région cérébrale impliquée dans le contrôle émotionnel et la cognition
[3]. Pour tenter de
comprendre l’origine des anomalies comportementales persistantes après un stress
précoce, nous avons entrepris d’identifier les mécanismes moléculaires et cellulaires
qui sous-tendent la perturbation du développement cérébral associée. |
Les étapes d’un développement cérébral normal Les neurones sont essentiellement générés pendant la vie embryonnaire. Puis, durant
une période de maturation, ils étendent leurs axones et leurs dendrites, avant
d’émettre des potentiels d’action et d’établir des contacts synaptiques afin de
former des réseaux fonctionnels. En parallèle de ce processus de maturation
neuronale a lieu la gliogenèse, c’est-à-dire la production des cellules gliales
(astrocytes, oligodendrocytes, et cellules microgliales) et leur différenciation.
Les cellules gliales sont essentielles au fonctionnement cérébral [4] (→) :
(→) Voir l’Éditorial d’Y. Agid et X. Fan, m/s n° 3, mars
2019, page 199
les astrocytes subviennent aux besoins énergétiques des neurones, les cellules
microgliales contrôlent la maturation synaptique, tandis que les oligodendrocytes
synthétisent la gaine de myéline autour des axones, ce qui permet une conduction
plus rapide de l’influx nerveux. Ces phénomènes de maturation neuronale et de
gliogenèse, qui débutent durant la vie intra-utérine et se prolongent dans
l’enfance, sont donc les plus susceptibles d’être affectés par un stress précoce.
Plus tard, durant l’adolescence, une étape de sélection des connexions neuronales
qui persisteront dans le cerveau adulte permet une optimisation des réseaux
neuronaux et ainsi l’adaptation à l’environnement. Les processus moléculaires contrôlant le développement cérébral étant pour la plupart
très conservés chez les mammifères, nous avons utilisé un modèle murin de séparation
maternelle pour analyser, à l’échelle moléculaire, les effets d’un stress précoce
sur le cerveau en développement. Dans ce modèle, les souriceaux sont séparés de leur
mère pendant 3 heures par jour entre le jour post-natal 2 (P2) et P14. La dernière
séparation est donc effectuée environ une semaine avant le sevrage des souriceaux,
qui a lieu vers P21. Plusieurs études préalables ont montré que les rongeurs ayant
subi un protocole de séparation maternelle présentent, à l’âge adulte, des
altérations comportementales similaires à celles d’hommes exposés à un traumatisme
précoce, notamment: 1) une réaction physiologique au stress exagérée, 2) une
diminution de l’activité du cortex préfrontal, et 3) une altération des processus
cognitifs et émotionnels [5].
A noter que, chez l’homme, les effets d’un stress peuvent être compensés ou non par
l’environnement social ou matériel, et les conséquences comportementales sont donc
souvent moins profondes que dans les modèles d’animaux de laboratoire, élevés dans
des conditions standardisées et pour lesquels il existe donc peu ou pas de « biais
environnemental ». |
Le stress précoce répété induit des altérations de l’activité neuronale et de la
myéline dans le cortex préfrontal en développement Nous cherchions à identifier les altérations moléculaires précoces pouvant être à
l’origine des troubles persistants observés chez l’adulte. Pour cela, nous avons
réalisé, chez des souriceaux exposés ou non à une séparation maternelle répétée, le
séquençage de tous les transcrits des gènes exprimés dans le cortex préfrontal à
P15, c’est-à-dire un jour après leur dernière séparation (Figure 1A) [6]. Nous avons ainsi découvert deux altérations
majeures chez les souriceaux ayant subi ce stress répété. D’une part, une diminution
du nombre des transcrits de gènes associés à l’activité neuronale, c’est-à-dire ceux
dont l’expression est rapidement modifiée par cette activité (Figure 1B). Nos résultats et ceux
d’autres équipes de recherche suggèrent que cette diminution de l’activité neuronale
au repos pourrait atténuer les pics transitoires d’activité neuronale dus au stress,
et persisterait à l’âge adulte [5, 7]. D’autre part, nous avons
observé une augmentation du nombre des transcrits de gènes dont l’expression est
spécifique des oligodendrocytes (les cellules synthétisant la myéline). En utilisant
des immunomarquages et des marqueurs de la division cellulaire, nous avons pu mettre
en évidence une différenciation prématurée des précurseurs d’oligodendrocytes (OPC)
en oligodendrocytes matures aux dépens des OPC qui continuent à proliférer, ainsi
qu’une augmentation des quantités de myéline dans le cortex préfrontal à P15 [6]. Enfin, les animaux ayant subi ce stress
précoce répété avaient, à l’âge adulte, une diminution de la densité des OPC, qui
pourrait être à l’origine d’une diminution de la quantité de myéline, ou tout au
moins d’une diminution de la plasticité de la myélinisation.
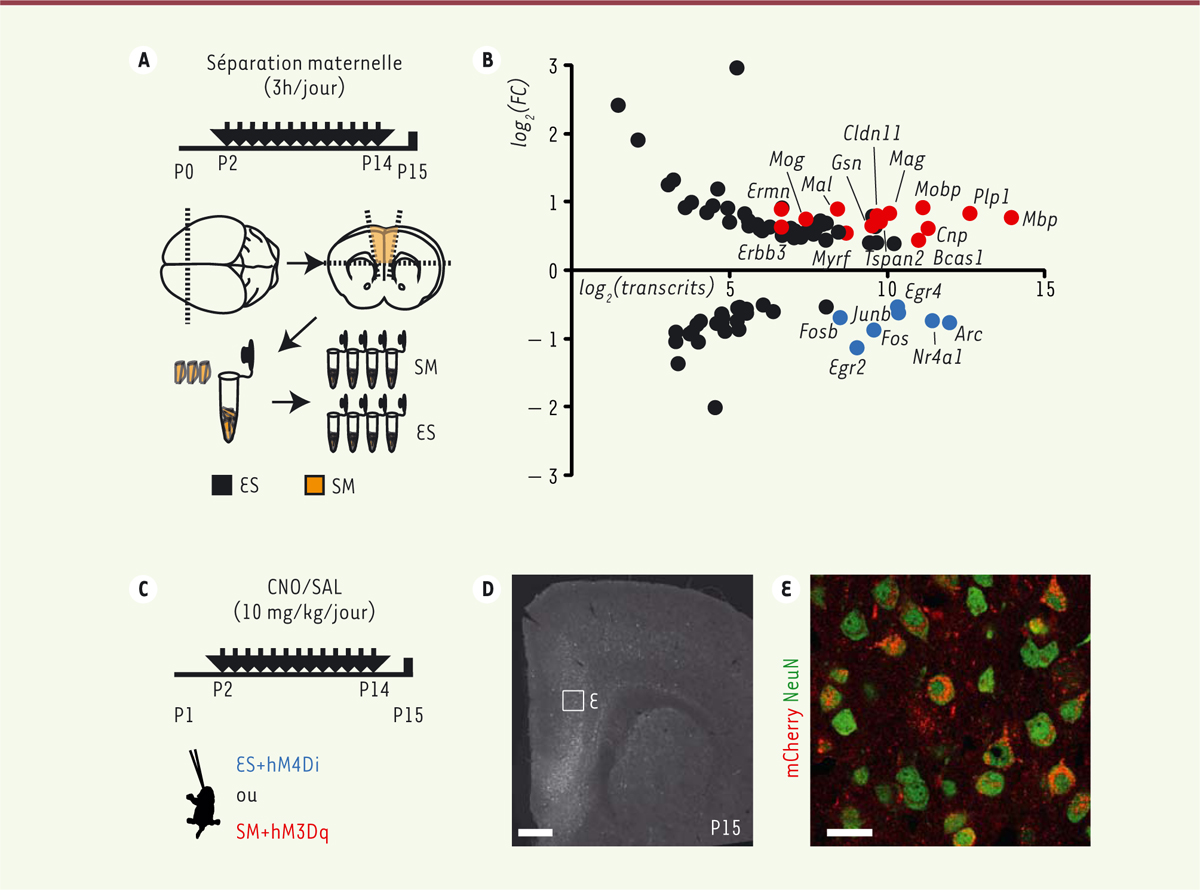
 | Figure 1. Les altérations moléculaires liées à un stress précoce répété peuvent
être reproduites ou prévenues par la modulation de l’activité neuronale
du cortex préfrontal. A. Les souriceaux
soumis au protocole de séparation maternelle (SM) ont été séparés de
leur mère pendant 3 heures chaque jour entre le jour post-natal 2 (P2)
et P14 ; leur cortex préfrontal a été prélevé à P15 pour analyser le
transcriptome. Les souriceaux témoins ont eu un élevage standard (ES).
B. Les résultats du séquençage
des transcrits montrent des changements affectant principalement
l’expression de gènes associés à l’activité neuronale (points bleus)
et à la myéline (points rouges). FC : fold
change. C. La modulation
répétée de l’activité neuronale a été effectuée par l’injection locale
à P1 d’un vecteur viral recombinant permettant l’expression d’un
récepteur muscarinique modifié (hM3Dq, stimulateur, ou hM4Di,
inhibiteur) dans les neurones du cortex préfrontal. Ces récepteurs ont
été activés par injections répétées (chaque jour entre P2 et P14) du
ligand inerte, la clozapine N-oxyde (CNO), ou n’ont pas été activés dans
le groupe témoin qui a reçu des injections répétées de solution
saline (SAL). D.Expression spécifique du
récepteur muscarinique modifié dans le cortex préfrontal à P15 après
injection à P1. (E) Image agrandie de la zone encadrée en (D). La
construction virale utilisée permet d’exprimer un marqueur fluorescent
(mCherry+) en même temps que le récepteur dans les neurones
(NeuN+). Barres d’échelle : 500 mm (D) et 20 mm (E). |
Ainsi, cette analyse moléculaire a permis d’identifier, chez la souris, deux
processus du développement du cortex cérébral affectés par un stress précoce répété,
et dont la perturbation a des conséquences à long terme sur le fonctionnement du
cerveau adulte, donc, potentiellement, sur le comportement. Il est à noter que
l’existence d’une perturbation de l’activité corticale et de la myélinisation a
également été suggérée pour les traumatismes de l’enfance chez l’homme. En effet,
Nelson et al. ont montré que des enfants élevés en orphelinat ont
une diminution de l’activité corticale et du volume de la substance blanche, par
rapport à ceux qui ont été adoptés avant l’âge de 2 ans [8]. De plus, chez de jeunes adultes ayant subi
une agression sexuelle pendant l’enfance, une différenciation précoce des
précurseurs d’oligodendrocytes a été rapportée [9]. Les modèles animaux offrent la possibilité d’étudier le mécanisme de ces
perturbations précoces et leurs liens avec les troubles comportementaux observés
ultérieurement. Nous avons ainsi pu détecter les défauts d’activité neuronale dans
le cortex préfrontal des souriceaux exposés au stress avant même qu’une altération
du processus de différenciation des OPC ne soit apparente. Nous avons donc cherché à
déterminer si une modulation de l’activité neuronale pendant le développement
pouvait induire les défauts de gliogenèse et des défauts comportementaux similaires
à ceux induits par le stress précoce. |
La modulation de l’activité du cortex préfrontal au cours du développement
reproduit ou, au contraire, prévient les défauts induits par un stress précoce
répété Pour manipuler localement l’activité neuronale du cortex préfrontal en développement,
nous avons utilisé les récents outils pharmacogénétiques. Ces derniers permettent,
après injection locale d’un vecteur d’expression viral, d’exprimer un récepteur
modifié puis de moduler l’activité neuronale en activant spécifiquement ce récepteur
grâce à un ligand exogène et inerte traversant la barrière hémato-encéphalique
[10]. Nous avons
injecté de façon bilatérale le cortex préfrontal de souriceaux à P1 avec des virus
permettant l’expression d’un récepteur muscarinique (récepteur couplé à une protéine
G) hM3Dq ou hM4Di modifié, afin de pouvoir renforcer (hM3Dq) ou inhiber (hM4Di)
l’activité des neurones de cette région du cerveau (Figure 1C, D). Nous avons ensuite exposé les
souriceaux au ligand de ces récepteurs chaque jour entre P2 et P14 afin de perturber
l’activité neuronale de façon répétée. Les souriceaux chez lesquels l’activité neuronale du cortex préfrontal a ainsi été
diminuée par activation du récepteur hM4Di présentent des altérations physiologiques
et comportementales très similaires à celles que nous avons observées après le
stress précoce répété, à savoir : 1) une diminution persistante de l’activité
neuronale, 2) une différenciation précoce des précurseurs d’oligodendrocytes, et 3)
une augmentation des comportements associés à l’anxiété et à un état dépressif,
ainsi qu’une altération de la mémoire à court terme [5]. Ainsi, nos résultats indiquent qu’une diminution locale et
transitoire de l’activité neuronale du cortex préfrontal est suffisante pour
reproduire plusieurs conséquences, à court terme et à long terme, d’un stress
précoce répété chez la souris. Inversement, nous avons ensuite voulu savoir si le rétablissement d’une activité
neuronale normale dans le cortex préfrontal de souriceaux subissant un stress
précoce répété permettrait de prévenir l’apparition des défauts de gliogenèse et de
comportement. Une augmentation de l’activité des neurones du cortex préfrontal, par
activation du récepteur hM3Dq, chez les souriceaux pendant le
protocole de séparation maternelle a entraîné la disparition du défaut de
prolifération des OPC, du déficit de la mémoire à court terme, ainsi que des
altérations comportementales associées à un état dépressif [6]. Cependant, cette augmentation n’a pas empêché l’apparition
des troubles du comportement associés à l’anxiété. Cette différence d’effet sur les
troubles anxieux et sur les troubles dépressifs pourrait être due à un biais spatial
de l’injection virale (qui n’aurait modifié l’activité que de certains circuits
émotionnels), ou au fait que le rétablissement de l’activité neuronale par cette
technique pharmacogénétique ne reproduit pas l’état physiologique des réseaux
neuronaux en développement. En effet, les rythmes d’activité neuronale détectables
sur l’électroencéphalogramme sont établis par l’activité synchrone de sous-ensembles
particuliers de neurones excitateurs et inhibiteurs d’une même région, alors que
l’activation pharmacogénétique ne permet pas d’établir cette distinction. Ces résultats ont donc permis de mettre en évidence la contribution physiologique
d’une baisse précoce de l’activité neuronale du cortex préfrontal dans l’apparition
de troubles comportementaux consécutive à un stress précoce répété chez la souris.
Il reste à identifier les mécanismes moléculaires impliqués dans cette diminution
persistante de l’activité neuronale. Par ailleurs, puisqu’un enrichissement de
l’environnement social et sensoriel augmente l’activité du cortex préfrontal [11], il serait intéressant de
tester l’efficacité préventive d’un tel enrichissement sur l’apparition des troubles
liés au stress précoce répété, d’abord chez la souris, puis chez l’homme. |
Les défauts de myélinisation au cœur des maladies psychiatriques ? Nous avons mis en évidence une accélération précoce du processus de myélinisation
dans le cortex préfrontal après exposition des souriceaux à un stress répété, avec
un impact à long terme sur la densité des précurseurs d’oligodendrocytes à l’âge
adulte. La différenciation précoce de ces précurseurs pourrait être adaptative à
court terme (les circuits neuronaux deviendraient plus rapidement fonctionnels grâce
à la myélinisation accélérée des axones), mais son coût à long terme serait une
baisse de la réserve d’OPC et un potentiel d’adaptation restreint à l’âge
adulte. De plus, nous avons montré que l’activité neuronale précoce contrôle l’équilibre
entre prolifération et différenciation des précurseurs d’oligodendrocytes au cours
du développement. Des défauts de myélinisation sont présents dans de nombreuses
maladies psychiatriques telles que les troubles du spectre autistique, la
schizophrénie, ou la dépression récurrente [12]. De plus, des données de plus en plus nombreuses suggèrent
que les oligodendrocytes et leurs précurseurs influent sur le comportement
émotionnel [13]. Il sera
intéressant de déterminer si la baisse de densité des OPC dans le cortex préfrontal
adulte est suffisante pour induire des troubles comportementaux. Comprendre le rôle
des oligodendrocytes et de la myélinisation dans l’émergence des troubles
émotionnels précoces pourrait ouvrir de nouvelles perspectives thérapeutiques. |
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
1.
Heim
C,
Shugart
M,
Craighead
WE,
Nemeroff
CB. Neurobiological
and psychiatric consequences of child abuse and neglect .
Dev Psychobiol.
2010; ; 52 :
:71.–90. 2.
Kessler
RC,
McLaughlin
K,
Green
J, et al.
Childhood adversities and adult psychopathology in the WHO world
mental health surveys . Br J Psychiatry.
2010; ; 197 :
:378.–385. 3.
Insana
SP,
Banihashemi
L,
Herringa
RJ, et al.
Childhood maltreatment is associated with altered frontolimbic
neurobiological activity during wakefulness in adulthood .
Dev Psychopathol.
2016; ; 28 :
:551.–564. 4.
Agid
Y,
Fan
X. L’autre moitié du
cerveau… les cellules gliales . Med Sci
(Paris).
2019; ; 35 :
:199.–200. 5.
Nishi
M,
Horii-Hayashi
N,
Sasagawa
T. Effects of early
life adverse experiences on the brain: Implications from maternal separation
models in rodents . Front Neurosci.
2014; ; 8 :
:1.–6. 6.
Teissier
A,
Andrade-da-Costa
B, Le
Magueresse
C, et al.
Early-life stress impairs postnatal oligodendrogenesis and adult
emotional behaviour through activity-dependent mechanisms .
Mol Psychiatry.
2019; https://doi.org/10.1038/s41380-019-0493-2. 7.
Benekareddy
M,
Vadodaria
KC,
Nair
AR,
Vaidya
VA. Postnatal
serotonin type 2 receptor blockade prevents the emergence of anxiety
behavior, dysregulated stress-induced immediate early gene responses, and
specific transcriptional changes that arise following early life
stress . Biol Psychiatry.
2011; ; 70 :
:1024.–1032. 8.
Nelson
CA. Hazards to early
development: the biological embedding of early life
adversity . Neuron.
2017; ; 96 :
:262.–266. 9.
Tanti
A,
Kim
JJ,
Wakid
M, et al.
Child abuse associates with an imbalance of
oligodendrocyte-lineage cells in ventromedial prefrontal white
matter . Mol Psychiatry.
2017; ; 23 :
:2018.–2028. 10.
Alexander
GM,
Rogan
A,
Abbas
S, et al.
Remote control of neuronal activity in transgenic mice expressing
evolved G protein-coupled receptors . Neuron.
2009; ; 63 :
:27.–39. 11.
Lehmann
ML,
Herkenham
M. Environmental
enrichment confers stress resiliency to social defeat through an infralimbic
cortex-dependent neuroanatomical pathway . J
Neurosci.
2011; ; 31 :
:6159.–6173. 12.
Fields
RD. White matter in
learning, cognition and psychiatric disorders .
Trends Neurosci.
2008; ; 31 :
:361.–370. 13.
Mount
CW,
Monje
M. Wrapped to adapt:
Experience-dependent myelination . Neuron.
2017; ; 95 :
:743.–756. |