| |
| Med Sci (Paris). 36(3): 222–224. doi: 10.1051/medsci/2020037.Rôle de l’hepcidine dans les infections
cutanées Mariangela Malerba1,2 and Carole Peyssonnaux1,2* 1Université de Paris, Institut Cochin, Inserm
U1016, CNRS UMR8104, 24 rue du Faubourg Saint Jacques,
F-75014Paris,
France 2Laboratoire d’excellence GR-Ex, Paris,
France MeSH keywords: Animaux, Hepcidines, Homéostasie, Humains, Immunité active, Facteurs immunologiques, Fer, Souris, Peau, Infections de la peau, génétique, physiologie, métabolisme, immunologie, anatomopathologie |
L’hepcidine hépatique, hormone clé de l’homéostasie du fer dans
l’organisme L’hepcidine est un peptide de 25 acides aminés principalement produit par le foie et
sécrété dans la circulation sanguine en conditions de surcharge en fer, d’infection,
ou d’inflammation [1].
L’hepcidine est l’hormone de l’homéostasie du fer. Elle inhibe l’exportation du fer
des entérocytes (site de l’absorption intestinale du fer alimentaire) et des
macrophages (site de recyclage du fer de l’hémoglobine) en dégradant la ferroportine
(FPN), une protéine exportatrice du fer située à la membrane de ces cellules [2]. Une augmentation de la
production d’hepcidine provoque donc une diminution de la concentration plasmatique
du fer. La carence en hepcidine est associée à l’hémochromatose héréditaire, une
maladie caractérisée par une surcharge progressive en fer pouvant entraîner de
graves dysfonctionnements de divers organes. Le fer est le seul micronutriment dont la régulation hormonale dépend à la fois de
l’état nutritionnel et d’une possible infection. Le fer joue un rôle particulier
dans la médiation des interactions hôte-pathogène, car ce métal est au centre d’une
bataille nutritionnelle entre l’hôte et les pathogènes. L’hepcidine contribue à
l’immunité innée en diminuant les niveaux de fer plasmatique, et ainsi la
disponibilité du fer pour les microbes [3]. À terme, cependant, cette diminution du fer plasmatique
associée à une inflammation conduit à une anémie. L’hepcidine est également produite dans d’autres organes/cellules que le foie (rein,
poumon, macrophages, etc.), notamment lors d’infections [4]. L’hepcidine produite par le foie étant
suffisante pour assurer l’homéostasie systémique du fer dans des conditions
physiologiques [5], la
production d’hepcidine par les autres tissus pourrait jouer un rôle local, notamment
au site des infections ou dans des tissus mal perfusés, inaccessibles à l’hepcidine
présente dans le sang. |
Nouveau rôle immunomodulateur de l’hepcidine cutanée en conditions
infectieuses Si l’hepcidine est désormais reconnue comme l’hormone de l’homéostasie du fer, elle a
été identifiée initialement comme un peptide antimicrobien cationique (PAM) du fait
de sa similarité de structure avec les b-défensines. Les PAM sont des antibiotiques
naturels capables de tuer des souches bactériennes variées [6]. Même si l’hepcidine conserve les fonctions
antimicrobiennes prototypiques des PAM dans différentes espèces de poissons, cette
propriété ne persiste qu’à l’état rudimentaire chez les vertébrés supérieurs et n’a
pas retenu l’attention de la communauté scientifique. Toutefois, les effets des PAM
sont pléiotropes et assurent la protection de l’hôte non seulement par la
destruction directe des agents pathogènes (fonction antimicrobienne) mais également
par la modulation du système immunitaire de l’hôte (fonction immunomodulatrice).
Pourtant, le rôle immunomodulateur de l’hepcidine et son éventuelle expression dans
des épithéliums tels que celui de la peau (source majeure de production de PAM)
n’avaient jamais été étudiés. Nous avons donc entrepris cette étude, en choisissant
comme modèle la fasciite nécrosante (FN), plus connue sous le nom de gangrène ou «
maladie mangeuse de chair ». La FN est une infection caractérisée par une nécrose
généralisée de la peau et des tissus profonds, décrite pour la première fois par
Hippocrate au Ve siècle. Le traitement standard comprend des
antibiotiques à large spectre et un débridement chirurgical1 complet. Cependant, malgré l’usage d’antibiotiques et
l’exérèse chirurgicale des tissus nécrotiques, le risque de septicémie reste élevé,
avec un taux de mortalité pouvant atteindre 30 %. Le streptocoque du groupe A est
considéré comme la cause la plus fréquente de FN associée à la septicémie [7]. Nous avons d’abord montré que l’hepcidine est produite par la peau de patients
souffrant de FN due au streptocoque du groupe A [8]. Pour étudier son rôle dans le développement
de la FN, nous avons utilisé un modèle murin d’infection nécrosante. Des bactéries
d’une souche de streptocoque du groupe A isolées à partir d’un patient atteint de FN
sont introduites chez la souris par voie sous-cutanée ; la souris développe alors
des lésions nécrotiques de la peau et une septicémie dans les jours suivant
l’infection. Comme chez l’homme, l’hepcidine est produite dans la peau infectée et
peut être détectée dans les kératinocytes de l’épiderme. Grâce à l’analyse de souris
mutantes dont le gène de l’hepcidine a été invalidé dans les kératinocytes, nous
avons pu montrer que la production locale d’hepcidine est nécessaire non seulement
pour limiter la prolifération bactérienne au site de la lésion mais également pour
empêcher la dissémination bactérienne [8].
Nous avons alors cherché à comprendre le mécanisme en cause. L’hepcidine n’a pas
d’effet antimicrobien direct sur ces bactéries. En revanche, l’hepcidine produite
par les kératinocytes est essentielle à la synthèse de chemokine (C-X-C
motif) ligand 1 (CXCL1), chimiokine clé des granulocytes neutrophiles.
Cette induction semble s’effectuer par une voie dépendant de la ferroportine, seul
récepteur connu de l’hepcidine. Cette augmentation de CXCL1 par l’hepcidine permet
le recrutement des granulocytes neutrophiles, cellules clés du système immunitaire,
au site de l’infection (Figure
1). Ces granulocytes sont des agents antibactériens essentiels
dans la défense de l’organisme, notamment contre les infections par les
streptocoques du groupe A. Lors de la détection de ces bactéries pyogènes, le
recrutement des granulocytes neutrophiles, qui débute dès les premières minutes de
l’infection, est également essentiel à sa résolution [9]. Toutefois, les streptocoques du groupe A
contrecarrent le système immunitaire de l’hôte en produisant des protéases, telles
que SpyCEP, qui vont dégrader CXCL1 et d’autres protéines impliquées dans le
recrutement et l’activation des granulocytes neutrophiles [10]. Nous avons montré que l’hepcidine,
contrairement à CXCL1, est résistante à la dégradation, ce qui suggère qu’elle
pourrait servir de réservoir pour maintenir un pool de CXCL1 dans le contexte de
l’infection. CXCL1 est phylogénétiquement ancien puisqu’il est déjà présent chez
l’amibe Dictyostelium discoideum, tandis que l’hepcidine est
apparue plus récemment au cours de l’évolution, chez les poissons téléostéens.
Compte tenu de la théorie selon laquelle les interactions hôte-pathogène
co-évoluent, nous pouvons spéculer que les streptocoques du groupe A ont évolué pour
contrer l’activité de CXCL1, alors qu’ils n’ont pas encore développé de facteurs de
virulence capables de neutraliser l’activité de l’hepcidine.
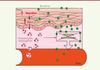 | Figure 1. L’hepcidine produite par la peau augmente le recrutement des granulocytes
neutrophiles au site d’infection et empêche l’invasion bactérienne. En
réponse à l’infection par les streptocoques du groupe A (SGA), les
kératinocytes produisent l’hepcidine nécessaire à la synthèse de CXCL1,
chimiokine clé des granulocytes (ou polynucléaires) neutrophiles.
Contrairement à CXCL1, l’hepcidine est résistante à la dégradation par
les principales protéases bactériennes (ici représentées par des
ciseaux), et pourrait donc servir de réservoir pour maintenir des
niveaux stables de CXCL1 dans les tissus infectés. L’hepcidine permet
alors un recrutement efficace de granulocytes neutrophiles, et empêche
la propagation systémique des bactéries. |
Nous avons fait l’hypothèse que l’hepcidine, du fait de sa résistance à la
dégradation et de ses propriétés immunomodulatrices, pourrait être utilisée dans un
but thérapeutique. En effet, l’administration de l’hepcidine à des souris dans les
24 heures suivant l’infection par des streptocoques du groupe A stimule le
recrutement de granulocytes neutrophiles et empêche l’invasion bactérienne [8]. L’utilisation thérapeutique de l’hepcidine
peut donc constituer une stratégie alternative opportune compte tenu de l’incidence
croissante des maladies invasives dues aux streptocoques du groupe A. En conclusion de cette étude, nous avons montré que l’hepcidine, outre son rôle clé
en tant qu’hormone de régulation du fer produite par le foie, est également un
composant essentiel, jusqu’ici non reconnu, de la réponse immunitaire à une
infection bactérienne lorsqu’elle est produite par l’épiderme. L’hepcidine possède
des rôles pléiotropes en conditions infectieuses. Elle restreint la disponibilité du
fer pour les microorganismes, favorise le recrutement des granulocytes neutrophiles,
et empêche la dissémination bactérienne. Elle est très résistante aux protéases
bactériennes, contrairement aux chimiokines des granulocytes neutrophiles. Comme
l’hepcidine n’agit pas sur les bactéries elles-mêmes, mais sur le système
immunitaire et sur la disponibilité du fer, un nutriment clé pour les bactéries,
nous pouvons supposer que son action thérapeutique ne se limite pas aux
streptocoques du groupe A, mais s’applique à un large éventail de bactéries.
L’hepcidine pourrait donc être envisagée comme une alternative thérapeutique aux
antibiotiques dans de nombreuses maladies. |
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Footnotes |
1.
Nicolas
G,
Chauvet
C,
Viatte
L, et al.
The gene encoding the iron regulatory peptide hepcidin is
regulated by anemia, hypoxia, and inflammation . J
Clin Invest.
2002; ; 110 :
:1037.–1044. 2.
Ganz
T.. Systemic iron
homeostasis . Physiol Rev.
2013; ; 93 :
:1721.–1741. 3.
Weiss
G,
Ganz
T,
Goodnough
LT. Anemia of
inflammation . Blood.
2019; ; 133 :
:40.–50. 4.
Daher
R,
Lefebvre
T,
Puy
H,
Karim
Z. Extrahepatic
hepcidin production: the intriguing outcomes of recent
years . World J Clin Cases.
2019; ; 7 :
:1926.–1936. 5.
Zumerle
S,
Mathieu
JR,
Delga
S, et al.
Targeted disruption of hepcidin in the liver recapitulates the
hemochromatotic phenotype . Blood.
2014; ; 123 :
:3646.–3650. 6.
Nakatsuji
T,
Gallo
RL. Antimicrobial
peptides: old molecules with new ideas . J Invest
Dermatol.
2012; ; 132 :
:887.–895. 7.
Hakkarainen
TW,
Kopari
NM,
Pham
TN,
Evans
HL. Necrotizing soft
tissue infections: review and current concepts in treatment, systems of
care, and outcomes . Curr Probl Surg.
2014; ; 51 :
:344.–362. 8.
Malerba
M,
Louis
S,
Cuvellier
S, et al.
Epidermal hepcidin is required for neutrophil response to
bacterial infection . J Clin Invest.
2020;; 130 :
:329.–34. 9.
Walker
MJ,
Barnett
TC,
McArthur
JD, et al.
Disease manifestations and pathogenic mechanisms of group A
Streptococcus . Clin Microbiol Rev.
2014; ; 27 :
:264.–301. 10.
Dohrmann
S,
Cole
JN,
Nizet
V. Conquering
neutrophils . PLoS Pathog.
2016; ; 12 :
:e1005682.. |


