| |
| Med Sci (Paris). 36(3): 261–263. doi: 10.1051/medsci/2020027.L’émergence des modèles miniatures de foie gras humain
en 3D générés en laboratoire Alexandra Collin de l’Hortet1* and Hélène Gilgenkrantz2 1Department of Pathology, University of
Pittsburgh, Pittsburgh,
PA, États-Unis 2Université de Paris, Centre de recherche sur l’inflammation,
Inserm-UMR1149, 75018Paris,
France |

Vignette (Photo © Inserm - Inserm U49). L’épidémie mondiale d’obésité entraîne une augmentation inquiétante du nombre de
personnes atteintes de stéatose hépatique, encore appelée NAFLD (non alcoholic
fatty liver disease) [1]. La NAFLD se caractérise par une accumulation excessive de triglycérides
dans les hépatocytes. Elle peut évoluer vers une stéatohépatite, ou NASH (non
alcoholic steatohepatitis), puis vers la cirrhose et ses complications,
l’hépatocarcinome et l’insuffisance hépatocellulaire. Cette maladie est asymptomatique
aux stades de NAFLD et de NASH, ce qui retarde souvent son diagnostic. Son étude est
également rendue complexe en raison d’une part de son origine multi-factorielle, mêlant
facteurs environnementaux (sédentarité, alimentation) et génétiques (prédisposition de
régulateurs métaboliques du foie) [2] et, d’autre part de la pertinence des modèles murins qui sont
majoritairement utilisés mais dont le régime alimentaire et le métabolisme diffèrent de
ceux de l’homme [3]. Ainsi, les
essais thérapeutiques de molécules issues des études pré-cliniques se sont le plus
souvent soldés par des résultats peu concluants, voire parfois contradictoires [4]. Pour pallier cette difficulté, de nouvelles approches expérimentales ont vu le jour,
combinant les dernières techniques de différenciation cellulaire avec celles des
cultures multicellulaires [5,
6] (→).
(→) Voir la Synthèse de J.L. Galzi et al., m/s
n° 5, mai 2019, page 467
Des mini-organes humains ont ainsi été développés en laboratoire à partir de cellules
souches pluripotentes induites (cellules iPS) [6,
7]. Ces outils sont
rapidement devenus particulièrement précieux pour modéliser des maladies humaines.
Ainsi, récemment, deux études « preuve de concept » ont mis en évidence le potentiel de
ces nouvelles techniques dans notre compréhension de la NAFLD. |
Des iPS déficientes en sirtuine pour modéliser un mini-foie stéatosique
humain Dans la première étude, que nous avons publiée dans la revue Cell
Metabolism, notre équipe (Department of Pathology, University
of Pittsburgh, États Unis) a eu comme objectif de modéliser une
stéatose sur un mini-organe humain. Dans ce but, nous nous sommes intéressés au rôle
de régulateur métabolique de la déacétylase sirtuine 1 (SIRT1) dans le développement
de la NAFLD [8]. SIRT1 est en
effet connue pour exercer un rôle protecteur vis-à-vis de la stéatose hépatique, en
modulant différentes voies de signalisation métaboliques, en particulier au niveau
du tissu adipeux et du foie. Elle joue également un rôle anti-inflammatoire au
niveau des cellules macrophagiques, ce qui explique qu’en son absence,
l’inflammation et le stress oxydant contribuent à la progression de la NAFLD vers la
NASH [9]
(→).
(→) Voir la Nouvelle de H. Gilgenkrantz et C. Perret, m/s n°
3, mars 2012, page 269
Nous avons donc modifié des cellules iPS humaines afin de contrôler à la demande,
l’expression de SIRT1. Pour construire un mini-foie humain, nous avons utilisé la
technique de décellularisation d’un foie de rat [10] (→)
(→) Voir la Brève de H. Gilgenkrantz, m/s n° 10, octobre
2010, page 819
afin d’obtenir une matrice cellulaire servant de support à différents types
cellulaires, dont des hépatocytes humains dérivés d’iPS, des macrophages, des
fibroblastes, des cellules souches mésenchymateuses et des cellules
endothéliales.
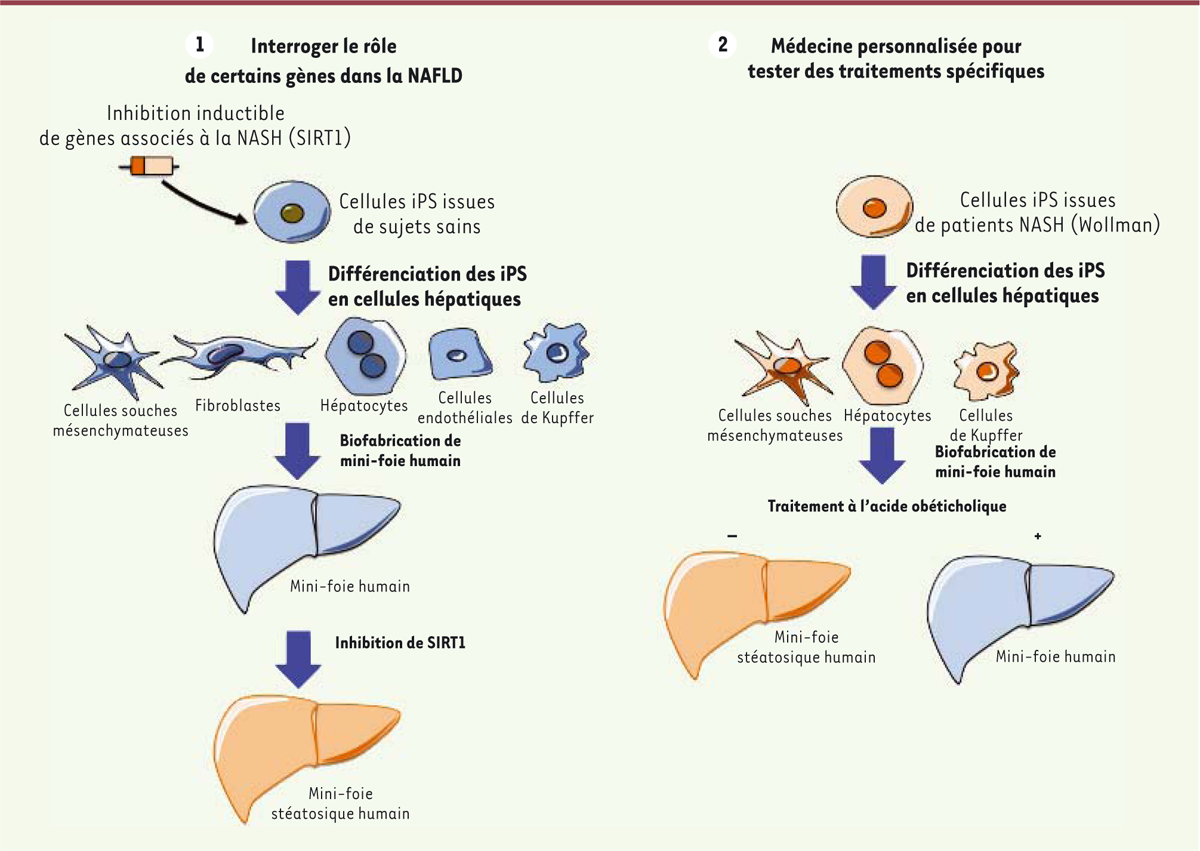
 | Figure 1. Intérêt des modèles de mini-foie steatosique dans le
traitement de la NAFLD. L’émergence de modèles
de mini-foies humains issus de cellules souches pluripotentes induites a
le potentiel d’être utilisée pour : (1) tester le rôle de certains gènes
dans l’origine de la NAFLD en modifiant génétiquement des cellules iPS
saines (2), modéliser des mini-foies à partir de cellules souches issues
de patients au foie stéatosique, afin de tester des traitements à la
carte. |
Des hépatocytes humains dérivés d’iPS et invalidés pour l’expression de SIRT1 ont été
utilisés pour générer de tels mini-foies. L’analyse de ces derniers a montré qu’ils
se gorgeaient rapidement de gouttelettes lipidiques, modélisant ainsi une stéatose
hépatique macro-vésiculaire, accompagné d’un profil de réponse proinflammatoire des
cellules associées. La comparaison du profil lipidique contenu dans ces mini-foies
stéatosiques reconstitués, avec des foies stéatosiques humains, a révélé une
surcharge de lipides identiques et l’analyse des voies métaboliques induites, une
activation de la majorité (41 sur 50) des voies stimulées dans un foie stéatosique
humain. Afin d’étudier la transition entre stéatohépatite et fibrose, il sera
intéressant d’intégrer à l’avenir dans ce modèle les principales cellules
productrices de matrice extracellulaire, les cellules étoilées. En attendant, cette
stratégie innovante consistant à modifier génétiquement des cellules iPS humaines
pour étudier le rôle de certains gènes, pourrait d’ores et déjà, être testée pour
créer d’autres tissus et modéliser d’autres maladies. |
Des iPS de patients atteints de la maladie de Wollman source d’organoïdes de foie
stéatosique Une approche différente, suivie par Takanori Takebe (Division of
Gastroenterology, Hepatology and Nutrition & Division of Developmental
Biology, Cincinnati Children’s Hospital Medical Center, Cincinatti,
États-Unis), également parue dans la revue Cell Metabolism, a quant
à elle cherché à dériver des cellules iPS issues de patients atteints de stéatose
hépatique afin de déterminer les mécanismes moléculaires et inflammatoires propres à
chaque patient [11]. Takebe
a tout d’abord mis un point un modèle d’organoïdes du foie dérivés d’iPS humains
issus de sujets sains par différenciation séquentielle en sphéroïdes de l’intestin
antérieur (foregut spheroids) puis en tissu hépatique
(liver organoids). L’addition d’acides gras libres dans le
milieu de culture a permis de reproduire la progression de la maladie, allant de la
stéatose à la stéatohépatite et à la fibrose hépatique. Ces résultats ont ensuite
été reproduits en utilisant des cellules iPS issues de patients atteints de la
maladie de Wollman, dont le déficit en lipase acide lysosomale (LIPA) induit une
accumulation massive de lipides dans différents organes, en particulier le foie.
Cette maladie autosomique récessive concerne environ 1 personne sur 50 000 en
Europe. Elle est considérée comme la manifestation la plus sévère du déficit en
LIPA. Elle se manifeste dès les premières semaines de vie et mène rapidement à une
insuffisance hépato-cellulaire grave. Les organoïdes hépatiques issus de foies de
patients atteints de cette maladie ont été traités avec l’acide obéticholique, un
activateur du récepteur nucléaire Farnésoïde X (FXR), actuellement en phase III dans
les essais thérapeutiques visant à corriger la NASH. Ce traitement a permis de
diminuer l’accumulation de lipides dans les organoïdes hépatiques, et a prolongé
leur survie, soulignant ainsi l’efficacité potentielle de ce traitement, non
seulement dans la maladie de Wollman mais également dans la NAFLD. Une des limites de cette étude pour affirmer la pertinence pré-clinique de cette
approche est cependant l’absence de caractérisation fonctionnelle du tissu qui est
obtenu. Cette nouvelle technologie pourrait à l’avenir devenir un outil de médecine
personnalisée, en offrant la possibilité de tester différents traitements à la carte
pour chaque patient. |
Quel que soit le type d’approche utilisée pour modéliser la NAFLD/NASH sur des tissus
humains, ces technologies restent expérimentales et ont besoin d’être optimisées. En
effet, la différenciation hépatocytaire de cellule iPS, semble encore incomplète, ne
permettant l’obtention que de cellules hépatiques immatures, à mi-chemin entre
hépatocytes fœtaux et hépatocytes adultes. Par ailleurs, l’agencement des cellules
qui forment le mini-organe n’est pas toujours optimal et induit une variabilité
phénotypique entre les modèles. Enfin, les mini-foies stéatosiques que nous avons
décrits ici ont un temps de vie limité qui est bien inférieur à celui nécessaire
pour le développement des maladies hépatiques dont le spectre, en particulier
l’évolution vers une cirrhose ou un carcinome hépatocellulaire, n’est pas reproduit
dans sa totalité. Néanmoins, l’incidence galopante de la NASH et l’absence de
traitement efficace pour enrayer sa progression justifient déjà pleinement
l’utilisation de ces modèles de foie humain stéatosique pour la compréhension de la
maladie et le développement de nouvelles cibles thérapeutiques. |
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
1.
Spengler
EK,
Loomba
R. Recommendations
for Diagnosis, Referral for Liver Biopsy, and Treatment of Nonalcoholic
Fatty Liver Disease and Nonalcoholic Steatohepatitis .
Mayo Clinic Proc.
2015; ; 90 :
:1233.–1246. 2.
Byrne
CD,
Targher
G. NAFLD: a
multisystem disease . J Hepatol.
2015; ; 62 :
:S47.–S64. 3.
Van Herck
MA,
Vonghia
L,
Francque
SM. Animal models of
nonalcoholic fatty liver disease . A starter’s guide.
Nutrients.
2017; ; 9 : :1072.. 4.
Ding
RB,
Bao
J,
Deng
CX. Emerging roles
of SIRT1 in fatty liver diseases . Intern J Biol
Sci.
2017; ; 13 :
:852.–867. 5.
Galzi
JL,
Jouault
T,
Amédée
J. Les organoïdes :
des mini-organes au service de la biomédecine . Med
Sci (Paris).
2019; ; 34 :
:467.–469. 6.
Prior
N,
Inacio
P,
Huch
M. Liver organoids:
from basic research to therapeutic applications .
Gut.
2019; ; 68 :
:2228.–2237. 7.
Beckwitt
CH,
Clark
AM,
Wheeler
S, et al.
Liver, organ on a chip . Exp Cell
Res.
2018; ; 363 :
:15.–25. 8.
Collin de l’Hortet
A,
Takeishi
K,
Guzman-Lepe
J, et al.
Generation of human fatty livers using custom-engineered induced
pluripotent stem cells with modifiable SIRT1 metabolism .
Cell Metab.
2019; ; 30 :
:385.–401. 9.
Gilgenkrantz
H,
Perret
H. Le silence
parlant de la sirtuine 1 . Med Sci (Paris).
2012; ; 28 :
:269.–271. 10.
Gilgenkrantz
H.. Un greffon de
foie implantable dérivé d’une matrice décellularisée .
Med Sci (Paris).
2010; ; 10 : :819.. 11.
Ouchi
R,
Togo
S,
Kimura
M, et al.
Modeling steatohepatitis in humans with pluripotent stem
cell-derived organoids . Cell Metab.
2019; ; 30 :
:374.–384. |