| |
| Med Sci (Paris). 36(3): 279–282. doi: 10.1051/medsci/2020042.Bioéthique L’existence des contraintes légales et réglementaires des
biobanques Zeineb Messaoudi,1* Nisrine Soltani,1** and Nicole Arrighi1*** 1MSc Biobanks and complex data management,
Université Côte d’Azur, Centre hospitalier universitaire de Nice, Hôpital
Pasteur, Biobanque
BB-0033-00025, Nice, France MeSH keywords: Biobanques, Confidentialité, Europe, France, Réglementation gouvernementale, Humains, Islande, Consentement libre et éclairé, Législation comme sujet, Sens moral, Manipulation d'échantillons, éthique, législation et jurisprudence, normes |
En 2000, l’Islande fut le premier pays européen à réglementer les pratiques des
biobanques par l’Icelandic Act on Biobanks n° 110/2000, suivie de
l’Estonie, de la Suède et de la Finlande en 2012. Contrairement aux pays d’Europe du
Nord, les biobanques françaises ne font pas l’objet d’une loi particulière. Cependant,
leurs activités sont strictement réglementées. Dans ce contexte, quelles sont les
contraintes légales et réglementaires des biobanques ? Pour répondre à cette question,
nous définirons d’abord le cadre juridique des biobanques en France, puis nous
expliquerons comment ce cadre légal garantit la protection des individus et des données
personnelles. |
Le cadre juridique des biobanques À ce jour, la réglementation française repose sur deux lois présentant les procédures
générales de gestion des collections d’échantillons biologiques humains à visée
scientifique : la loi n° 2004-806 du 9 août 2004 relative à la politique de santé
publique [1] et la loi n°
2004-800 du 6 août 2004 relative à la bioéthique [2]. Réformée avec la loi n° 2011-814 du 7
juillet 2011, le législateur a procédé à une modification ponctuelle de la loi de
2011 par la loi n° 2013-715 du 6 août 2013 « autorisant sous certaines conditions la
recherche sur l’embryon et les cellules souches embryonnaires » [3]. Ce dispositif législatif figure dans le code civil pour les principes généraux :
dignité de la personne, inviolabilité du corps humain, extra-patrimonialité du corps
et de ses produits et éléments (code civil, art. 16 à 16-14). Plus largement, les
biobanques sont soumises aux textes du code de la santé publique (CSP) encadrant les
activités scientifiques et la recherche biomédicale subordonnée au respect des
principes généraux relatifs au don et à l’utilisation des éléments et des produits
du corps humain (CSP art. L 1211-1 à L 1211-9). |
Les activités réglementées, les régimes de déclaration et d’autorisation Par définition, une collection d’échantillons biologiques humains « résulte de la
réunion, à des fins scientifiques, de prélèvements biologiques effectués sur un
groupe de personnes identifiées et sélectionnées en fonction des caractéristiques
cliniques ou biologiques d’un ou plusieurs membres du groupe, ainsi que des dérivés
de ces prélèvements » (CSP art. L. 1243-3). Avant de commencer la collection, son
responsable scientifique ou celui de la biobanque engage plusieurs démarches
administratives :
-
la demande d’avis favorable d’un comité de protection des personnes
(CPP). L’information des participants, le recueil du consentement, et le
protocole de recherche, la pertinence éthique et scientifique du projet
sont alors évaluées.
-
la déclaration de demande de conservation de collection auprès de
l’agence nationale de sécurité du médicament et des produits de santé
(ANSM) et auprès du ministère chargé de la recherche (art. 36-I de la
loi du 6 août 2004) (Figure
1).
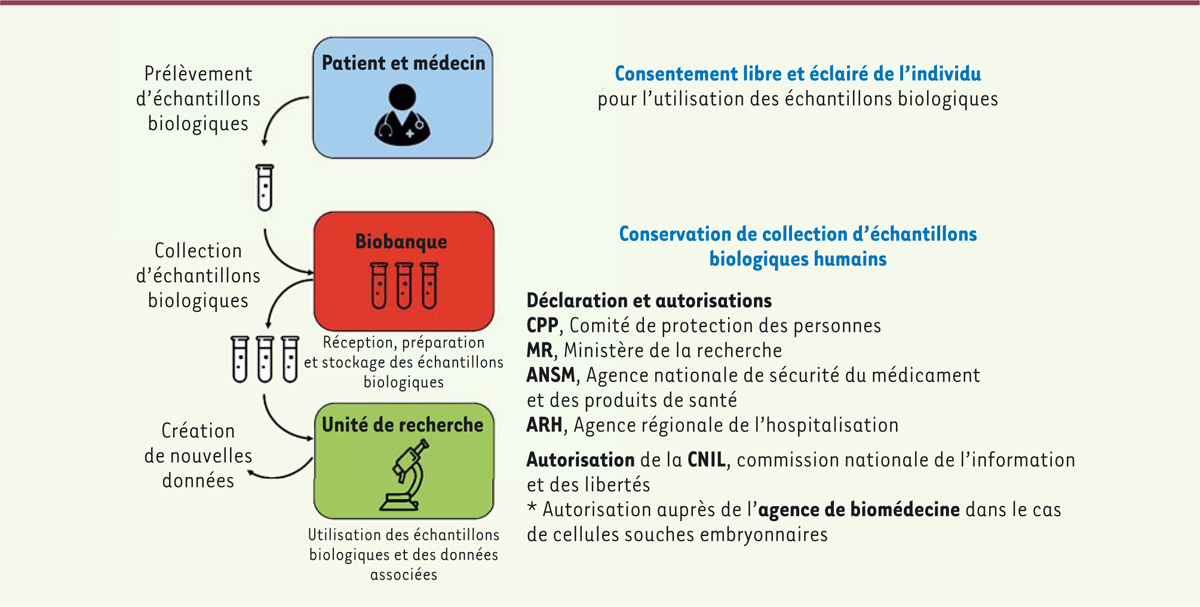
 | Figure 1. Les démarches administratives indispensables à la conservation de la
collection d’échantillons biologiques humains dans une biobanque. Le
consentement est signé par le patient avant le prélèvement de
l’échantillon biologique. Cet échantillon peut être inclus dans une
collection d’une biobanque. Au préalable, le responsable de la biobanque
aura demandé l’avis favorable du comité de protection des personnes
(CPP) et déclaré la conservation de la collection auprès du ministère de
l’Enseignement supérieur, de la Recherche et de l’Innovation et de
l’Agence nationale de sécurité du médicament (ANSM) et des produits de
santé ainsi que de l’agence régionale de l’hospitalisation (ARH). La
création de nouvelles données issues de la recherche est soumise pour
autorisation auprès de la commission nationale de l’informatique et des
libertés (CNIL). Dans le cas de cellules souches embryonnaires,
l’autorisation de conservation de la collection est demandée auprès de
l’agence de biomédecine. |
|
Le cas particulier des embryons et des cellules souches embryonnaires La loi n° 2013-715 du 6 août 2013 a modifié le régime des recherches sur l’embryon et
les cellules souches embryonnaires [4]. Seuls sont autorisés à mener ces recherches les établissements et
organismes titulaires de l’autorisation de conservation des cellules souches
embryonnaires à des fins de recherche ainsi que les établissements et organismes
publics et privés poursuivant une activité de recherche et ayant conclu une
convention avec les établissements et organismes précédents (CSP art. R 2151-3,
II). La conservation des embryons et des cellules souches embryonnaires à des fins de
recherche exige une autorisation délivrée par l’agence de la biomédecine (CSP art. R
2151-20). Tout organisme conservant des embryons ou des cellules souches embryonnaires à fin de
recherche doit pouvoir justifier du recueil des consentements donnés par les
géniteurs des embryons. Lorsque les cellules souches embryonnaires ont été
importées, l’organisme doit être en mesure de justifier qu’elles ont été obtenues
dans le respect des prescriptions du code civil, avec le consentement préalable du
couple géniteur de l’embryon conçu dans le cadre d’une assistance médicale à la
procréation, et que cet embryon ne fait plus l’objet d’un projet parental, ceci sans
qu’aucun paiement, quelle qu’en soit la forme, n’ait été alloué au couple (CSP art.
R 2151 - 18). |
La chaîne des opérations et la chaîne des responsabilités Le responsable d’une collection doit s’assurer du respect du cadre juridique. Il est
le responsable administratif. Cependant, la personne initiatrice de la collection
peut également être identifiée comme responsable scientifique de la collection et
peut superviser la chaîne des opérations. Les exigences quant au nombre d’échantillons et la pertinence des projets de
recherches sont déterminées par le conseil scientifique de la biobanque. Il est
composé de médecins et de chercheurs, et décide de la nature et du type de
prélèvements autorisés dans la biobanque. La biobanque peut céder ses échantillons par un accord de transfert de matériel
(material transfer agreement, MTA) respectant les articles L.
1243-3, L.1243-4 et R. 1243-49 du CSP. Ce document contient les références et le but
du demandeur (identité du demandeur, structure de l’institution, contexte de la
demande, utilisation des matériels biologiques, charges et indemnités, respect de la
confidentialité). La biobanque en demandera l’autorisation auprès du ministère
chargé de la recherche. |
La protection des participants et des données Selon le CSP (art L.1211-2), « le prélèvement d’éléments du corps humain et la
collecte de ses produits ne peuvent être pratiqués sans le consentement préalable du
donneur. Ce consentement est révocable à tout moment ». Le consentement du patient
et la protection des données sont les piliers de la recherche biomédicale. |
L’indispensable consentement du patient L’autorisation d’utilisation d’un échantillon humain nécessite le consentement libre
et éclairé de l’individu (informed consent). Le patient exprime par
écrit sa volonté de participer au projet de recherche après avoir été informé de
façon claire sur le but des chercheurs. À tout moment, il peut se retirer de
l’étude. Ce consentement, transmis au CPP, est obligatoire dès qu’il s’agit de
l’utilisation des échantillons biologiques et des données personnelles ou de
recherches génétiques. Parfois, l’échantillon peut être utile à plusieurs investigateurs. Alors, le patient
est consulté à nouveau et informé du nouveau domaine d’application. En France,
l’utilisation secondaire des échantillons est fondée sur le principe de
non-opposition. Dans le cadre du consentement éclairé large (broad informed
consent), le patient est d’accord pour que - il ne s’oppose pas à ce
que - les données associées à son échantillon soient utilisées dans un projet futur.
En revanche, s’il est impossible de recontacter les patients, le responsable
scientifique peut demander une requalification globale d’une collection auprès du
CPP, en expliquant les objectifs des nouvelles recherches et surtout la nécessité
d’inclure les échantillons des patients injoignables. Le CPP peut alors accepter la
requalification, sauf dans le cas des études génétiques, pour lesquelles le
consentement individuel est obligatoire, ainsi que pour l’utilisation des cellules
germinales. Finalement, les principes de non-opposition et de requalification montrent les
limites de traçabilité du consentement individuel. Le retour d’informations au
patient est une étape longue mais indispensable pour les biobanques qui veulent
accroitre la taille de leur collection. Grâce à internet, les échanges avec le
patient pourraient être accélérés par le consentement électronique dynamique
(electronic informed consent) [5] (→).
(→) Voir le Forum de H.C. Stoeklé et al.,
m/s n° 2, février 2017, page 188
La food and drug administration (FDA) américaine propose des
recommandations dans ce sens, destinées aux responsables scientifiques, dans ses
orientations de 2016 [6]. Ce
consentement électronique apporte une information au patient, enrichie en vidéos et
en échanges interactifs. En temps réel, il offre une traçabilité de l’échantillon :
le clinicien s’assure que le patient a bien reçu les informations relatives au
projet, et les industriels suivent l’utilisation des échantillons et des
données. |
La protection des données associées à l’échantillon et des données
personnelles Lorsqu’un individu consent à participer à un projet scientifique, il accorde sa
confiance au médecin qui assure le prélèvement et garantit la confidentialité des
résultats. L’échantillon biologique est ensuite inséré dans une collection d’une
biobanque. La gestion de ces échantillons nécessite l’anonymisation des données.
Quel est alors le degré d’anonymat recommandé ? La procédure de pseudonymisation est standardisée dans une biobanque. Les
informations d’identité de la personne (nom, prénoms, numéro de sécurité sociale)
sont codées par une clé ou un code de cryptage, le même pour un même individu. Ce
codage facilite le suivi longitudinal et le retour d’information au patient. Après
le traitement des échantillons, le promoteur du projet va créer de nouvelles
données, qui doivent être protégées. Depuis 2018, le nouveau règlement général sur
la protection des données personnelles (RGPD) de l’union européenne remplace la
directive 95/46/CE sur la protection des données personnelles et leur libre
circulation [7]. Ce règlement
affecte les deux pôles de la biobanque, les actions relatives aux échantillons
(prélèvement, conservation, utilisation en recherche) et les activités relatives aux
données personnelles associées (collecte, conservation, utilisation) [8]. S’agissant souvent de données personnelles, le traitement des données doit respecter
notamment la loi n° 78-17 du 6 janvier 1978 relative à « l’informatique, aux
fichiers et aux libertés », version consolidée le 23 juillet 2019. La commission
nationale de l’informatique et des libertés (CNIL) doit être saisie avant tout
traitement de données afin de s’assurer du respect de la sécurité et de la
confidentialité, ainsi que de la bonne utilisation des données personnelles, surtout
s’il s’agit de données génétiques. Les biobanques virtuelles (e-biobanking) échangent déjà des données
cliniques ou des clichés d’imagerie médicale. Le partage de ces données massives
(big data) nous projette dans une dynamique d’échanges en temps
réel (biobank cloud) dans le monde entier. Le troisième pilier de
la recherche médicale - après les échantillons biologiques et les données associées
- est l’encadrement réglementaire et légal qui veille au respect des droits des
personnes, en les informant sur ces droits et en leur permettant de les exercer. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
1.
Loi n° 2004–806 du 9 août 2004 relative à la politique de santé
publique. NOR : SANX0300055L, JORF n° 185 du 11 août 2004, p.
14277.
2.
Loi n° 2004–800 du 6 août 2004 relative à la bioéthique. NOR :
SANX0100053L, JORF n° 182 du 7 août 2004, p. 14040.
3.
Binet
JR. Recherches sur
l’embryon : fin d’un symbole éthique et abandon d’une illusion
thérapeutique. ; à propos de la loi n° 2013–715 du 6
août 2013.
JCP G.
2013; :905.. 4.
Arrighi
N.. Les cellules
souches : des innovations thérapeutiques sous contrôle .
ISTE.
2018 : :121.–127. 5.
Stoeklé
HC,
Deleuze
JF,
Vogt
G,
Hervé
C. Vers un
consentement éclairé dynamique . Med Sci
(Paris).
2017; ; 33 :
:188.–192. 6.
Use of electronic informed consent in clinical investigations -
Questions and answers. Guidance for institutional review boards,
investigators, and sponsors. December 2016.
8.
Règlement (UE) 2016/679 du Parlement européen et du Conseil du 27 avril
2016 relatif à la protection des personnes physiques à l’égard du traitement
des données à caractère personnel et à la libre circulation de ces données,
et abrogeant la directive 95/46/CE (règlement général sur la protection des
données). JOUE L119 du 4 mai 2016.
9.
Chassang
G, Cambon
Thomsen
A,
Rial-Sebbag
E,
Dagher
G. Éthique et
réglementation des biobanques de recherche. Aspects opérationnels et
perspectives . Paris:
: Biobanques; ,
2016. |