| |
| Med Sci (Paris). 36(4): 308–310. doi: 10.1051/medsci/2020045.Le mimétisme du microbiote intestinal à l’origine d’une
cardiomyopathie inflammatoire létale Ludivine Laurans1* and Soraya Taleb1** 1Université de Paris, PARCC, Inserm U970, Hôpital européen
Georges Pompidou, 56 rue
Leblanc, 75015Paris,
France MeSH keywords: Animaux, Cardiomyopathies, Cause de décès, Microbiome gastro-intestinal, Humains, Muqueuse intestinale, Mimétisme moléculaire, Myocardite, Indice de gravité de la maladie, étiologie, immunologie, mortalité, physiologie, microbiologie |
La cardiomyopathie inflammatoire La myocardite est une maladie inflammatoire du myocarde qui se caractérise par une
activation du système immunitaire et une nécrose de myocytes. La myocardite évolue
en trois phases, et peut aboutir à une cardiomyopathie létale [1]. La maladie est généralement
déclenchée par un microorganisme pathogène tel qu’un virus (cytomégalovirus, virus
de la Dengue, virus d’Epstein-Barr, virus de l’hépatite A ou C, virus de l’herpès,
etc.), une bactérie (méningocoque, Brucella, staphylocoque, etc.),
un parasite (Toxoplasma gondii, trypanosome), mais aussi parfois
par une réaction allergique (colchicine, lidocaïne, etc.), par une drogue ou un
médicament (amphétamines, cocaïne, éthanol, anthracyclines, etc.), voire par une
toxine (venins de serpent ou de scorpion) [1].
Cette phase dure quelques jours. La phase auto-immune qui lui succède dure de
quelques semaines à quelques années. Les peptides antigéniques dérivés du pathogène
responsable de la primo-infection sont présentés à la surface des cellules infectées
en association avec le complexe majeur d’histocompatibilité (CMH). Ce complexe,
reconnu par les lymphocytes T, induit la sécrétion de cytokines ou de perforines
conduisant, en cas d’amplification de la réaction inflammatoire, à la destruction
massive de cardiomyocytes [2]. Cette activation immunitaire aiguë est alors associée à une réponse
auto-immune contre la chaîne lourde 6 de la myosine (myosin heavy chain
6, MYH6), une isoforme de la chaîne lourde de la myosine des
cardiomyocytes [3,4]. La troisième phase de la
maladie, dite tardive, conduit à une cardiomyopathie dilatée, et ne concerne que les
patients présentant une persistance virale. |
Rôle du microbiote intestinal dans la myocardite Dans un article récemment publié dans la revue Science [5], les auteurs ont testé
l’hypothèse selon laquelle l’activation des cellules immunitaires au cours de la
myocardite avait pour origine le microbiote intestinal. Pour cela, ils ont utilisé
un modèle murin de myocardite : des souris transgéniques, sur fonds génétique
BALB/c, dont plus de 95 % des lymphocytes T CD4+ expriment un récepteur
TCR (T cell receptor) spécifique de MYH6 (souris TCRM). Toutes les
souris TCRM ont un développement spontané de la maladie, qui évolue vers une
cardiomyopathie létale chez 50 % d’entre elles [6]. Pour étudier l’impact du microbiote
intestinal sur la maladie, les souris TCRM sont élevées dans des conditions où elles
sont dépourvues de flore commensale (souris « germ-free », GF, ou
axéniques). Les auteurs ont observé que les souris GF étaient protégées contre
l’inflammation cardiaque et la survenue de la myocardite. Ils ont également montré,
par des expériences de transfert de flore intestinale, que le microbiote intestinal
était responsable de l’apparition d’un infiltrat inflammatoire cardiaque et de
l’aggravation de la maladie. L’infiltrat était composé de lymphocytes T auxiliaires
Th17 qui produisent de l’interleukine 17 (IL-17), et était caractérisé par un
recrutement accru de cellules inflammatoires d’origine myéloïde (monocytes,
macrophages activés, et macrophages résidents) dans le cœur. Par ailleurs,
l’administration d’un traitement antibiotique aux souris TCRM prévient l’apparition
de l’infiltrat cardiaque et diminue la sévérité de la maladie, conduisant à une
absence de mortalité. Ces résultats suggèrent l’implication du microbiote intestinal
dans l’évolution létale de la myocardite, via la prolifération des
lymphocytes Th17 CD4+ spécifiques de MYH6 et l’accumulation de cellules
inflammatoires dans le myocarde des souris TCRM. Le transfert adoptif des
lymphocytes T CD4+ de souris TCRM à des souris invalidées pour le gène
Rag1 (recombination activating gene 1), qui
sont dépourvues de lymphocytes, a montré que les lymphocytes T transférés, après
avoir proliféré dans le chorion (lamina propria) de la muqueuse
intestinale, ont la capacité de migrer dans les zones T des tissus lymphoïdes de
l’intestin (plaques de Peyer et ganglions mésentériques), avant de coloniser le cœur
(Figure 1).
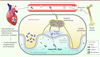 | Figure 1. Implication du microbiote intestinal dans l’aggravation de
la cardiomyopathie. Les peptides β-gal dérivés
de la β-galactosidase exprimée par Bacteroides
thetaiotaomicron (B. theta), une bactérie
présente dans le microbiote intestinal, ont une forte avidité pour le
TCR (T cell receptor) de lymphocytes T, conduisant à la
prolifération de lymphocytes T helper 17 (Th17) dans le
chorion (lamina propria) de la muqueuse intestinale.
Ces lymphocytes T stimulés vont migrer dans les organes lymphoïdes
(plaques de Peyer et ganglions mésentériques) environnant l’intestin,
puis rejoindre le cœur. Le recrutement, dans le myocarde, de cellules
inflammatoires d’origine myéloïde conduit à une altération de la
fonction cardiaque pouvant aboutir à une cardiomyopathie létale. |
|
Le mimétisme du microbiote intestinal dans la myocardite Gil-Cruz et al. ont mis en évidence l’existence de peptides
bactériens ayant une très forte affinité pour le TCRM des lymphocytes T
CD4+. En particulier, ces chercheurs ont isolé un peptide dérivé de
la β-galactosidase (β-gal) qui est présente chez Bacteroides
thetaiotaomicron (B. theta) et Bacteroides
faecis, des bactéries trouvées dans le microbiote intestinal, et ont
montré in vitro que les lymphocytes T CD4+ de souris
TCRM prolifèrent autant en réponse à une stimulation par MYH6 qu’en réponse à une
stimulation par le peptide β-gal provenant de Bacteroides. Cela
indique qu’il existe un mimétisme moléculaire entre les deux peptides, MYH6 et
β-gal, conduisant à l’activation de lymphocytes T CD4+ [5]. De plus, lorsque l’intestin des animaux TCRM
GF est recolonisé avec B. theta, on observe une induction de
cellules Th17 dans le cœur, qui est cependant réduite en l’absence du peptide β-gal.
Ces résultats mettent en évidence l’existence de peptides bactériens issus du
microbiote intestinal et ayant la capacité d’être reconnus par le TCR de lymphocytes
T spécifiques d’antigènes cardiaques. Un tel mécanisme de mimétisme des bactéries
commensales a également été mis en évidence dans l’activation de lymphocytes T
CD8+ pro-diabétogènes chez les souris NOD (non-obese
diabetic) [7]. |
Le dosage des immunoglobulines G (IgG) sériques dirigées contre
Bacteroides montre une augmentation significative des anticorps
anti-B. theta dans le sang des patients présentant une
myocardite aiguë (cohorte AMITIS) comparativement à des sujets sains, et cela même à
un stade très précoce de la maladie [5]. Une
telle différence n’existe pas pour les anticorps dirigés contre d’autres espèces de
Bacteroides. L’amélioration clinique de ces patients au cours
du temps (avec une augmentation de la fraction d’éjection systolique, qui reflète la
contractilité du myocarde, et une diminution de la concentration plasmatique de la
C reactive protein [CRP], qui est un marqueur de
l’inflammation), s’accompagne d’une diminution des taux sériques d’IgG
anti-B. theta. L’analyse des liaisons prévisibles des peptides MYH6 et β-gal B.
theta à différentes molécules du CMH in silico indique
que ces deux peptides se lient préférentiellement aux allèles HLA-DQA1*/B1*. De
plus, il existe une corrélation entre les nombres de lymphocytes T spécifiques de
MYH6 et spécifiques de β-gal chez les patients atteints de myocardite présentant les
allèles HLA-DQB1. Enfin, le transfert de matières fécales provenant de patients possédant B.
theta dans leur microbiote intestinal (B. theta
+) à des souris TCRM GF induit une plus forte infiltration du cœur par
des cellules immunitaires qu’un transfert de matières fécales provenant de patients
n’ayant pas de B. theta (B. theta
-) dans leur microbiote intestinal. |
Conclusions et perspectives L’équipe dirigée par Burkhard Ludewig [5] a
montré que les lymphocytes T CD4+ activés par des peptides dérivés de
protéines de bactéries intestinales pouvaient migrer ultérieurement vers le cœur et
exacerber les dommages myocardiques causés par une infection virale. De plus, la
présence des allèles HLA-DQA1*/B1* chez certains patients atteints d’une myocardite
[8], associée à la perte
d’autocontrôle par les lymphocytes T, semble être à l’origine d’une cardiomyopathie
inflammatoire très sévère, qui peut entraîner la mort. Cela suggère qu’en ciblant le
microbiote de ces patients, par exemple par un traitement antibiotique, il serait
possible d’atténuer la gravité de la maladie et d’en prévenir les séquelles
potentiellement létales. |
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
1.
Feldman
AM
,
McNamara
D
. Myocarditis . N Engl J
Med.
2000; ; 343 :
:1388.–1398. 2.
Liu
PP
,
Mason
JW
. Advances in the understanding of
myocarditis . Circulation.
2001; ; 104 :
:1076.–1082. 3.
Pummerer
CL
,
Luze
K
,
Grässl
G
, et al.
Identification of cardiac myosin peptides capable of inducing
autoimmune myocarditis in BALB/c mice . J Clin
Invest.
1996; ; 97 :
:2057.–2062. 4. Rose
NR. Learning from
myocarditis: mimicry, chaos and black holes .
F1000Prime Rep.
2014;; 6. 5.
Gil-Cruz
C
,
Perez-Shibayama
C
,
De Martin
A
, et al.
Microbiota-derived peptide mimics drive lethal inflammatory
cardiomyopathy . Science.
2019; ; 366 :
:881.–886. 6.
Nindl
V
,
Maier
R
,
Ratering
D
, et al.
Cooperation of Th1 and Th17 cells determines transition from
autoimmune myocarditis to dilated cardiomyopathy: Cellular immune
response . Eur J Immunol.
2012; ; 42 :
:2311.–2321. 7.
Tai
N
,
Peng
J
,
Liu
F
, et al.
Microbial antigen mimics activate diabetogenic CD8 T cells in NOD
mice . J Exp Med.
2016; ; 213 :
:2129.–2146. 8.
Portig
I
,
Sandmoeller
A
,
Kreilinger
S
, et al.
HLA-DQB1* polymorphism and associations with dilated
cardiomyopathy, inflammatory dilated cardiomyopathy and
myocarditis . Autoimmunity.
2009; ; 42 :
:33.–40. |


