Le glioblastome est la tumeur primaire du cerveau la plus fréquente et la plus agressive. Elle touche aussi bien les enfants et les jeunes adultes que les personnes âgées. Le traitement standard (chirurgie, chimiothérapie, radiothérapie) n’est que modestement efficace, et la médiane de survie des individus atteints de ce cancer se situe entre 15 et 20 mois [1]. De ce fait, de nouvelles stratégies de traitement, dont l’immunothérapie constitue un pilier majeur, sont à l’étude depuis de nombreuses années. En effet, la manipulation du système immunitaire a fait la preuve de son efficacité pour combattre les cancers, notamment avec le succès des anticorps inhibant les molécules de points de contrôle de l’immunité [2] (→). À côté de ces anticorps, dont l’administration au patient n’est possible que depuis quelques années, la vaccination thérapeutique est testée depuis plusieurs décennies, avec toutefois une efficacité clinique encore limitée [3].
(→) Voir le numéro thématique Anticorps monoclonaux en thérapeutique, m/s n° 12, décembre 2019
La vaccination thérapeutique vise à générer chez le patient des lymphocytes T spécifiques de la tumeur, dans l’espoir d’une destruction ciblée des cellules cancéreuses [3]. Si cette stratégie est relativement simple à mettre en pratique et n’induit que rarement des effets secondaires sévères, elle comporte plusieurs contraintes (Figure 1). Tout d’abord, il est nécessaire d’identifier des antigènes exprimés par les cellules tumorales mais pas par les cellules saines, afin d’éviter une attaque des tissus sains. Les protéines mutées au cours du processus de tumorigénèse sont une source privilégiée de tels antigènes. Toutefois, la portion mutée de la protéine doit être à l’origine d’un épitope T, c’est-à-dire d’un peptide reconnu par les lymphocytes T lorsqu’il est associé aux molécules du complexe majeur d’histocompatibilité (CMH) (Figure 2). Ces antigènes spécifiques de tumeur, ou néoantigènes, sont relativement peu fréquents, et on estime que seule une faible proportion (quelques pourcents) des mutations génèrent des épitopes T à la surface des cellules tumorales. Une autre possibilité est d’utiliser des antigènes surexprimés par les cellules tumorales, mais faiblement exprimés par les cellules saines, avec toutefois le risque de déclencher des phénomènes d’auto-immunité [4]. Un deuxième obstacle à l’efficacité de la vaccination thérapeutique réside dans le fait que les lymphocytes T induits doivent migrer au site de la tumeur, un processus moins efficace que dans le cas de réponses immunitaires induites par un microorganisme pathogène. Finalement, si l’on admet que ces lymphocytes sont capables d’arriver au site tumoral, leur efficacité y sera limitée par l’environnement immunosuppresseur. En effet, l’expression de ligands des récepteurs des lymphocytes T, conduisant à l’inhibition des fonctions anti-tumorales de ces derniers, ainsi que la sécrétion de cytokines immunosuppressives sont une caractéristique commune à la majorité des cancers. Ces effets sont induits par les cellules tumorales elles-mêmes ou par l’attraction et la reprogrammation des cellules du système immunitaire (macrophages, granulocytes neutrophiles, lymphocytes T régulateurs) à l’avantage de la tumeur (Figure 1).
| Figure 1. Contraintes associées à la vaccination
anti-tumorale. La nature des antigènes
(1), la formulation du vaccin, y
compris le choix d’adjuvants forts (2),
l’optimisation de la migration des lymphocytes T au site de la tumeur par
production d’un gradient de chimiokines (en brun)
(3), et le ciblage des mécanismes
d’immunosuppression au site de la tumeur (4)
sont autant de facteurs à considérer pour une vaccination thérapeutique
efficace. |
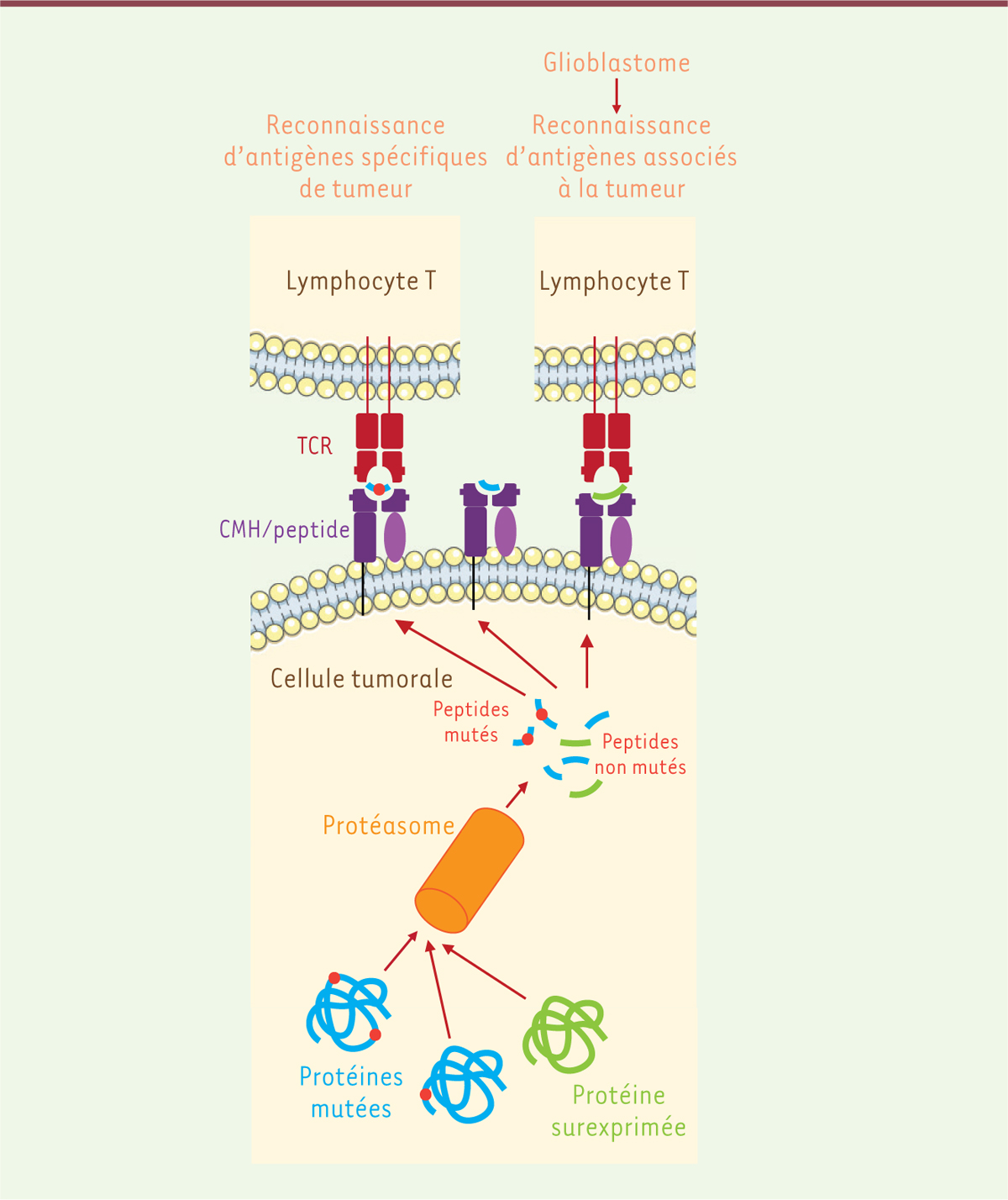
| Figure 2. Antigènes spécifiques et antigènes surexprimés par les
tumeurs. Une cellule tumorale exprime deux types
d’antigènes : des protéines contenant une mutation (en bleu) et des
protéines ne contenant pas de mutation, mais qui sont surexprimées (en
vert). Ces protéines vont être dégradées par le protéasome en peptides,
contenant ou pas une mutation. La probabilité qu’un des peptides contenant
une mutation (point rouge) soit présent à la surface de la cellule tumorale
sous forme d’un peptide associé au complexe majeur d’histocompatibilité
(CMH), constituant ainsi un épitope T, est très faible. Le lymphocyte T
pourra reconnaître soit un peptide contenant une mutation (à gauche) soit un
peptide non muté (à droite). Dans le cas du glioblastome, le taux de
mutations étant très faible, des épitopes contenant un peptide muté ne
seront que très rarement générés. Il sera donc nécessaire d’utiliser, pour
la vaccination, des antigènes surexprimés par les cellules tumorales mais
qui ne sont pas spécifiques de ces cellules. TCR : récepteur des cellules T
(T cell receptor). |
À ces caractéristiques observées dans la grande majorité des cancers, s’ajoute une difficulté supplémentaire dans le cas du glioblastome : la localisation de la tumeur dans le cerveau, qui produit naturellement des molécules immunosuppressives. La migration des lymphocytes T dans le cerveau est également moins efficace que dans d’autres sites. Enfin, le glioblastome est une tumeur comportant peu de mutations géniques, donc produisant peu de néoantigènes. L’utilisation, pour la vaccination, d’antigènes surexprimés par la tumeur mais exprimés également par des tissus sains comporte donc le risque d’induire une destruction de ces derniers [4]. À ce jour, même si les vaccins thérapeutiques utilisant des antigènes surexprimés n’ont pas provoqué de phénomènes d’auto-immunité, il reste à déterminer si cela est dû à l’inefficacité de l’approche actuellement utilisée et si l’on doit craindre de telles réactions lorsque l’on saura vacciner les patients de manière robuste. Malgré ces limitations, des résultats encourageants ont été obtenus ces dernières années dans le domaine de la vaccination thérapeutique du glioblastome, en utilisant des antigènes spécifiques ou surexprimés par la tumeur sous forme de peptides (vaccins peptidiques), ou en utilisant la tumeur elle-même (vaccins tumoraux).