| |
| Med Sci (Paris). 36(4): 322–326. doi: 10.1051/medsci/2020051.Une imagerie métabolique des cancers primitifs du foie
fondée sur leur addiction à la choline prédit leur oncogénotype et ouvre
une piste thérapeutique Angélique Gougelet1* and Sabine Colnot1** 1Équipe « Rôles oncogéniques de la signalisation par la
b-caténine dans le foie », labellisée par la Ligue nationale contre le
cancer, Centre de recherche des Cordeliers, Inserm, Sorbonne Université,
Université de Paris, UMRS1138, 15 rue de l’École de médecine,
75006Paris,
France MeSH keywords: Animaux, Carcinome hépatocellulaire, Choline, Imagerie diagnostique, Mutation gain de fonction, Génotype, Humains, Tumeurs du foie, Voies et réseaux métaboliques, Thérapie moléculaire ciblée, Pronostic, Voie de signalisation Wnt, bêta-Caténine, diagnostic, génétique, métabolisme, thérapie, analyse, méthodes, tendances |
Vers une imagerie métabolique des tumeurs cancéreuses L’imagerie des tumeurs malignes par tomographie par émission de positons (TEP)
utilise une propriété essentielle des cellules cancéreuses : leur métabolisme
modifié afin d’acquérir une autonomie énergétique. Suite à l’injection d’un
métabolite radio-marqué, la tumeur primaire et ses métastases éventuelles sont
visualisées par l’incorporation accrue de ce métabolite dans les cellules tumorales
par rapport aux cellules saines adjacentes [1] (→).
(→) Voir le Forum de J.L. Coatrieux et al.,
m/s n° 12, décembre 2010, page 1103
L’utilisation de cette technique d’imagerie dans le cancer a fait suite aux travaux
réalisés par Otto Warburg dans les années 1930, qui avait montré « l’addiction » des
tumeurs au glucose qu’elles utilisent comme substrat énergétique (Figure 1). La TEP a ainsi permis de
visualiser bon nombre de tumeurs par leur addiction au fluorodésoxyglucose
radio-marqué au fluor 18F (FDG). Les dernières décennies ont vu s’affiner
cette notion d’addiction métabolique, ce qui a conduit à proposer divers substrats
énergétiques pouvant être utilisés pour l’imagerie, traduisant la diversité
métabolique des tumeurs cancéreuses [2] (→).
(→) Voir la Synthèse de M. Cordier-Bussat et al.,
m/s n° 8-9, août-septembre 2018, page 701
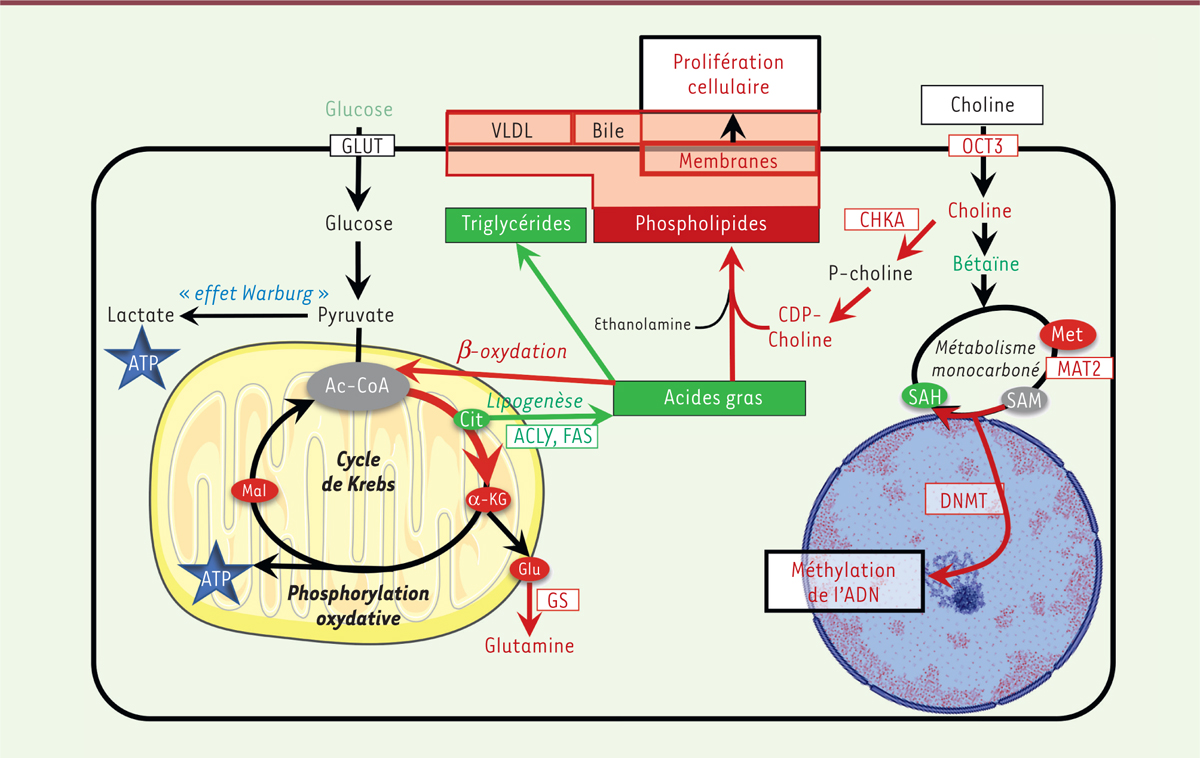
 | Figure 1. Métabolisme de l’hépatocyte présentant une activation de la
signalisation
b-caténine. L’augmentation de la
quantité des métabolites et des ARN messagers des enzymes clés des voies
métaboliques concernées par l’activation de la signalisation β-caténine
est indiquée en rouge, tandis qu’une diminution est indiquée en vert. La
glycolyse (à gauche sur la figure) n’est pas réorientée vers la
production de lactate (effet Warburg), mais vers une production accrue
de glutamine. La lipogenèse est diminuée, alors que la β-oxydation des
acides gras constitue la source énergétique principale. Enfin, une
captation accrue de choline alimentaire par le transporteur OCT3
permet : (1) la synthèse accrue de phospholipides, constituant de la
bile, des VLDL, et surtout des membranes cellulaires, favorisant ainsi
la prolifération cellulaire ; (2) son oxydation en bétaïne et son rôle
de pourvoyeur de groupements méthyle, en favorisant le métabolisme
monocarboné et la méthylation de l’ADN. OCT3, organic cation
transporter 3 ; CHKA, choline kinase a ;
CDP-choline, cytidine-diphosphate-choline ; Met,
méthionine ; SAM/SAH,
S-adénosylméthionine/S-adénosylhomocystéine ;
MAT2, méthionine adénosyltransférase 2 ; DNMT,
DNA methyltransferase ; GLUT, glucose
transporter ; Cit, citrate ;
a-KG, a-kétoglutarate ; Glu,
glutamate ; ACLY, ATP citrate
lyase ; FAS, fatty acid synthase. |
C’est ainsi qu’une nouvelle imagerie métabolique s’est récemment développée. Elle
permet certes de diagnostiquer la présence de tumeurs, mais le choix du traceur
radioactif vise maintenant à les stratifier, afin de proposer au patient un
traitement personnalisé adapté au tissu d’origine de la tumeur, ainsi qu’à ses
caractéristiques métaboliques, morphologiques et génétiques. |
Le cas du carcinome hépatocellulaire Le carcinome hépatocellulaire (CHC) est le cancer primitif du foie le plus fréquent,
survenant le plus souvent dans un foie cirrhotique associé à une hépatite chronique
sous-jacente liée aux infections par les virus de l’hépatite B ou C, à l’alcoolisme,
ou à l’obésité et au diabète. Dans le CHC, un certain nombre de mutations génétiques
ont été identifiées, et un tiers d’entre elles activent la voie de signalisation
Wnt/β-caténine. Cette voie, essentielle pour le développement embryonnaire et
l’homéostasie des cellules souches adultes, joue un rôle physiologique particulier
dans le foie. Elle y contrôle la régionalisation de ses fonctions métaboliques en
contrôlant la transcription des enzymes et des transporteurs qui les assurent. Dans
le CHC, la TEP utilisant le FDG (TEP-FDG) n’est pas la méthode de choix,
puisqu’environ 30 % des CHC ne présentent pas d’accroissement d’importation du FDG.
Aussi, les tumeurs du foie sont diagnostiquées en première intention par
échographie, dont la sensibilité (< 80 %) n’est cependant pas optimale. Une
imagerie par tomodensitométrie aux rayons X (scanner) ou par résonance magnétique
nucléaire (IRM) est souvent requise pour confirmer le diagnostic évoqué par
l’échographie. Ces examens permettent aussi de repérer des nodules additionnels et
d’éventuelles extensions de la tumeur à d’autres organes (ganglions lymphatiques,
os, poumon, glande surrénale, péritoine). Plus récemment, l’imagerie morphologique a
été complétée par des techniques d’imagerie fonctionnelle : IRM de diffusion, IRM ou
scanner avec agent de contraste hépato-spécifique, et enfin TEP, avec ses
limitations. Dans le CHC, le glucose n’est pas le seul substrat énergétique utilisé par les
cellules tumorales, qui peuvent également utiliser les acides gras, la glutamine, ou
la choline [3, 4] (Figure 1). C’est pour cette raison
qu’une TEP utilisant la 18F-choline (TEP-FCh), qui permet une
visualisation des tumeurs les plus différenciées, a été proposée par nos
collaborateurs comme alternative à la TEP-FDG dès 2010 [5] (Figure
2). La choline, initialement classée dans la famille des
vitamines B, est un nutriment essentiel apporté principalement par l’alimentation et
capté de manière active par le foie. Elle entre dans la composition de certains
phospholipides des membranes cellulaires et est, par ailleurs, à l’origine de la
voie de la bétaïne, pourvoyeur de groupements méthyle pour la méthylation de l’ADN
notamment. Dans le foie, les phospholipides sont également un constituant majeur des
VLDL (very low density lipoproteins) permettant l’exportation des
lipides et de la bile, participant ainsi à la sécrétion des acides biliaires.
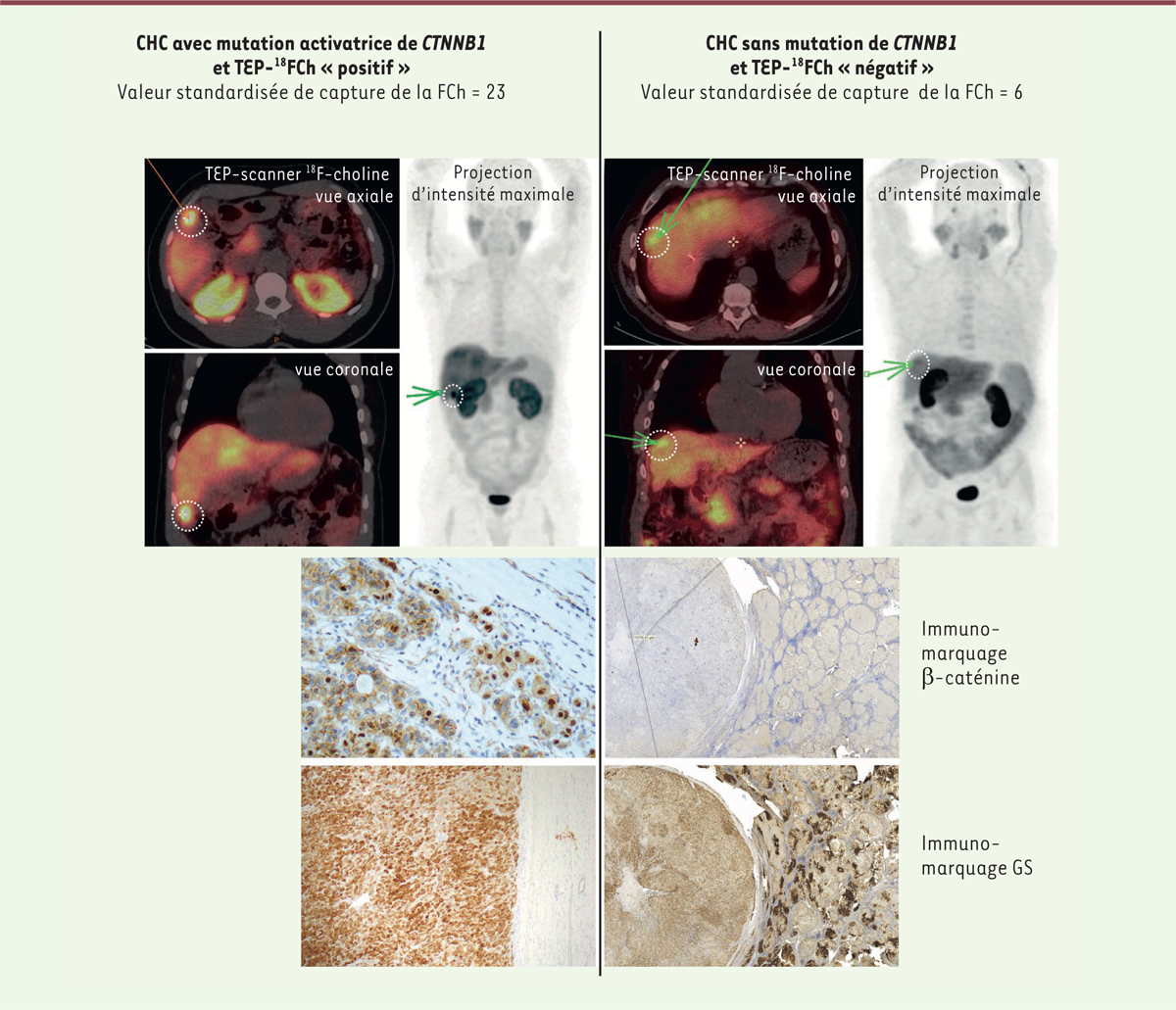
 | Figure 2.Tomodensitométrie associée à une TEP 18F-choline chez deux
patients porteurs de CHC. Le premier CHC (à
gauche), qui présente une captation accrue de 18FCh mesurée
par sa SUV ( standardized uptake value) (valeur de
capture standardisée) maximale, a été caractérisé par immunohistochimie
pour son statut quant à l’expression de la β-caténine. La détection de
la β-caténine dans le cytoplasme et le noyau des cellules tumorales,
mais pas dans les cellules du foie non tumoral adjacent, indique
l’activation de la voie de signalisation Wnt/β-caténine dans les
cellules tumorales. Cette activation est confirmée par l’abondance, dans
ces cellules, de la glutamine synthétase (GS), qui est une cible
transcriptionnelle de la β-caténine, permettant le diagnostic in
situ de cette classe de tumeur. A l’inverse, le deuxième
CHC (à droite) ne présente ni captation accrue de la 18FCh,
ni activation de la voie β-caténine. La détection de la glutamine
synthétase dans le foie non-tumoral adjacent correspond aux zones
péricentrales, dans lesquelles il existe une activation physiologique de
la signalisation β-caténine (figure adaptée de [ 9]). |
|
Addiction à la choline du CHC présentant des mutations activatrices du gène de la
b-caténine Notre équipe s’est intéressée à l’addiction à la choline d’un sous-groupe de CHC dont
les cellules tumorales sont porteuses d’une mutation du gène de la β-caténine
(CTNNB1) induisant une activation aberrante de cette voie de
signalisation. Par un crible « métabolomique » et un séquençage des ARN et des
produits d’immunoprécipitation de la chromatine obtenus avec un anticorps
anti-β-caténine, réalisés dans un modèle murin préclinique mimant ce sous-type de
CHC (ApcΔHep) [6-8], nous avons
observé une induction massive du métabolisme de la choline associée à une
accumulation de phospholipides et une captation accrue de choline alimentaire [9] (Figure
1). Des études de flux réalisées sur des hépatocytes
pré-tumoraux et sur des tumeurs isolées à partir de ces souris modèles ont confirmé
que la captation accrue de choline radiomarquée par les hépatocytes
ApcΔHep entraîne une synthèse exacerbée de phospholipides contenant
de la choline, et fournit des groupements méthyle contribuant à l’hyperméthylation
de l’ADN tumoral. L’addiction à la choline regroupe ainsi les caractéristiques
principales des cellules cancéreuses hépatiques présentant une hyperactivation de la
voie β-caténine : hyperméthylation de l’ADN, prolifération, et absence de
stéatose. Cette captation accrue de la choline permet également une imagerie du carcinome
hépatocellulaire par TEP-FCh chez l’homme (Figure 2). Nous avons analysé de manière rétrospective deux
groupes de patients atteints de CHC, chez lesquels une double imagerie de la tumeur
par TEP-FDG et TEP-FCh avait été réalisée, et avons annoté le statut mutationnel des
49 tumeurs analysées. La fixation accrue de FCh par les CHC présentant une mutation
de CTNNB1 a permis de discriminer, par TEP-FCh, ces tumeurs de
celles dépourvues d’une telle mutation, majoritairement indétectables avec cette
technique, alors que la TEP-FDG n’était pas discriminante. Nous avons ainsi démontré
la valeur de la TEP-FCh pour prédire un oncogénotype
« CTNNB1-muté » dans le CHC. Les résultats de notre étude
confirment et complètent d’autres résultats publiés la même année, révélant
l’association entre détection par TEP-FCh, transcriptome tumoral, et survie des
patients [10]. Dans cette
étude, l’avidité des CHC pour la FCh était associée à un pronostic favorable de
tumeurs caractérisées par la présence de mutations dans des gènes impliqués dans la
phosphorylation oxydative et dans le métabolisme des acides gras, des acides
biliaires, des xénobiotiques, et du peroxysome. En ce sens, nous avons également
montré que l’oxydation des acides gras était fortement augmentée dans le foie des
souris ApcΔHep, ce qui contribue à l’absence de stéatose hépatique
observée chez ces souris et dans ce sous-type de CHC chez les patients. De plus, en
l’absence du récepteur activé par les proliférateurs de peroxysomes
(peroxisome proliferator-activated receptor a, PPARα), la
progression des tumeurs des souris ApcΔHep est réduite, démontrant ainsi
la dépendance énergétique aux acides gras des CHC mutés dans CTNNB1
[3]. Ce sous-type de CHC est un exemple de
tumeurs qui ne suivent pas le modèle historique de Warburg. Notre étude a apporté la première démonstration en cancérologie qu’une imagerie peu
invasive de la tumeur peut prédire son génotype et fournir un outil diagnostique
informatif de l’évènement mutationnel à l’origine du développement tumoral. Elle est
complémentaire d’une étude similaire portant sur le gliome, qui a montré une
imagerie TEP-FCh différentielle des gliomes présentant une délétion 1p/19q ou une
mutation du gène codant l’isocitrate déshydrogénase [11]. Ainsi, l’utilisation de différents
traceurs pour la TEP permettrait d’élargir le champ des possibilités diagnostiques
pour de nombreux cancers (prostate, poumon, foie, etc.). |
Réduire l’apport alimentaire en choline : une piste thérapeutique pour le CHC
présentant une mutation activatrice du gène de la b-caténine ? Au-delà de la mise en évidence de l’intérêt diagnostique de la TEP-FCh, notre étude
montre également que l’absence de choline dans l’alimentation modifie la
reprogrammation épigénétique des hépatocytes ApcΔHep précancéreux en
réduisant le niveau de méthylation de leur ADN, limitant ainsi la prolifération de
ces cellules à des stades précoces du processus tumorigénique [9]. De plus, la privation en choline alimentaire freine la
progression des tumeurs ApcΔHep constituées, ce qui ouvre la voie à une
stratégie d’intervention thérapeutique au carrefour du métabolisme et de
l’épigénétique. Chez les patients porteurs de CHC présentant une mutation
activatrice de CTNNB1, il est difficile d’envisager une restriction
sévère prolongée en choline alimentaire étant donné son caractère essentiel, mais
l’effet d’un régime alimentaire appauvri en choline sur la progression de la tumeur
mériterait cependant d’être étudié. Par ailleurs, l’utilisation d’inhibiteurs
pharmacologiques de la choline kinase α (CHKA), qui phosphoryle la choline au cours
de la première étape de la synthèse des phospholipides, fait actuellement l’objet
d’essais cliniques de Phase I en cancérologie, en sachant que l’utilisation
thérapeutique de tels inhibiteurs ne pourrait pas empêcher les effets de la choline
sur la méthylation de l’ADN des cellules tumorales. |
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
1.
Coatrieux
JL
,
Velut
J
,
Dillenseger
JL
, et al.
De l’imagerie médicale à la thérapie guidée par
l’image . Med Sci (Paris).
2010; ; 26 :
:1103.–1109. 2.
Cordier-Bussat
M
,
Thibert
C
,
Sujobert
P
, et al.
Même l’effet Warburg est oxydable : coopération métabolique et
développement tumoral . Med Sci (Paris).
2018; ; 34 :
:701.–708. 3.
Senni
N
,
Savall
M
,
Cabrerizo Granados
D
, et al.
b-catenin-activated hepatocellular carcinomas are addicted to
fatty acids . Gut.
2019; ; 68 :
:322.–334. 4.
Yuneva
MO
,
Fan
TW
,
Allen
TD
, et al.
The metabolic profile of tumors depends on both the responsible
genetic lesion and tissue type . Cell Metab.
2012; ; 15 :
:157.–170. 5.
Talbot
JN
,
Fartoux
L
,
Balogova
S
, et al.
Detection of hepatocellular carcinoma with PET/CT: a prospective
comparison of 18F-fluorocholine and 18F-FDG in patients with cirrhosis or
chronic liver disease . J Nucl Med.
2010; ; 51 :
:1699.–1706. 6.
Colnot
S
,
Decaens
T
,
Niwa-Kawakita
M
, et al.
Liver-targeted disruption of Apc in mice activates b-catenin
signaling and leads to hepatocellular carcinomas .
Proc Natl Acad Sci USA.
2004; ; 101 :
:17216.–17221. 7.
Gougelet
A
,
Sartor
C
,
Bachelot
L
, et al.
Antitumour activity of an inhibitor of miR-34a in liver cancer
with b-catenin-mutations . Gut.
2016; ; 65 :
:1024.–1034. 8.
Gougelet
A
,
Torre
C
,
Veber
P
, et al.
T-cell factor 4 and b-catenin chromatin occupancies pattern zonal
liver metabolism in mice . Hepatology.
2014; ; 59 :
:2344.–2357. 9.
Gougelet
A
,
Sartor
C
,
Senni
N
, et al.
Hepatocellular carcinomas with mutational activation of b-catenin
require choline and can be detected by positron emission
tomography . Gastroenterology.
2019; ; 157 :
:807.–822. 10.
Kwee
SA
,
Tiirikainen
M
,
Sato
MM
, et al.
Transcriptomics associates molecular features with
18F-fluorocholine PET/CT imaging phenotype and its potential
relationship to survival in hepatocellular carcinoma .
Cancer Res.
2019; ; 79 :
:1696.–1704. 11.
Garcia Vicente
AM
,
Perez-Beteta
J
,
Amo-Salas
M
, et al.
18F-Fluorocholine PET/CT in the prediction of
molecular subtypes and prognosis for gliomas . Clin
Nucl Med.
2019; ; 44 :
:e548.–e558. |