| |
| Med Sci (Paris). 36(4): 341–347. doi: 10.1051/medsci/2020060.Origine et nature de la réponse immunitaire
neutralisante contre le facteur VIII thérapeutique Mélissa Bou Jaoudeh,1 Sandrine Delignat,1 Aditi Varthaman,1 and Sébastien Lacroix-Desmazes1* 1Centre de recherche des Cordeliers, Inserm, Sorbonne
Université, Université de Paris, F-75006, Paris, France |

L’avènement des protéines thérapeutiques a révolutionné le traitement d’un grand nombre
de maladies humaines : des déficits congénitaux, tels que l’hémophilie et la maladie de
Willebrand, aux maladies inflammatoires chroniques ou auto-immunes (polyarthrite
rhumatoïde, sclérose en plaques, diabète de type 1), en passant par les infections
virales et les cancers. Le problème majeur lié à leur utilisation réside dans leur
immunogénicité, c’est-à-dire leur capacité à déclencher une réponse immunitaire
génératrice d’anticorps anti-protéine thérapeutique, dits anti-drug
antibodies (ADA), qui peuvent neutraliser le potentiel thérapeutique de la
protéine administrée. Ainsi, de nombreuses protéines thérapeutiques utilisées
actuellement, telles que l’érythropoïétine, l’insuline, l’interleukine 2 et plusieurs
anticorps monoclonaux, présentent une immunogénicité qui se révèle potentiellement
délétère. Cette revue, consacrée au facteur VIII thérapeutique utilisé chez les patients
hémophiles A, a pour objectif de revisiter la notion selon laquelle une réponse ADA
résulte d’une reconnaissance aberrante de la protéine thérapeutique par le système
immunitaire. |
L’hémophilie A (HA) est une maladie hémorragique rare de transmission récessive, liée
au chromosome X. Elle est caractérisée par un défaut qualitatif et/ou quantitatif en
facteur VIII (FVIII) pro-coagulant1. Les
patients atteints d’HA présentent un large spectre d’anomalies génétiques qui se
manifestent de manières variées sur le plan phénotypique. Selon la mutation
génétique dont ils sont atteints, trois degrés de sévérité, corrélés à l’activité
pro-coagulante résiduelle de FVIII détectée dans le plasma, peuvent être distingués.
Ainsi, l’hémophilie est dite sévère lorsque l’activité du FVIII plasmatique est
indétectable (moins de 1 % de l’activité normale), modérée quand elle est comprise
entre 1 et 5 %, et mineure lorsqu’elle est comprise entre 5 et 40 %. Les patients HA
sévères peuvent en outre être discriminés selon qu’ils expriment une forme
dysfonctionnelle du FVIII, ou qu’ils n’expriment aucune molécule FVIII circulante
(appelée FVIII:Ag). Ces notions sont importantes du point de vue immunologique car,
selon que le FVIII:Ag est présent ou non dans le sang, le risque de développer une
réponse adaptative du système immunitaire contre le FVIII thérapeutique exogène est
plus ou moins élevé. Aujourd’hui, la prévention ou le traitement des épisodes hémorragiques repose sur
l’administration, par voie intraveineuse, de concentrés de FVIII thérapeutiques
exogènes. Ces molécules sont obtenues soit par extraction à partir de pools de
plasma de donneurs sains (dérivés plasmatiques), soit par bio-ingénierie génétique
(produits recombinants). Les concentrés de FVIII plasmatiques et recombinants
présentent des différences qualitatives selon leur structure, leur profil de
glycosylation, leur capacité de liaison au facteur de Willebrand (VWF), la protéine
chaperonne du FVIII. Néanmoins, quelle que soit leur origine, ils partagent tous la
capacité d’induire une réponse « anticorps » avec la production d’immunoglobulines G
(IgG) neutralisantes, que l’on appelle « inhibiteurs du FVIII », chez 5 à 30 % des
patients. La survenue de ces inhibiteurs du FVIII rend les patients réfractaires au
traitement, ce qui entraîne une dégradation de leur qualité de vie ainsi qu’une
complication de leur prise en charge clinique. Plusieurs facteurs de risque ont été
proposés pour expliquer l’apparition des inhibiteurs du FVIII, en particulier des
facteurs de risques génétiques, tels que des antécédents familiaux, le type
d’anomalie génétique causant l’HA et la sévérité de la maladie qui en découle, les
haplotypes HLA-DR (human leukocyte antigen-DR) et les
polymorphismes de certains gènes liés à l’immunité et à l’inflammation qu’ils
présentent. Il est à ce jour toutefois impossible de prédire avec certitude si un
patient donné développera ou non des inhibiteurs du FVIII. |
Réponse immunitaire contre le FVIII La réponse immunitaire contre le FVIII thérapeutique est considérée comme une réponse
immunitaire classique semblable à celle que l’on observe pour un antigène exogène
[1]. Administré par voie
intraveineuse, une partie du FVIII s’accumule dans les organes lymphoïdes
secondaires, notamment la rate. Ceci a été mis en évidence dans un modèle d’HA
sévère : les souris déficientes en FVIII (FVIII-KO) traitées avec du FVIII exogène.
Le FVIII est ensuite internalisé par des cellules présentatrices d’antigènes (CPA)
et est présenté aux lymphocytes T (LT) CD4+ naïfs mais spécifiques du
FVIII. Après avoir reçu un signal d’activation adéquat, les CPA activent alors ces
LT qui, à leur tour, stimulent des lymphocytes B (LB) spécifiques du FVIII qui se
différencient en LB mémoires et en plasmocytes sécréteurs d’anticorps
anti-FVIII. Bien que les étapes effectrices de la réponse immunitaire dirigée contre le FVIII
soient désormais connues, les causes de l’initiation de cette réponse restent encore
à élucider. Ceci est important afin de comprendre pourquoi 5 à 30 % des patients
développent une telle réponse anti-FVIII neutralisante à la suite d’une
administration de FVIII thérapeutique, alors que 70 à 95 % des patients restants ne
développeront pas de réponse. Au cours des 20 dernières années, une grande partie de la recherche consacrée à
comprendre les mécanismes associés à l’immunogénicité du FVIII s’est fondée sur la
« théorie du danger » proposée par Polly Matzinger. Selon cette théorie, les CPA ne
s’activent et ne deviennent matures que si elles reçoivent des « signaux de
danger ». Examinons donc les données cliniques et expérimentales disponibles
concernant les potentielles sources de signaux de danger adjuvants de la réponse
immunitaire anti-FVIII chez ces patients : saignements aigus/chroniques,
traumatismes, chirurgie, infections ou vaccinations. |
Facteurs de risques potentiellement impliqués dans l’initiation de la réponse
immunitaire contre le FVIII thérapeutique La dose administrée La dose de FVIII administrée est l’un des rares paramètres qui a été associé de
façon consistante au développement d’une réponse immunitaire anti-FVIII. Des
travaux réalisés sur des souris FVIII-KO ont clairement démontré que l’intensité
de la réponse immunitaire était directement corrélée à la dose de facteur
injecté par voie intraveineuse. Ces données expérimentales ont été confirmées
par l’étude RODIN qui montre que l’intensité du traitement FVIII et la dose
moyenne de FVIII administrée sont corrélées à l’incidence du développement
d’inhibiteurs chez les patients atteints d’HA sévère (activité du FVIII
< 0,01 UI/mL ou < 1 % de l’activité dans le plasma normal).
L’administration quotidienne de fortes doses de FVIII aux patients ayant
développé des inhibiteurs (un protocole appelé « induction de tolérance
immunitaire » ou ITI) permet néanmoins l’éradication des inhibiteurs du FVIII
chez deux tiers des patients, ce qui suggère que la relation entre la dose de
FVIII administrée et son immunogénicité n’est pas linéaire et que ce seul
paramètre de dose n’est pas suffisant pour expliquer l’immunogénicité du
FVIII. Immunogénicité intrinsèque du FVIII Comme proposé dans la « théorie du danger », une réponse immunitaire ne survient
que si les CPA sont activées par des signaux de danger via des
récepteurs qui appartiennent à la famille des PRR ( pattern recognition
receptors), dont les Toll-like receptors (TLR),
des récepteurs de l’immunité innée spécifiques d’antigènes microbiens (ou PAMP,
pour pathogen-associated molecular pattern) ou de molécules
produites à la suite de stress cellulaires (ou DAMP, pour damage
associated molecular pattern). Il a été proposé que la molécule
FVIII pouvait être elle-même à l’origine de ces signaux de danger.
L’immunogénicité intrinsèque du FVIII a ainsi été suggérée par sa capacité à
conférer à d’autres molécules, immunologiquement inertes, une immunogénicité.
Par exemple, l’injection à des souris FVIII-KO du premier domaine de
l’hémagglutinine (HA1) fusionné à la chaîne légère du FVIII 2 augmente considérablement la réponse immunitaire
anti-hémagglutinine [ 2].
Toutefois, le FVIII ne peut être considéré lui-même comme un signal de danger
puisqu’il est incapable d’activer l’un des TLR, le TLR-2 [ 3], et n’induit pas la maturation de
cellules dendritiques humaines immatures in vitro [ 4]. Des travaux ont, par ailleurs, suggéré que le FVIII, dont le rôle dans la cascade
de la coagulation est d’induire une explosion de génération de thrombine,
permettrait l’activation indirecte des récepteurs activés par les protéases
(proteinase-activated receptors, PAR), via
la thrombine alors produite en excès, récepteurs qui, à leur tour, induiraient
la libération de cytokines et de chimiokines pro-inflammatoires [5]. Ces données ont cependant été
contredites par des études plus récentes utilisant un mutant de FVIII, portant
la mutation V634M qui génère une protéine inactive. Le mutant V634M, non-actif,
présente une activité immunogène similaire à celle du FVIII sauvage chez les
souris FVIII-KO : la génération de thrombine induite par le FVIII comme signal
de danger, n’apparaît donc pas suffisante pour justifier de l’immunogénicité du
FVIII [6]. Des résultats
similaires ont également été obtenus dans des expériences où l’activation de la
voie extrinsèque de la coagulation avait été altérée [7]. L’incapacité du FVIII à activer directement ou indirectement le système
immunitaire suggère donc qu’il n’est pas impliqué dans la génération des signaux
de danger à l’origine de la réponse immunitaire primaire nécessaire à la
formation des anticorps. Statut inflammatoire des patients Les infections, les actes chirurgicaux ou les vaccinations qui peuvent être
concomitants à l’injection du FVIII thérapeutique chez les patients ont souvent
été évoqués comme des évènements susceptibles de générer des signaux de danger
capables d’activer la réponse immunitaire contre le FVIII. Cependant, des
expériences récentes démontrent que l’exposition de souris FVIII-KO au vaccin
vivant atténué contre la rougeole, les oreillons et la rubéole, au moment de
l’administration du FVIII, n’a aucune influence sur l’incidence ou l’intensité
de la réponse immunitaire anti-FVIII [ 8]. Ces données expérimentales ont été confirmées par des
observations cliniques rétrospectives (registre PEDNET) montrant que la
vaccination pédiatrique réalisée de façon concomitante à l’injection du FVIII
thérapeutique n’est pas associée à une incidence accrue d’allo-immunisation
contre le FVIII [ 9]. L’influence de l’inflammation sur la réponse immunitaire anti-FVIII a également
été examinée. Chez la souris FVIII-KO, une inflammation chronique, provoquée par
une hémorragie récurrente [10] ou par une hémarthrose aiguë induite par une blessure [11], n’augmente pas la
réponse immunitaire contre du FVIII exogène administré. Ces observations
obtenues dans un modèle pré-clinique trouvent, encore une fois, un écho chez les
patients atteints d’HA, mais de manière indirecte. En effet, l’administration de
FVIII thérapeutique à distance d’évènements à l’origine d’une réponse
inflammatoire (vaccinations, infections virales ou bactériennes, chirurgie) à
des patients HA n’ayant jamais été exposés auparavant au FVIII
(previously untreated patients, ou PUPs) est associée à une
incidence d’inhibiteurs du FVIII de l’ordre de 40 %3 [12,
13]. Ainsi, la grande majorité des études effectuées au cours des dix dernières années
n’a pas permis d’identifier d’évènements particuliers, source de l’induction de
signaux de danger, dont le contrôle préviendrait ou réduirait l’intensité de la
réponse immunitaire contre le FVIII thérapeutique. Il est donc possible que ces
signaux de danger ne soient pas si importants pour le déclenchement de la
réponse anti-FVIII, et que le niveau d’activation basal du système immunitaire
soit, lui, suffisant pour permettre la stimulation de LT naïfs spécifiques du
FVIII, à condition toutefois qu’une quantité suffisante de FVIII soit prise en
charge par les CPA, internalisée et présentée aux LT. |
La reconnaissance du soi : le péché originel du système immunitaire Les lymphocytes B et T subissent, respectivement dans la moelle osseuse et le thymus,
des processus de sélection positive et négative. Cette sélection garantit la
fonctionnalité des lymphocytes émergents et de leurs récepteurs de l’antigène
respectifs, BCR (B cell receptor) et TCR (T cell
receptor). Lors de cette sélection, les lymphocytes présentant une
auto-réactivité importante sont éliminés et les lymphocytes peu auto-réactifs sont
retenus. Dans le cas des LT, les cellules ayant une affinité intermédiaire pour des
antigènes du soi (auto-antigènes) peuvent se différencier en LT régulateurs (Treg)
dits naturels. Ces cellules inhiberont les LT auto-réactifs ayant échappé à la
sélection négative [14]. La
reconnaissance du soi est donc le fondement même de la sélection des lymphocytes qui
peuplent l’organisme. Elle fait partie de l’homéostasie du système immunitaire et
peut être considérée comme le péché originel du système immunitaire. Ceci est
notamment vrai pour la reconnaissance du FVIII par les cellules de l’immunité
adaptative. |
Reconnaissance du FVIII endogène par les lymphocytes T en conditions
physiologiques La présence de LT CD4+ anti-FVIII dans le sang d’individus sains a été
suggérée par la capacité de ces cellules à proliférer in vitro en
présence de FVIII ou de peptides couvrant les différents domaines de la molécule
[15,16]. Les LT CD4+ spécifiques
du FVIII ont été récemment quantifiés avec précision chez des individus sains par le
groupe de Bernard Maillère (CEA, Saclay) : la fréquence de cellules spécifiques du
FVIII chez un individu sain est de 2 cellules par million de LT CD4+
[17] ; cette proportion
est proche de celle des cellules spécifiques de protéines exogènes, telles que
l’ovalbumine ou l’hémocyanine (respectivement 1,3 et 20 cellules/million de cellules
T CD4+) [18].
Elle est en revanche 10 fois plus élevée que celle des LT spécifiques de protéines
thérapeutiques immunogènes comme l’adalimumab, le rituximab, l’infliximab ou
l’érythropoïétine (0,1 à 1 cellule/million de cellules T CD4+) [18,19]. Ces données suggèrent l’existence d’une sélection négative
inefficace des LT qui reconnaissent le FVIII endogène, et cela malgré l’expression
d’ARN messagers codant le FVIII par les cellules épithéliales thymiques médullaires
qui expriment cet autoantigène [20]. La moitié des LT CD4+ anti-FVIII détectés dans le sang des individus sains
ont un phénotype de cellules mémoires [17].
Ceci suggère l’existence d’une réponse immunitaire contre le FVIII endogène chez les
individus en conditions physiologiques, mais aussi une régulation concomitante
destinée à éviter une auto-réactivité qui pourrait être délétère. La présence
simultanée de lymphocytes Treg et de LT réactifs au FVIII avait été suggérée dans
deux études indépendantes, même si la spécificité des Treg pour le FVIII n’avait pas
été démontrée [21,22]. |
Reconnaissance du FVIII endogène par les immunoglobulines en conditions
physiologiques La présence d’IgG naturelles (ne provenant pas d’une immunisation délibérée)
anti-FVIII dans le sang de donneurs sains a été décrite pour la première fois par le
groupe de Michel Kazatchkine [23]. Le groupe de Birgit Reipert a récemment confirmé la présence de ces
anticorps chez environ 19 % des donneurs sains, des anticorps majoritairement
d’isotypes IgG1, IgG3 et IgA, et présentant de faibles affinités de liaison au
FVIII, avec des constantes d’affinité à l’équilibre de l’ordre du nanomolaire [24,25]. La reconnaissance physiologique du FVIII
endogène par les immunoglobulines est associée à une régulation qui implique des
anticorps anti-idiotypiques [26,27],
rappelant ainsi la situation des lymphocytes T anti-FVIII : les anticorps
anti-idiotypiques protecteurs « naturels » sont produits spontanément chez les
individus sains et contrôlent les IgG « naturelles » anti-FVIII potentiellement
neutralisantes. Le FVIII endogène n’est donc pas ignoré par le système immunitaire en conditions
physiologiques. Au contraire, l’homéostasie de la reconnaissance du FVIII par un
système immunitaire sain repose sur un équilibre entre une réaction immunitaire
contre le FVIII impliquant les lymphocytes T et B spécifiques du FVIII, ainsi que
les anticorps anti-FVIII, et une réponse tolérogène qui s’y oppose, qui repose sur
les lymphocytes Treg et les anticorps anti-idiotypiques. |
Reconnaissance du FVIII exogène thérapeutique chez les patients HA Chez 5 à 30 % des patients atteints d’HA, l’administration intraveineuse de FVIII
exogène entraîne une réponse immunitaire dirigée contre le FVIII thérapeutique qui
se traduit par la production d’IgG anti-FVIII neutralisantes. Plusieurs facteurs de
risque permettent d’expliquer le développement des inhibiteurs du FVIII. Le type
d’anomalie génétique responsable de l’HA, et plus précisément la présence ou non de
la protéine endogène FVIII:Ag dans la circulation, est le facteur de risque le mieux
démontré. Les patients HA sévères, et particulièrement ceux n’exprimant aucun
FVIII:Ag circulant, présentent la plus forte incidence de développement
d’inhibiteurs [28]. À
l’inverse, les patients ayant des mutations faux-sens et produisant un FVIII
anormal, présentent un plus faible risque de développer des inhibiteurs du FVIII.
Cette corrélation illustre l’importance du degré d’éducation, soit centrale, dans le
thymus, soit en périphérie, du système immunitaire des patients envers le FVIII
endogène : plus le FVIII endogène ressemble au FVIII exogène administré, plus le
risque de développer une réponse immunitaire neutralisante est faible. |
Existe-t-il une tolérance immunitaire contre le FVIII exogène chez les patients
HA ? Environ la moitié des anticorps inhibiteurs du FVIII qui sont produits chez les
patients atteints d’HA sont de faible titre (≤ 5 unités Bethesda4 par ml). Ils n’ont pas d’incidence clinique et disparaissent
généralement spontanément. Selon l’étude SIPPET, 27 % des patients développent des
inhibiteurs transitoires dans les premiers mois suivant la première exposition au
FVIII thérapeutique [29].
Ce phénomène traduit la mise en œuvre d’une réponse immunitaire anti-FVIII
neutralisante qui ne devient pas pathogène et est rapidement contrôlée. Des IgG
anti-FVIII, non-neutralisantes, sont présentes chez les patients ne présentant pas
d’inhibiteurs et chez les patients ayant été traités par ITI après la survenue
d’inhibiteurs [24]. Bien que le risque de développement d’inhibiteurs chez les patients atteints d’HA
sévère soit plus élevé au cours des 20 premiers jours cumulés d’exposition (2-3
premières années de vie) [30], l’incidence des inhibiteurs du FVIII présente un pic à un âge
avancé [31]. Incidemment,
le grand âge est caractérisé par un affaiblissement des mécanismes de tolérance
immunitaire et le risque de développer des manifestations auto-immunes s’accroît
[32]. La survenue de ce
pic d’apparition des inhibiteurs à un moment où la tolérance immunitaire décline
suggère indirectement l’existence d’une tolérance immunitaire active chez les
patients multi-transfusés avec du FVIII thérapeutique n’ayant jamais développé
d’inhibiteurs. L’ITI permet d’éradiquer la production d’inhibiteurs du FVIII chez 60 à 70 % des
patients qui en produisent. Bien que l’induction d’une tolérance immunitaire active
au FVIII pendant l’ITI n’ait jamais été formellement démontrée, la disparition des
inhibiteurs et le rétablissement d’une pharmacocinétique normale du FVIII sont
associés chez certains patients à la persistance des LT spécifiques du FVIII [33], d’IgG anti-FVIII et à
l’induction concomitante d’anticorps anti-idiotypiques bloquants [34]. La disparition d’inhibiteurs
détectables dans le plasma lors de l’ITI ne repose donc pas simplement sur
l’élimination des cellules et des anticorps spécifiques du FVIII. Collectivement, ces observations suggèrent l’existence d’un équilibre entre les
cellules ou les molécules spécifiques du FVIII exogène et les éléments régulateurs
de la réponse immunitaire ; cela rappelle les mécanismes de maintien de
l’homéostasie immunitaire vis-à-vis du FVIII endogène qui sont mis en œuvre dans des
conditions physiologiques. |
Importance de la réponse anti-inflammatoire La comparaison de polymorphismes génétiques portés par des patients ayant ou n’ayant
pas développé d’inhibiteurs du FVIII suite à son administration a révélé l’existence
d’associations entre la survenue d’inhibiteurs et certains polymorphismes de
promoteurs de gènes codant des cytokines, le TNF-a (tumor necrosis factor
alpha), l’IL(interleukine)-10, et un point de contrôle immunitaire,
CTLA-4 (cytotoxic T-lymphocyte-associated protein 4). Nous avons
également décrit une corrélation entre un polymorphisme (répétitions GT) du
promoteur du gène hmox1, codant l’enzyme anti-inflammatoire
heme-oxygenase 1 (HO-1), et le développement d’inhibiteurs chez
les patients HA sévères [35]. Plus récemment, Matino et al. ont démontré que, après
stimulation in vitro par du CpG, les cellules dendritiques de
patients ayant développé des inhibiteurs du FVIII sont moins susceptibles d’exprimer
l’indoléamine 2,3 dioxygénase 1 (IDO1), une enzyme impliquée dans le renforcement
des fonctions régulatrices des LT [36]. Ces résultats suggèrent que la capacité de l’organisme des patients
à activer une machinerie anti-inflammatoire et/ou des voies régulatrices joue un
rôle clef dans leur capacité à contrôler la réponse immunitaire dirigée contre le
FVIII thérapeutique. |
Survenue d’inhibiteurs anti-FVIII : réponse immunitaire exacerbée ou tolérance
immunitaire avortée Les travaux réalisés ces 15 dernières années ont cherché à expliquer les raisons pour
lesquelles 5 à 30 % des patients atteints d’HA développent une réponse immunitaire
neutralisant le FVIII thérapeutique, alors que 70 à 95 % de ces patients ne
répondent pas au FVIII. La nature des signaux de danger, qui jouent le rôle
d’adjuvant de la réponse naïve anti-FVIII, a également été examinée. Chez l’individu
sain, le FVIII endogène n’est pas « ignoré » par le système immunitaire en
conditions physiologiques, mais il est bel et bien reconnu. Le maintien de
l’homéostasie de la réponse anti-FVIII repose sur un équilibre entre une
reconnaissance potentiellement pathogène (inhibitrice) et un contrôle actif de cette
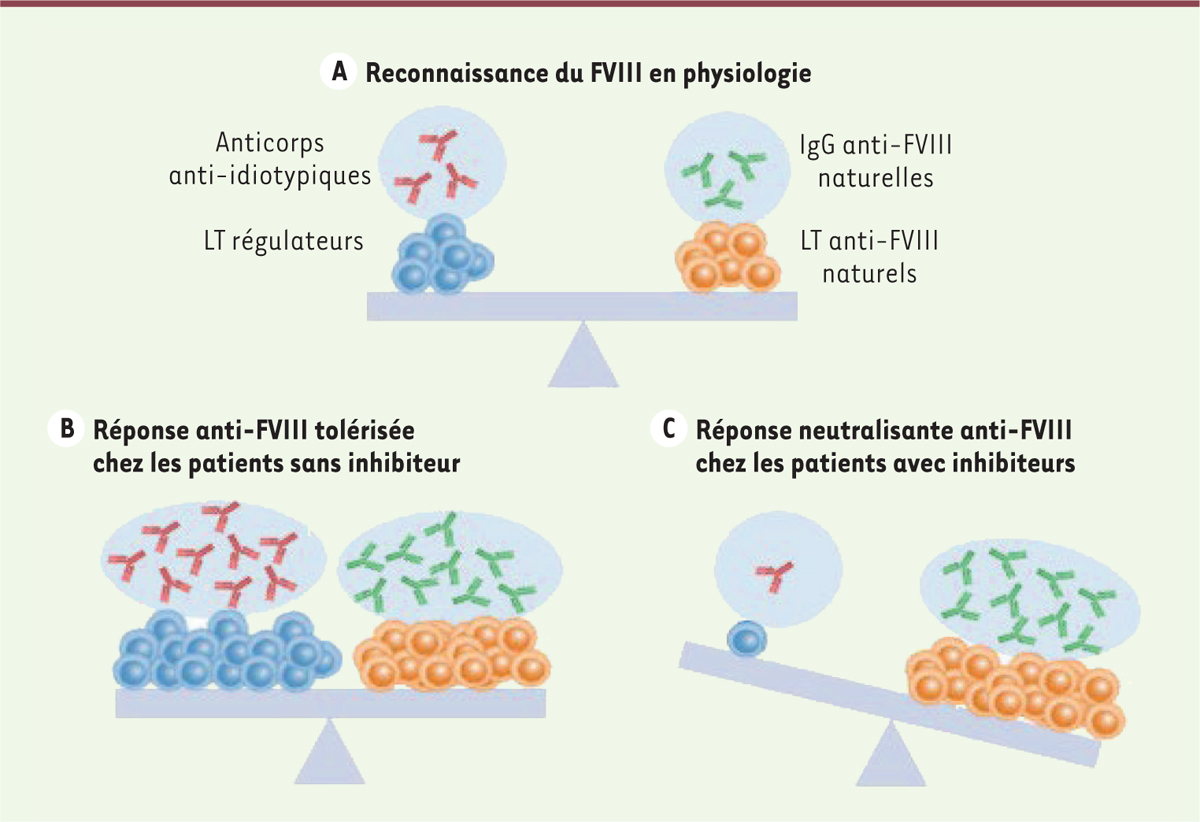
reconnaissance (Figure 1A).
Les IgG anti-FVIII sont détectables chez un bon nombre de patients atteints d’HA.
Des anticorps inhibiteurs sont détectés de manière transitoire chez un grand nombre
de patients après leur première exposition au FVIII thérapeutique. Ces inhibiteurs
du FVIII peuvent apparaître à un âge où les mécanismes de régulation immunitaire
sont compromis. L’apparition d’inhibiteurs du FVIII est, de plus, associée à une
capacité réduite de l’organisme à activer les mécanismes
anti-inflammatoires/tolérogènes qui reposent sur HO-1 ou IDO1.
 | Figure 1. Réponses immunitaires dirigées contre le FVIII endogène ou
exogène. A. Reconnaissance du FVIII en
physiologie. L’homéostasie de la réponse anti-FVIII
en conditions physiologiques repose sur un équilibre entre une
reconnaissance immunitaire du FVIII endogène par les lymphocytes T (LT)
spécifiques et des immunoglobulines (Ig) G anti-FVIII naturelles
autoréactives, et une régulation impliquant des LT régulateurs et des
anticorps anti-idiotypiques B. Réponse anti-FVIII
tolérisée chez les patients hémophiles A sans
inhibiteur. Nous proposons que tous les patients
développent une réponse immunitaire anti-FVIII après administration de
FVIII thérapeutique. Cette réponse potentiellement neutralisante est
contrôlée par une tolérance immunitaire active. C. Réponse
neutralisante anti-FVIII chez les patients hémophiles A avec
inhibiteurs. L’organisme de 5 à 30 % des
patients ne parvient pas à développer une réponse anti-inflammatoire
et/ou immunitaire tolérogène capable de contrebalancer la réponse
neutralisante initiée par l’administration de FVIII thérapeutique. |
Sur la base de ces observations, nous proposons l’hypothèse selon laquelle tous les
patients hémophiles A traités avec du FVIII thérapeutique développent une réponse
immunitaire anti-FVIII. Dans le cas des patients qui ne développent pas de réponse
neutralisante, le FVIII thérapeutique n’est pas « ignoré » par le système
immunitaire ; il est reconnu et évalué « immunologiquement » comme tout antigène
exogène (Figure 1B). Un
corollaire de cette hypothèse est qu’il n’existe pas de signaux de dangers
spécifiques de la réponse anti-FVIII neutralisante : la maturation des CPA
conduisant à l’activation de LT naïfs spécifiques du FVIII thérapeutique est permise
par un système immunitaire dynamique confronté à un environnement en constante
évolution. Dans ce contexte, nous ne pensons pas que l’apparition d’anticorps
neutralisant le FVIII résulte de l’activation exacerbée du système immunitaire au
moment de l’administration du FVIII. Au contraire, nous proposons que l’apparition
d’anticorps neutralisant le FVIII résulte de l’incapacité de l’organisme des
patients à développer une réponse anti-inflammatoire et/ou immunitaire tolérogène
spécifique du FVIII qui contrebalancerait la réponse neutralisante déclenchée
(Figure 1C). Un tel changement de perspective devrait avoir des répercussions sur la prise en
charge clinique des patients. Par exemple, chez les patients développant une réponse
avec inhibiteurs, l’utilisation d’immunosuppresseurs [37,38] favorisant la mise en place de réponses tolérogènes devrait
être privilégiée à celle de médicaments qui suppriment simplement la réponse
adaptative. Il devrait également encourager à élaborer des stratégies
d’immuno-interventions destinées à établir une tolérance immunitaire spécifique du
FVIII. Reste à déterminer si un tel changement de paradigme est aussi valable pour
les réponses immunitaires neutralisantes qui se développent contre d’autres
protéines thérapeutiques, telles que les anticorps monoclonaux ou les protéines
thérapeutiques n’ayant pas d’équivalent endogène. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Ce travail a bénéficié du soutien de l’Inserm et du CNRS, de financements
ANR-18-CE17-0010-02 et H2020-MSCA-ITN-2019 (number 859974). MBJ bénéficie d’une
allocation de recherche de Sorbonne Université (École doctorale ED394).
|
Footnotes |
1.
Lacroix-Desmazes
S
,
Navarrete
A-M
,
André
S
, et al.
Dynamics of factor VIII interactions determine its immunologic
fate in hemophilia A . Blood.
2008; ; 112 :
:240.–249. 2.
Ing
M
,
Gupta
N
,
Teyssandier
M
, et al.
Immunogenicity of long-lasting recombinant factor VIII
products . Cell Immunol.
2016; ; 301 :
:40.–48. 3.
Teyssandier
M
,
André
S
,
Gupta
N
, et al.
Therapeutic factor VIII does not trigger TLR1.2 and TLR2.6
signalling in vitro . Haemophilia.
2013; ; 19 :
:399.–402. 4.
Pfistershammer
K
,
Stöckl
J
,
Siekmann
J
, et al.
Recombinant factor VIII and factor VIII-von Willebrand factor
complex do not present danger signals for human dendritic
cells . Thromb Haemost.
2006; ; 96 :
:309.–316. 5.
Skupsky
J
,
Zhang
A-H
,
Su
Y
, et al.
A role for thrombin in the initiation of the immune response to
therapeutic factor VIII . Blood.
2009; ; 114 :
:4741.–4748. 6.
Meeks
SL
,
Cox
CL
,
Healey
JF
, et al.
A major determinant of the immunogenicity of factor VIII in a
murine model is independent of its procoagulant function .
Blood.
2012; ; 120 :
:2512.–2520. 7.
Gangadharan
B
,
Delignat
S
,
Ollivier
V
, et al.
Role of coagulation-associated processes on factor VIII
immunogenicity in a mouse model of severe hemophilia A .
J Thromb Haemost.
2014; ; 12 :
:2065.–2069. 8.
Lai
JD
,
Moorehead
PC
,
Sponagle
K
, et al.
Concurrent influenza vaccination reduces anti-FVIII antibody
responses in hemophilia A mice via chemotactic antigen
competition . Blood.
2016; ; 127 :
:3439.–3449. 9.
Platokouki
H
,
Fischer
K
,
Gouw
SC
, et al.
Vaccinations are not associated with inhibitor development in
boys with severe haemophilia A . Haemophilia.
2018; ; 24 :
:283.–290. 10.
Dimitrov
JD
,
Dasgupta
S
,
Navarrete
A-M
, et al.
Induction of heme oxygenase-1 in factor VIII-deficient mice
reduces the immune response to therapeutic factor VIII .
Blood.
2010; ; 115 :
:2682.–2685. 11.
Peyron
I
,
Dimitrov
JD
,
Delignat
S
, et al.
Haemarthrosis and arthropathy do not favour the development of
factor VIII inhibitors in severe haemophilia A mice .
Haemoph Off J World Fed Hemoph.
2015; ; 21 :
:e94.–e98. 12.
Kurnik
K
,
Bidlingmaier
C
,
Engl
W
, et al.
New early prophylaxis regimen that avoids immunological danger
signals can reduce FVIII inhibitor development .
Haemophilia.
2010; ; 16 :
:256.–262. 13.
Auerswald
G
,
Bidlingmaier
C
,
Kurnik
K
. Early prophylaxis/FVIII tolerization regimen that
avoids immunological danger signals is still effective in minimizing FVIII
inhibitor developments in previously untreated patients - long-term
follow-up and continuing experience .
Haemophilia.
2012; ; 18 :
:e18.–e20. 14.
Sakaguchi
S
,
Vignali
DAA
,
Rudensky
AY
, et al.
The plasticity and stability of regulatory T
cells . Nat Rev Immunol.
2013; ; 13 :
:461.–467. 15.
Hu
G-L
,
Okita
DK
,
Diethelm-Okita
BM
, et al.
Recognition of coagulation factor VIII by CD4+ T cells
of healthy humans . J Thromb Haemost.
2003; ; 1 :
:2159.–2166. 16.
Reding
MT
,
Wu
H
,
Krampf
M
, et al.
Sensitization of CD4+ T cells to coagulation factor
VIII: response in congenital and acquired hemophilia patients and in healthy
subjects . Thromb Haemost.
2000; ; 84 :
:643.–652. 17.
Meunier
S
,
Menier
C
,
Marcon
E
, et al.
CD4 T cells specific for factor VIII are present at high
frequency in healthy donors and comprise naïve and memory
cells . Blood Adv.
2017; ; 1 :
:1842.–1847. 18.
Delluc
S
,
Ravot
G
,
Maillere
B
. Quantitative analysis of the CD4 T-cell
repertoire specific to therapeutic antibodies in healthy
donors . FASEB J.
2011; ; 25 :
:2040.–2048. 19.
Delluc
S
,
Ravot
G
,
Maillere
B
. Quantification of the preexisting CD4 T-cell
repertoire specific for human erythropoietin reveals its immunogenicity
potential . Blood.
2010; ; 116 :
:4542.–4545. 20.
Pinto
S
,
Michel
C
,
Schmidt-Glenewinkel
H
, et al.
Overlapping gene coexpression patterns in human medullary thymic
epithelial cells generate self-antigen diversity .
Proc Natl Acad Sci U S A.
2013; ; 110 :
:E3497.–E3505. 21.
Hu
GL
,
Okita
DK
,
Diethelm-Okita
BM
, et al.
Recognition of coagulation factor VIII by CD4+ T cells
of healthy humans . J Thromb Haemost.
2003; ; 1 :
:2159.–2166. 22.
Kamaté
C
,
Lenting
PJ
,
Van Den Berg
HM
, et al.
Depletion of CD4+ /CD25high regulatory T
cells may enhance or uncover factor VIII-specific T-cell responses in
healthy individuals . J Thromb Haemost.
2007; ; 5 :
:611.–613. 23.
Algiman
M
,
Dietrich
G
,
Nydegger
UE
, et al.
Natural antibodies to factor VIII (anti-hemophilic factor) in
healthy individuals . Proc Natl Acad Sci USA.
1992; ; 89 :
:3795.–3799. 24.
Whelan
SFJ
,
Hofbauer
CJ
,
Horling
FM
, et al.
Distinct characteristics of antibody responses against factor
VIII in healthy individuals and in different cohorts of hemophilia A
patients . Blood.
2013; ; 121 :
:1039.–1048. 25.
Hofbauer
CJ
,
Whelan
SFJ
,
Hirschler
M
, et al.
Affinity of FVIII-specific antibodies reveals major differences
between neutralizing and nonneutralizing antibodies in
humans . Blood.
2015; ; 125 :
:1180.–1188. 26.
Gilles
JG
,
Saint-Remy
JM
. Healthy subjects produce both anti-factor VIII
and specific anti-idiotypic antibodies . J Clin
Invest.
1994; ; 94 :
:1496.–1505. 27.
Sakurai
Y
,
Shima
M
,
Tanaka
I
, et al.
Association of anti-idiotypic antibodies with immune tolerance
induction for the treatment of hemophilia A with inhibitors .
Haematologica.
2004; ; 89 :
:696.–703. 28.
Oldenburg
J
,
El-Maarri
O
,
Schwaab
R
. Inhibitor development in correlation to factor
VIII genotypes . Haemophilia.
2002; ; 8 :
:23.–29. 29.
Peyvandi
F
,
Mannucci
PM
,
Garagiola
I
, et al.
A randomized trial of factor VIII and neutralizing antibodies in
hemophilia A . N Engl J Med.
2016; ; 374 :
:2054.–2064. 30.
Gouw
SC
,
van der Bom
JG
. Marijke van den Berg H. Treatment-related risk
factors of inhibitor development in previously untreated patients with
hemophilia A: the CANAL cohort study . Blood.
2007; ; 109 :
:4648.–4654. 31.
Hay
CRM
,
Palmer
B
,
Chalmers
E
, et al.
Incidence of factor VIII inhibitors throughout life in severe
hemophilia A in the United Kingdom . Blood.
2011; ; 117 :
:6367.–6370. 32.
Jagger
AT
,
Shimojima
Y
,
Goronzy
JJ
, et al.
T regulatory cells and the immune aging process .
Gerontology.
2014; ; 60 :
:130.–137. 33.
Pautard
B
D’oiron
R, Li
Thiao
Te V, et al.
Successful immune tolerance induction by FVIII in hemophilia A
patients with inhibitor may occur without deletion of FVIII-specific T
cells . J. Thromb Haemost.
2011; ; 9 :
:1163.–1170. 34.
Gilles
JG
,
Desqueper
B
,
Lenk
H
, et al.
Neutralizing antiidiotypic antibodies to factor VIII inhibitors
after desensitization in patients with hemophilia A .
J Clin Invest.
1996; ; 97 :
:1382.–1388. 35.
Repesse
Y
,
Peyron
I
,
Dimitrov
JD
, et al.
Development of inhibitory antibodies to therapeutic factor VIII
in severe hemophilia A is associated with microsatellite polymorphisms in
the HMOX1 promoter . Haematologica.
2013; ; 98 :
:1650.–1655. 36.
Matino
D
,
Gargaro
M
,
Santagostino
E
, et al.
IDO1 suppresses inhibitor development in hemophilia A treated
with factor VIII . J Clin Invest.
2015; ; 125 :
:3766.–3781. 37.
Moghimi
B
,
Sack
BK
,
Nayak
S
, et al.
Induction of tolerance to factor VIII by transient
co-administration with rapamycin . J Thromb
Haemost.
2011; ; 9 :
:1524.–1533. 38.
Hassan
S
,
Fijnvandraat
K
,
van der Bom
JG
, et al.
Preventing or eradicating factor VIII antibody formation in
patients with hemophilia A: what can we learn from other
disorders? . Semin Thromb Hemost.
2018; ; 44 :
:531.–543. |