| |
| Med Sci (Paris). 36(4): 358–366. doi: 10.1051/medsci/2020081.CRISP(R)ation musculaire Océane Ballouhey,1 Marc Bartoli,1 and Nicolas Levy1,2,3* 1Aix Marseille Univ, Inserm, MMG, U1251,
13005Marseille,
France 2AP-HM Département de Génétique Médicale, Hôpital d’Enfants
de la Timone, Marseille, 13005France 3GIPTIS, Genetics Institute for Patients Therapies
Innovation and Science, 13002Marseille,
France |

Vignette (Photo © Christophe Praud-Inserm/INRA). Le muscle squelettique représente environ 40 % de la masse corporelle d’un individu
[1]. L’intégrité de ce tissu
dynamique et plastique dépend de l’équilibre établi entre la synthèse et la dégradation
des protéines qui le composent. Des facteurs, tels que la nutrition, l’équilibre
hormonal, l’activité physique, le stress, mais aussi de nombreuses mutations géniques
fragilisent l’homéostasie du muscle. Il existe plus de 800 pathologies monogéniques associées à une dégénérescence et une
dysfonction du muscle. Parmi celles-ci, les dystrophies musculaires sont un ensemble de
pathologies musculaires rares caractérisées par une faiblesse et une dégénérescence
progressive du muscle : les fibres musculaires dégénèrent, les muscles s’atrophient
progressivement et une faiblesse musculaire s’installe [2]. Ces pathologies apparaissent à tout âge :
rarement dès la naissance, mais le plus souvent durant l’enfance ou l’adolescence, ou
encore à l’âge adulte. Ce sont des maladies d’origine génétique causées par la mutation
d’un ou de plusieurs gènes impliqués dans les fonctions musculaires, tels que
DMD (codant la dystrophine) impliqué dans la dystrophie musculaire
de Duchenne (DMD), la dystrophie musculaire la plus connue et la plus fréquente,
CAPN3 (codant la calpaïne 3) impliqué dans les dystrophies
musculaires des ceintures, LGMD R1 et LGMD D4 (limb girdle muscular dystrophy
type R1 and D4), ou encore DYSF (codant la dysferline)
impliqué dans les dysferlinopathies (LGMD R2 et myopathie de Miyoshi). Il n’existe pas de traitement curatif pour les dystrophies musculaires. Cependant,
l’identification des gènes responsables de chaque type de dystrophie musculaire et la
compréhension des mécanismes qui la sous-tendent, ont permis des avancées considérables
sur le plan du développement d’approches thérapeutiques. Parmi ces dernières, les
principales voies explorées sont le saut d’exon utilisant des oligonucléotides antisens
(AON), la trans-lecture de codons stop fondée sur des molécules pharmacologiques
(gentamycine, TRANSLARNA® ou ataluren) ou encore la thérapie génique par transfert de
gène corrigé [3]. L’enjeu de ces
stratégies thérapeutiques est d’atteindre les cellules satellites musculaires, cellules
souches adultes du muscle strié squelettique logeant le long des myofibres, puisque les
principales cellules qui composent le muscle sont des cellules post-mitotiques. La
réparation/régénération du muscle est donc assurée par les cellules satellites. Dans le
but de mettre en place une thérapie à long terme, il est nécessaire de cibler ces
cellules, surtout lorsque le traitement est initié très tôt chez les enfants en pleine
croissance. Ces dernières années, un outil d’édition génomique a permis des avancées majeures dans
les approches thérapeutiques pour les dystrophies musculaires, et semble extrêmement
prometteur pour devenir un outil de premier plan dans l’arsenal thérapeutique pour les
maladies génétiques. Ce système CRISPR-Cas9 permet une édition stable et permanente du
génome, et doit permettre d’éviter les traitements longs et répétitifs. Les stratégies
d’utilisation de cet outil d’édition génomique sont variées. Dans cette revue, nous
aborderons les dernières avancées thérapeutiques utilisant le système CRISPR-Cas9 dans
le cadre des dystrophies musculaires d’origine génétique. |
Des outils d’édition génomique existent depuis les années 1970 [53]. Ils permettent de modifier
précisément une séquence génomique. Les principaux sont les nucléases à doigts de
zinc (zinc finger nucleases, ZFN), les méganucléases, les nucléases
effectrices de type activateur de transcription (transcription
activator-like effector nucleases, TALEN) ou encore, identifié plus
récemment, le système CRISPR (clustered regularly interspaced short
palindromic repeats)-Cas9 (CRISPR-associated
protein 9) [4]. Ce
dernier a permis des avancées considérables grâce à sa rapidité d’exécution, à sa
facilité d’utilisation, et à son efficacité démontrée dans des modèles cellulaires
et vivants utilisés en laboratoire. CRISPR-Cas9 est composé d’une enzyme, Cas9, et
d’un ARN guide synthétique (ARNg) qui forment ensemble un complexe
ribonucléoprotéique [5].
L’enzyme Cas9 chargée avec l’ARN guide reconnaît une séquence complémentaire située
à côté d’une séquence spécifique de 3 à 5 nucléotides (séquence PAM,
protospacer adjacent motif). Lorsque le complexe Cas9-ARNg
reconnaît un site cible, il déclenche la dénaturation locale de l’ADN et l’invasion
dans l’ADN du brin d’ARN pour assurer le clivage de la double hélice d’ADN. La
coupure double brin créée par l’enzyme Cas9 est alors réparée soit par jonction
d’extrémités non-homologues (NHEJ pour non homologous end joining),
résultant en de petites insertions et/ou délétions aléatoires (indel) sur le site de
clivage, soit par réparation fondée sur l’homologie (HDR pour
homology-directed repair), réparation dirigée qui entraîne une
modification précise du génome (Figure
1) [6]. Cependant, la précision et l’efficacité de ce système sont modulées par
un inconvénient qu’il conviendra de surmonter dans l’avenir. En effet, des éditions
génomiques sont susceptibles d’apparaître dans des sites adjacents d’une séquence
PAM et qui ne diffèrent que de quelques nucléotides par rapport à la séquence
ciblée : ces modifications sont appelées mutations hors cible
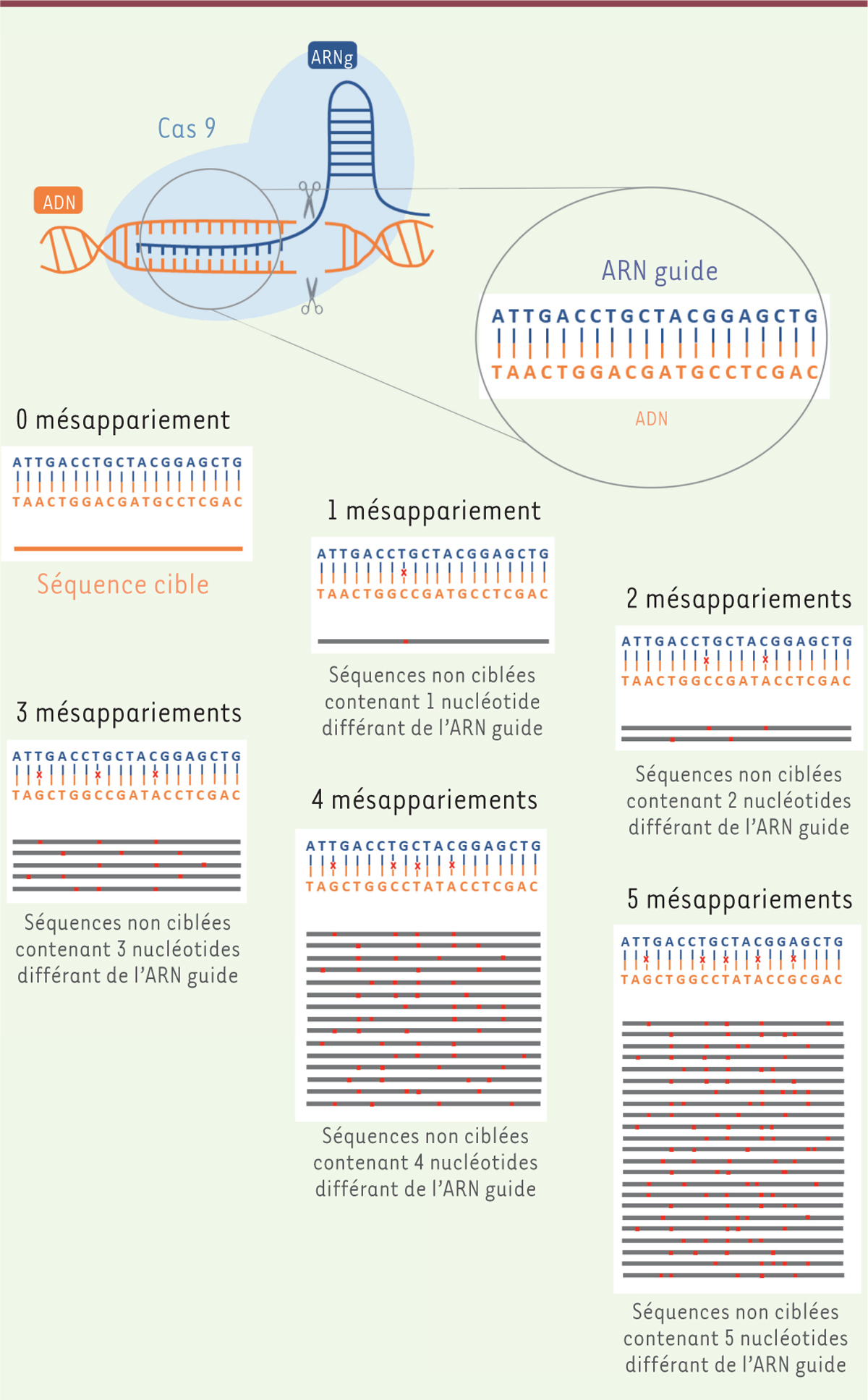
(off-target) [7,8]. Le système
CRISPR-Cas9 est ainsi capable de cliver une séquence d’ADN contenant jusqu’à 5
nucléotides qui diffèrent de l’ARN guide, ce qui est la cause de mutations hors
cible. Plus le nombre de mésappariements tolérés par l’outil d’édition génomique est
important, plus ce dernier générera des mutations hors cible (Figure 2).
 | Figure 1. Mécanismes d’action du système CRISPR-Cas9.
NHEJ : non homologous end joining ; HDR : homology directed repair. |
 | Figure 2. Le système CRISPR-Cas9 peut causer des mutations
hors cible puisqu’il est
capable de cliver une séquence d’ADN
contenant jusqu’à 5 nucléotides
différant de la séquence de
l’ARN guide. |
Ces dernières années, le système CRISPR-Cas9 a largement été utilisé dans diverses
études. Les possibilités d’utilisation de cet outil sont diverses. L’utilisation de
l’enzyme Cas9 et de deux ARN guides peut permettre de déléter un fragment d’ADN,
voire même un gène entier [9]. D’un autre côté, lorsque la réparation du clivage induit par Cas9 est
réalisée par le mécanisme NHEJ, il est possible d’altérer le cadre de lecture d’une
protéine ou un site d’épissage. Enfin, lorsque la réparation du clivage induit par
Cas9 utilise le mécanisme HDR grâce à la présence d’un ADN donneur, il est possible
d’insérer un fragment d’ADN, de modifier une séquence afin de créer une mutation, ou
encore de corriger une mutation. Ces utilisations diverses peuvent permettre la
création de modèles dans différents organismes afin de modéliser une pathologie.
Elles permettent également de neutraliser une mutation existante afin de restaurer
la production ou la fonction d’une protéine [10,11]. Pour délivrer cet outil d’édition génomique dans les organes cibles, de nombreuses
méthodes ont été utilisées. La méthode de transport la plus utilisée in
vitro est la transfection d’ADN plasmidique. In vivo,
certaines études utilisent des méthodes de transport non-viral pour acheminer le
système CRISPR-Cas9, telles que le transport hydrodynamique ou encore le transport
par nanoparticules [12-13]. Ces
stratégies de transport non-viral permettent une expression transitoire de la
protéine Cas9 et ainsi de réduire les mutations hors cible. La méthode la plus
utilisée pour transporter le système CRISPR-Cas9 in vivo reste le
transport par AAV (virus associés aux adénovirus) [14]. Ce système viral très efficace dans le
muscle et versatile est fortement utilisé en thérapie génique, malgré sa capacité
d’encapsidation assez faible. |
Création d’organismes modèles Dans le cadre des dystrophies musculaires, de nombreux modèles ont été créés en
utilisant le système CRISPR-Cas9, notamment pour la myopathie de Duchenne causée par
des mutations dans le gène DMD. Nakamura et son équipe ont ainsi
généré un rat afin de modéliser cette pathologie [15]. Pour cela, deux exons du gène
Dmd ont été ciblés dans le but de les éliminer et ainsi
empêcher la production de dystrophine. Grâce à cette modification génomique ciblée,
ce rat présente de nombreuses caractéristiques phénotypiques et mécanistiques de la
pathologie, avec notamment une diminution de la force musculaire et l’émergence de
phénotypes histologiques dégénératifs/régénératifs dans le muscle squelettique, le
cœur et le diaphragme. Il représente ainsi un excellent modèle de DMD. Plus
récemment, en 2018, deux équipes ont également utilisé le système CRISPR-Cas9 afin
d’obtenir des organismes modèles de DMD : une souris dont l’exon 50 du gène
Dmd a été délétée [16], et un lapin possédant des mutations dans l’exon 51 du même
gène [17]. Enfin, un modèle
de la myopathie a été obtenu grâce à l’outil CRISPR-Cas9 chez le singe en ciblant
les exons 4 et 46 du gène Dmd, afin d’en faire un modèle pertinent
d’évaluation des stratégies thérapeutiques [18]. D’autres modèles de dystrophies musculaires ont également été créés. Une souris
modélisant la dystrophie musculaire des ceintures de type R5 (LGMD R5) a ainsi été
obtenue par Demonbreun et ses collaborateurs [19]. Cette pathologie est causée par des
mutations dans le gène SGCG qui code la γ-sarcoglycane. Dans le but
de reproduire la mutation principale de cette dystrophie musculaire (521ΔT), les
auteurs ont utilisé le système CRISPR-Cas9 afin de déléter un nucléotide de l’exon 6
du gène Sgcg, produisant un décalage du cadre de lecture et donc
l’absence de production de la protéine. Une autre souris modélisant la myopathie
liée au récepteur RYR1 (ryanodine receptor 1) a été réalisée [20] par Brennan et ses
collaborateurs qui ont introduit une mutation ponctuelle identique à celle
identifiée chez un patient, dans un allèle du gène Ryr1, ainsi
qu’une délétion de 16 nucléotides produisant un décalage du cadre de lecture dans le
deuxième allèle. Ce modèle murin présente une réduction de la masse musculaire due à
une atrophie des myofibres, avec un impact sur la masse corporelle globale. L’outil
CRISPR-Cas9 a donc permis, ces dernières années, de modéliser plusieurs formes de
dystrophies musculaires, de façon plus précise, rapide et efficace que les approches
utilisant la réparation par homologie permettant l’inactivation d’un gène
(knock-out). |
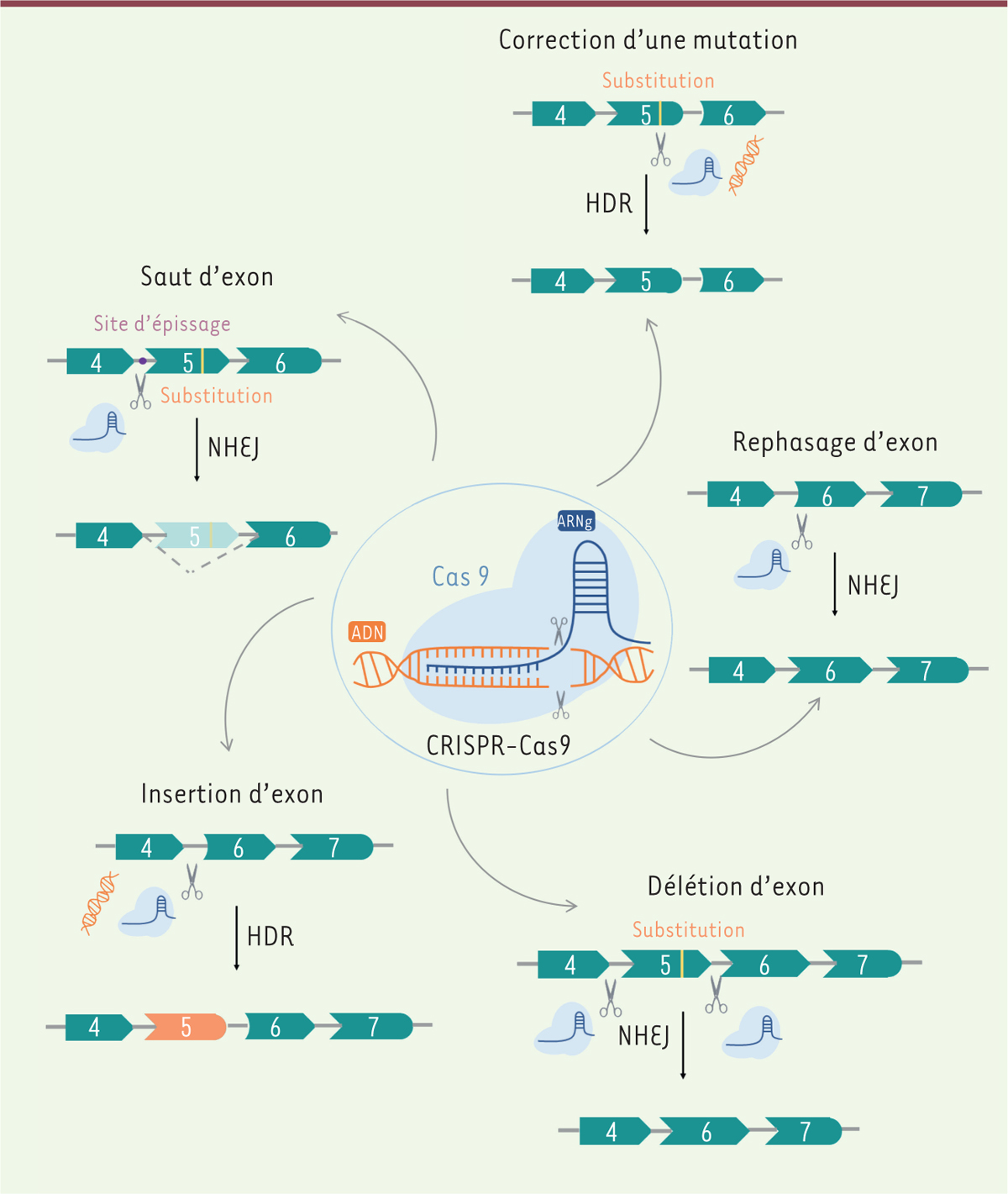
Le système CRISPR-Cas9 ne permet pas seulement de modéliser une pathologie, il rend
possible son traitement. Une des utilisations thérapeutiques du système CRISPR-Cas9
est l’altération d’un site d’épissage afin de réaliser un saut d’exon pour restaurer
le cadre de lecture permettant de produire une protéine (Figure 3). À la différence de la
thérapie par saut d’exon utilisant des oligonucléotides antisens (AON),
l’utilisation de CRISPR-Cas9 permet d’altérer un site d’épissage afin d’empêcher
l’incorporation d’un exon dans l’ARN messager (ARNm) mature par le spliceosome.
Cette approche a été largement utilisée ces dernières années, particulièrement pour
en évaluer la pertinence et l’efficacité dans la DMD. Dans ce contexte, les
chercheurs ont ciblé une région correspondant à un site fréquent de mutations du
gène DMD (exons 45 à 55). Les mutations dans cette région
provoquent un décalage du cadre de lecture, constituant ainsi un fort rationnel pour
l’exploration du saut d’exon dans cette dystrophie musculaire.
 | Figure 3. Stratégies thérapeutiques utilisant le système CRISPR-Cas9. |
Ainsi, Amoasii et son équipe ont utilisé l’outil CRISPR-Cas9 dans le but de réaliser
un saut de l’exon 51 du gène Dmd dans des modèles de mammifères
présentant une délétion de l’exon 50 : la souris ΔEx50 [16], la souris ΔEx50-Dmd-Luc [21] et le chien ΔEx50-MD [22]. La délétion de l’exon 50 du gène
Dmd provoque une altération du cadre de lecture, menant alors à
l’absence de production de la dystrophine. Le saut de l’exon 51 permet alors la
restauration du cadre de lecture et la production d’une protéine plus courte mais
fonctionnelle. Ces 3 études thérapeutiques ont conduit à des résultats
encourageants : restauration de la dystrophine dans le muscle squelettique, le
muscle cardiaque et le diaphragme. Suivant le même principe, l’équipe de Long, en 2016, a utilisé CRISPR-Cas9 chez les
souris mdx, modèle standard de DMD, qui présentent une anomalie
génétique dans l’exon 23 de la dystrophine, afin de réaliser le saut de l’exon 23 du
gène Dmd [23]. Pour cela, ils ont délivré le système CRISPR-Cas9 dans le muscle
ciblé grâce au virus AAV9. Leurs résultats indiquent une restauration de la
dystrophine dans les muscles cardiaque et squelettique, ainsi qu’une amélioration
des fonctions musculaires squelettiques (force de préhension). En 2018, Ifuku et ses
collaborateurs ont altéré le site accepteur d’épissage de l’exon 45 du gène
DMD afin de provoquer le saut du même exon dans des cellules
souches pluripotentes induites (iPS) dérivées d’un patient atteint de DMD dépourvu
de l’exon 44 du gène DMD [24]. Ceci a permis de restaurer le cadre de lecture et ainsi
l’expression de la dystrophine dans des myoblastes différenciés. Enfin, l’équipe de
Long, toujours en pointe, a utilisé des ARN guides permettant d’introduire des
petites insertions/délétions (indel) au niveau de 12 sites d’épissage dans des
lignées d’iPS de patients atteints de DMD afin de provoquer le saut des exons
correspondants, qui sont fréquemment mutés dans le gène DMD [25]. Cette étude a permis de
restaurer l’expression de la dystrophine dans les cardiomyocytes dérivés d’iPS et de
démontrer que la correction de 30 à 50 % des cardiomyocytes était suffisante pour
restaurer le phénotype cardiaque à un niveau proche de la normale. |
Thérapie par délétion d’exons L’outil CRISPR-Cas9 a également été utilisé afin de déléter un ou plusieurs exons,
dans le but de restaurer la cadre de lecture d’un gène ou de supprimer un ou
plusieurs exons contenant des mutations (Figure 3). À la différence de la thérapie par saut d’exon,
cette approche thérapeutique n’implique pas la machinerie de l’épissage. Cette
utilisation thérapeutique de CRISPR-Cas9 a été explorée dans le cadre des
dystrophies musculaires. Duchêne et ses collaborateurs ont ainsi restauré le cadre
de lecture de la dystrophine à partir de quatre biopsies musculaires de patients
atteint de DMD (chaque biopsie possédant une délétion d’un exon différent) [26]. Pour cela, ces auteurs
ont utilisé l’enzyme Cas9 et deux ARN guides ciblant chacun l’exon 47 et l’exon 58
du gène DMD afin de déléter les exons 48 à 57 et ainsi former un
exon chimérique avec la partie 5’ de l’exon 47 et la partie 3’ de l’exon 58 du gène.
Cette technique a permis de restaurer l’expression d’une forme plus courte de
dystrophine fonctionnelle dans les cellules des quatre patients. L’enzyme Cas9 et deux ARN guides ciblant les introns 22 et 23 du gène
Dmd ont par ailleurs été utilisés chez des souris
mdx [27-29]. Cette
méthode a permis d’éliminer la mutation présente dans le gène Dmd
des souris mdx grâce à la délétion de l’exon 23, et l’expression de
la dystrophine a pu être restaurée dans les myofibres, les cardiomyocytes et les
cellules souches musculaires. L’expression de la protéine a persisté durant 18 mois,
et les fonctions musculaires ont été partiellement restaurées. Dans le cadre de la dystrophie myotonique de type 1 (DM1 ou maladie de Steinert),
deux équipes ont utilisé le système CRISPR-Cas9 afin de déléter la répétition CTG,
présente dans la région 3’ du gène DMPK (dystrophia
myotonica 1) et à l’origine de la pathologie [30-31]. Lorsque ce triplet CTG est répété de 50 à plusieurs
milliers de fois, le fonctionnement des muscles est atteint, ainsi que celui
d’autres organes, selon la forme de la maladie (difficultés respiratoires, troubles
cardiaques, troubles hormonaux, etc.). Dastidar et al. ont utilisé
CRISPR-Cas9 afin d’éliminer ces répétitions CTG grâce à deux ARN guides dans des
cellules myogéniques dérivées d’iPS de patients présentant une DM1 [30]. Leur étude montre la disparition des
foyers ribonucléaires et la restauration de la localisation de MBLN1
(muscleblind like splicing regulator 1), un régulateur
d’épissage alternatif autorégulant la transcription du gène DMPK
dans les cellules myogéniques. Une étude réalisée sur des cellules musculaires
dérivées d’iPS de patients atteints de DM1, et chez une souris modélisant la DM1 (la
souris transgénique DMSXL1,) montre qu’avec
cette méthode, les foyers de ribonucléoprotéine disparaissent et que les anomalies
d’épissage dans divers transcrits sont corrigés dans les cellules musculaires
dérivées d’iPS des patients et chez la souris [31]. |
Thérapie par correction de mutations Le système CRISPR-Cas9 permet aussi de corriger des mutations grâce à la présence
d’un ADN donneur afin de restaurer l’intégralité d’un gène par HDR (Figure 3). Cette stratégie
thérapeutique a été explorée dans plusieurs dystrophies musculaires. Selvaraj et ses
collaborateurs ont, par exemple, restauré la protéine calpaïne 3, codée par le gène
CAPN3, dans des myotubes dérivés de trois lignées iPS de
patients atteints de dystrophie musculaire des ceintures de type R1 [32]. Pour cela, ils ont
utilisé l’enzyme Cas9, un ARN guide ciblant la mutation présente dans le gène
CAPN3 et un ADN donneur afin de réparer par HDR, le clivage
induit par Cas9 dans ces cellules iPS mutées. Ils ont ensuite transplanté les
progéniteurs myogéniques corrigés dans un modèle murin présentant un déficit
immunitaire et en calpaïne 3. Cette étude a révélé le potentiel de CRISPR-Cas9 pour
la thérapie génique couplée à la thérapie cellulaire. Le système CRISPR-Cas9 et un
ADN donneur ont également été utilisés par Wang et son équipe, dans le but
d’éliminer les répétitions toxiques du triplet CTG dans la région 3’ du gène
DMPK dans des lignées iPS de patients DM1. Pour cela, des
signaux de polyadénylation ont été insérés en amont des répétitions CTG afin
d’achever prématurément la transcription. Cette stratégie thérapeutique a permis
d’augmenter la précision de correction par rapport à l’approche de délétion des
répétitions CTG avec pour résultats, la réversion du phénotype dans les cellules
souches neurales, les neurones du cerveau antérieur, les cardiomyocytes et les
myofibres du muscle squelettique [33]. De nouveau dans le cadre de la DMD, plusieurs études montrent la correction des
mutations dans le gène DMD grâce au système CRISPR-Cas9 et la
présence d’un ADN donneur [34-36]. Long
et al. ont ainsi utilisé cette méthode afin de corriger la
mutation présente chez la souris mdx dans sa lignée germinale
[34]. L’édition génomique de ces souris a
conduit à la production d’animaux mosaïques présentant entre 2 et 100 % de
correction du gène Dmd, avec une restauration partielle de la
dystrophine. Une construction Cas9 muscle-spécifique, contenant l’ARN guide et une
région homologue à la dystrophine (ADN donneur), a également été utilisée pour
corriger la mutation de la souris mdx [35]. Les muscles traités expriment alors des
taux de dystrophine atteignant 70 % du taux normal, et recouvrent une force
importante après l’injection intramusculaire du système CRISPR-Cas9. Son injection
dans la circulation induit l’expression généralisée de la dystrophine dans les
muscles squelettiques et cardiaques. L’utilisation d’une construction
muscle-spécifique permet de limiter le risque de mutations hors cible dans les
cellules non-musculaires et de minimiser le déclenchement d’une réponse
immunitaire. Matre et al. ont, eux, obtenu la restauration de la dystrophine en
ciblant l’exon 23 du gène Dmd dans des progéniteurs musculaires de
souris mdx [36] avec pour
résultats encourageants, l’amélioration de la prolifération et de la différenciation
cellulaire, et la résistance des cellules au stress oxydatif et au stress du
réticulum endoplasmique. De même, en utilisant CRISPR-Cas9 et un ADN donneur afin
d’induire une réparation par homologie (HDR), Lee et al. ont réussi
à corriger la mutation du gène Dmd chez la souris
mdx [11] avec une
restauration de l’expression de la dystrophine dans les tissus musculaires. Ces
auteurs ont utilisé des nanoparticules d’or afin de transporter directement la
protéine Cas9 dans les cellules, et obtenir un clivage rapide de l’ADN et réduire
les mutations hors cible. Ces stratégies thérapeutiques, qui ont en commun l’utilisation d’un ADN donneur,
présentent des résultats prometteurs pour le traitement des dystrophies musculaires.
L’avantage de ces techniques est la restauration de la protéine entière,
contrairement à la thérapie par saut d’exon et par délétion d’exon que nous avons
décrites. L’inconvénient de cette méthode reste la limitation de la taille de l’ADN
donneur utilisable. Il n’est donc pas possible de corriger de larges délétions avec
cette technique. |
Les défis du système CRISPR Grâce aux progrès technologiques, de nombreuses études ont été menées afin d’explorer
les bénéfices thérapeutiques du système CRISPR-Cas9, notamment pour les nombreuses
dystrophies musculaires (Tableau
I). Cet outil d’édition génomique nécessite cependant de relever
plusieurs défis avec en particulier le choix de l’enzyme Cas9, dont il existe
plusieurs formes aux activités différentes (SaCas9, SpCas, dCas9, etc.), de l’ARN
guide, ou le choix de la méthode de transport [37].
Tableau I.
| Pathologie |
Modèle |
Enzyme Cas9 |
Transport |
Stratégie |
Références |
| Dystrophie musculaire de
Duchenne
(DMD) |
Souris ΔEx50 |
SpCas9 |
AAV9 (IM) |
Saut de l’exon 51 du gène
Dmd
|
[12] |
| Souris
ΔEx50-Dmd-Luc |
|
|
|
|
[17] |
| Chien ΔEx50-MD |
|
|
|
|
[18] |
| Souris mdx
|
SaCas9 |
AAV9 (IV) |
Délétion de l’exon 23 du gène
Dmd
|
|
[23] |
| AAV9 (IM) |
|
|
|
|
[24] |
| AAV8 (IM) |
|
|
|
|
[25] |
| SpCas9 |
AAV9 (IP, IM ou RO) |
Saut de l’exon 23 du gène Dmd
|
|
|
[19] |
| Nanoparticule en or (IM) |
Correction de la mutation dans le gène
Dmd grâce à un ADN donneur |
|
|
|
[8] |
| Souris mdx4c |
SpCas9 et SaCas9 |
AAV6 (IM) |
Délétion des exons 52 et 53 du gène
Dmd
|
|
[31] |
| SpCas9 |
|
|
|
|
Correction de la mutation dans l’exon 53 du gène
Dmd grâce à un ADN donneur |
| Myoblastes de patients |
SaCas9 |
Plasmide |
Délétion des exons 48 à 57 pour former un exon
hybride 47-58 du gène DMD
|
|
[22] |
| iPS de patients |
SpCas9 |
ARNm SpCas9 et ARNg |
Saut de l’exon 45 du gène DMD
|
|
[20] |
| Plasmide |
Saut des exons 6-7, 8, 43, 44, 45, 46, 50, 51, 52,
53 ou 55 du gène DMD
|
|
|
|
[21] |
| Dystrophie myotonique de type
1
(DM1) |
iPS de patients |
SpCas9 et SaCas9 |
Plasmide |
Insertion de signaux de polyadénylation en amont
des répétitions CTG du gène DMPK
|
[29] |
| SpCas9 |
Lentivirus |
Délétion de la répétition CTG du gène
DMPK
|
|
|
[26] |
| Souris DMSXL |
SaCas9 |
AAV (IM) |
Délétion de la répétition CTG du gène
DMPK
|
|
[27] |
| LGMD R1 |
iPS de patients |
SpCas9 |
Plasmide et RNP Cas9 |
Correction des mutations dans le gène
CAPN3 grâce à un ADN donneur |
[28] |
Études pré-cliniques ayant utilisé le système CRISPR-Cas9
pour traiter une
dystrophie musculaire.
|
Le choix de l’enzyme Cas9 utilisée peut apporter certains avantages. La longueur de
la séquence PAM diffère selon l’enzyme (3 nucléotides pour SpCas9, 5 nucléotides
pour SaCas9), ce qui permet une meilleure spécificité de l’enzyme pour son substrat.
Il existe également des éditeurs de base qui convertissent un nucléotide du génome.
Ce système utilise une déaminase fusionnée à l’enzyme nCas9 (Cas9 nickase) ou à
l’enzyme dCas9 (Cas9 catalytiquement déficiente). L’avantage de cette technique est
qu’elle n’induit pas de coupure de l’ADN et ne nécessite pas un ADN donneur pour la
réparation de l’ADN. Dernièrement, Ryu et son équipe ont ainsi utilisé un éditeur de
base pour substituer une guanine à une adénine, dans un modèle de souris DMD portant
une mutation non-sens dans l’exon 20 du gène Dmd [38]. L’enzyme dCas9, dépourvue
d’activité lytique, fusionnée avec des molécules effectrices, n’implique pas le
clivage de l’ADN ciblé. Cette stratégie permet d’induire l’activation ou
l’inhibition de la transcription, comme pour l’utrophine (un paralogue de la
dystrophine), candidat de choix à surexprimer pour réduire le phénotype DMD chez la
souris mdx [39]. Le transport viral du système CRISPR-Cas9 par un vecteur AAV implique plusieurs
contraintes, comme la limitation de la taille d’encapsidation du virus (4.7kb), ou
la présence d’anticorps spécifiques des différents sérotypes d’AAV préexistant chez
la majorité des adultes à la suite d’expositions naturelles (infection) aux AAV
durant l’enfance [13]. La taille
d’encapsidation du virus est une contrainte majeure et dans la plupart des cas, les
études menées sur des organismes modèles, utilisent deux transporteurs distincts :
l’un pour l’enzyme Cas9, l’autre pour les ARN guides. Or, dans une optique
thérapeutique, il est nécessaire de transporter l’enzyme Cas9 et les ARN guides dans
le même vecteur afin d’augmenter l’efficacité de transport et de ciblage. Le vecteur
AAV a également l’inconvénient de s’intégrer dans le génome de l’hôte traité, au
niveau des ruptures occasionnées par l’enzyme Cas9 [40]. Les sites d’intégration du génome viral
sont divers : région intronique (44,7 %), région intergénique (33,4 %), région
exonique (3,5 %) et région régulatrice (9,2 %) et il est important de prendre en
compte ces insertions dans les applications d’édition génomique. Il faut également
considérer un potentiel rôle oncogène de l’AAV après son intégration, dû à la
transactivation des gènes via la région ITR (inverted
terminal repeats) du virus [51] (→).
(→) Voir la Synthèse de A. Rossi et A. Salvetti, m/s n° 2,
février 2016, page 167
Le choix de la méthode de transport influence également la durée d’expression du
système CRISPR dans l’organisme, avec une corrélation avec la fréquence d’apparition
de mutations hors cible. Une étude propose une stratégie afin de limiter l’induction
de ces mutations hors cible avec l’utilisation de protéines anti-CRISPR (Acr), dont
l’activité est modulée par des microARN, qui permettent de limiter l’édition
génomique non souhaitée dans un type cellulaire ou un tissu spécifique [41]. Utilisant CRISPR-Cas9 et
l’AcrII, qui réprime le miR122 spécifique du foie, une édition génomique
spécifiquement dans le foie, et pas dans les autres tissus de l’organisme, a ainsi
été obtenue. Pour les dystrophies musculaires, l’un des défis de l’utilisation de CRISPR reste son
transport ciblé au niveau du muscle et l’expression de la protéine restaurée à long
terme [42, 43]. Les résultats thérapeutiques
précliniques obtenus montrent en effet souvent une expression de la protéine à long
terme qui se révèle plus importante dans le muscle cardiaque que dans le muscle
squelettique, ce qui s’explique par la régénération possible de ce dernier. Il est
donc nécessaire que le complexe CRISPR-Cas9 atteigne les cellules satellites
musculaires pour éviter la répétition des injections, mais pour atteindre cet
objectif, des études supplémentaires devront être entreprises. À noter, finalement, que des études très récentes réalisée chez l’homme ont révélé la
préexistence très fréquente dans le sérum, d’anticorps spécifiques de Cas9 de
bactéries particulières : SaCas9 (Staphylococcus aureus Cas9) et
SpCas9 (Streptococcus pyogenes Cas9), les orthologues les plus
courants de Cas9 [44-46]. Ces résultats importants
doivent donc être pris en considération à l’heure où les essais cliniques sont
envisagés, afin de prévenir le risque éventuel lié à cette réponse immunitaire
adaptative préexistante. Aucune étude ne démontre cependant que cette réponse
immunitaire anti-Cas9 puisse être à l’origine d’une élimination des cellules
modifiées et exprimant Cas9. L’absence d’effet de ces anticorps, qui seraient
délétères pour la thérapie et limiteraient l’utilisation future chez l’homme de
l’outil CRISPR-Cas9, nécessite d’être examinée et confirmée. |
Le système CRISPR dans la société Le système CRISPR est désormais envisagé comme outil thérapeutique pour l’homme
(Tableau II) et
plusieurs essais sont en cours d’évaluation. Aux États-Unis, la société
Editas a ainsi obtenu l’autorisation de la FDA (Food
and Drug Administration) pour effectuer un essai clinique chez des
patients atteints d’amaurose congénitale de Leber (LCA10). D’autres essais cliniques
sont également réalisés pour traiter des pathologies oncologiques, telles que le
myélome ou les sarcomes, ou des pathologies hématologiques, telles que la
drépanocytose et la b-thalassémie. Plusieurs défis restent néanmoins à relever avant
de pouvoir utiliser cet outil comme thérapie chez l’homme. La modification du génome
qu’il permet, en particulier à cause des modifications potentielles hors cible, peut
aboutir à des effets adverses qu’il est aujourd’hui difficile d’anticiper. De telles
mutations hors cible pourraient perturber l’ensemble de protéines interagissant
entre elles et constituant un réseau. Or, nombre de ces interactions protéiques sont
encore insuffisamment identifiées, et leur altération pourrait avoir des
conséquences qui restent imprévisibles à long terme.
Tableau II.
| Société / Sponsor |
Désignation |
Pathologies |
Méthode |
Phase de l’essai clinique |
| Editas |
EDIT-101 |
Amaurose congénitale de Leber (LCA10) |
Édition génomique in vivo par
délétion de la mutation IVS26 présente dans le gène
CEP290
|
Phase I/II |
| CRISPR Therapeutics et Vertex
Pharmaceuticals |
CTX001 |
Drépanocytose |
Édition génomique
ex-vivo des cellules souches
hématopoïétiques par correction des mutations dans le gène des
β-globines |
Phase I/II |
| |
|
|
|
β-thalassémie |
| Université de Pennsylvanie |
HLA-A*0201 |
Myélome |
Édition génomique
ex-vivo des lymphocytes T par inhibition de
l’expression du récepteur TCR et de PD-1 |
Phase I |
| |
|
|
|
Sarcome |
Études cliniques utilisant le système CRISPR-Cas9 pour
traiter des pathologies chez
l’homme.
|
L’utilisation biaisée et/ou non encadrée de cet outil d’édition génomique pourrait
conduire à des applications en dehors du strict champ thérapeutique et à des dérives
liées à sa capacité de modifier des traits non pathogènes. Sans aborder les dérives
eugéniques qui pourraient résulter de cet usage, la technique CRISPR-Cas9 peut être
utilisée pour modifier des caractéristiques et, par exemple, augmenter chez
l’animal, la production carnée ou en améliorer les qualités nutritionnelles. Outre
les manipulations de He en Chine sur le CCR5 (C-C chemokine receptor type
5) afin de rendre des embryons résistants à l’infection par le VIH
(virus de l’immunodéficience humaine) [54] (→), il a pu être également imaginé une
application humaine dans laquelle l’outil CRISPR-Cas9 pourrait être utilisé pour
modifier certains gènes afin de doper génétiquement des athlètes ou des militaires
[49]2. Des gènes, tels que MSTN
(myostatin), EPOR (erythropoietin receptor),
IGF1 (insulin-like growth factor 1) ou
FST (follistatin) pourraient ainsi être
ciblés : par exemple, une mutation du gène MSTN provoque une
hypertrophie musculaire [50]. Josiah Zayner, un chercheur en biophysique moléculaire et qui a
travaillé pour la NASA, a ainsi tenté en 2017 de modifier une partie de son génome
dans le but d’augmenter sa masse musculaire en s’injectant l’enzyme Cas9 et un ARN
guide ciblant le gène MSTN afin d’empêcher la production de
myostatine, qui inhibe la croissance musculaire. Cette expérience fut un échec
notoire mais elle montre que l’outil, simple d’utilisation et peu coûteux, le rend
accessible à tous scientifiques, mais aussi aux amateurs éclairés de
biologie [52]
(→).
(→) Voir la Chronique bioéthique de B. Jordan, m/s
n° 3,mars 2019, page 266
(→) Voir le Repères de M. Meyer, m/s n° 5, mai 2018,
page 473
Malgré son échec, Zayner a créé une société, The ODIN, qui
commercialise des kits permettant de réaliser de l’édition génomique à domicile,
notamment en utilisant l’outil CRISPR. Cette situation a conduit les autorités
fédérales et la FDA à rappeler que l’utilisation de CRISPR chez l’homme devait faire
l’objet d’une autorisation, et que la vente de ces kits était illégale… Face aux risques liés à de telles situations et à la rapidité de développement de
cette technologie, en termes d’efficacité, de précision, de ciblage, de
simplification et de reproductibilité, il semble donc essentiel et urgent de définir
les limites de son utilisation, ses indications, et qu’un cadre soit établi par les
autorités sanitaires. C’est une des conditions indispensables pour que la
technologie accompagne la médecine et la science et grâce à laquelle les meilleurs
bénéfices thérapeutiques seront apportés aux malades, sans risques de dérive
sociétale. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Nous tenons à remercier l’ensemble des membres du laboratoire MMG et de GIPTIS.
|
Footnotes |
1. Frontera
WR,
Ochala
J. Skeletal muscle:
a brief review of structure and function .
Calcif Tissue Int
2015; ; 96 :
:183.-95. 2. Carter
JC,
Sheehan
DW,
Prochoroff
A,
Birnkrant
DJ. Muscular
dystrophies . Clin Chest
Med
2018; ; 39 :
:377.-89. 3. Al-Zaidy
S,
Rodino-Klapac
L,
Mendell
JR. Gene therapy for
muscular dystrophy: moving the field forward .
Pediatr Neurol : 2014; ;
51 : :607.-18. 4. Gaj
T,
Gersbach
CA,
Barbas
CF. ZFN, TALEN, and
CRISPR/Cas-based methods for genome engineering .
Trends Biotechnol
2013; ; 31 :
:397.-405. 5. Nishimasu
H,
Ran
FA,
Hsu
PD, et al.
Crystal structure of Cas9 in complex with guide RNA and
target DNA . Cell
2014; ; 156 :
:935.-49. 6. Jiang
F,
Doudna
JA. CRISPR-Cas9
Structures and Mechanisms . Annu Rev
Biophys
2017; ; 46 :
:505.-29. 7. Zhang
XH,
Tee
LY,
Wang
XG, et al.
Off-target effects in CRISPR/Cas9-mediated genome
engineering . Mol Ther Nucleic
Acids
2015; ; 4 : :264.. 8. Aryal
NK,
Wasylishen
AR,
Lozano
G. CRISPR/Cas9 can
mediate high-efficiency off-target mutations in mice in
vivo . Cell Death Dis
2018; ; 9 : :1099.. 9. Neldeborg
S,
Lin
L,
Stougaard
M,
Luo
Y. Rapid and
efficient gene deletion by CRISPR/Cas9 .
Methods Mol Biol
2019; ; 1961 :
:233.-47. 10. Min
YL,
Bassel-Duby
R,
Olson
EN. CRISPR
correction of Duchenne muscular dystrophy .
Annu Rev Med
2019; ; 70 :
:239.-55. 11. Gee
P,
Xu
H,
Hotta
A. Cellular
reprogramming, genome editing, and alternative CRISPR Cas9 technologies for
precise gene therapy of Duchenne muscular dystrophy .
Stem Cells Int
2017 ; :8765154.. 12. Chen
G,
Abdeen
AA,
Wang
Y, et al.
A biodegradable nanocapsule delivers a Cas9 ribonucleoprotein
complex for in vivo genome editing . Nat
Nanotechnol
2019; ; 14 :
:974.-80. 13. Lee
K,
Conboy
M,
Park
HM, et al.
Nanoparticle delivery of Cas9 ribonucleoprotein and donor DNA
in vivo induces homology-directed DNA repair .
Nat Biomed Eng
2017; ; 1 :
:889.-901. 14. Lau
CH,
Suh
Y. In vivo genome
editing in animals using AAV-CRISPR system: applications to translational
research of human disease .
F1000Res
2017; ; 6 : :2153.. 15. Nakamura
K,
Fujii
W,
Tsuboi
M, et al.
Generation of muscular dystrophy model rats with a CRISPR/Cas
system . Sci Rep
2014; ; 4 : :5635.. 16. Amoasii
L,
Long
C,
Li
H, et al.
Single-cut genome editing restores dystrophin expression in a
new mouse model of muscular dystrophy . Sci
Transl Med
2017 ; :9.. 17. Sui
T,
Lau
YS,
Liu
D, et al.
A novel rabbit model of Duchenne muscular dystrophy generated
by CRISPR/Cas9 . Dis Model
Mech
2018 ; :11.. 18. Chen
Y,
Zheng
Y,
Kang
Y, et al.
Functional disruption of the dystrophin gene in rhesus monkey
using CRISPR/Cas9 . Hum Mol
Genet
2015; ; 24 :
:3764.-74. 19. Demonbreun
AR,
Wyatt
EJ,
Fallon
KS, et al.
A gene-edited mouse model of Limb-Girdle muscular dystrophy
2C for testing exon skipping . Dis Model
Mech
2019; ; 13. pii:
:dmm040832.. 20. Brennan
S,
Garcia-Castaneda
M,
Michelucci
A, et al.
Mouse model of severe recessive RYR1-related
myopathy . Hum Mol Genet
2019; ; 28 :
:3024.-36. 21. Amoasii
L,
Li
H,
Zhang
Y, et al.
In vivo non-invasive monitoring of dystrophin correction in a
new Duchenne muscular dystrophy reporter mouse .
Nat Commun
2019; ; 10 : :4537.. 22. Amoasii
L,
Hildyard
JCW,
Li
H, et al.
Gene editing restores dystrophin expression in a canine model
of Duchenne muscular dystrophy .
Science
2018; ; 362 :
:86.-91. 23. Long
C,
Amoasii
L,
Mireault
AA, et al.
Postnatal genome editing partially restores dystrophin expression in a mouse
model of muscular dystrophy. Science
2016; ; 351 :
:400.-3. 24. Ifuku
M,
Iwabuchi
KA,
Tanaka
M, et al.
Restoration of dystrophin protein expression by exon skipping
utilizing CRISPR-Cas9 in myoblasts derived from DMD patient iPS
cells . Methods Mol Biol
2018; ; 1828 :
:191.-217. 25. Long
C,
Li
H,
Tiburcy
M, et al.
Correction of diverse muscular dystrophy mutations in human
engineered heart muscle by single-site genome editing .
Sci Adv
2018; ; 4 :
:eaap9004.. 26. Duchêne
BL,
Cherif
K,
Iyombe-Engembe
JP, et al.
CRISPR-induced deletion with SaCas9 restores dystrophin
expression in dystrophic models in vitro and in vivo .
Mol Ther
2018; ; 26 :
:2604.-16. 27. Nance
ME,
Shi
R,
Hakim
CH, et al.
AAV9 edits muscle stem cells in normal and dystrophic adult
mice . Mol Ther
2019; ; 27 :
:1568.-85. 28. Tabebordbar
M,
Zhu
K,
Cheng
JKW, et al.
In vivo gene editing in dystrophic mouse muscle and muscle
stem cells . Science
2016; ; 351 :
:407.-11. 29. Nelson
CE,
Hakim
CH,
Ousterout
DG, et al.
In vivo genome editing improves muscle function in a mouse
model of Duchenne muscular dystrophy .
Science
2016; ; 351 :
:403.-7. 30. Dastidar
S,
Ardui
S,
Singh
K, et la.
Efficient CRISPR/Cas9-mediated editing of trinucleotide
repeat expansion in myotonic dystrophy patient-derived iPS and myogenic
cells . Nucleic Acids Res
2018; ; 46 :
:8275.-98. 31. Lo
Scrudato
M,
Poulard
K,
Sourd
C, et al.
Genome editing of expanded CTG repeats within the human DMPK
gene reduces nuclear RNA foci in muscle of DM1 mice .
Mol Ther
2019; ; 27 :
:1372.-88. 32. Selvaraj
S,
Dhoke
NR,
Kiley
J, et al.
Gene correction of LGMD2A patient-specific iPSCs for the
development of targeted autologous cell therapy .
Mol Ther
2019; ; 27 :
:2147.-57. 33. Wang
Y,
Hao
L,
Wang
H, et al.
Therapeutic genome editing for myotonic dystrophy type 1
using CRISPR/Cas9 . Mol
Ther
2018; ; 26 :
:2617.-30. 34. Long
C,
McAnally
JR,
Shelton
JM, et al.
Prevention of muscular dystrophy in mice by
CRISPR/Cas9-mediated editing of germline DNA .
Science
2014; ; 345 :
:1184.-8. 35. Bengtsson
NE,
Hall
JK,
Odom
GL, et al.
Muscle-specific CRISPR/Cas9 dystrophin gene editing
ameliorates pathophysiology in a mouse model for Duchenne muscular
dystrophy . Nat Commun
2017; ; 8 : :14454.. 36. Matre
PR,
Mu
X,
Wu
J, et al.
CRISPR/Cas9-based dystrophin restoration reveals a novel role
for dystrophin in bioenergetics and stress resistance of muscle
Pprogenitors . Stem Cells
2019; ; 37 :
:1615.-28. 37. Hwang
J,
Yokota
T. Recent
advancements in exon-skipping therapies using antisense oligonucleotides and
genome editing for the treatment of various muscular
dystrophies . Expert Rev Mol
Med
2019; ; 21 : :e5.. 38. Ryu
SM,
Koo
T,
Kim
K, et al.
Adenine base editing in mouse embryos and an adult mouse
model of Duchenne muscular dystrophy . Nat
Biotechnol
2018; ; 36 :
:536.-9. 39. Ricotti
V,
Spinty
S,
Roper
H, et al.
Safety, tolerability, and pharmacokinetics of SMT C1100, a
2-Arylbenzoxazole utrophin modulator, following single- and multiple-dose
administration to pediatric patients with Duchenne muscular
dystrophy . PLoS One
2016; ; 11 :
:e0152840.. 40. Hanlon
KS,
Kleinstiver
BP,
Garcia
SP, et al.
High levels of AAV vector integration into CRISPR-induced DNA
breaks . Nat Commun
2019; ; 10 : :4439.. 41. Lee
J,
Mou
H,
Ibraheim
R, et al.
Tissue-restricted genome editing in vivo specified by
microRNA-repressible anti-CRISPR proteins .
RNA
2019; ; 25 :
:1421.-31. 42. Min
YL,
Bassel-Duby
R,
Olson
EN. CRISPR
correction of Duchenne muscular dystrophy .
Annu Rev Med
2019; ; 70 :
:239.-55. 43. Cohen
J. In dogs, CRISPR
fixes a muscular dystrophy .
Science
2018; ; 361 : :835.. 44. Attenello
FJ. Immunity to
CRISPR-Cas9 . Sci Transl
Med
2019; ; 1 : :5328.. 45. Crudele
JM,
Chamberlain
JS. Cas9 immunity
creates challenges for CRISPR gene editing therapies .
Nat Commun
2018; ; 9 : :3497.. 46. Charlesworth
CT,
Deshpande
PS,
Dever
DP, et al.
Identification of preexisting adaptative immunity to Cas9
proteins in humans . Nat
Med
2019; ; 25 :
:249.-54. 49. Neuberger
EWI,
Simon
P. Gene and cell
doping: the new frontier. Beyond myth or reality .
Med Sport Sci
2017; ; 62 :
:91.-106. 50. Schuelke
M,
Wagner
KR,
Stolz
LE, et al.
Myostatin mutation associated with gross muscle hypertrophy
in a child . N Engl J Med
2004; ; 350 :
:2682.-8. 51. Rossi
A,
Salvetti
A. Intégration des
vecteurs AAV et mutagenèse insertionnelle .
Med Sci (Paris)
2016; ; 32 :
:167.-74. 52. Meyer
M. Biologie et
médecine « do-it-yourself ». Histoire, pratiques, enjeux .
Med Sci (Paris)
2018; ; 34 :
:473.-9. 53. Smithies
O,
Gregg
RG,
Boggs
SS, et al.
Insertion of DNA sequences into the human chromosomal beta-globin
locus by homologous recombination .
Nature
1985; ; 317 :
:230.-4. 54. Jordan
B. Bébés CRISPR :
anatomie d’une transgression . Med Sci
(Paris)
2019; ; 35 :
:266.-70. |