| |
| Med Sci (Paris). 36(4): 382–388. doi: 10.1051/medsci/2020056.Les organoïdes pulmonaires Chloé Bourguignon,1 Charlotte Vernisse,2 Joffrey Mianné,1 Mathieu Fieldès,1 Engi Ahmed,1,3 Aurélie Petit,2 Isabelle Vachier,2 Thierry Lavabre Bertrand,4 Said Assou,1 Arnaud Bourdin,2,3* and John De Vos1,5** 1IRMB, Univ Montpellier, CHU de Montpellier, Hôpital Saint
Eloi, Inserm, 80 avenue
Augustin Fliche, 34295Montpellier,
France 2PhyMedExp, Univ Montpellier, CHU de Montpellier,
Inserm, Montpellier, France 3Département de pneumologie, CHU de
Montpellier, Montpellier, France 4Unité de génétique médicale et cytogénétique, CHU de
Nîmes, Montpellier, France 5Département d’ingénierie cellulaire et tissulaire, CHU de
Montpellier, Montpellier, France |

Vignette (Photo © Charlotte Vernisse). Les pathologies pulmonaires chroniques comme l’asthme, la bronchopneumopathie chronique
obstructive (BPCO) ou la fibrose pulmonaire primitive, représentent un lourd fardeau en
santé publique avec plus de 3 millions de morts par an dans le monde [1]. Cependant, il n’existe aucun traitement
curatif à ce jour. La mise au point de modèles pouvant reproduire la complexité
architecturale et les fonctionnalités du poumon sont donc un enjeu médical majeur. Les premiers modèles qui ont contribué à la connaissance du développement, de
l’homéostasie et des pathologies du système respiratoire, en dehors des modèles animaux,
ont été les cultures organotypiques in vitro de tissu pulmonaire [2]. L’avènement plus récent des
organoïdes offre un modèle supplémentaire qui pourrait constituer un tournant dans la
modélisation des maladies pulmonaires chroniques et pourrait très significativement
accélérer le développement de nouvelles thérapies. Les organoïdes sont de petits
systèmes biologiques structurés en 3 dimensions (3D), résultats de l’auto-organisation
des cellules. Ces structures miment in vitro, au moins en partie, le
développement et la fonction d’un organe en miniature. Ils reproduisent la complexité
des types cellulaires et l’organisation de l’organe. Les premiers organoïdes pulmonaires ont été obtenus à partir de cellules fœtales [3] mais c’est grâce aux cellules
souches pluripotentes (CSP) [4]
et notamment aux cellules souches pluripotentes induites humaines (iPS), que leur
utilisation a été popularisée, offrant de nouvelles perspectives. Bien que la définition des organoïdes implique une structure en 3D, la fonction
pulmonaire d’interface ouverte sur le milieu extérieur peut être modélisée en 2D de
façon légitime, puisqu’une telle organisation est inscrite dans l’architecture de la
paroi de la trachée, des bronches, des bronchioles ou des alvéoles. C’est pourquoi cette
revue décrira non seulement les organoïdes pulmonaires 3D mais également les épithéliums
bronchiques cultivés en 2D, dont les mises au point ont précédé et accompagné celles des
structures en 3D. |
Structure et développement pulmonaire : quand complexité rime avec
nécessité L’arbre respiratoire intra-thoracique adulte se divise en deux zones de compositions
architecturales et cellulaires bien distinctes qui répondent à deux impératifs
fonctionnels différents : 1) les voies aériennes de conduction (trachée, bronches et
bronchioles) pour le transport et la filtration de l’air, et 2) la zone des échanges
gazeux (bronchioles respiratoires, canaux alvéolaires, alvéoles) pour l’apport
d’oxygène et l’élimination de gaz carbonique. Ces fonctions requièrent un haut degré
de spécialisation cellulaire. La trachée, les bronches et les bronchioles
constituent des épithéliums cylindriques ou cubiques formant les voies aériennes.
Elles garantissent l’humidification de l’air et la protection des zones distales
contre les particules inhalées et les agents pathogènes grâce, d’une part aux
cellules à mucus (ou cellules caliciformes) sécrétant le mucus qui capte ces mêmes
particules, et, d’autre part, aux cellules ciliées qui en assurent la clairance. Les
cellules basales sont les progéniteurs de cet épithélium pseudostratifié. Les
cellules neuroendocrines, moins nombreuses, régulent la réponse épithéliale face à
des stimulus physiologiques, tels que l’hypoxie, tandis que les ionocytes,
nouvellement découverts, sont responsables d’une forte activité de transport d’ions
chlorures reposant sur la protéine membranaire CFTR (cystic fibrosis
transmembrane conductance regulator), un canal chlorure dont des
mutations sont à l’origine de la mucoviscidose [5]. La fonction de l’épithélium est modulée par
la proportion de ces différents types cellulaires, qui varie le long de l’arbre
bronchique avec une augmentation de certaines populations rares au niveau des
bronchioles terminales, comme les cellules Club qui sécrètent des
glycosaminoglycanes et des peptides antimicrobiens. La fonction ventilatoire est
réalisée au niveau des sacs alvéolaires grâce aux pneumocytes de type 1 qui
tapissent l’alvéole et permettent les échanges gazeux par diffusion avec les
capillaires sous-jacents. Les pneumocytes de type 2 synthétisent le surfactant,
essentiel pour réduire la tension de surface au niveau des alvéoles. Ils jouent
également le rôle de cellules souches et sont capables de se différencier en
pneumocytes de type 1. Cette organisation étagée et complexe est le fruit d’un long développement qui
commence dès le début de la période embryonnaire et s’étend jusqu’à plusieurs années
après la naissance. On distingue 5 phases de développement, chacune correspondant à
des degrés supérieurs de ramification de l’arbre respiratoire : embryonnaire,
pseudo-glandulaire, canaliculaire, sacculaire et alvéolaire. La compréhension de la
phase embryonnaire est particulièrement instructive pour la mise au point des
protocoles de différenciation des cellules souches pluripotentes en épithélium
bronchique. Cette phase débute par la mise en place de l’endoderme définitif, qui
devient l’intestin primitif et se subdivise en 3 sections selon un axe
antéro-postérieur. L’activation de la voie Activine/Nodal est essentielle pour le
déroulement de cette étape. Une invagination se forme ensuite au niveau de
l’intestin primitif antérieur. Ce bourgeon endodermique envahit alors le mésoderme
environnant avec lequel il entretiendra des relations étroites tout au long du
développement pulmonaire. Ce bourgeon apparaît dans la partie ventrale de l’intestin
primitif antérieur, région caractérisée par l’expression du facteur de transcription
NKX2.1 (aussi nommé thyroid transcription factor 1 ou TTF-1), sous
l’influence de l’inhibition des voies de signalisation du TGF-β
(transforming growth factors β) et des protéines
morphogénétiques osseuses (BMP, pour bone morphogenetic protein).
Les progéniteurs pulmonaires exprimant NKX2.1 suivent ensuite un schéma de
différenciation selon un gradient proximo-distal sous l’effet de facteurs de
croissance, tels que BMP4, FGF (fibroblast growth factor) et WNT,
pour donner naissance à l’arbre bronchique proximal et aux alvéoles distales [6]. Le processus
d’alvéolisation débute quelques semaines avant la naissance pour s’achever après
l’adolescence [7]. Les modèles animaux ont longtemps été la méthode de choix pour étudier le
développement pulmonaire, simuler et prédire la réponse biologique face à des
agressions externes afin d’anticiper des succès pharmacologiques chez l’homme. Ils
ont permis des avancées considérables dans ce domaine [8], mais ces modèles, en plus d’être coûteux,
longs et fastidieux à mettre en place, ne sont pas toujours prédictifs des réponses
chez l’homme [9]
(→).
(→) Voir la Synthèse de H. Hardin-Pouzet et S. Morosan, m/s
n° 2, février 2019, page 153
En effet, il existe des différences structurelles entre le poumon humain et celui des
rongeurs. Par exemple, les cellules basales qui permettent le renouvellement
épithélial tout au long des voies aériennes chez l’homme, ne sont présentes que dans
la trachée chez la souris [10]. Les cellules à mucus sont également moins fréquentes dans les
modèles murins [11]. Chez
les souris et les rats, la production de surfactant apparaît déjà en place dès le
stade sacculaire [12] alors
que la maturation des pneumocytes de type 2 dont le surfactant est issu, est bien
plus tardive chez l’homme. |
Cellules primaires in vitro : de la 2D vers les débuts des organoïdes Cellules primaires bronchiques en interface air-liquide :
2-dimensions La culture in vitro de cellules primaires épithéliales
bronchiques humaines (CEBH) en interface air-liquide (ALI) est un très bon
modèle pour étudier les phénomènes physiopathologiques des voies aériennes : à
partir d’une biopsie ou d’un brossage bronchique réalisé lors d’une fibroscopie,
les CEBH en ALI permettent de reconstituer un épithélium complet et différencié
(Figure 1) [ 13]. Après dissociation
mécanique des biopsies, les cellules basales sont amplifiées puis transférées
sur une membrane poreuse tendue sur un insert ( TranswellTM
). Le milieu nutritif se trouve au pôle baso-latéral, alors que le pôle
apical des cellules est au contact de l’air. Les cellules basales, ainsi
positionnées à l’interface air-liquide physiologique, se différencient en
cellules ciliées et cellules à mucus notamment. En 28 jours de culture ALI, un
épithélium différencié et fonctionnel est produit à partir de biopsies de sujets
sains ou de patients atteints de pathologies respiratoires. Ce système a été
utilisé avec succès pour étudier l’asthme ou les infections virales, par exemple
[ 14].
L’introduction récente d’un nouveau milieu de culture
( PneumacultTM
) a permis de mieux développer les cultures de CEBH en conditions ALI,
dans une architecture pseudostratifiée proche de l’architecture 3D de la bronche
[ 15].
 | Figure 1. Culture ALI obtenue à partir de biopsies
bronchiques. Les biopsies sont dissociées
mécaniquement puis repiquées en boîte de Pétri afin d’isoler les
cellules basales par adhérence préférentielle. Ces cellules basales
prolifèrent pendant plusieurs semaines, puis une phase de
différenciation débute lorsqu’on les dépose sur un
Transwell® - une membrane poreuse tendue sur un
insert - où elles sont recouvertes de milieu de culture au niveau
apical et basolatéral. Après adhérence des cellules, l’interface
air-liquide (ALI) est mise en place en aspirant le milieu de culture
au niveau apical, exposant à l’air libre la face apicale des
cellules, tout en leur permettant de continuer à être nourries par
le milieu présent en basolatéral. Ce système ALI reproduit ainsi en
culture les conditions naturelles des cellules bronchiques. Une fois
le système ALI établi, les cellules basales se différencient et
l’épithélium bronchique constitué notamment des cellules ciliées,
des cellules caliciformes et des cellules Club, apparaît. |
La troisième dimension Bien que ce modèle permette de reproduire un épithélium pseudo-stratifié
in vitro et qu’il puisse être enrichi par co-culture avec
d’autres types cellulaires [ 16], la culture de CEBH en conditions ALI ne reproduit pas
l’architecture tri-dimensionnelle essentielle pour assurer des interactions et
des fonctions cellulaires fidèles aux processus in vivo [ 4]. Certaines équipes ont proposé de
combiner ce modèle à une matrice pour créer une 3 e dimension :
broncho-sphères [ 17],
trachéo-sphères [ 18] ou
alvéolo-sphères, en isolant des pneumocytes de type 2 par tri cellulaire [ 19], voire des structures
mimant in vitro la ramification des bronches au cours du
développement, réalisant ainsi les premiers organoïdes [ 20]. Les matrices utilisées sont des
hydrogels, le plus souvent le Matrigel. Celui-ci est une
préparation solubilisée extraite du sarcome murin d’Engelbreth-Holm-Swarm (EHS),
une tumeur riche en laminine (60 %), collagène IV (30 %) et entactine (8 %)
– cette dernière molécule contribuant à l’organisation structurale en liant la
laminine et le collagène. Le Matrigel contient également des protéoglycanes
héparane sulfate et des facteurs de croissance. Ses propriétés de polymérisation
à température ambiante en font une matrice biologiquement et physiquement active
semblable à la matrice basale. Notons cependant l’influence favorable de l’ajout
de cellules d’origine mésodermique (fibroblastes, cellules endothéliales) pour
la structuration et la maturation de ces structures en 3D. Ce type de modèle a
permis à Gao et al. [ 17], grâce à des outils d’édition génomique, d’identifier deux facteurs
de transcription impliqués dans les processus de ciliogenèse (ZNF750), et de
différenciation et de coordination des fonctions de barrière (GRHL2). Un autre
exemple d’utilisation de ce modèle, couplé à une approche haut débit en plaques
de 384 puits, a montré que l’interleukine 13 induisait la production de mucus,
tandis que le blocage du récepteur Notch2 par un anticorps diminuait la
proportion de cellules à mucus par rapport aux cellules ciliées [ 21]. Organoïdes issus de cellules fœtales Les cultures en 2 ou 3 dimensions de cellules primaires adultes sont très
intéressantes pour étudier les mécanismes physiologiques ou pathologiques
survenant à l’âge adulte mais, du fait du stade de différenciation avancé des
cellules prélevées, et malgré des processus de transdifférenciation, ces modèles
ne sont pas pertinents pour la compréhension des phénomènes intervenant lors du
développement pulmonaire. À ce titre, bien que l’accès à ces cellules soit
délicat, certains auteurs ont rapporté l’utilisation de cellules pulmonaires
fœtales [ 22, 23]. Les informations
issues de ces études sont précieuses : elles montrent que des cellules
pulmonaires fœtales prélevées au stade canaliculaire peuvent générer l’ensemble
des cellules de l’arbre respiratoire adulte [ 22] et que ces tissus immatures peuvent être utilisés pour
comprendre le développement pulmonaire ou pour mimer in vitro
la dysplasie broncho-pulmonaire [ 23]. Lung on a chip : quand la bio-ingénierie s’en mêle Afin de contrôler le plus finement possible le micro-environnement cellulaire
in vitro, l’équipe de Donald Ingber a développé un système
micro-fluidique mimant l’interface air-liquide alvéolaire en 3D. Il s’agit d’une
fine membrane poreuse et flexible de polydiméthylsiloxane (PDMS), recouverte sur
sa face supérieure d’une matrice extra-cellulaire sur laquelle repose une couche
de cellules épithéliales alvéolaires au contact de l’air, et, sur sa face
inférieure, d’une couche de cellules endothéliales immergée dans un milieu de
culture [ 24]. Ce
« lung on a chip » (ou poumon sur puce) reproduit dans
quelques millimètres carrés la complexité et la diversité de l’épithélium
pulmonaire. Grâce à un système de pressions négatives mimant les mouvements
respiratoires, il a été utilisé pour mettre en évidence l’importance des
contraintes mécaniques dans la réponse inflammatoire liée aux nanoparticules de
silice. En effet, dans ce modèle, le stress mécanique augmente la capture des
particules par les cellules endothéliales et épithéliales, accentuant ainsi les
réponses toxiques et inflammatoires induites par les nanoparticules. Cependant,
cette technologie n’est, pour le moment, maîtrisée que par une seule équipe. Les cellules primaires bronchiques isolées de tissus adultes ou fœtaux présentent
néanmoins un inconvénient majeur : elles ne sont disponibles qu’en quantité très
limitée. En effet, elles ne peuvent être obtenues qu’à partir de procédures
médicales invasives (fibroscopie) et/ou dans des cadres éthiques restreints
(utilisation de tissus fœtaux à visée de recherche). De plus, leur durée de
culture limitée, leur faible potentiel de pré-amplification in
vitro et la grande variabilité interindividuelle sont des limites
qui justifient de rechercher d’autres sources cellulaires pour produire des
organoïdes. |
Organoïdes dérivés de cellules souches pluripotentes humaines Les CSP, les cellules souches embryonnaires humaines ou les cellules souches
pluripotentes induites humaines (iPS) sont une source alternative très prometteuse
[25]. En effet, les CSP
ont un potentiel d’auto-renouvellement illimité et peuvent se différencier vers tous
les types cellulaires, y compris ceux du système respiratoire. Plusieurs protocoles
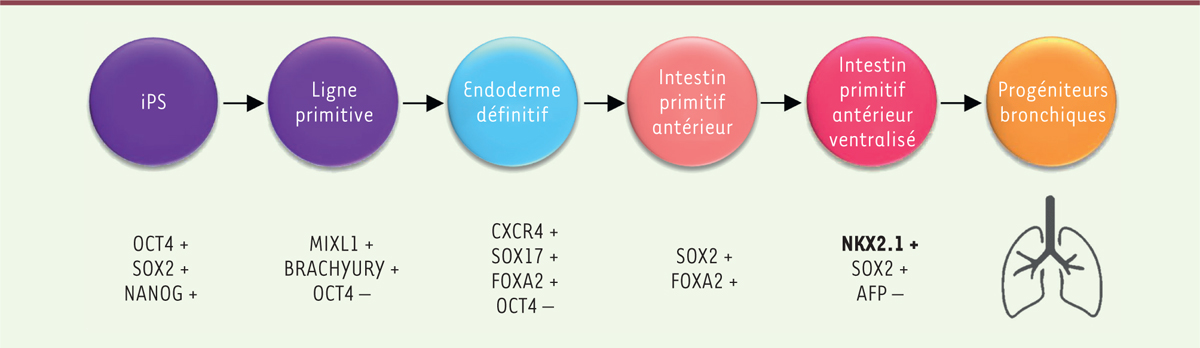
de culture 2D d’épithéliums respiratoires dérivés de CSP ont été publiés [26-28]. Ils reproduisent in vitro
les conditions du développement embryonnaire du système respiratoire, intégrant les
étapes d’endoderme définitif, d’intestin primitif antérieur ventralisé, puis de
progéniteurs pulmonaires (Figure
2), et permettent d’obtenir des épithéliums constitués des
principaux types cellulaires bronchiques ou alvéolaires (pour une revue, voir [7]).
 | Figure 2. Étapes-clés des protocoles de différenciation pulmonaire à
partir de cellules souches pluripotentes, mimant in
vitro le développement de l’épithélium
respiratoire. iPS : cellules souches
pluripotentes induites. |
Les CSP permettent également de produire des organoïdes 3D. Certaines équipes
réalisent les premières étapes de différenciation en culture monocouche 2D [29-32]. Les progéniteurs pulmonaires exprimant
NKX2.1 sont ensuite purifiés grâce à des marqueurs membranaires qui leur sont
spécifiques – CPM (carboxypeptidase M)+ ou
CD47high/CD26low – avant d’être mis en culture en 3D dans
du Matrigel. D’autres équipes préfèrent induire la culture en 3D juste après le
stade d’endoderme définitif, passant par un stade de précurseurs organisés en
sphéroïdes avant d’induire la structure organoïde [33-35]. L’une des grandes difficultés rencontrées par les équipes
travaillant sur la différenciation des CSP en tissu bronchique réside dans le degré
de maturité de l’épithélium obtenu : l’aspect morphologique et les données
transcriptomiques montrent ainsi souvent des caractéristiques équivalentes à celles
de poumons fœtaux [36]. Cet
écueil peut-être contourné par la transplantation des cellules dans une souris
immunodéficiente afin d’achever la maturation de ces organoïdes in
vivo, à condition d’y associer, avant la greffe, une niche
bioartificielle synthétique en PLG (poly(lactide-co-glycolide)) [34]. L’implémentation du milieu
commercial PneumacultTM
, initialement destiné à la culture de cellules primaires bronchiques en
ALI, permet également d’obtenir in vitro des organoïdes présentant
de nombreuses cellules multi-ciliées suffisamment matures pour permettre des études
portant sur les battements ciliaires [30]. D’autres protocoles se concentrent sur la différenciation du compartiment alvéolaire
au sein des organoïdes [29, 32]. Ces alvéolo-sphères produisent du
surfactant (SFPC), et les cellules qui les constituent présentent des profils
d’expression génique proches de celui des pneumocytes de type 2 et possèdent des
corps lamellaires. Certaines problématiques restent néanmoins à résoudre, comme l’absence de
modélisation de l’interface entre l’épithélium et le tissu sous-jacent (cellules
endothéliales et fibroblastiques/mésenchymateuses) au sein des organoïdes. Même si
un compartiment de nature mésenchymateuse est parfois présent dans ces modèles, il
n’atteint jamais le stade de cellule endothéliale, y compris après greffe in
vivo [33, 36]. Il sera donc très utile de complexifier le modèle en y
intégrant un véritable compartiment mésenchymateux. |
Les organoïdes pulmonaires au service de la médecine D’aujourd’hui Les organoïdes pulmonaires dérivés de CSP sont des outils puissants. Ils sont
capables de modéliser de manière pertinente des maladies génétiques rares
touchant le poumon, telles que la mucoviscidose [ 38] ou le syndrome de Hermansky-Pudlak
[ 39]. L’avènement
de la technologie CRISPR/Cas9 démultiplie les possibilités de modélisation de
ces pathologies et permet d’imaginer de possibles thérapies géniques [ 40]. Par ailleurs, les
virus à tropisme respiratoire sont à l’origine de lésions majeures, à plus ou
moins long terme, au niveau de l’épithélium bronchique. Ces lésions peuvent être
reproduites et étudiées sur ces organoïdes, comme par exemple celles induites
par un virus parainfluenza, le virus respiratoire syncytial et le virus de la
rougeole [ 41]. Enfin,
la modélisation en 2D ou en 3D ouvre une voie majeure pour l’innovation dans le
traitement des pathologies respiratoires, en particulier chroniques, telles que
la BPCO ou la fibrose pulmonaire. La génération à grande échelle d’organoïdes
dérivés d’iPS modélisant ces pathologies devrait en effet permettre le criblage
pharmacologique massif de petites molécules en tenant compte du terrain
génétique par la sélection de cellules de patients susceptibles à ces maladies
[ 7]. Et de demain Les travaux réalisés sur les matrices pulmonaires décellularisées et l’ingénierie
pulmonaire ex vivo pourraient être une alternative au don
d’organe issu de patients en état de mort encéphalique [ 42], seule option thérapeutique actuelle
pour les patients atteints d’insuffisance respiratoire chronique. Mais les
protocoles de décellularisation des matrices et
d’amplification/fonctionnalisation des cellules en bioréacteurs pour produire un
organe complet n’en sont qu’à leur balbutiement. |
Le poumon est un organe complexe et diversifié, tant sur le plan cellulaire que sur
le plan structurel. Cette revue des différents modèles d’organoïdes pulmonaires en
est le reflet : diversité des sources cellulaires, diversité des architectures,
diversité des applications (Figure
3). Les modèles en 2D sont privilégiés pour leur facilité
d’utilisation et de suivi. Les modèles en 3D sont eux préférés pour leur pertinence
histologique. Par rapport aux autres sources cellulaires, les CSP donnent accès à
tous les stades développementaux et permettent une production quasi infinie
d’organoïdes. Associées à la technologie CRISPR, ces cellules offrent ainsi une
palette de modèles illimitée. Les pistes d’amélioration des organoïdes pulmonaires
intègreront certainement la complexification du modèle avec, en particulier,
l’implémentation de vaisseaux, de nerfs, de cellules immunitaires, etc. pour tendre
à un système in vitro le plus complet possible. Le rôle
architectural et paracrine joué par les vaisseaux au cours du développement [43] et de la réparation du
poumon est en effet majeur. Outre les « lung on a chip » que nous
avons évoqués, les co-cultures avec des cellules mésenchymateuses et endothéliales
avant greffe chez l’animal immunodéprimé [44] pourraient être une solution. L’amélioration continue des
matériaux biocompatibles, notamment des hydrogels modulables à souhait et
photo-polymérisables, favorisera très probablement la production de vaisseaux dans
ces organoïdes pulmonaires [45]. L’ensemble de ces avancées technologiques seront, sans conteste, à
l’origine de grands progrès en pneumologie.
 | Figure 3. Sources cellulaires, types et applications des organoïdes
pulmonaires. CSE : cellules souches
embryonnaires ; iPS : cellules souches pluripotentes induites. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Nous remercions la Fondation pour la recherche médicale pour son soutien (financement
FDM20170638083).
|
1. GBD 2017 .
Causes of death collaborators. Global, regional, and national
age-sex-specific mortality for 282 causes of death in 195 countries and
territories, 1980–2017: a systematic analysis for the global burden of
disease study 2017 . Lancet Lond Engl.
2018;; 392 :
:1736.–88. 2.
Ekelund
L
,
Arvidson
G
,
Emanuelsson
H
, et al.
Effect of cortisol on human fetal lung in organ culture: a
biochemical, electron-microscopic and autoradiographic
study . Cell Tissue Res.
1975; ; 163 :
:263.–272. 3.
Zimmermann
B.
. Lung organoid culture .
Differ Res Biol Divers.
1987; ; 36 :
:86.–109. 4.
Nadkarni
RR
,
Abed
S
,
Draper
JS
. Organoids as a model system for studying human
lung development and disease . Biochem Biophys Res
Commun.
2016; ; 473 :
:675.–682. 5.
Plasschaert
LW
,
Žilionis
R
,
Choo-Wing
R
, et al.
A single-cell atlas of the airway epithelium reveals the
CFTR-rich pulmonary ionocyte . Nature.
2018; ; 560 :
:377.–381. 6.
Dye
BR
,
Miller
AJ
,
Spence
JR
. How to grow a lung: applying principles of
developmental biology to generate lung lineages from human pluripotent stem
cells . Curr Pathobiol Rep.
2016; ; 4 :
:47.–57. 7.
Ahmed
E
,
Sansac
C
,
Assou
S
, et al.
Lung development, regeneration and plasticity: from disease
physiopathology to drug design using induced pluripotent stem
cells . Pharmacol Ther.
2018; ; 183 :
:58.–77. 8.
Morrisey
EE
,
Hogan
BLM
. Preparing for the first breath: genetic and
cellular mechanisms in lung development . Dev
Cell.
2010; ; 18 :
:8.–23. 9.
Hardin-Pouzet
H
,
Morosan
S
. Organismes-modèles et réglementation de la
recherche animale . Med/Sci (Paris).
2019; ; 35 :
:153.–156. 10.
Boers
JE
,
Ambergen
AW
,
Thunnissen
FB
. Number and proliferation of clara cells in normal
human airway epithelium . Am J Respir Crit Care
Med.
1999; ; 159 :
:1585.–1591. 11.
Rock
JR
,
Randell
SH
,
Hogan
BLM
. Airway basal stem cells: a perspective on their
roles in epithelial homeostasis and remodeling . Dis
Model Mech.
2010; ; 3 :
:545.–556. 12.
Jobe
AH
. Animal models, learning lessons to prevent and
treat neonatal chronic lung disease . Front
Med.
2015; ; 2 : :49.. 13.
Gras
D
,
Petit
A
,
Charriot
J
, et al.
Epithelial ciliated beating cells essential for ex vivo ALI
culture growth . BMC Pulm Med.
2017; ; 17 : :80.. 14.
Kast
JI
,
McFarlane
AJ
, Głobin΄ska
A, et al.
Respiratory syncytial virus infection influences tight junction
integrity . Clin Exp Immunol.
2017; ; 190 :
:351.–359. 15.
Rayner
RE
,
Makena
P
,
Prasad
GL
, et al.
Optimization of normal human bronchial epithelial (NHBE) cell 3D
cultures for in vitro lung model studies . Sci
Rep.
2019; ; 9 : :500.. 16.
Gras
D
,
Martinez-Anton
A
,
Bourdin
A
, et al.
Human bronchial epithelium orchestrates dendritic cell activation
in severe asthma . Eur Respir J.
2017 ; :49.. 17.
Gao
X
,
Bali
AS
,
Randell
SH
, et al.
GRHL2 coordinates regeneration of a polarized mucociliary
epithelium from basal stem cells . J. Cell
Biol.
2015; ; 211 :
:669.–682. 18.
Rock
JR
,
Gao
X
,
Xue
Y
, et al.
Notch-dependent differentiation of adult airway basal stem
cells . Cell Stem Cell.
2011; ; 8 :
:639.–648. 19.
Barkauskas
CE
,
Cronce
MJ
,
Rackley
CR
, et al.
Type 2 alveolar cells are stem cells in adult
lung . J Clin Invest.
2013; ; 123 :
:3025.–3036. 20.
Franzdóttir
SR
,
Axelsson
IT
,
Arason
AJ
, et al.
Airway branching morphogenesis in three dimensional
culture . Respir Res.
2010; ; 11 : :162.. 21.
Danahay
H
,
Pessotti
AD
,
Coote
J
, et al.
Notch2 is required for inflammatory cytokine-driven goblet cell
metaplasia in the lung . Cell Rep.
2015; ; 10 :
:239.–252. 22.
Rosen
C
,
Shezen
E
,
Aronovich
A
, et al.
Preconditioning allows engraftment of mouse and human embryonic
lung cells, enabling lung repair in mice . Nat
Med.
2015; ; 21 :
:869.–879. 23.
Sucre
JMS
,
Vijayaraj
P
,
Aros
CJ
, et al.
Posttranslational modification of β-catenin is associated with
pathogenic fibroblastic changes in bronchopulmonary
dysplasia . Am J Physiol Lung Cell Mol
Physiol.
2017; ; 312 :
:L186.–L195. 24.
Huh
D
,
Matthews
BD
,
Mammoto
A
, et al.
Reconstituting organ-level lung functions on a
chip . Science.
2010; ; 328 :
:1662.–1668. 25.
De Vos
J
,
Bouckenheimer
J
,
Sansac
C
, et al.
Human induced pluripotent stem cells: a disruptive
innovation . Curr Res Transl Med.
2016; ; 64 :
:91.–96. 26.
Firth
AL
,
Dargitz
CT
,
Qualls
SJ
, et al.
Generation of multiciliated cells in functional airway epithelia
from human induced pluripotent stem cells . Proc Natl
Acad Sci USA.
2014; ; 111 :
:E1723.–E1730. 27.
Huang
SXL
,
Green
MD
,
de Carvalho
AT
, et al.
The in vitro generation of lung and airway progenitor cells from
human pluripotent stem cells . Nat Protoc.
2015; ; 10 :
:413.–425. 28.
Wong
AP
,
Bear
CE
,
Chin
S
, et al.
Directed differentiation of human pluripotent stem cells into
mature airway epithelia expressing functional CFTR protein .
Nat Biotechnol.
2012; ; 30 :
:876.–882. 29.
Gotoh
S
,
Ito
I
,
Nagasaki
T
, et al.
Generation of alveolar epithelial spheroids via isolated
progenitor cells from human pluripotent stem cells .
Stem Cell Rep.
2014; ; 3 :
:394.–403. 30.
Konishi
S
,
Gotoh
S
,
Tateishi
K
, et al.
Directed induction of functional multi-ciliated cells in proximal
airway epithelial spheroids from human pluripotent stem
cells . Stem Cell Rep.
2016; ; 6 :
:18.–25. 31.
McCauley
KB
,
Hawkins
F
,
Kotton
DN
. Derivation of epithelial-only airway organoids
from human pluripotent stem cells . Curr Protoc Stem
Cell Biol.
2018; ; 45 : :e51.. 32.
Yamamoto
Y
,
Gotoh
S
,
Korogi
Y
, et al.
Long-term expansion of alveolar stem cells derived from human iPS
cells in organoids . Nat Methods.
2017; ; 14 :
:1097.–1106. 33.
Chen
YW
,
Huang
SX
,
de Carvalho
ALRT
, et al.
A three-dimensional model of human lung development and disease
from pluripotent stem cells . Nat Cell Biol.
2017; ; 19 :
:542.–549. 34.
Dye
BR,
Dedhia
PH,
Miller
AJ, et al. A
bioengineered niche promotes in vivo engraftment and maturation of
pluripotent stem cell derived human lung organoids .
eLife.
2016; :5.. 35.
Miller
AJ
,
Hill
DR
,
Nagy
MS
, et al.
In vitro induction and in vivo engraftment of lung bud tip
progenitor cells derived from human pluripotent stem cells .
Stem Cell Rep.
2018; ; 10 :
:101.–119. 36.
Dye
BR,
Hill
DR,
Ferguson
MAH, et al. In vitro
generation of human pluripotent stem cell derived lung
organoids . eLife.
2015; :4.. 37.
Ronaldson-Bouchard
K
,
Ma
SP
,
Yeager
K
, et al.
Advanced maturation of human cardiac tissue grown from
pluripotent stem cells . Nature.
2018; ; 556 :
:239.–243. 38.
McCauley
KB
,
Hawkins
F
,
Serra
M
, et al.
Efficient derivation of functional human airway epithelium from
pluripotent stem cells via temporal regulation of Wnt
signaling . Cell Stem Cell.
2017; ; 20 : (844–57)
:e6.. 39.
Strikoudis
A
, Cies΄lak
A,
Loffredo
L, et al.
Modeling of Fibrotic Lung Disease Using 3D Organoids Derived from
Human Pluripotent Stem Cells . Cell Rep.
2019; ; 27 : (3709–23)
:e5.. 40.
Mianné
J
,
Ahmed
E
,
Bourguignon
C
, et al.
Induced pluripotent stem cells for primary ciliary dyskinesia
modeling and personalized medicine . Am. J Respir
Cell Mol Biol.
2018; ; 59 :
:672.–683. 41.
Porotto
M,
Ferren
M,
Chen
YW, et al. Authentic
modeling of human respiratory virus infection in human pluripotent stem
cell-derived lung organoids . mBio.
2019; :10.. 42.
Gilpin
SE
,
Wagner
DE
. Acellular human lung scaffolds to model lung
disease and tissue regeneration . Eur Respir
Rev.
2018 ; :27.. 43.
Peng
T
,
Tian
Y
,
Boogerd
CJ
, et al.
Coordination of heart and lung co-development by a multipotent
cardiopulmonary progenitor . Nature.
2013; ; 500 :
:589.–592. 44.
Takebe
T
,
Sekine
K
,
Enomura
M
, et al.
Vascularized and functional human liver from an iPSC-derived
organ bud transplant . Nature.
2013; ; 499 :
:481.–484. 45.
Grigoryan
B
,
Paulsen
SJ
,
Corbett
DC
, et al.
Multivascular networks and functional intravascular topologies
within biocompatible hydrogels . Science.
2019; ; 364 :
:458.–464. |