|
Entretien avec Éric Cascales mené par les auteurs de la Nouvelle

Éric Cascales est directeur de recherche au CNRS et travaille sur les
systèmes de sécrétion bactériens au Laboratoire d’Ingénierie des Systèmes
Macromoléculaires (LISM) à Marseille. Son équipe est à l’origine de
nombreuses avancées sur la structure et l’assemblage du système de sécrétion
de type VI, découvert en 2006. Eric Cascales est également éditeur pour
différents journaux scientifiques. Il a reçu plusieurs distinctions dont la
médaille de bronze du CNRS en 2011 et le prix Bettencourt « Coups d’élan
pour la recherche française » en 2018.
Pourriez-vous vous présenter en quelques mots ?
Éric Cascales
Je suis directeur de recherche au CNRS et je dirige une équipe qui est
actuellement composée d’une quinzaine de membres. Dans cette équipe, il y a
des chercheurs statutaires, des ingénieurs, des techniciens, des
post-doctorants français et étrangers et des doctorants.
Est-ce que vous pouvez nous présenter les différentes thématiques
sur lesquelles travaille votre équipe ?
EC : Nous travaillons sur les mécanismes qui permettent de
contrôler et réguler les communautés bactériennes. Ce qui nous intéresse,
c’est de comprendre comment les bactéries vont interagir les unes avec les
autres. Actuellement, deux projets principaux sont développés. Le premier
projet porte sur le système de sécrétion de type VI qui est l’une des armes
utilisées par les bactéries pour en tuer d’autres. Bien entendu, la
compétition bactérienne fait partie du contrôle des communautés
microbiennes. Plus récemment, nous avons débuté un nouveau projet sur un
autre système de sécrétion : le système de sécrétion de type IX dont le rôle
est la sécrétion de toxines, mais également la propulsion des bactéries.
Le SST6, c’est un sujet où il y a beaucoup de compétition. Comment
vous situezvous par rapport à cela ? Est-ce plutôt motivant ou, à
l’inverse, une source de stress ?
EC : C’est une source de motivation bien évidemment car on sait
qu’il y a des équipes dans le monde qui travaillent sur des choses très
similaires aux nôtres. Ça veut dire qu’on ne peut pas se permettre
d’attendre, il faut être pro-actif et c’est une source de motivation. C’est
aussi une source de stress puisque quand on a bien avancé une étude, on se
dit qu’on peut se faire « scooper » à n’importe quel moment. Parfois on
passe devant un concurrent, parfois ce sont eux qui nous passent devant,
c’est ainsi… Mais le plus souvent, on discute avec ces équipes pour se tenir
au courant de ce qu’elles font, parfois même on collabore. Actuellement, il
y a une grosse quinzaine d’équipes dans le monde qui travaillent sur le
SST6. Nous savons qu’il y a des risques que nos projets se chevauchent. On
va donc essayer d’engager la conversation et de voir comment on peut le
faire de manière « intelligente » pour tout le monde.
Est-ce que vulgariser est un exercice que vous avez souvent
l’occasion de faire et qui vous plaît ?
EC : On n’a pas eu souvent l’occasion de le faire mais chaque
fois que nous l’avons fait, cela a été avec grand plaisir. Nous sommes
souvent invités à faire des conférences ou des séminaires dans des instituts
scientifiques ou dans des congrès. On s’adresse alors à un public de
spécialistes. Dans un article scientifique, on décrit des faits et on ne
vulgarise pas tellement. Quelquefois, il arrive qu’une télé passe au
laboratoire pour faire un reportage. On a eu aussi Sciences & Vie Junior
qui voulait faire un article et on a dû faire de la vulgarisation. Le SST6
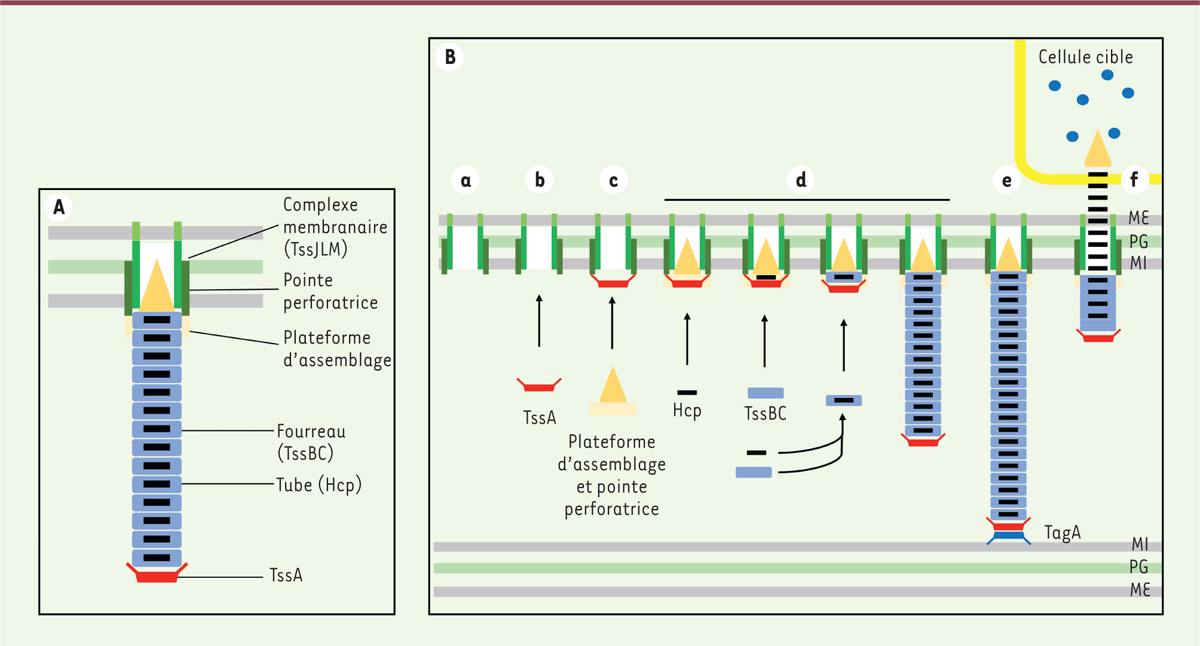
s’y prête plutôt bien car même pour des enfants, on peut comparer le tube
interne et la pointe avec les toxines à une flèche, comme une sarbacane.
Pour le fourreau contractile, on peut parler d’un ressort. Le complexe
membranaire serait une meurtrière par laquelle la flèche va être éjectée.
Donc oui, c’est plutôt simple de vulgariser nos projets actuels.
À un niveau un peu plus personnel, est-ce que vous pourriez nous
parler de votre parcours ?
EC : Je ne me destinais pas du tout à faire de la science. Je
suis violoniste ; j’ai commencé le violon quand j’avais 4 ans. Pour faire
court, après des études poussées en violon, j’avais l’appréhension de faire
de la musique toute ma vie ou de me retrouver professeur de musique. Et en
cherchant ce qui pourrait m’intéresser, j’ai trouvé la biochimie et du coup,
j’ai fait un bac technique en biochimie (STL). Après, je suis allé à la fac
et j’ai continué là-dedans. Chaque année, je me disais que l’année d’après,
j’allais arrêter. Finalement, le parcours a été extrêmement linéaire à
partir du moment où je suis rentré à la fac, même s’il n’était pas du tout
prévu dans ma tête. C’est comme ça que je me suis retrouvé en post-doctorat
aux États-Unis. À mon retour, j’ai obtenu un poste au CNRS où j’ai pu monter
mon équipe.
C’est comme ça qu’est venu le système de sécrétion de type 6
?
EC : C’est comme ça qu’est venu le système de sécrétion de type
4 ! À l’époque, le type 6 n’était pas encore identifié. Mais, à vrai dire,
ce n’était même pas le système de type 4 qui m’intéressait, j’étais amoureux
de la bactérie Agrobacterium tumefaciens, et je me demandais « Comment une
bactérie peut-elle avoir des gènes avec des signaux d’expression eucaryotes
? ». J’avais trouvé ça absolument fascinant, en termes d’évolution et je
voulais vraiment travailler là-dessus. Le système de sécrétion de type 6 est venu plus tard. À mon retour au CNRS,
j’ai commencé à travailler sur le système de sécrétion de type 4. Mais quand
le système de sécrétion de type 6 a été identifié par une équipe américaine,
je me suis dit « Allons-y ! ». En réalité, je désirais repartir avec la
thématique sur laquelle je travaillais durant mon post-doctorat et continuer
des choses qui ont été développées, mais cela a été compliqué. Du coup,
quand l’opportunité du système de sécrétion de type 6 s’est présentée, je
suis parti directement dessus en me disant que ça me faisait commencer
quelque chose de nouveau et à un endroit où je pouvais faire ma niche.
Après ce parcours, de quelle réussite êtes-vous particulièrement
fier ?
EC : Il n’y a pas un résultat particulier qui va me faire dire «
Je suis fier de ça », parce qu’en fait c’est une succession de petits
plaisirs. Je dirais qu’il y a deux choses qui m’importent et que je regarde
avec fierté. La première, c’est la continuité. Quand on regarde et on se dit
qu’on a réalisé un joli travail pour essayer de bien décortiquer toute cette
machine, son assemblage et son mode de fonctionnement. C’est plutôt la
globalité que je trouve intéressante, c’est de se dire « Ça fait douze ans
qu’on travaille sur ça et, petit à petit, par petites briques, on a
construit quelque chose. », que ce soit nous ou des contributions d’autres
équipes, on peut être fier de ce qu’on a construit, de ce qu’on a apporté à
la connaissance scientifique dans ce domaine. La seconde, c’est la fierté quand on voit les doctorants qui partent après
avoir fait un beau travail. On peut être fier de la thèse, mais c’est encore
plus de fierté quand ils réussissent en post-doctorat. Je suis fier d’eux
quand ils publient un article dans leur nouveau laboratoire, et encore plus
quand ils reviennent et qu’ils ont obtenu un poste. Par exemple, la première
étudiante que j’ai eue en thèse sur le système de sécrétion de type 6 au
laboratoire est partie faire un post-doctorat aux États-Unis, puis elle a eu
un poste dans un institut prestigieux en Suède. Quand elle est arrivée au
laboratoire, en master 2, elle a appris à pipeter ; et maintenant, elle va
diriger une équipe au Karolinska Institutet à Stockholm. S’il y a une
véritable source de fierté, c’est plutôt cela.
|