| |
| Med Sci (Paris). 36(5): 442–446. doi: 10.1051/medsci/2020070.La méthylation des ARNm, une nouvelle modalité de
régulation de la présentation croisée des antigènes de cellules
tumorales Marine Gros1* and Marianne Burbage1** 1Inserm U932, section recherche, Institut Curie,
26 rue d’Ulm,
75005Paris,
France MeSH keywords: Présentation d'antigène, Antigènes néoplasiques, Cross-priming, Cellules dendritiques, Humains, Méthylation, Methyltransferases, Tumeurs, Maturation post-transcriptionnelle des ARN, ARN messager, physiologie, immunologie, métabolisme |
Réponses anti-tumorales et stratégies actuelles d’immunothérapie Si elle repose sur des intuitions scientifiques anciennes, l’immunothérapie s’impose
depuis une dizaine d’années comme un changement majeur de paradigme dans le
traitement des cancers. Contrairement aux approches de radiothérapie et
chimiothérapie traditionnellement employées, elle ne repose pas sur la destruction
directe des cellules cancéreuses, mais sur la potentialisation des réponses
immunitaires dirigées contre la tumeur. Un nombre important de médicaments
immunothérapeutiques actuellement mis sur le marché vise à lever les « freins
moléculaires » (« checkpoints » PD-1, PD-L1 ou CTLA-4) exercés par
les tumeurs sur les lymphocytes T CD8+, et à restaurer ainsi la capacité
cytotoxique de ces cellules effectrices de l’immunité [1] (→).
(→) Voir la Synthèse de M. Dubois et al.,
m/s n° 12, décembre 2019, page 937
L’acquisition des propriétés anti-tumorales de ces lymphocytes résulte de la
reconnaissance, à la surface des cellules dendritiques (dendritic
cells, DC), d’un complexe moléculaire constitué de peptides
antigéniques enchâssés dans des molécules du complexe majeur d’histocompatibilité
(CMH) de classe I. Dans le cas d’antigènes tumoraux, d’origine exogène puisqu’issus
des cellules cancéreuses, la formation d’un tel complexe découle d’un processus
intracellulaire fondamental, appelé présentation croisée1, spécifique d’une sous-population de cellules dendritiques,
les cellules cDC1 (conventional type 1 dendritic cells). |
La présentation croisée de l’antigène comme support de l’immunité
anti-tumorale L’utilisation de souris dépourvues de cDC1 ou porteuses de cDC1 incapables de
réaliser la présentation croisée des antigènes a démontré l’importance de ces
cellules dans l’initiation de réponses anti-tumorales protectrices [2, 3]. Dans cette sous-population spécialisée de
cellules dendritiques, la présentation croisée s’effectue exclusivement selon la
voie intracellulaire dite « cytosolique » [4] : à la suite de leur endocytose, les antigènes tumoraux
internalisés sont exportés dans le cytosol où ils sont dégradés par le protéasome.
Les peptides ainsi générés sont ensuite importés dans différents compartiments
(réticulum endoplasmique, endo/phagosomes), où ils s’associent aux molécules du
CMH-I. Les complexes CMH-I/peptides sont enfin exportés à la membrane plasmique,
lieu de leur interaction avec les lymphocytes T CD8+ cytotoxiques. Le
déroulement de chacune des étapes de ce mécanisme intracellulaire complexe paraît
être contrôlé par de nombreux paramètres. Si certains demeurent obscurs, la
dégradation ménagée des antigènes, opérée spécifiquement par les cDC1, semble
constituer l’une des bases moléculaires de la capacité de présentation croisée
propre à ces cellules. |
Limitation du potentiel de dégradation des compartiments intracellulaires dans
les cDC1 L’existence d’un lien entre intensité de la protéolyse dans les compartiments
intracellulaires et efficacité de la présentation antigénique a été suggérée au
début des années 2000, grâce à la comparaison de deux populations de cellules
immunitaires : les cellules dendritiques, spécialisées pour la présentation croisée,
et les macrophages, largement incompétents pour cette fonction. Dans les
macrophages, l’abondance de protéases dans les lysosomes favorise la dégradation des
microorganismes pathogènes, mais détruit également certains épitopes
antigéniques2. En revanche, dans les
cellules dendritiques et à plus forte raison dans les cDC1, une protéolyse modérée
préserve les antigènes et facilite leur engagement ultérieur dans les voies de
présentation croisée [5].
Cette propriété des cDC1 est finement contrôlée à différents niveaux cellulaires et
moléculaires. Ainsi, la sous-expression du facteur de transcription TFEB
(transcription factor EB) dans les cDC1 restreint la synthèse
des protéases du lysosome, ce qui limite la dégradation des antigènes par ces
protéases et promeut par conséquent la présentation croisée de l’antigène par ces
cellules. Les cDC1 disposent également d’un riche arsenal moléculaire, dont la NADPH
oxydase NOX2 constitue le fer de lance, en vue de contrôler l’activité des enzymes
protéolytiques in situ. NOX2, qui est recrutée à la membrane de
l’endo/phagosome par l’intermédiaire de la protéine Rac2 spécifiquement dans les
cDC1, contribue au maintien d’un pH alcalin dans ce compartiment subcellulaire et y
limite ainsi l’activation des protéases et la destruction des épitopes antigéniques
[6] (Figure 1). Récemment, les travaux de
l’équipe dirigée par Chuan He ont enrichi notre compréhension de ce paramètre clé
pour l’efficacité de la présentation croisée, en identifiant un mécanisme de
contrôle traductionnel des protéases du lysosome, régulé par la protéine YTHDF13.
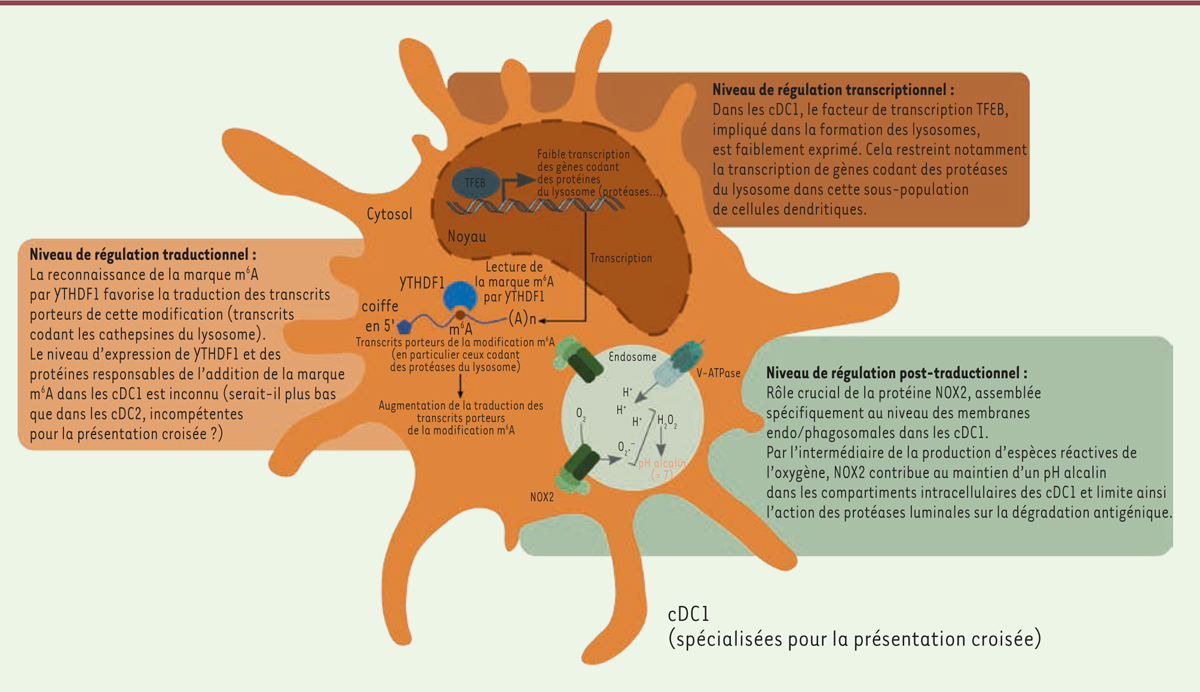
 | Figure 1. Niveaux de régulation du potentiel de dégradation des
compartiments intracellulaires dans les cDC1.
Les cDC1 limitent la dégradation des antigènes au sein des compartiments
d’endocytose par le contrôle transcriptionnel, traductionnel et
post-traductionnel de la synthèse et de l’activité des protéases du
lysosome. A(n) : queue poly-A. |
|
La méthylation de l’ARNm, une forme particulière de régulation
post-transcriptionnelle Tout comme l’ADN, l’ARN messager (ARNm) peut être la cible de diverses modifications
de ses nucléotides constitutifs, permettant un contrôle très fin de l’expression des
gènes et de la synthèse des protéines. Chez les mammifères, la modification la plus
fréquente est l’addition d’un groupement méthyle en position 6 des résidus adénosine
(m6A), qui est observée sur environ 25 % des ARNm [7]. Effectuée au fur et à mesure de la
transcription par des protéines dites « d’écriture » (comme METTL3
[methyltransferase-like 3]), la méthylation des adénosines est
interprétée par des protéines « lectrices » (comme YTHDF1, YTHDF2 et YTHDF3), et
peut être supprimée par des protéines « d’effacement » (comme la déméthylase ALKHB5
[alkB homolog 5]). La présence de cette modification,
majoritairement près du codon stop et dans la région 3’ non codante, participe au
contrôle de la stabilité des ARNm et de l’efficacité de leur traduction [8]. Cependant, malgré une
grande homologie, les trois protéines lectrices YTHDF n’interprètent pas cette
modification de la même manière et exercent des fonctions distinctes dans le
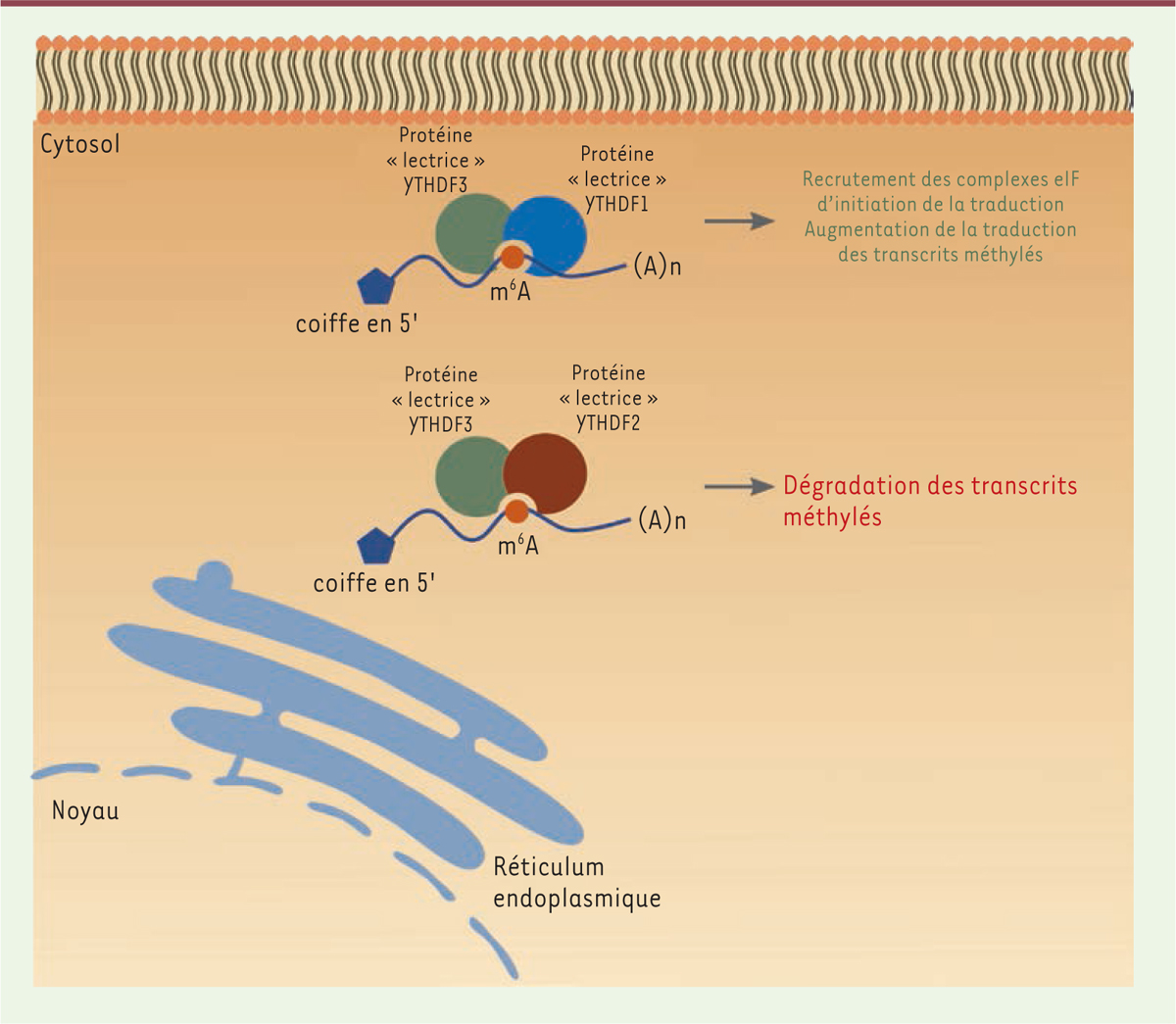
contrôle de la traduction. En effet, la liaison de YTHDF1 à l’ARNm méthylé favorise
la synthèse protéique grâce au recrutement des complexes de traduction [9], tandis qu’YTHDF2 diminue la
stabilité des transcrits méthylés en adressant les ARNm vers des complexes de
dégradation [10]
(Figure 2). Quant à la
protéine YTHDF3, elle semble agir avec YTHDF1 ou YTHDF2 à des moments distincts en
vue de la réalisation de l’une ou l’autre des fonctions précédemment citées.
Plusieurs travaux récents fondés sur des approches du type « perte de fonction » ont
commencé à éclairer l’importance de la méthylation des ARNm dans de nombreux
processus physiologiques. L’une de ces études, menée par le groupe de Chuan He, a
apporté un nouvel éclairage sur l’importance de la lecture de la méthylation des
ARNm par YTHDF1 dans la régulation des réponses immunitaires anti-tumorales [11].
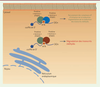 | Figure 2.
Les protéines lectrices YTHDF1, YTHDF2 et YTHDF3 modulent la
stabilité des ARNm porteurs de la modification m6A de
manière différentielle.
|
Pour commencer, les auteurs injectent à des souris des cellules de deux lignées
tumorales murines connues (lignée de mélanome B16-OVA ou d’adénocarcinome du côlon
MC38), suivent la croissance du volume tumoral au cours du temps, et constatent que
cette croissance tumorale est moins rapide chez les animaux génétiquement déficients
pour YTHDF1 (souris Ythdf1-/-) que chez les animaux
témoins. En utilisant des anticorps induisant une déplétion de certaines populations
immunitaires, ils montrent ensuite que cette amélioration dépend des lymphocytes T
CD8+. Pour quantifier la réponse anti-tumorale, les auteurs
s’appuient sur la lignée tumorale B16-OVA, dans laquelle l’antigène modèle
ovalbumine est surexprimé. Les tumeurs des souris
Ythdf1-/- contiennent plus de lymphocytes T
CD8+ spécifiques de l’ovalbumine que celles portées par des souris
témoins. Pour tester à quel moment cette différence apparaît, les auteurs prélèvent
le ganglion lymphatique drainant le site tumoral six jours après l’injection des
cellules tumorales, soit avant que les tumeurs ne deviennent visibles, et y
détectent, chez les souris Ythdf1-/-, une forte
augmentation du nombre de lymphocytes T CD8+ activés par un peptide
dérivé de l’ovalbumine. Cette observation suggère l’existence d’une activation plus
efficace des lymphocytes T CD8+ en l’absence de YTHDF1, et conduit les
auteurs à s’interroger sur la contribution de cette protéine à la présentation
d’antigènes par les DC. Ils utilisent alors un anticorps permettant de mesurer la
présentation d’un peptide dérivé de l’ovalbumine sur le CMH-I, et trouvent que les
DC provenant des souris Ythdf1-/- présentent davantage
de peptides à leur surface que les DC des souris témoins. Ces résultats indiquent
que YTHDF1 module l’efficacité de la présentation croisée de l’antigène tumoral par
les cellules dendritiques. |
Régulation de la présentation croisée par la méthylation des ARNm Afin d’identifier les sites de l’ARNm auxquels YTHDF1 est lié, les auteurs réalisent
ensuite des expériences de précipitation des ARNm suivies d’un séquençage à haut
débit (RIP-seq). En parallèle, ils comparent les niveaux d’ARNm porteurs
d’adénosines méthylées et l’efficacité de leur traduction dans des DC de souris
Ythdf1-/- et de souris témoins. En croisant les
informations apportées par ces différentes approches, il apparaît que dans les DC,
YTHDF1 promeut la traduction de divers ARNm, dont plusieurs codent des protéines du
lysosome, en particulier des cathepsines. Ainsi, dans les DC privées de YTHDF1, les
ARNm codant ces protéases sont moins traduits, ce qui rend les lysosomes moins
capables de dégradation protéique extensive. Les antigènes tumoraux ainsi préservés
sont présentés plus efficacement aux lymphocytes T CD8+, ce qui se
traduit par une amélioration des réponses anti-tumorales (Figure 3).
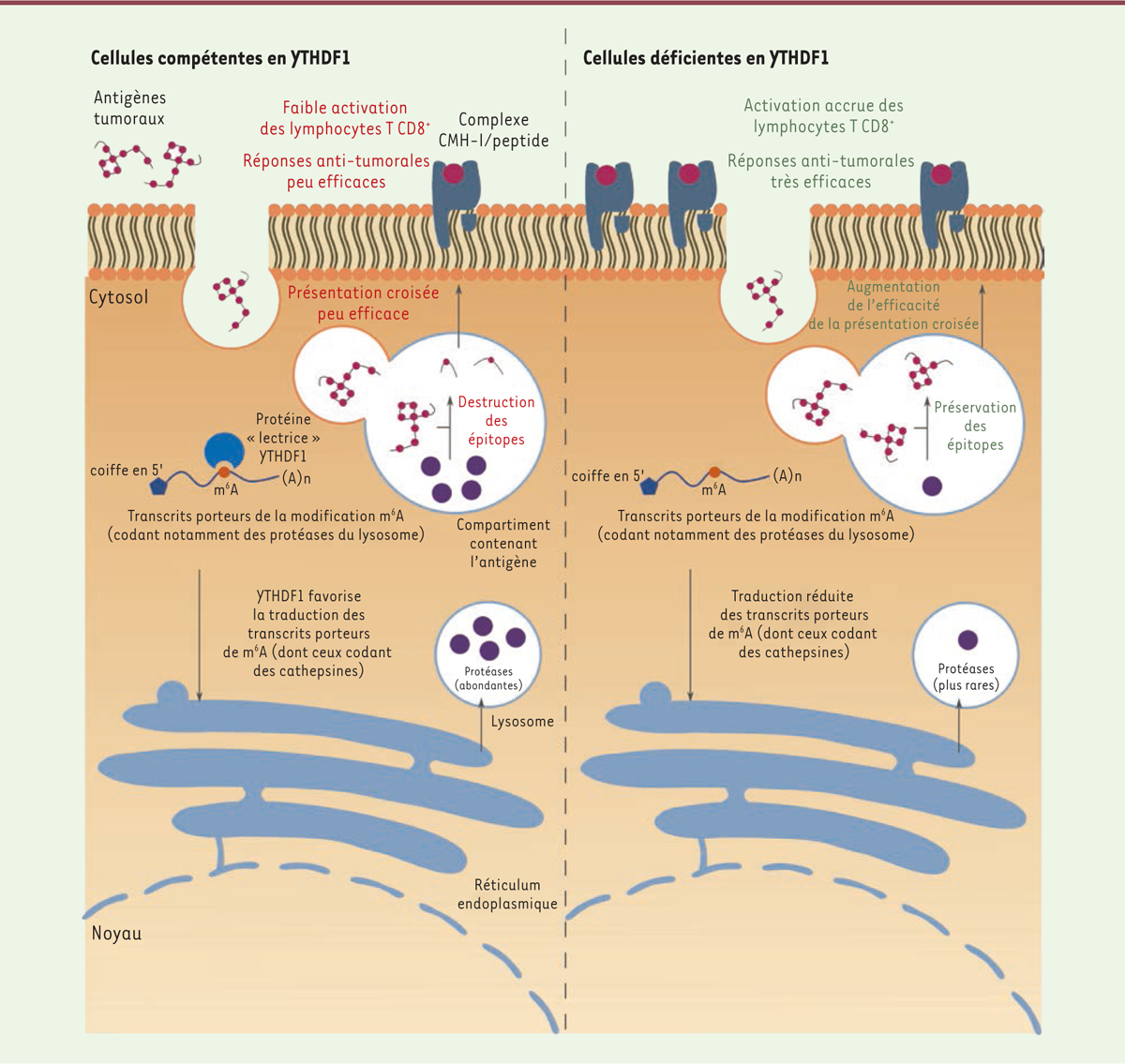
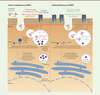 | Figure 3. La lecture de la modification m6A des ARNm par
YTHDF1 module l’efficacité de la présentation antigénique
croisée et des réponses antitumorales. Après
leur endocytose, les antigènes tumoraux sont partiellement dégradés au
sein des compartiments intracellulaires des cellules dendritiques par
les cathepsines. Dans les cellules dendritiques déficientes en YTHDF1,
la traduction des transcrits codant ces cathepsines est réduite, ce qui
conduit à une préservation des épitopes antigéniques. Ces épitopes sont
alors présentés plus efficacement aux lymphocytes T CD8+ par
l’intermédiaire des molécules du CMH-I. |
Ces résultats démontrent l’existence d’un niveau supplémentaire de contrôle de la
présentation croisée des antigènes. À cet égard, l’analyse des niveaux d’expression
de YTHDF1 et YTHDF2 dans les différentes populations de DC enrichirait certainement
notre compréhension des bases moléculaires de la spécialisation fonctionnelle des
cDC1 pour la présentation croisée. En effet, la protéolyse modérée observée dans les
compartiments intracellulaires des cDC1 pourrait, au moins en partie, s’expliquer
par une expression réduite de YTHDF1, à l’origine d’une plus faible traduction des
transcrits codant des protéases du lysosome. Par ailleurs, il est également
envisageable que cette sous-population de DC exprime davantage YTHDF2 et dégrade
donc plus activement ces transcrits. Si elles s’avèrent vérifiées expérimentalement,
ces hypothèses pourraient ouvrir la voie à un ciblage thérapeutique des protéines
YTHDF1 et YTHDF2 afin d’améliorer la capacité des cellules dendritiques à déclencher
les réponses anti-tumorales. |
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Footnotes |
1. DuboisM,
ArdinC,
AndréF,
et al.
L’immunothérapie, une révolution en oncologie. Revue de
l’efficacité des inhibiteurs de points de contrôle
immunitaire . Med Sci (Paris).
2019; ; 35 :
:937.–945. 2. HildnerK,
EdelsonBT,
PurthaWE,
et al.
Batf3 deficiency reveals a critical role for CD8α+
dendritic cells in cytotoxic T cell immunity .
Science.
2008; ; 322 :
:1097.–1100. 3. AlloattiA,
RookhuizenDC,
JoannasL,
et al.
Critical role for Sec22b-dependent antigen cross-presentation in
antitumor immunity . J Exp Med.
2017; ; 214 :
:2231.–2241. 4. SeguraE,
AlbistonAL,
WicksIP,
et al.
Different cross-presentation pathways in steady-state and
inflammatory dendritic cells . Proc Natl Acad Sci
USA.
2009; ; 106 :
:20377.–20381. 5. DudziakD,
KamphorstAO,
HeidkampGF,
et al.
Differential antigen processing by dendritic cell subsets in
vivo . Science.
2007; ; 315 :
:107.–111. 6. SavinaA,
JancicC,
HuguesS,
et al.
NOX2 controls phagosomal pH to regulate antigen processing during
crosspresentation by dendritic cells . Cell.
2006; ; 126 :
:205.–218. 7. ZhangC,
FuJ,
ZhouY.
A review in research progress concerning m6A
methylation and immunoregulation . Front
Immunol.
2019; ; 10 : :922.. 8. MeyerKD,
JaffreySR.
Rethinking m6A readers, writers, and
erasers . Annu Rev Cell Dev Biol.
2017; ; 33 :
:319.–342. 9. WangX,
ZhaoBS,
RoundtreeIA,
et al.
N6-methyladenosine modulates messenger RNA translation
efficiency . Cell.
2015; ; 161 :
:1388.–1399. 10. WangX,
LuZ,
GomezA,
et al.
N6-methyladenosine-dependent regulation of messenger
RNA stability . Nature.
2014; ; 505 :
:117.–120. 11. HanD,
LiuJ,
ChenC,
et al.
Anti-tumour immunity controlled through mRNA m6A
methylation and YTHDF1 in dendritic cells .
Nature.
2019; ; 566 :
:270.–274. |