| |
| Med Sci (Paris). 36(5): 449–451. doi: 10.1051/medsci/2020072.Monocytes et virus Zika À la conquête du cerveau Emma Partiot1 and Raphaël Gaudin1* 1Université de Montpellier, CNRS UMR 9004, Institut de recherche en
infectiologie de Montpellier, 1919 route de Mende, 34293Montpellier,
France MeSH keywords: Adulte, Animaux, Encéphale, Chimiotaxie des leucocytes, Femelle, Humains, Échappement immunitaire, Monocytes, Grossesse, Complications infectieuses de la grossesse, Charge virale, Virus Zika, Infection par le virus Zika, anatomopathologie, virologie, physiologie, immunologie, pathogénicité, épidémiologie |
Le réchauffement climatique est l’une des préoccupations majeures de notre société, et
certains ennemis de l’homme profitent de ce phénomène pour se propager. En effet, le
moustique tigre (Aedes albopictus) colonise dans l’hémisphère nord des
régions toujours plus septentrionales, et les arbovirus, qui utilisent ce moustique
comme vecteur de dissémination, profitent de cette conquête pour infecter de nouveaux
hôtes. Les virus comptent parmi les derniers « prédateurs » de l’homme [1]. Ils ont une grande capacité évolutive et
s’adaptent rapidement aux changements de leur environnement. Parmi les arbovirus, le
virus Zika (ZIKV), peu étudié il y a encore cinq ans, a fait récemment la une des
informations internationales. Découvert en 1947 dans la forêt Zika en Ouganda, ZIKV a
colonisé des territoires variés et provoqué de graves épidémies, dont la plus connue en
2015, au Brésil, où des millions de personnes ont été infectées [2]. En quelques années, l’épidémie s’est propagée au
reste du monde (États-Unis, autres pays d’Amérique du Sud, Asie), et en novembre 2019,
deux cas autochtones d’infection par le virus ont été découverts en France [3]. Cette colonisation rapide de
ZIKV à l’échelle mondiale a entraîné l’intensification des recherches sur ce virus. Plus de 70 % des infections par ZIKV sont asymptomatiques [4]. Cependant, l’infection chez la femme enceinte,
en particulier lors des premiers mois de la grossesse, augmente significativement le
risque de microcéphalie et d’autres anomalies neurologiques chez le fœtus. Chez
l’adulte, bien que l’association de ZIKV avec des troubles neurologiques graves comme
une encéphalite ou le syndrome de Guillain-Barré ait été rapportée, les effets de
l’infection à moyen et long terme sont encore incertains. En effet, ZIKV est capable de
persister dans le sperme et dans le système nerveux central (SNC) pendant plusieurs
mois, et une étude a montré que la présence du virus pourrait avoir des conséquences
non-négligeables sur les capacités cognitives de jeunes macaques [5]. Dans ce contexte, il reste à comprendre comment ZIKV est capable de passer de la
circulation sanguine au SNC, séparés par une couche de cellules imperméable : la
barrière hémato-encéphalique (BHE). Nos travaux récents nous ont conduits à proposer un
modèle, métaphoriquement comparable à la légende du cheval de Troie, selon lequel ZIKV
se cache dans les monocytes circulants du sang pour passer la BHE et se dissémine alors
dans le système nerveux central [6] (Figure 1).
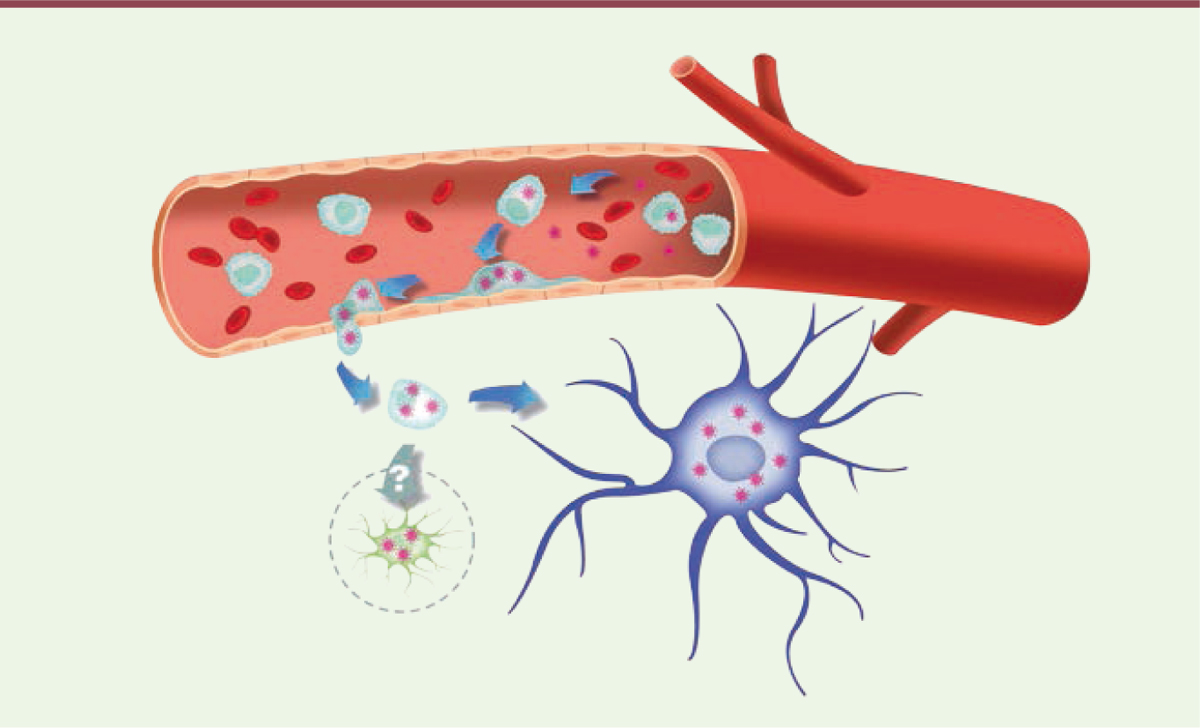
 | Figure 1. Modèle du « cheval de Troie »
ZIKV-monocyte-BHE. Le virus Zika (ZIKV, en rose)
circulant dans le vaisseau sanguin (en rouge) infecte les monocytes
environnants (en bleu clair). Il s’ensuit alors une reprogrammation qui
augmente la quantité de protéines impliquées dans l’adhérence cellulaire à
la surface des monocytes. Les monocytes infectés tendent alors à adhérer
davantage à l’endothélium du vaisseau sanguin (en beige) et à migrer dans le
tissu nerveux à travers la BHE. Une fois dans le tissu nerveux, les
monocytes favorisent la dissémination du virus vers les cellules neurales
(en violet). Le devenir des monocytes infectés (en vert clair) reste
inconnu. |
|
Les monocytes du sang sont une cible du virus Zika Les monocytes circulants du sang ont la capacité de transmigrer vers les tissus et de
s’y différencier en cellules dendritiques ou en macrophages, selon le contexte
cytokinique [7]. Ces cellules
sont donc des cibles de choix pour les virus, leur permettant de voyager sur de
longues distances sans être « repérés » par le système immunitaire [8]. Plusieurs groupes, incluant le nôtre, ont montré que ZIKV infecte préférentiellement
les monocytes (en particulier le sous-type CD14+ CD16+) plutôt
que les autres leucocytes [6, 9, 10]. De plus, grâce à la détection de la
protéine virale non structurale NS2B et de l’ARN double brin, et grâce à la
quantification de la production de particules virales infectieuses, nous avons
montré que le virus infecte de façon productive les monocytes primaires humains,
bien que les niveaux de production du virus par les monocytes soient très bas [6]. |
Les monocytes, agents de dissémination du virus Zika Nous avons étudié la capacité de monocytes (cellules aptes à migrer dans les tissus)
à propager l’infection à des cellules neuronales dans un modèle d’organoïdes
cérébraux dérivés de cellules souches embryonnaires. Dans ce modèle, nous avons
observé une accélération de la dissémination de ZIKV associé aux monocytes par
rapport à celle du virus libre. En effet, des cellules neuronales étaient déjà
infectées deux jours après l’introduction de ZIKV dans le milieu de culture,
uniquement dans le cas d’une incubation avec des monocytes infectés. En revanche,
sept jours plus tard, des niveaux similaires d’infection des cellules neuronales
étaient observés, que les organoïdes aient été incubés avec des monocytes
préalablement infectés par le virus ou avec le virus libre [6]. Ces résultats semblent indiquer que l’infection des
monocytes par ZIKV constitue un moyen efficace pour accélérer la dissémination de
ZIKV et l’infection des tissus de l’hôte. Nous avons ensuite étudié le rôle des monocytes infectés dans les maladies
neuronales. L’infection de souris par ZIKV provoque des modifications considérables
de l’architecture neuronale, notamment dans le cervelet [11]. Nous avons utilisé un modèle de culture
ex vivo de coupes de cervelet de souris, qui nous a permis de
montrer que les monocytes infectés provoquent des perturbations structurelles du
cervelet, un phénomène qui n’apparaît pas en présence du virus libre ou de monocytes
non-infectés. L’ensemble de ces résultats suggère que les monocytes jouent un rôle
majeur dans la physiopathologie de l’infection par ZIKV. |
Le virus Zika induit un programme pro-migratoire dans les monocytes La BHE est constituée par les cellules endothéliales des capillaires cérébraux, qui
sont unies par des jonctions serrées (tight junctions). Il existe
cependant, à travers la BHE, des échanges moléculaires et cellulaires contrôlés
entre le système nerveux central et le reste de l’organisme [12]. Les monocytes traversent la BHE par un
processus de transmigration comportant plusieurs étapes : d’abord un roulement de la
cellule le long de la paroi interne du vaisseau sanguin, puis son attachement plus
ferme à l’endothélium grâce à une séquence d’interactions entre différentes
molécules d’adhérence exprimées par les monocytes et les cellules endothéliales, ce
qui entraîne l’immobilisation du monocyte ; l’attachement se renforce ensuite par de
nouvelles interactions plus robustes entre molécules d’adhérence lors du contact
cellule-cellule, avant l’étape finale de migration à travers l’endothélium
(diapédèse). Deux modes de passage sont possibles, sans être mutuellement exclusifs
: un passage « paracellulaire » du monocyte à la jonction entre deux cellules
endothéliales, ou un passage « transcellulaire » à travers une cellule endothéliale
[13]. Afin de mimer la transmigration des monocytes, nous avons utilisé comme modèle de la
BHE une couche de cellules endothéliales (lignée cellulaire endothéliale dérivée de
la BHE) cultivées sur une membrane poreuse placée au-dessus d’un puits. Les
monocytes sont déposés sur cette membrane, et l’efficacité de leur transmigration
est évaluée par quantification des cellules récupérées dans la chambre inférieure du
puits. Ce système expérimental a permis de montrer que les monocytes infectés par
ZIKV transmigrent davantage que des monocytes non infectés. Grâce à ce système et à
l’ajout d’organoïdes cérébraux dans la chambre inférieure du puits, nous avons pu
également confirmer l’avantage du virus à utiliser le monocyte pour se disséminer
dans le tissu nerveux [6]. Ce modèle expérimental ne permet cependant pas de mimer le flux sanguin auquel sont
naturellement exposés les monocytes circulants. Nous avons donc développé un modèle
d’embryon de poisson-zèbre permettant de mesurer la transmigration des monocytes
in vivo. En accord avec les résultats obtenus in
vitro, l’exposition des monocytes à ZIKV induit une augmentation
significative de leur transmigration par rapport à des monocytes non-infectés. Ce
résultat constitue l’une des premières preuves in vivo à l’appui du
modèle du « cheval de Troie », qui avait été proposé pour la première fois il y a 35
ans à propos d’un lentivirus infectant les ovins [14]. |
L’exposition de monocytes au virus Zika augmente leur capacité d’adhérence à
divers substrats Une analyse protéomique différentielle des monocytes afin de déterminer les
mécanismes moléculaires responsables de l’augmentation de la transmigration des
monocytes infectés par ZIKV a révélé que l’infection par ce virus augmente
l’expression de nombreuses molécules d’adhérence par rapport aux monocytes
non-infectés. Ce résultat est spécifique de l’infection par ZIKV, puisque ni le
virus de la dengue (un flavivirus proche de ZIKV), ni le virus de l’immunodéficience
humain VIH-1 (un virus induisant aussi une augmentation de la transmigration) [15] n’augmente l’expression
des molécules d’adhérence dans les monocytes. En revanche, ZIKV n’induit pas
d’activation notable du monocyte. Dans des tests in vitro
d’adhérence sur collagène, fibronectine, ICAM-1 (intercellular adhesion
molecule-1), ou sur cellules endothéliales de BHE, ZIKV favorise
l’adhérence des monocytes sur tout type de substrat. L’imagerie en temps réel de
monocytes injectés dans la circulation sanguine de poissons-zèbres a révélé
qu’in vivo, les monocytes exposés à ZIKV ont également une plus
grande capacité d’attachement à l’endothélium des vaisseaux sanguins. En effet,
environ quatre monocytes sur dix adhèrent à l’endothélium lorsqu’ils ont
préalablement été exposés à ZIKV, contre seulement un monocyte naïf sur dix.
Cependant, une fois que le monocyte a adhéré, la durée moyenne d’attachement à
l’endothélium est similaire, qu’il ait été exposé au virus ou non. Enfin, les monocytes exposés au virus semblent adopter un mode migratoire différent
des cellules non-infectées. En effet, l’infection par ZIKV entraîne d’importants
changements morphologiques des monocytes, qui s’aplatissent et s’étendent sur les
cellules endothéliales, ce qui implique un remodelage majeur du cytosquelette et des
membranes de ces monocytes, alors que les monocytes non infectés conservent une
forme relativement sphérique (Figure
2).
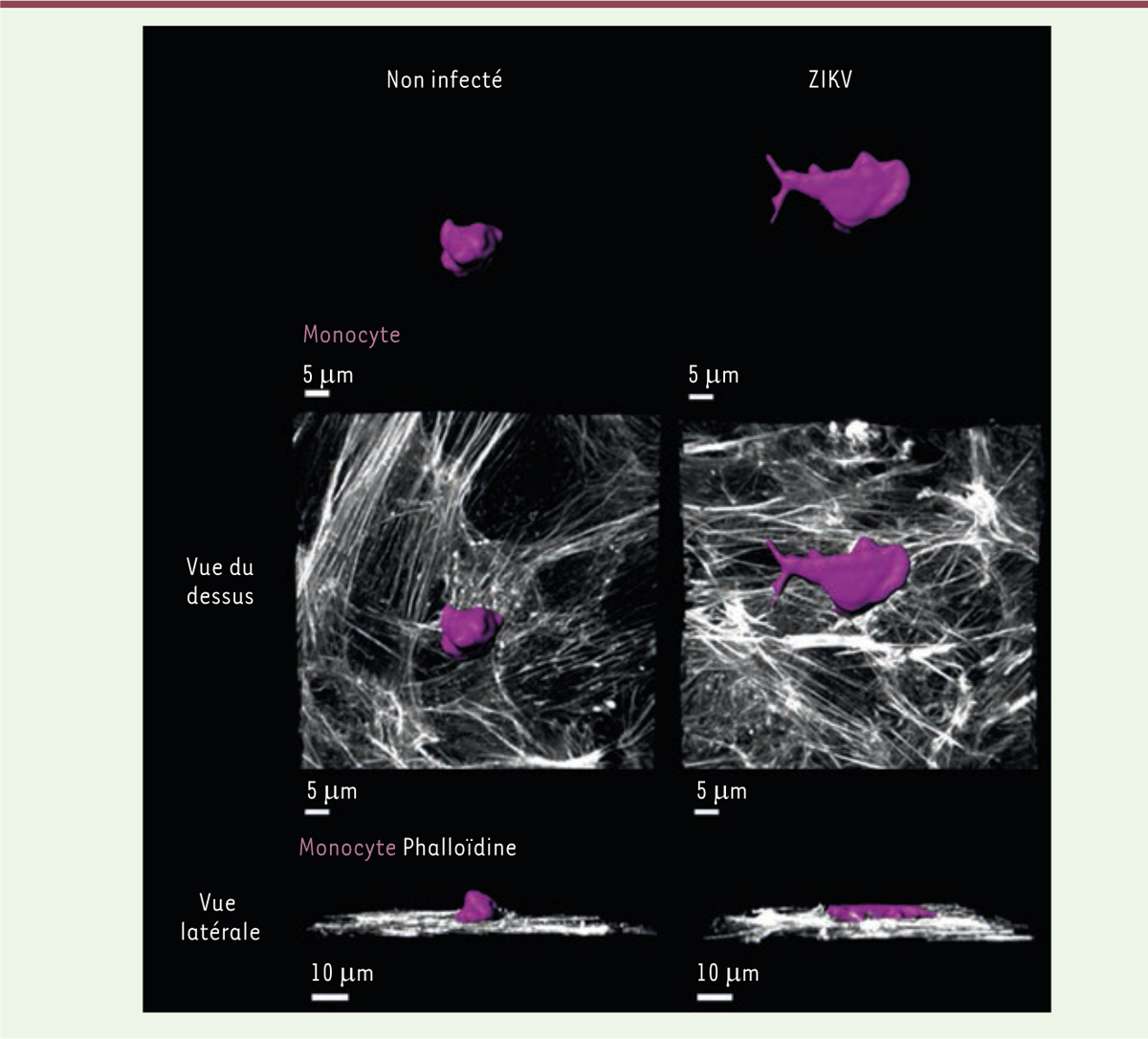
 | Figure 2. Influence du virus Zika sur la morphologie des monocytes
adhérant aux cellules endothéliales. À droite,
l’infection du monocyte (en rose) par ZIKV provoque son aplatissement
lors de son immobilisation sur une monocouche de cellules endothéliales,
dont le cytosquelette d’actine a été marqué par la phalloïdine (en
blanc). À gauche, monocyte non infecté, pour comparaison. |
|
Nous avons caractérisé in vitro, ex vivo, et
in vivo, un nouveau processus par lequel ZIKV favorise la
transmigration des monocytes exposés à travers la BHE et se dissémine dans le
cerveau. Cependant, les mécanismes moléculaires impliqués dans les différentes
étapes de ce processus restent en grande partie à élucider. Les modifications
morphologiques des monocytes induites par ZIKV lors de leur transmigration laissent
entrevoir la possibilité d’une thérapie ciblant ces modifications afin d’empêcher ou
de limiter les atteintes neurologiques au cours de l’infection. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
E.P. et R.G. bénéficient respectivement d’un financement de l’école doctorale
Sciences chimiques et biologiques pour la santé (CBS2 Montpellier) et du CNRS. Nous
remercions Marie-José Partiot pour la réalisation de l’illustration présentée sur la
Figure 1.
|
1. Outbreak (novel). Wikipedia
2019.. 2. HillsSL,
FischerM,
PetersenLR.
Epidemiology of Zika virus infection .
J Infect Dis.
2017; ; 216 :
:S868.–S874. 3. SalinasS,
SimoninY,
L’AmbertG,
NisoleS.
Cas autochtones de virus Zika en France métropolitaine : un
changement de paradigme pour cet arbovirus ? .
Virologie.
2019; ; 23 :
:329.–332. 4. PiersonTC,
DiamondMS.
The emergence of Zika virus and its new clinical
syndromes . Nature.
2018; ; 560 :
:573.–581. 5. Mavigner
M,
Raper
J,
Kovacs-Balint
Z, et al.
Postnatal Zika virus infection is associated with persistent
abnormalities in brain structure, function, and behavior in infant
macaques . Sci Transl Med.
2018;; 10 : doi: 10.1126/scitranslmed.aao6975. 6. Ayala-NunezNV,
FollainG,
DelalandeF,
et al.
Zika virus enhances monocyte adhesion and transmigration favoring
viral dissemination to neural cells . Nat
Commun.
2019; ; 10 :
:1.–16. 7. TehYC,
DingJL,
NgLG,
ChongSZ.
Capturing the fantastic voyage of monocytes through time and
space . Front Immunol.
2019; ; 10 : :834.. 8. Nikitina
E,
Larionova
I,
Choinzonov
E,
Kzhyshkowska
J. Monocytes and
macrophages as viral targets and reservoirs . Int J
Mol Sci.
2018;; 19 : doi: 10.3390/ijms19092821. 9. FooSS,
ChenW,
ChanY,
et al.
Asian Zika virus strains target CD14+ blood monocytes
and induce M2-skewed immunosuppression during pregnancy .
Nat Microbiol.
2017; ; 2 :
:1558.–1570. 10. MichlmayrD,
AndradeP,
GonzalezK,
et al.
CD14+ CD16+ monocytes are the main target
of Zika virus infection in peripheral blood mononuclear cells in a
paediatric study in Nicaragua . Nat
Microbiol.
2017; ; 2 :
:1462.–1470. 11. CuiL,
ZouP,
ChenE,
et al.
Visual and motor deficits in grown-up mice with congenital Zika
virus infection . EBioMedicine.
2017; ; 20 :
:193.–201. 12. DanemanR,
PratA.
The blood-brain barrier . Cold Spring
Harb Perspect Biol.
2015; ; 7 :
:a020412.. 13. GerhardtT,
LeyK.
Monocyte trafficking across the vessel wall .
Cardiovasc Res.
2015; ; 107 :
:321.–330. 14. PelusoR,
HaaseA,
StowringL,
et al.
Trojan Horse mechanism for the spread of visna virus in
monocytes . Virology.
1985; ; 147 :
:231.–236. 15. WilliamsDW,
EugeninEA,
CalderonTM,
BermanJW.
Monocyte maturation, HIV susceptibility, and transmigration
across the blood brain barrier are critical in HIV
neuropathogenesis . J Leukoc Biol.
2012; ; 91 :
:401.–415. |