| |
| Med Sci (Paris). 36(5): 452–454. doi: 10.1051/medsci/2020073.Glioblastome multiforme Les fleurs du MALT1 Clément Maghe,1 Kathryn A. Jacobs,1 Nicolas Bidère,1 and Julie Gavard1,2* 1Équipe SOAP (Signalisation en oncogenèse, angiogenèse et
perméabilité), CRCINA (centre de recherche en cancérologie et immunologie
Nantes Angers), Inserm, CNRS, Université de Nantes, Université d’Angers,
IRSUN (Institut de recherche en santé de l’université de
Nantes), 8 quai
Moncousu, 44000Nantes,
France. 2Institut de cancérologie de l’Ouest (ICO),
Saint-Herblain,
France. MeSH keywords: Tumeurs du cerveau, Carcinogenèse, Survie cellulaire, Glioblastome, Humains, Lysosomes, Protéine-1 de translocation de lymphome du tissu lymphoïde associé aux muqueuses, Cellules souches tumorales, Transduction du signal, Niche de cellules souches, Microenvironnement tumoral, génétique, anatomopathologie, métabolisme, physiologie |
Le glioblastome multiforme, un cancer incurable L’Organisation mondiale de la santé (OMS) a défini le glioblastome multiforme comme
un cancer astrocytaire de grade IV. La survie médiane de cette tumeur cérébrale est
d’environ 15 mois, malgré un traitement combinant chirurgie intracrânienne et
séances concomitantes de radiothérapie et de chimiothérapie [1]. Les rechutes à proximité de la tumeur
initiale, quasi inéluctables, évoluent rapidement et inexorablement jusqu’au décès
du patient. Cet échec thérapeutique peut s’expliquer non seulement par les
résistances intrinsèques des cellules tumorales, mais aussi par la présence d’un
groupe minoritaire de cellules tumorales aux caractéristiques de cellules souches
(glioblastoma stem-like cells, GSC). Les résultats de plusieurs
travaux convergent vers l’idée que les GSC contrôlent l’initiation, la progression
et la rechute de ces tumeurs [2], bien que les mécanismes en jeu restent mal compris. Ces cellules
partagent de nombreuses caractéristiques avec les cellules souches neurales adultes,
notamment la capacité d’auto-renouvellement et de différenciation dans le lignage
neural [2]. Éradiquer cette fraction de
cellules tumorales apparaît donc comme une stratégie thérapeutique pertinente. |
Afin d’identifier des facteurs de vulnérabilité contrôlant l’expansion des GSC, les
données transcriptomiques du TCGA (the cancer genome atlas)
concernant plus de 400 patients atteints d’un glioblastome ont été interrogées. En
se concentrant sur les gènes impliqués dans l’activation du facteur de transcription
NF-κB (nuclear factor-kappa B), une voie essentielle dans la
prolifération et la survie cellulaires dans de nombreux cancers [3, 4], la paracaspase MALT1
(mucosa-associated lymphoid tissue lymphoma translocation protein
1) a émergé comme un nouvel acteur potentiel de la gliomagenèse [5]. L’expression de cette
enzyme apparaît en effet corrélée à la fois au grade des tumeurs cérébrales et à la
survie des patients atteints d’un glioblastome. Les fonctions cellulaires de MALT1
sont doubles. D’une part, elle agit en tant que protéine adaptatrice au sein du
complexe de protéines impliqué dans la mise en place de la voie de signalisation
NF-κB [3, 4], et, d’autre part, elle exerce une activité protéolytique à un site
consensus de la séquence de ses protéines cibles, après un résidu arginine. Le
nombre de substrats avérés de MALT1 se limite à une dizaine, mais leur champ
d’action s’étend du contrôle des voies NF-κB et JNK (jun N-terminal
kinase), à l’adhérence cellulaire et à la stabilité des ARN [3] (Figure
1). La protéase MALT1, normalement maintenue dans une
conformation inactive, est activée dans les cellules immunitaires pour contrôler la
signalisation antigénique [3]. C’est aussi le
cas dans les cellules non-immunitaires en réponse à l’activation de certains
récepteurs membranaires (Figure
1). Pourtant, une étude biochimique du répertoire connu des
substrats de MALT1 montre qu’une fraction de cette protéase est constitutivement
active dans les GSC [5]. En accord avec ce
résultat, l’expression d’une version de MALT1 dépourvue d’activité catalytique
permet de réduire la protéolyse de ses substrats dans les cellules de patients
atteints d’un glioblastome. Nos résultats sont en faveur de l’idée que MALT1 serait
« piratée » dans le glioblastome, comme c’est le cas dans certains lymphomes [3-5].
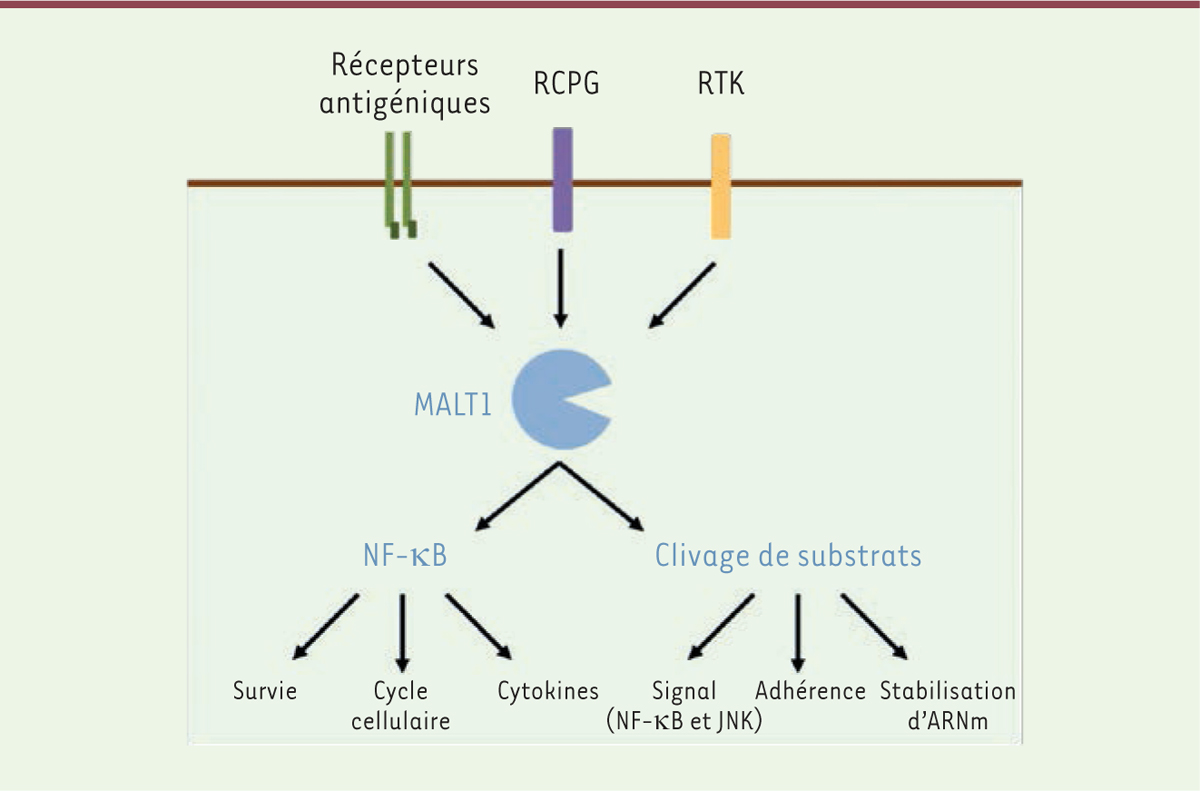
 | Figure 1. MALT1 est un acteur essentiel de la voie de signalisation
NF-kB. La protéine MALT1 est activée par la
stimulation des récepteurs antigéniques dans les cellules immunitaires,
ainsi que par l’activation des récepteurs à activité tyrosine kinase
(RTK) ou couplés aux protéines G (RCPG) dans les cellules
non-immunitaires. Par sa fonction de protéine adaptatrice, MALT1
contribue à l’élaboration d’un complexe de signalisation en charge
d’activer le facteur de transcription NF-κB. Cette cascade de
signalisation libère également l’activité enzymatique de la paracaspase
MALT1. La protéolyse des substrats de MALT1 module des mécanismes
d’adhérence cellulaire, de stabilité des ARN messagers (ARNm), et de la
régulation des voies NF-κB et JNK. |
|
MALT1 contribue à la survie des GSC Par analogie avec les travaux démontrant l’addiction de cellules de lymphomes à
l’activité de MALT1 [3, 4], nous avons exploré l’impact de l’expression et de l’activité
de cette protéase sur le maintien du réservoir de GSC et avons montré que la
réduction de l’expression de MALT1 dans des GSC induit une diminution de leur
prolifération, de leur survie, et de l’expression de marqueurs de ces cellules
[5]. Ces résultats ont été reproduits en
utilisant des inhibiteurs de MALT1, tels que l’antagoniste peptidique compétitif
z-VRPR-fmk, et des médicaments de la famille des phénothiazines, comme la molécule
anti-psychotique mépazine, un inhibiteur allostérique de MALT1 [4] (Figure
2). Ces agents pharmacologiques ont une toxicité sélective
pour les GSC, et n’affectent pas la viabilité de cellules saines du cerveau
(astrocytes, neurones, et cellules endothéliales) [5]. Finalement, l’administration journalière de mépazine permet de
réduire de façon significative la croissance tumorale dans un modèle de souris
greffées avec des GSC humaines [5]. Ces
résultats montrent que la protéase MALT1 est nécessaire au maintien des GSC et
contribue à l’expansion tumorale.
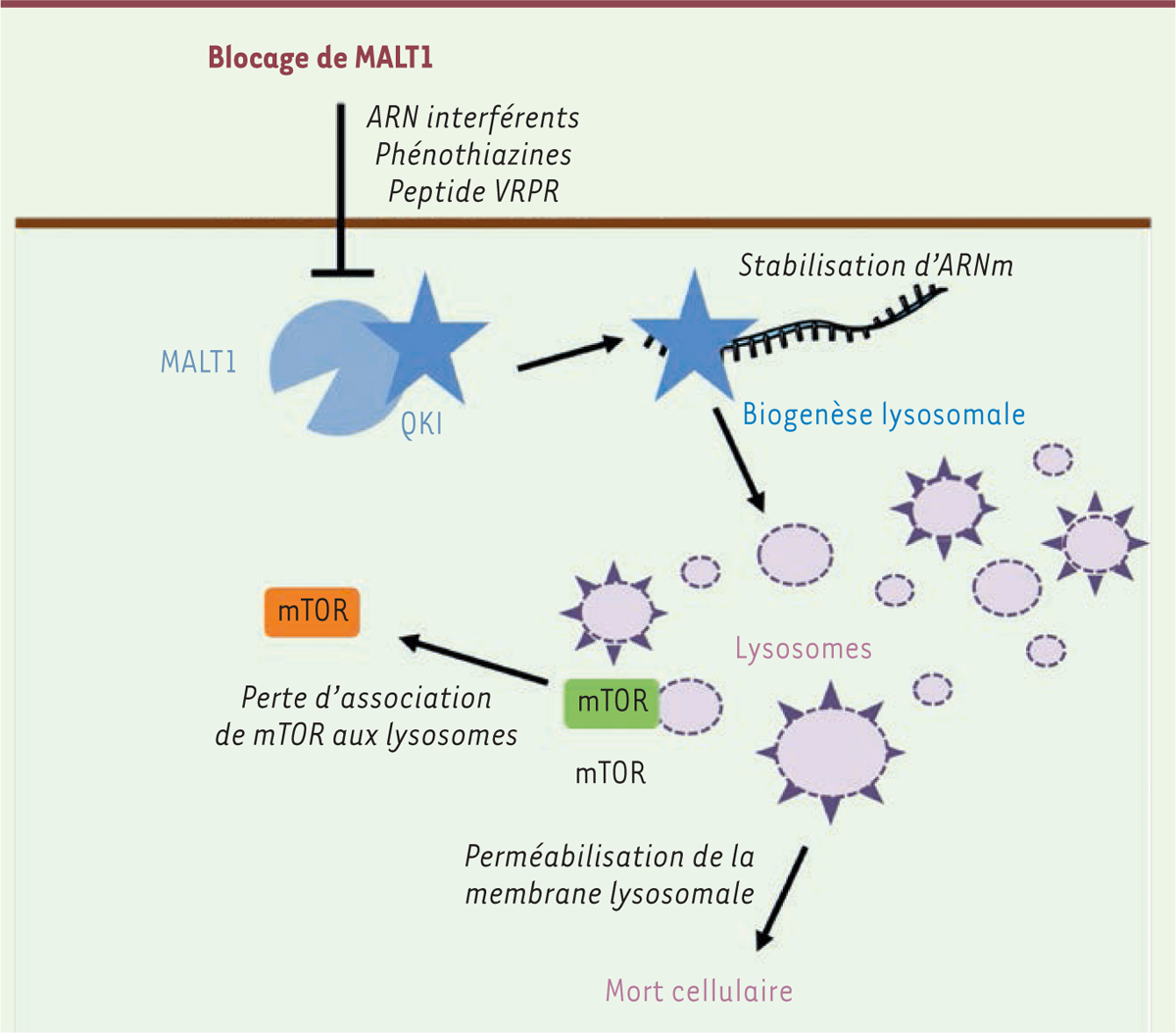
 | Figure 2. MALT1 est un agent essentiel de l’homéostasie des lysosomes
dans les GSC. Dans les cellules de type «
cellule souche » du glioblastome (GSC, glioblastoma stem-like
cells), MALT1 interagit avec la protéine
quaking (QKI), une protéine de liaison à l’ARN.
L’inhibition de l’activité enzymatique de MALT1 par les phénothiazines
ou par le peptide compétitif VRPR, ainsi que la réduction de son
expression par des ARN interférents libère QKI, qui exerce alors son
activité de protéine de liaison à l’ARN, et autorise la traduction d’ARN
messagers (ARNm) codant des protéines du lysosome. Il en résulte une
abondance anormale des lysosomes. Les lysosomes nouvellement formés ont
une membrane plus perméable aux protéases et sont déconnectés de la voie
de signalisation mTOR. La perte d’intégrité de la membrane de ces
lysosomes induit un déversement de leurs enzymes dégradatives dans le
cytosol, conduisant à la mort des GSC. |
|
Rôle de MALT1 dans l’homéostasie des lysosomes Fonctionnellement, nos résultats indiquent que la mort des GSC induite par la
mépazine n’implique pas un processus de mort cellulaire programmée par apoptose ou
nécroptose [5]. En revanche, le blocage des
enzymes du lysosome, telles que les cathepsines, contrecarre en partie l’effet de la
mépazine sur la viabilité des GSC. En outre, l’inhibition de MALT1 est associée au
relargage de protéases du lysosome dans le cytoplasme, suggérant donc un phénomène
de perméabilisation de la membrane lysosomale [6], fatal aux GSC. Par ailleurs, des analyses du
compartiment endo-lysosomal des GSC par imagerie cellulaire ont montré une
augmentation de l’abondance de ce compartiment en cas d’inhibition de MALT1 ou de
réduction de son expression [5]. Ces résultats
font écho aux données récentes indiquant que le nombre de lysosomes est finement
régulé dans les cellules souches neurales normales, et que ce nombre contrôle la
survie des GSC [7-9]. MALT1 agirait donc comme un
rempart contre une augmentation de la quantité de lysosomes, nocive pour les GSC,
dévoilant ainsi un facteur de vulnérabilité de ces cellules (Figure 2). Dans le but de comprendre le lien entre MALT1 et les lysosomes, nous avons mené une
analyse transcriptomique par séquençage de l’ARN dans les GSC traitées ou non à la
mépazine [5]. Étonnamment, l’expression des
gènes impliqués dans l’homéostasie et la biogenèse endo-lysosomales n’est pas
modifiée en réponse à l’inhibition de MALT1. En revanche, l’analyse in
silico des données transcriptomiques prédit la modification d’une
signature de gènes correspondant à la voie de signalisation mTOR
(mammalian/mechanistic target of rapamycin). Ces résultats nous
ont conduits à étudier plus en détail la voie de signalisation mTOR, dont une partie
des protéines est ancrée aux lysosomes. Nous avons montré que l’inhibition de MALT1
déconnecte mTOR des lysosomes et atténue la voie de signalisation mTOR tumorale
[5], essentielle au maintien des GSC
[10]. Ainsi,
l’inactivation de MALT1 entraîne une augmentation incontrôlée de la biosynthèse des
lysosomes qui, en plus, semblent dysfonctionnels. En effet, nos résultats suggèrent
que les lysosomes nouvellement formés ont une plus grande perméabilité de leur
membrane, ce qui permet à des enzymes protéolytiques, normalement confinées à
l’intérieur des lysosomes, d’exercer leur activité dans le cytosol. En outre, une
analyse en imagerie confocale montre que les lysosomes nouvellement formés sont
déconnectés de la voie de signalisation mTOR. Nos recherches s’attachent désormais à
mieux caractériser les défauts de ces lysosomes. Comment MALT1 peut-elle moduler la quantité de lysosomes ? L’action déterminante de
quaking (QKI), une protéine qui se lie à l’ARN messager (ARNm),
dans le maintien des GSC a récemment été rapportée [7]. Cette protéine permet en effet de stabiliser des ARNm codant des
protéines endo-lysosomales. Nous avons montré que MALT1 et QKI interagissent dans
les GSC [5]. La surexpression de QKI, qui
modifie la stœchiométrie du complexe MALT1/QKI, suffit à reproduire les effets de
l’inhibition de MALT1 dans les GSC. Inversement, la réduction de l’expression de QKI
permet de contrer l’effet de l’inhibition de MALT1 dans ces cellules [5]. Ainsi, il existe une interaction réciproque
antagoniste entre ces deux protéines. |
Nos travaux attribuent donc un nouveau rôle à la protéase MALT1 dans l’homéostasie
des lysosomes. Par la rétention de QKI, MALT1 restreint la genèse du compartiment
endo-lysosomal. Nous montrons également que l’activité de MALT1 permet la
signalisation mTOR, essentielle à l’expansion des GSC, renforçant l’idée que MALT1
participe au contrôle de cette voie métabolique. En révélant le rôle de la protéase
MALT1 dans le contrôle de la quantité et de l’activité des lysosomes qui, lorsqu’ils
sont en excès, empêchent l’expansion des GSC, nos résultats ouvrent une perspective
thérapeutique originale dans le combat contre le glioblastome multiforme. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Nous tenons à remercier les membres présents et passés du laboratoire « Signalisation
en oncogenèse, angiogenèse et perméabilité », Centre de recherche en
cancérologie-immunologie de Nantes Angers, Inserm, CNRS, université de Nantes. Les
projets de l’équipe sont soutenus par la fondation pour la recherche médicale, la
fondation ARC, la Ligue contre le cancer, la Fondation de France, et l’Institut
national du cancer.
|
1. StuppR,
MasonWP,
Van den
BentMJ, et
al.
Radiotherapy plus concomitant and adjuvant temozolomide for
glioblastoma . N Engl J Med.
2005; ; 352 :
:987.–996. 2. LathiaJD,
MackSC,
Mulkearns-HubertEE,
et al.
Cancer stem cells in glioblastoma . Genes
Dev.
2015; ; 29 :
:1203.–1217. 3. ThysA,
DouanneT,
BidereN.
Post-translational modifications of the CARMA1-BCL10-MALT1
complex in lymphocytes and activated B-cell-like subtype of diffuse large
B-cell lymphoma . Front Oncol.
2018; ; 8 : :498.. 4. NagelD,
SprangerS,
VincendeauM,
et al.
Pharmacologic inhibition of MALT1 protease by phenothiazines as a
therapeutic approach for the treatment of aggressive
ABC-DLBCL . Cancer Cell.
2012; ; 22 :
:825.–837. 5. Jacobs
KA,
André-Grégoire
G,
Maghe
C, et al.
Paracaspase MALT1 regulates glioma cell survival by controlling
endo-lysosome homeostasis . EMBO J.
2020;; 39 :
:e102030.. 6. AitsS,
JäätteläM.
Lysosomal cell death at a glance . J
Cell Sci.
2013; ; 126 :
:1905.–1912. 7. ShinguT,
HoA
L,
YuanL,
et al.
Qki deficiency maintains stemness of glioma stem cells in
suboptimal environment by downregulating endolysosomal
degradation . Nat Genet.
2017; ; 49 :
:75.–86. 8. LeemanDS,
HebestreitK,
RuetzT,
et al.
Lysosome activation clears aggregates and enhances quiescent
neural stem cell activation during aging .
Science.
2018; ; 359 :
:1277.–1283. 9. Le
JoncourV,
FilppuP,
HyvönenM,
et al.
Vulnerability of invasive glioblastoma cells to lysosomal
membrane destabilization . EMBO Mol Med.
2019; ; 11 : :e9034.. 10. Galan-MoyaEM,
Le
GuelteA,
Lima
FernandesE,
et al.
Secreted factors from brain endothelial cells maintain
glioblastoma stem-like cell expansion through the mTOR
pathway . EMBO Rep.
2011; ; 12 :
:470.–476. |