| |
| Med Sci (Paris). 36(5): 455–458. doi: 10.1051/medsci/2020074.Sévérité de l’hypertension hyperkaliémique familiale
causée par les mutations de CUL-3 Une histoire de reins et de vaisseaux Chloé Rafael1,2b and Juliette Hadchouel3,4a 1Centre de recherche des Cordeliers, Inserm UMR-S1138,
Sorbonne université, Université de Paris, 15 rue de l’École de Médecine,
75006Paris,
France. 2CNRS ERL 8228 - Laboratoire de physiologie rénale et
tubulopathies, 75006, Paris, France. 3Inserm UMR_S1155, Hôpital Tenon,
4 rue de la Chine,
75020Paris,
France. 4Faculté de médecine, Sorbonne université,
Paris,
France. MeSH keywords: Vaisseaux sanguins, Cullines, Humains, Hypertension artérielle, Rein, Mutation, Protéolyse, Pseudohypoaldostéronisme, Indice de gravité de la maladie, Vasoconstriction, Protéine G RhoA, anatomopathologie, physiopathologie, génétique, métabolisme |
L’hypertension hyperkaliémique familiale (HHF) est une forme mendélienne rare
d’hypertension artérielle associée à une hyperkaliémie et une acidose métabolique
hyperchlorémique. Ces troubles sont corrigés par les diurétiques thiazidiques,
inhibiteurs du cotransporteur Na+/Cl-
(Na+-Cl− cotransporter, NCC) exprimé dans
le tube contourné distal du néphron. Les premières analyses génétiques ont mis en
évidence des mutations dans les gènes codant les sérine-thréonine kinases WNK1 et WNK4
(with no (K) lysine) chez une minorité (8,5 %) de patients HHF
[1]. De multiples études
in vitro et in vivo ont permis de montrer que ces
kinases stimulent l’activité du cotransporteur NCC grâce à une cascade de
phosphorylations [2]
(→).
(→) Voir la Synthèse de C. Rafael et al., m/s n° 3, mars 2016,
page 274
En 2012, des nouvelles mutations dans les gènes CUL3
(cullin-3) et KLHL3 (kelch-like family
member 3) ont été identifiées chez 47 % des patients [3]. Les protéines CUL3 et KLHL3 font partie
d’un complexe ubiquitine-ligase E3 permettant l’ubiquitination de protéines cibles en
vue de leur dégradation par le protéasome. WNK1 et WNK4 sont des substrats de ce
complexe enzymatique [4]
(Figure 1).
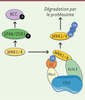 | Figure 1.Le complexe ubiquitine ligase E3-CUL3/KLHL3 inhibe la voie de
signalisation induite par WNK1 et WNK4. Les kinases
SPAK ( Ste20-related proline alanine-rich kinase) et OSR1
( oxidative stress response 1) sont phosphorylées et
activées par les kinases WNK1 et WNK4. Une fois activées, SPAK et OSR1
activent NCC ( Na+-Cl− cotransporter)
par phosphorylation. Le complexe ubiquitine ligase E3 CUL3/KLHL3 recrute
WNK1 et WNK4 pour induire leur dégradation par le protéasome, ce qui
entraîne une diminution de leur abondance. La diminution de l’abondance des
kinases diminue l’activation de NCC, ce qui limite la réabsorption de NaCl
dans le tube contourné distal du néphron (figure adaptée de [ 7]). |
|
Des mutations de gènes différents, mais des conséquences communes Les mutations de WNK1 sont de grandes délétions du premier intron du
gène. Ces délétions entraînent une augmentation de l’expression de l’isoforme longue
de la kinase WNK1 (long WNK1, L-WNK1) dans le tube contourné distal
du néphron [5]. Les mutations
de WNK4 empêchent, quant à elles, l’interaction entre WNK4 et
KLHL3, ce qui entraîne une diminution de l’ubiquitination et de la dégradation de la
kinase par le protéasome [4]. Les mutations de
KLHL3 ont un effet équivalent car elles empêchent le
recrutement des substrats ou la fixation de KLHL3 à CUL3. Dans les deux cas, ces
mutations empêchent la dégradation des substrats du complexe KLHL3-CUL3, dont L-WNK1
et WNK4, par le protéasome (Figure
1). Enfin, les mutations de CUL3 sont
localisées dans des séquences impliquées dans l’épissage de l’exon 9, et entraînent
l’absence de cet exon (par exon skipping) dans le transcrit mature
[6]. Toutes les études
in vitro ont montré que l’absence du domaine protéique codé par
cet exon diminue l’activité du complexe ubiquitine-ligase, bien que les mécanismes
ne soient pas encore définis avec précision [7]. Les mutations de CUL3 causent donc également une
diminution de l’ubiquitination et de la dégradation de L-WNK1 et WNK4. Par
conséquent, toutes les mutations responsables de l’HHF ont un effet commun quel que
soit le gène muté : une augmentation de l’abondance des protéines L-WNK1 et/ou
WNK4. |
Les patients porteurs d’une mutation de CUL3 souffrent d’une forme plus sévère de
HHF Comme nous l’avons mentionné, L-WNK1 et WNK4 font partie d’une cascade de
signalisation aboutissant à la phosphorylation et à l’activation du cotransporteur
NCC. Les mutations de WNK1, WNK4,
KLHL3 et CUL3 entraînent donc toutes une
stimulation de l’activité de NCC. Le tableau clinique est d’ailleurs similaire chez
tous les patients HHF quelle que soit la mutation dont ils sont porteurs. Toutefois,
les patients porteurs de mutations de CUL3 ont une forme plus
sévère de la maladie [6]. En effet, 94 %
d’entre eux souffrent d’hypertension artérielle avant l’âge de 18 ans, alors que ce
taux n’est que de 10 à 17 % chez les autres patients atteints d’HHF. Les valeurs de
la kaliémie sont également beaucoup plus élevées chez ces patients (supérieures à 7
mM en moyenne) (Tableau I)
[6]. Enfin, la plupart d’entre eux
présentent également un défaut de croissance ou de développement, plus rarement
rapporté chez les autres patients. Les résultats d’études in vitro
et in vivo indiquent que cette sévérité pourrait résulter d’une
atteinte de la fonction vasculaire s’ajoutant à la rétention de NaCl causée par
l’activation de NCC dans le tube contourné distal du néphron [8,9].
Tableau I.
| Gène muté |
Âge lors du diagnostic (années) * |
Concentration plasmatiquede K+ (mM) ** |
Concentration plasmatique d’HCO3− (mM) ** |
Hypertension artérielle avant l’âge de 18
ans** |
|
CUL3
|
9 ± 6 |
7,5 ± 0,9 |
15,5 ± 2,0 |
94 % |
|
KLHL3
|
24 ± 18 |
6,2 ± 0,6 |
17,2 ± 2,5 |
17 % |
|
WNK4
|
28 ± 18 |
6,4 ± 0,7 |
20,8 ± 2,3 |
10 % |
|
WNK1
|
36 ± 20 |
5,8 ± 0,8 |
22,4 ± 4,6 |
13 % |
Caractéristiques des patients atteints de HHF en fonction
du type de mutation dont ils sont porteurs. Les
valeurs indiquées correspondent à la moyenne ± écart-type. Tests
statistiques utilisés : ANOVA (pour l’âge lors du diagnostic et les
concentrations plasmatiques de K + et d’HCO3 -) ou
test exact de Fisher (pour l’hypertension artérielle) ; *
p = 0,0002 ; ** p < 0,0001
(tableau adapté de [ 6]). |
|
CUL3 inhibe la vasoconstriction en stimulant la dégradation de RhoA Une première étude, de l’équipe dirigée par Curt Sigmund, a permis de montrer que la
protéine RhoA (Ras homolog family member A) est une cible du
complexe d’ubiquitination dépendant de CUL3. RhoA est une protéine G monomérique de
la famille des protéines Rho, elle-même membre de la super-famille des protéines Ras
[12] (→).
Lorsque RhoA est stimulée dans les cellules musculaires lisses vasculaires par des
agents vasoconstricteurs comme l’angiotensine II, elle active la kinase ROCK
(Rho-associated protein kinase), qui inhibe la phosphatase
spécifique de la chaîne légère de la myosine (MLCP) et la déphosphorylation de la
myosine, ce qui favorise la contraction vasculaire [10]. In vitro, l’inhibition de
CUL3 ou la surexpression de la protéine CUL3 Δ403-459, délétée de la séquence codée
par l’exon 9, entraîne unse diminution de l’ubiquitination et de la dégradation de
RhoA [8,10].
(→) Voir le Repères de H. Barelli et al., m/s n° 4, avril
2020, page 394
CUL3 pourrait donc inhiber le tonus vasculaire en stimulant la dégradation de RhoA
dans les cellules musculaires lisses vasculaires. Cette hypothèse a été confirmée
in vivo par la même équipe. L’administration d’un inhibiteur
des protéines CUL à des souris témoins provoque en effet une vasoconstriction et une
hypertension artérielle. De même, les souris surexprimant la protéine CUL3 Δ403-459
spécifiquement dans les cellules musculaires lisses vasculaires ont une hypertension
artérielle due à une stimulation de la vasoconstriction et à une inhibition de la
vasorelaxation [9]. |
Deux modèles murins pour comprendre la sévérité de l’hypertension artérielle
associée aux mutations CUL3 Ces études ont donc permis de montrer que l’inhibition de CUL3 et la surexpression de
CUL3 Δ403-459 entraînent un dysfonctionnement vasculaire suite à la dérégulation de
la voie de signalisation RhoA dans les cellules musculaires lisses des artères. Par
ailleurs, l’analyse de souris porteuses d’une mutation de Cul3
semblable à celle des patients a confirmé que la délétion de la séquence codée par
l’exon 9 dans la protéine CUL3 conduit effectivement à une diminution de la
dégradation de WNK4, associée à une stimulation de NCC et à une hypertension
artérielle [8]. Cependant, ces deux séries
d’étude n’avaient pas permis de déterminer les contributions respectives des
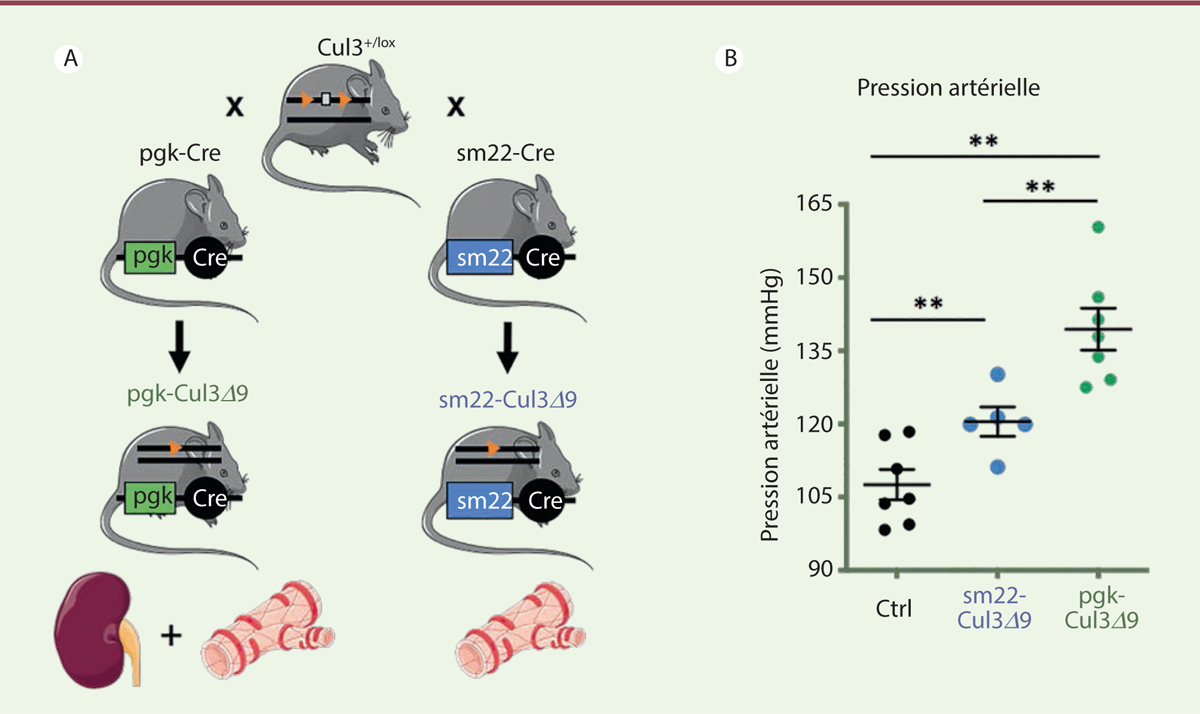
atteintes rénale et vasculaire dans la HHF. Afin d’étudier ces contributions, nous
avons généré deux modèles de souris : les souris pgk-Cul3Δ9, qui
ont une délétion ubiquitaire de l’exon 9 de Cul3, et les souris
sm22-Cul3Δ9, porteuses de cette mutation uniquement dans les
cellules musculaires lisses vasculaires (Figure 2) [11].
 | Figure 2.Les souris sm22-Cul3D 9 ont une hypertension artérielle moins sévère que les
souris pgk-Cul3D 9.
(A) Des femelles
Cul3+/lox, porteuses de sites loxP de
part et d’autre de l’exon 9 du gène Cul3, ont été
croisées avec des mâles transgéniques pgk-Cre pour
générer les animaux pgk-Cul3D 9,
porteurs de la délétion hétérozygote ubiquitaire de l’exon 9 de
Cul3. Les femelles
Cul3+/lox ont également été croisées
avec des mâles transgéniques sm22-CreTg pour
générer les animaux sm22-Cul3D 9,
porteurs de la délétion hétérozygote de l’exon 9 de
Cul3 spécifiquement dans les cellules musculaires
lisses vasculaires. (B) Les souris
sm22-Cul3D 9 ont une hypertension
artérielle modérée, tandis que les souris
pgk-Cul3D 9 ont une hypertension
artérielle sévère. La pression artérielle systolique a été mesurée par
une méthode non-invasive de sphygmomanométrie («
tail-cuff ») chez les souris
pgk-Cul3∆9 (points verts), chez les souris
sm22-Cul3D 9 (points bleus), et
chez des souris témoins ( control, ctrl, points noirs).
Test statistique : ANOVA à deux facteurs suivi de comparaisons
multiples. **
p < 0,0001 (figure adaptée de [ 11]). |
Les souris pgk-Cul3Δ9 présentent tous les phénotypes associés à la
HHF, c’est-à-dire une hyperkaliémie, une acidose métabolique hyperchlorémique et une
hypertension artérielle sévère, associées à une activation de la voie de
signalisation WNK4/NCC. Ces troubles tensionnels et métaboliques sont plus sévères
que chez les souris Wnk1+/FHHt, porteuses d’une mutation
intronique de Wnk1 équivalente de celles des patients. Comme chez
l’homme, les mutations de Cul3 chez la souris entraînent donc un
phénotype plus sévère que les mutations de Wnk1. L’abondance et la
phosphorylation de NCC sont en revanche similaires dans les deux groupes de souris
mutantes. Ce résultat indique que la sévérité des troubles métaboliques chez les
souris pgk-Cul3D9 n’est pas causée par une plus
forte activation de NCC. Contrairement aux souris pgk-Cul3Δ9, les
souris sm22-Cul3Δ9 ne présentent aucun trouble métabolique, mais
ont cependant une hypertension artérielle, bien qu’elle soit moins sévère que chez
les souris pgk-Cul3D9 (Figure
2). L’hypertension artérielle des souris
sm22-Cul3Δ9 résulte d’un défaut de la vasorelaxation
consécutive à une surabondance de RhoA, comme dans le modèle de surexpression de
CUL3 ∆403-459 restreinte aux cellules musculaires lisses vasculaires cité
précédemment. Notre étude a donc permis de montrer pour la première fois que la
sévérité de l’hypertension artérielle associée aux mutations de
CUL3 chez les patients atteints d’HHF résulte des
dysfonctionnements cumulés du néphron et du tonus vasculaire. Elle n’a cependant pas
permis d’expliquer la sévérité des troubles métaboliques chez ces patients. La
poursuite d’une recherche physiopathologique dans cette forme génétique de la
maladie conduira peut-être à la découverte de nouvelles voies de régulation du
transport ionique dans le rein, et plus particulièrement dans le tube contourné
distal du néphron. |
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
1. WilsonFH,
Disse-NicodèmeS,
ChoateKA,
et al.
Human hypertension caused by mutations in WNK
kinases . Science.
2001; ; 293 :
:1107.–1112. 2. RafaelC,
Chavez-CanalesM,
HadchouelJ.
Réabsorption du sel et sécrétion du potassium par le néphron
distal : vision nouvelle du rôle régulateur des kinases de la famille
WNK . Med Sci (Paris).
2016; ; 32 :
:274.–280. 3. Louis-Dit-PicardH,
BarcJ,
TrujillanoD,
et al.
KLHL3 mutations cause familial hyperkalemic hypertension by
impairing ion transport in the distal nephron . Nat
Genet.
2012; ; 44 :
:456.–460. 4. WakabayashiM,
MoriT,
IsobeK,
et al.
Impaired KLHL3-mediated ubiquitination of WNK4 causes human
hypertension . Cell Rep.
2013; ; 3 :
:858.–868. 5. Vidal-PetiotE,
Elvira-MatelotE,
MutigK,
et al.
WNK1-related familial hyperkalemic hypertension results from an
increased expression of L-WNK1 specifically in the distal
nephron . Proc Natl Acad Sci USA.
2013; ; 110 :
:14366.–14371. 6. BoydenLM,
ChoiM,
ChoateKA,
et al.
Mutations in kelch-like 3 and cullin 3 cause hypertension and
electrolyte abnormalities . Nature.
2012; ; 482 :
:98.–102. 7. FerdausMZ,
McCormickJA.
Mechanisms and controversies in mutant Cul3-mediated familial
hyperkalemic hypertension . Am J Physiol Renal
Physiol.
2018; ; 314 :
:F915.–F920. 8. SchumacherFR,
SiewK,
ZhangJ,
et al.
Characterisation of the cullin-3 mutation that causes a severe
form of familial hypertension and hyperkalaemia .
EMBO Mol Med.
2015; ; 7 :
:1285.–1306. 9. Agbor
LN,
Ibeawuchi
SRC,
Hu
C, et al.
Cullin-3 mutation causes arterial stiffness and hypertension
through a vascular smooth muscle mechanism . JCI
Insight.
2016;; 1 : doi: 10.1172/jci.insight.91015. 10. PelhamCJ,
KetsawatsomkronP,
GrohS,
et al.
Cullin-3 regulates vascular smooth muscle function and arterial
blood pressure via PPAR γ and RhoA/Rho-kinase . Cell
Metab.
2012; ; 16 :
:462.–472. 11. Abdel
Khalek
W,
Rafael
C,
Loisel-Ferreira
I, et al.
Severe arterial hypertension from cullin-3 mutations is caused by
both renal and vascular effects . J Am Soc
Nephrol.
2019;; 30 :
:811.–23. 12. Barelli
H,
Camonis
J, de
Gunzburg
J. Pierre Chardin,
un pionnier de la découverte des gènes et protéines de la super famille
Ras . Med Sci (Paris).
2020;; 36 :
:394.–8. |