| |
| Med Sci (Paris). 36(5): 458–460. doi: 10.1051/medsci/2020075.Surexpression de PAX4 par thérapie
génique Un espoir pour le traitement du diabète de type 1 Kevin Perge1,2* and Assia Eljaafari3,4 1Hospices civils de Lyon, Hôpital femme mère enfant, Service
d’endocrinologie pédiatrique, 59 boulevard Pinel, 69677Bron Cedex,
France. 2Université Claude Bernard Lyon 1, Lyon,
France. 3Laboratoire CarMeN, Inserm U1060, Université Claude Bernard Lyon 1,
INRAE U1397, INSA-Lyon, Lyon,France Clinical Research Department, Hospices civils de
Lyon, Centre hospitalier Lyon-Sud, Pierre-Bénite,
France. 4Do-it team, Hospices Civils de Lyon, Bâtiment CENS-ELI, CHU Lyon
Sud, Lyon,
France. MeSH keywords: Animaux, Diabète de type 1, Thérapie génétique, Protéines à homéodomaine, Humains, Cellules à insuline, Facteurs de transcription PAX, génétique, anatomopathologie, thérapie, méthodes, métabolisme |
Dans un rapport de 2016, l’Organisation mondiale de la santé (OMS) reconnaît que le
diabète est devenu un problème majeur de santé publique, du fait de la hausse
spectaculaire du nombre de personnes diabétiques dans le monde durant les dernières
décennies (estimé à 108 millions d’adultes en 1980, et 422 millions en 2014) associée à
une morbidité et une mortalité très importantes [1]. Divers variants génétiques (mutations) du gène
PAX4 (Paired Box gene 4), codant pour un facteur
de transcription, ont été associés à la susceptibilité de développer un diabète de type
1, un diabète de type 2, ou un diabète monogénique de type MODY (maturity onset
diabetes of the young) [2]. Du fait de son rôle essentiel dans la prolifération et la maturation des
cellules pancréatiques sécrétrices d’insuline (cellules β) lors du développement [2], PAX4 apparaît comme une cible
de choix pour une thérapie génique dans le diabète de type 1 (qui représente environ 10
% de tous les cas de diabète), contre lequel il n’existe pas encore de traitement
spécifique permettant de rétablir la fonction des cellules β, et qui a un impact
considérable sur la qualité de vie [1]. Cette
nouvelle étude offre un aperçu des trois mécanismes impliquant PAX4 dans les ilôts
endocrines du pancréas (îlots de Langerhans) afin de proposer une éventuelle piste
thérapeutique dans le traitement du diabète de type 1. |
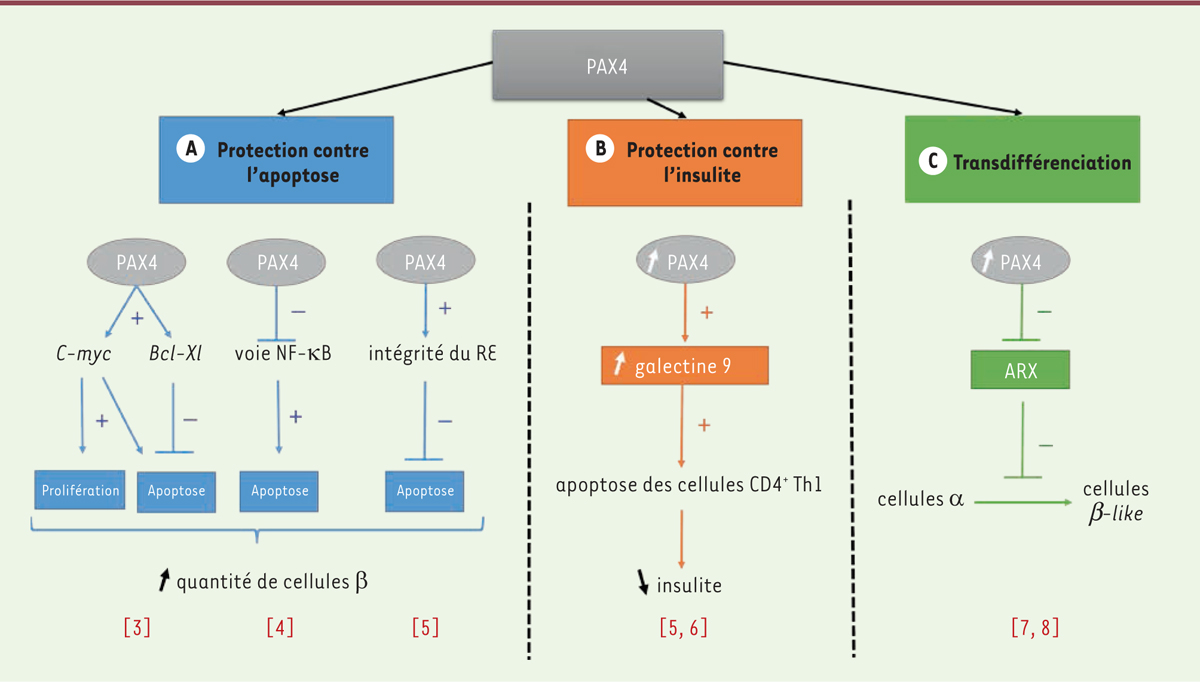
Rôle de PAX4 dans la prolifération et la survie des cellules b
pancréatiques L’expression de PAX4 dans les cellules β pancréatiques de l’adulte
est faible comparativement à son expression embryonnaire. PAX4 joue cependant un
rôle important dans le contrôle de la plasticité des cellules β au cours de la vie,
en partie lié à la prolifération et la survie de ces cellules [3]. En effet, la destruction sélective
des cellules β induite par la streptozotocine stimule l’expression du gène
PAX4, suggérant que dans des conditions de stress,
PAX4 est induit en tant que mécanisme adaptatif de protection
des cellules β contre les agressions de l’environnement. L’effet protecteur de PAX4
sur les cellules β passe par trois voies de signalisation [3-5]. La
première est la voie c-myc/bcl-xl [3]. Chez le rat, la surexpression constitutive de PAX4 dans les îlots de
Langerhans au moyen d’un vecteur de type adénovirus recombinant stimule la
prolifération et la survie des cellules β grâce à la régulation concomitante de
l’oncogène c-myc et du gène anti-apoptotique
bcl-xl [3]. L’oncogène
c-myc est un important régulateur de la prolifération des
cellules β, mais paradoxalement, il favorise simultanément leur apoptose [3]. Bcl-xl prévient l’apoptose
induite par c-myc et favorise la prolifération des cellules β en
supprimant la voie mitochondriale de l’apoptose [3]. Il existe donc un couplage intime, régulé par PAX4, entre
c-myc et bcl-xl dans la promotion de la
prolifération et de la survie des cellules β. Le deuxième mécanisme est l’inhibition
de la voie NF-κB (nuclear factor-kappa B) [4]. La surexpression constitutive de PAX4 dans
les cellules β chez la souris, induit une réduction du taux de transcrits codant
pour l’interleukine 1β (IL-1β), la principale cytokine responsable de l’activation
de la voie NF-κB et des transcrits de Nos2 (nitric oxide
synthase 2), un gène cible de NF-κB [4]. Par ce mécanisme, PAX4 prévient les dommages exercés sur les
cellules β par l’hyperglycémie [4]. Enfin,
PAX4 cible de nombreux gènes impliqués dans la protéostase, la translocation des
protéines du réticulum endoplasmique vers l’appareil de Golgi, et l’homéostasie du
calcium [5]. L’ensemble de ces régulations
font de PAX4 un acteur essentiel de l’homéostasie du réticulum endoplasmique,
d’autant plus importante en cas de stress, prévenant par ce biais la dégénérescence
des cellules β [5]. Ainsi, PAX4 amplifie la
quantité de cellules β en stimulant leur prolifération et en améliorant leur survie
en cas de stress. |
PAX4 protecteur des cellules b pancréatiques contre l’insulite dans le diabète de
type 1 Le diabète de type 1 est une maladie auto-immune du pancréas endocrine caractérisée
par l’infiltration de lymphocytes T CD4+ auto-réactifs de type Th1
(T helper 1), responsable de l’insulite1 qui détruit spécifiquement les cellules β [6]. Un traitement optimal contre le
diabète de type 1 devrait donc également agir à l’interface entre le pancréas et
l’auto-immunité. Il a été montré, dans un modèle murin de diabète auto-immun
expérimental, que la sur-expression de PAX4 dans les cellules β leur confère une
protection contre l’apoptose liée à l’attaque auto-immune, en réduisant l’insulite
de façon significative [5]. Ce mécanisme
pourrait passer par une augmentation de l’expression du gène de la galectine 9
(Gal-9), un puissant immunomodulateur, qui est l’une des cibles principales de PAX4
dans les îlots pancréatiques [5]. En effet,
Gal-9 régule les lymphocytes T CD4+ Th1 et induit leur apoptose par
l’intermédiaire de son récepteur, Tim-3 (T-cell immunoglobulin and
mucin-containing protein-3), qui est principalement exprimé par ces
cellules [6]. La surexpression de Gal-9 chez
la souris NOD (non-obese diabetic) réduit l’insulite et
l’hyperglycémie [6]. Cette protection est
directement due à la diminution du nombre de lymphocytes T auxiliaires Th1, sans
modification d’autres sous-populations de lymphocytes T (Th2 et T régulateurs)
[6]. L’activation des lymphocytes Th1 est
impliquée dans les rejets de greffe. La protéine Gal-9, en diminuant cette « voie
Th1 » sans perturber la « voie Th2 », pourrait donc permettre de prolonger la survie
de greffons d’îlots pancréatiques. Ainsi, la voie Gal-9/Tim-3 joue un rôle pivot
dans le contrôle de l’auto-immunité Th1, et il est donc plausible qu’en augmentant
l’expression de Gal-9, PAX4 puisse freiner l’activation des lymphocytes Th1
auto-réactifs, entraver partiellement l’insulite, et améliorer la survie des
cellules β dans le diabète de type 1 [6]. |
PAX4, un acteur de la transdifférenciation des cellules pancréatiques Au cours du développement du pancréas, un réseau complexe de facteurs de
transcription, dont PAX4 et ARX (aristaless-related homeobox),
favorise la différenciation des cellules progénitrices vers leurs différentes
destinées endocriniennes [7].
Les îlots pancréatiques des souris déficientes en ARX sont dépourvus de cellules α
matures et ont en revanche un plus grand nombre de cellules β et δ, alors que ceux
des souris déficientes en PAX4 ont un phénotype inverse ; cela suggère que durant
les premiers stades du développement du pancréas endocrine, ARX et PAX4 exercent
l’un sur l’autre une inhibition réciproque [7]. Dans un modèle de souris exprimant le gène Pax4 de
manière conditionnelle et ectopique, la surexpression de PAX4 dans le pancréas en
développement favorise la genèse d’îlots surdimensionnés composés en grande majorité
de cellules β [7]. Cet effet n’est pas dû à la
prolifération des cellules β, mais à un mode particulier de différenciation des
cellules progénitrices du pancréas endocrine, la transdifférenciation des cellules α
en cellules β [7], qui résulte, entre autres,
de la régulation négative d’Arx [7, 8]. En effet,
l’inactivation du gène Arx dans les cellules α du pancréas chez le
rat entraîne une transdifférenciation de ces cellules a en cellules β,
indépendamment du niveau d’expression de Pax4, ce qui fait de la
répression du gène codant ARX le principal déclencheur de la conversion des cellules
α en cellules β [8]. Pour compenser la perte
des cellules α, le facteur de transcription neurogénine 3 (Ngn3) est réactivé,
induisant une néogenèse continue à partir de cellules précurseurs des cellules α,
qui sont elles-mêmes converties continuellement en cellules β lors de l’expression
ectopique de PAX4 [7]. La surexpression de
PAX4 dans un modèle murin de déplétion en cellules β pancréatiques induite par la
streptozotocine entraîne la réapparition d’un grand nombre de cellules β, une
normalisation progressive de la glycémie, et une durée de vie prolongée des souris
[7]. Plus récemment, il a été montré
in vivo chez la souris que le neurotransmetteur GABA
(gamma-aminobutyric acid), par l’intermédiaire de son
récepteur, déclenche une transdifférenciation des cellules α en cellules β
via la régulation négative d’Arx et
l’activation concomitante de Pax4 [9]. Cette conversion des cellules α en cellules
β induit des mécanismes compensateurs de remplacement des cellules α manquantes par
la mobilisation de cellules progénitrices de l’épithélium canalaire, qui adoptent
une identité de cellules α avant d’être converties en cellules β, uniquement lors
d’une exposition prolongée au GABA [9]. Les
cellules β ainsi générées sont fonctionnelles et peuvent inverser le diabète induit
chimiquement in vivo [9]. Le
traitement d’îlots pancréatiques humains greffés chez la souris avec du GABA
entraîne une perte de cellules α et une augmentation concomitante du nombre de
cellules β, suggérant l’existence des processus de conversion de cellules α en
cellules β également chez l’homme [9]. Ainsi,
PAX4 induit la transdifférenciation des cellules α en cellules β,
via la régulation négative du gène codant ARX. |
PAX4 et perspectives thérapeutiques dans le diabète de type 1 Les trois mécanismes d’action de PAX4 dans le pancréas endocrine, récapitulés dans la
Figure 1
, font de ce facteur de transcription une cible thérapeutique de choix
contre le diabète de type 1. La pharmacologie permet de proposer une première
perspective de thérapie : l’utilisation de médicaments GABAergiques, qui
moduleraient positivement l’expression de PAX4, lui-même régulant
négativement l’expression d’ARX, dans les îlots pancréatiques,
pourrait permettre la transdifférenciation des cellules α en cellules β [9]. D’autres perspectives relèvent de la
thérapie génique. Le transfert, par un vecteur de type adénovirus, de
PAX4 dans les cellules α induirait leur conversion en cellules
β fonctionnelles, permettant une diminution de la glycémie comme cela a été montré
dans un modèle de souris diabétiques [10]. Une autre possibilité serait de surexprimer
PAX4 précocement dans les cellules β afin de favoriser leur
prolifération, leur protection vis-à-vis de l’auto-immunité, ainsi que leur survie.
D’autres études, chez l’animal et chez l’homme, seront nécessaires pour évaluer la
faisabilité de telles approches et comparer leurs efficacités.
 | Figure 1. Mécanismes d’action de PAX4 sur le pancréas endocrine,
offrant une éventuelle piste thérapeutique dans le traitement du
diabète de type 1. A. PAX4 amplifie la quantité
de cellules β en stimulant leur prolifération et en améliorant leur
survie en cas de stress. RE : réticulum endoplasmique.
B. PAX4, en augmentant
l’expression de Gal-9, freine l’activation des lymphocytes T auxiliaires
Th1 auto-réactifs, entrave partiellement l’insulite, et améliore la
survie des cellules β pancréatiques. C. PAX4 induit la transdifférenciation des
cellules α en cellules β, via la régulation négative du
gène codant ARX. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Footnotes |
2. PanneerselvamA,
KannanA,
Mariajoseph-AntonyLF,
et al.
PAX proteins and their role in pancreas .
Diabetes Res Clin Pract.
2019; ; 155 :
:107792.. 3. BrunT,
FranklinI,
St-OngeL,
et al.
The diabetes-linked transcription factor PAX4 promotes β-cell
proliferation and survival in rat and human islets .
J Cell Biol.
2004; ; 167 :
:1123.–1135. 4. HeKHH,
LorenzoPI,
BrunT,
et al.
In vivo conditional Pax4 overexpression in mature islet β-cells
prevents stress-induced hyperglycemia in mice .
Diabetes.
2011; ; 60 :
:1705.–1715. 5. Mellado-GilJM,
Jiménez-MorenoCM,
Martin-MontalvoA,
et al.
PAX4 preserves endoplasmic reticulum integrity preventing beta
cell degeneration in a mouse model of type 1 diabetes
mellitus . Diabetologia.
2016; ; 59 :
:755.–765. 6. ChouFC,
ShiehSJ,
SytwuHK.
Attenuation of Th1 response through galectin-9 and T-cell Ig
mucin 3 interaction inhibits autoimmune diabetes in NOD
mice . Eur J Immunol.
2009; ; 39 :
:2403.–2411. 7. CollombatP,
XuX,
RavassardP,
et al.
The ectopic expression of Pax4 in the mouse pancreas converts
progenitor cells into α- and subsequently β-cells .
Cell.
2009; ; 138 :
:449.–462. 8. CourtneyM,
GjernesE,
DruelleN,
et al.
The inactivation of Arx in pancreatic α-cells triggers their
neogenesis and conversion into functional β-like cells .
PLoS Genet.
2013; ; 9 :
:e1003934.. 9. Ben-OthmanN,
VieiraA,
CourtneyM,
et al.
Long-term GABA administration induces α cell-mediated β-like cell
neogenesis . Cell.
2017; ; 168 :
:73.–85. 10. ZhangY,
FavaGE,
WangH,
et al.
PAX4 gene transfer induces α-to-β cell phenotypic conversion and
confers therapeutic benefits for diabetes treatment .
Mol Ther.
2016; ; 24 :
:251.–260. |