| |
| Med Sci (Paris). 36(5): 528–530. doi: 10.1051/medsci/2020087.Le lipidosome Lieu de synthèse de LTB4, un médiateur de
l’inflammation stérile Camille Dupouy,1* Laura Saban,2** and Sophie Dupré-Crochet2*** 1M1 Biologie Santé, Université Paris-Saclay,
91405Orsay,
France 2Institut de Chimie Physique, UMR8000, CNRS, Université
Paris-Saclay, 91405Orsay,
France MeSH keywords: Animaux, Endosomes, Humains, Inflammation, JNK Mitogen-Activated Protein Kinases, Leucotriène B4, Métabolisme lipidique, Thérapie moléculaire ciblée, Granulocytes neutrophiles, Pneumopathie infectieuse, Transduction du signal, Silice, Silicose, métabolisme, anatomopathologie, physiologie, thérapie |
Cristaux de silice et inflammation pulmonaire L’exposition répétée aux cristaux de silice est responsable de la silicose, qui est
une des maladies professionnelles les plus répandues dans le monde. Elle se
caractérise par une fibrose progressive du poumon et est associée au risque de
développer d’autres maladies, dont le cancer du poumon [1]. L’inhalation de cristaux de silice entraîne
un recrutement de polynucléaires neutrophiles, de macrophages et de lymphocytes dans
les poumons, à l’origine d’une inflammation stérile1. Des médiateurs de l’inflammation, tels que le leucotriène
B4 (LTB4) et l’interleukine 1β (IL-1β), contribuent au
recrutement de ces cellules immunitaires [2,3]. Les
mécanismes cellulaires responsables de la production de ces médiateurs, notamment de
LTB4, en présence de cristaux de silice sont encore peu connus. Les
cristaux de silice, présents dans les poumons, sont internalisés dans les cellules
épithéliales, les mastocytes et les macrophages résidents. Dans ces derniers,
Hornung et al. ont observé une rupture des phagolysosomes contenant
les cristaux de silice, avec pour conséquence une activation de l’inflammasome
NLRP32, (→) et de la caspase 1.
Cela permet le clivage de la pro-IL1β synthétisée3, en IL-1β [2]. LTB4
est produit dans les cellules à partir de l’acide arachidonique grâce à la
5-lipoxygénase (5-LO) et la leucotriène A4-hydrolase (LTA4H). Dans un
article récent [5], Hegde
et al. ont identifié les processus cellulaires conduisant à la
synthèse de LTB4 en présence de cristaux de silice. L’originalité de
l’étude réside aussi dans l’identification du lieu de synthèse de cette
molécule.
(→) Voir la Synthèse de Y. Jamilloux et T. Henry, m/s n° 11,
novembre 2013, page 975
|
À la recherche des mécanismes cellulaires et moléculaires de production du LTB4
et de l’IL-1β Les auteurs ont tout d’abord étudié le rôle de la phagocytose de cristaux de silice
sur la production de LTB4 dans des macrophages dérivés de la moelle
osseuse. Ces cellules, préalablement stimulées avec du lipopolysaccharide (LPS), ont
été traitées avec de la cytochalasine D (Cyt D), qui inhibe la polymérisation de
l’actine. Des expériences de microscopie confocale montrent que des macrophages
incubés avec la Cyt D perdent leur capacité à phagocyter des cristaux de silice. De
même, la Cyt D inhibe la production de LTB4 et d’IL-1β par les
macrophages murins stimulés avec des cristaux de silice. La production de
LTB4, en présence de Cyt D et de cristaux de silice, est également
inhibée dans les polynucléaires neutrophiles et les mastocytes ; ceux-ci ne
produisant pas d’IL-1β. La phagocytose des cristaux est donc nécessaire à la
production de LTB4 et d’IL-1β. Après sa formation, le phagosome va se
transformer en un phagolysosome suite à sa fusion avec les endosomes puis avec le
lysosome. Hegde et al. montrent que la formation de ce
phagolysosome n’est pas indispensable pour la production de LTB4
contrairement à celle d’IL-1β. Une étude précédente avait montré que ce
phagolysosome, contenant les cristaux de silice, est rompu ; cette rupture entraîne
l’activation de l’inflammasome NLRP3. L’activation de ce dernier est indispensable
pour la production d’IL-1β [2]. Afin de tester
si NLRP3 est également nécessaire pour la production de LTB4, les
chercheurs ont traité, avec des cristaux de silice et du LPS, des macrophages murins
provenant de souris génétiquement déficientes pour NLRP3. Les macrophages déficients
pour NLRP3 produisent du LTB4 mais pas d’IL-1β comme attendu. La
production de LTB4 est donc un événement précoce qui ne dépend pas de
l’activation de l’inflammasome et de la production d’IL-1β. Ayant déterminé les
évènements cellulaires nécessaires à la production de LTB4, Hegde
et al. se sont intéressés aux acteurs moléculaires impliqués.
Ils ont analysé l’implication des MAPK3 (mitogen-activated
protein kinases) p38 et JNK (Jun N-terminal kinase)
dans la modulation de la sécrétion de LTB4 et d’IL-1β. Les chercheurs ont pu
observer que seul un inhibiteur de JNK diminuait de façon significative la
production de LTB4 et d’IL-1β dans les macrophages. Il en est de même
pour la production de LTB4 dans les polynucléaires neutrophiles et
mastocytes. Les auteurs montrent aussi que cet inhibiteur empêche le recrutement des
leucocytes, et notamment des macrophages et des polynucléaires neutrophiles, suite à
l’injection des cristaux de silice à des souris. Afin de mieux comprendre les
différences dans les mécanismes cellulaires conduisant à la production de
LTB4 d’une part, et à la production d’IL-1β d’autre part, Hegde
et al. ont alors recherché le lieu de production de
LTB4. |
À la découverte du lieu de synthèse du LTB4 : le lipidosome. LTB4 est un lipide synthétisé à partir de l’acide arachidonique. En
incubant les cellules avec une sonde fluorescente lipophile, marquant les
gouttelettes lipidiques dans les cellules, les chercheurs ont observé, en
microscopie confocale, une augmentation de ces gouttelettes lipidiques dans des
macrophages murins traités avec des cristaux de silice. Les gouttelettes lipidiques,
appelées ici lipidosomes, sont des lieux de stockage et de modifications des lipides
; ils peuvent interagir avec les organites cellulaires et sont impliqués dans
l’immunité innée [7]. En
utilisant les approches décrites précédemment, Hegde et al. ont
démontré une diminution du nombre de ces lipidosomes lors de l’inhibition de la
phagocytose des cristaux de silice ou de JNK. En revanche, en l’absence de NLRP3,
ces lipidosomes sont présents, ce qui expliquerait la conservation de la production
de LTB4 dans les macrophages des souris déficientes pour NLRP3. Ces différents résultats suggèrent que le lipidosome serait le lieu de production de
LTB4. Afin de le prouver, les chercheurs ont utilisé des techniques
d’immunofluorescence et montré une co-localisation des enzymes responsables de la
synthèse de LTB4, 5-LO et LTA4H, avec les lipidosomes. Ces
lipidosomes sont, de plus, absents dans des macrophages de souris génétiquement
déficientes pour la 5-LO. Ces lipidosomes seraient donc les lieux de synthèse de
LTB4. En les traquant par vidéo-microscopie, les chercheurs ont
observé qu’ils apparaissaient 5 minutes après l’ajout des cristaux de silice dans
les macrophages. En marquant simultanément les lipidosomes et le phagosome, Hedge
et al. ont également observé, en microscopie confocale que ces
lipidosomes sont accolés au phagosome. Après avoir identifié ces lipidosomes, les
chercheurs ont essayé de déterminer quelles protéines étaient impliquées dans leur
formation. Ils ont étudié tout d’abord le rôle d’une centaine de protéines choisies
parmi celles impliquées dans les voies de la phagocytose ou de l’autophagie. Des
macrophages, transfectés par des petits ARN interférents (siRNA) ciblant les ARN
messagers codant ces protéines, ont alors été mis en contact avec des cristaux de
silice. Une forte inhibition de la production de LTB4 a été détectée
suite à la diminution du taux des ARN messagers codant un grand nombre de ces
protéines incluant notamment des GTPases, des kinases impliquées dans la
signalisation et des protéines impliquées dans le métabolisme lipidique. Une étude
plus approfondie a également permis de mettre en évidence une implication des
protéines Rab (Rab5c et Rab40c) et de JNK dans la formation de ces lipidosomes. |
JNK, une cible thérapeutique contre les silicoses ? Les travaux présentés par Hedge et al. ont permis de mettre en
évidence la formation de gouttelettes lipidiques lors de la phagocytose des
particules de silice par les macrophages. Ces gouttelettes ou lipidosomes sont le
lieu de synthèse de LTB4, un puissant chimioattractant des polynucléaires
neutrophiles (Figure 1). Il
serait intéressant d’approfondir l’étude du lipidosome afin de mieux définir les
mécanismes à l’origine de la formation de cette structure. La production de
LTB4 et d’IL-1β fait intervenir des mécanismes cellulaires différents
(Figure 1).
L’activation de la kinase JNK est cependant nécessaire à la production de ces deux
médiateurs de l’inflammation. Cette production nécessite in vitro
la stimulation des cellules phagocytaires par le LPS et les particules de silice.
In vivo, elle interviendrait donc potentiellement lors
d’infections bactériennes associées à l’inhalation de cristaux de silice. D’autres
études seront nécessaires pour préciser l’importance du LTB4 et de
l’IL-1β dans l’inflammation lors d’expositions répétées aux cristaux de silice, et
établir si la kinase JNK constitue une cible intéressante pour diminuer cette
inflammation.
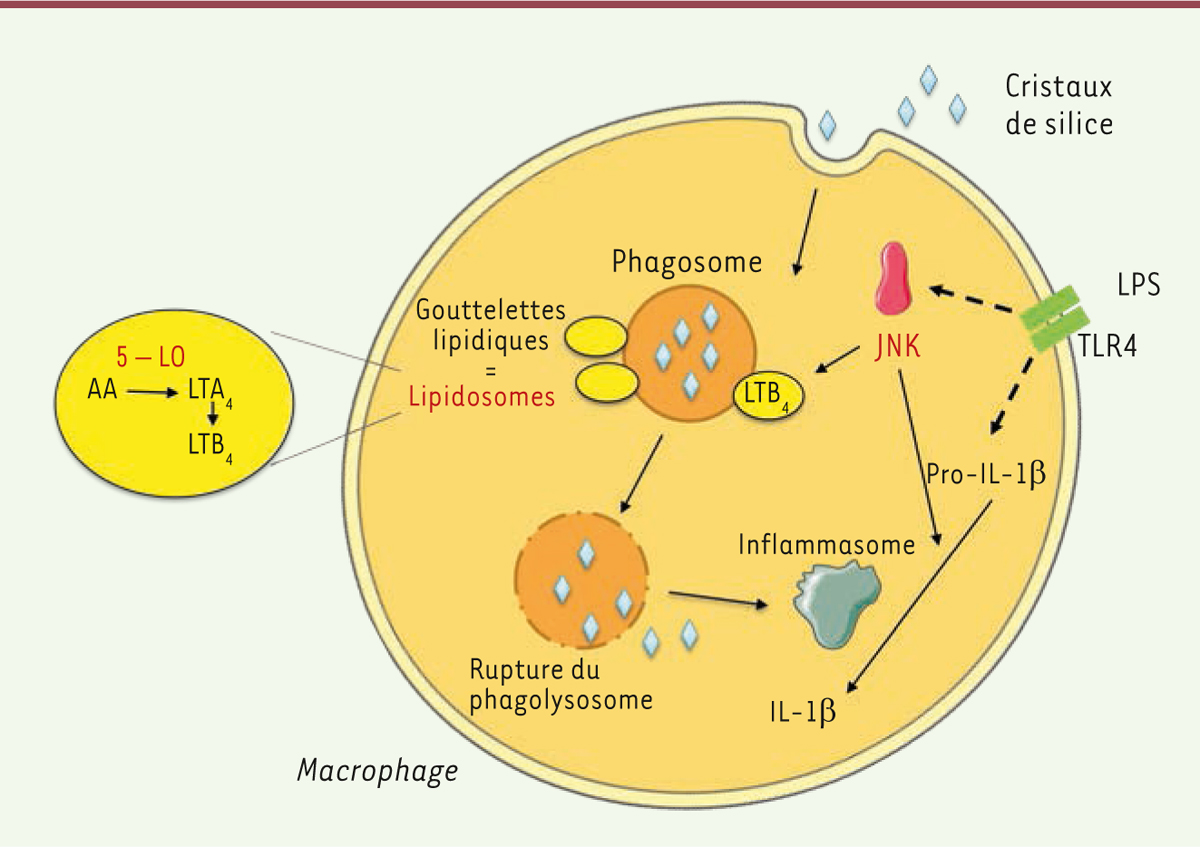
 | Figure 1. Production du leucotriène B4 (LTB4) et de
l’interleukine 1β (IL-1β) en réponse à l’internalisation de
cristaux de silice. Les cristaux de silice sont
phagocytés par les macrophages pré-activés par du LPS. Ce dernier induit
une signalisation via TLR4 qui conduit à l’activation
de JNK et à la synthèse de pro-IL-1β. Le phagosome fusionne avec le
lysosome. Il s’ensuit une rupture du phagolysosome qui libère les
cristaux de silice. Cette libération des cristaux de silice entraîne
l’activation de l’inflammasome ce qui conduit à la synthèse de l’IL-1β.
JNK est également indispensable pour cette synthèse ainsi qu’à la
formation des gouttelettes lipidiques appelées lipidosomes. Dans ces
lipidosomes, proches du phagosome, LTB4 est synthétisé à
partir de l’AA. Cette synthèse implique la 5-LO. 5-LO : 5-lipoxygénase ;
AA : acide arachidonique ; JNK : Jun N-terminal kinase
; LPS : lipopolysaccharide ; LTA4 : leucotriène A4 ; TLR :
Toll-like receptor. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Footnotes |
1. LeungCC,
YuITS,
ChenW.
Silicosis. Lancet.
2012; ; 379 :
:2008.–2018. 2. HornungV,
BauernfeindF,
HalleA,
et al.
Silica crystals and aluminum salts activate the NALP3
inflammasome through phagosomal destabilization . Nat
Immunol.
2008; ; 9 :
:847.–856. 3. SatpathySR,
JalaVR,
BodduluriSR,
et al.
Crystalline silica-induced leukotriene B4-dependent inflammation
promotes lung tumour growth . Nat Commun.
2015; ; 6 : :7064.. 4. JamillouxY,
HenryT.
Les inflammasomes. Med Sci (Paris).
2013; ; 29 :
:975.–984. 5. HegdeB,
BodduluriSR,
SatpathySR,
et al.
Inflammasome-independent leukotriene B 4 production drives
crystalline silica-induced sterile inflammation . J
Immunol.
2018; ; 200 :
:3556.–3567. 6. TakedaK,
AkiraS.
TLR signaling pathways. Semin Immunol.
2004; ; 16 :
:3.–9. 7. RoingeardP,
MeloRCN.
Lipid droplet hijacking by intracellular
pathogens . Cell Microbiol.
2017; ; 19 :
:e12688.. |