| |
| Med Sci (Paris). 36(5): 531–533. doi: 10.1051/medsci/2020089.Rôle de la phagocytose associée à la protéine LC3 au
cours de l’infection par Listeria monocytogenes Léa Dutour,1* Éléonore Mandonnet,1** and Oliver Nüsse2*** 1M1 Biologie Santé, Université Paris-Saclay,
91405Orsay,
France. 2Université Paris-Saclay, CNRS, Institut de chimie physique,
UMR8000, 91405Orsay,
France. MeSH keywords: Animaux, Humains, Immunité innée, Lactosylcéramides, Listeria monocytogenes, Infections à Listeria, Phagocytose, physiologie, métabolisme, immunologie, pathogénicité, anatomopathologie |
Listeria monocytogenes, bactérie Gram-positive, est à l’origine de la
listériose, infection provoquant chez l’homme des septicémies ou des infections du
système nerveux central. Cette bactérie est transmise principalement par l’alimentation
et infecte plusieurs types cellulaires grâce à sa capacité à franchir les barrières
hémato-encéphalique, intestinale et placentaire [1]. Bien que la listériose soit rare, la mortalité associée ainsi
que les séquelles neurologiques sont élevées (25 à 30 %). De précédentes études ont
permis de mettre en évidence la capacité de cette bactérie à infecter des cellules
immunitaires de l’hôte, les macrophages, et à détruire les membranes des phagosomes par
la sécrétion de toxines. Toutefois, dans un article récent de Gluschko et
al. [2], il a été
montré que l’organisme est capable de combattre l’infection par L.
monocytogenes en utilisant une forme particulière de phagocytose associée à
la protéine LC3 (microtubule-associated protein 1A/1β-light chain 3),
la LAP (pour LC3-associated phagocytosis), qui va utiliser certains
éléments de la machinerie autophagique. Elle est qualifiée d’autophagie non
canonique. |
Listeria est internalisée via la LAP Dans un premier temps, Gluschko et al. ont voulu caractériser le
type d’autophagie (canonique ou LAP) déclenchée par l’infection par L.
monocytogenes. Afin de répondre à cette question, ils ont étudié la
surface des phagosomes après infection de macrophages par des souches de L.
monocytogenes de type sauvage ou déficientes pour différentes
fonctions. Ils ont ainsi pu observer, en microscopie confocale, la présence de
LC3-II (résultant de la conversion de la forme cytoplasmique LC3-I, en la forme
LC3-II associée au phagosome) à la surface des phagosomes ayant internalisé
Listeria. Ce recrutement de LC3 dépend de la production
d’espèces réactives de l’oxygène (ROS) par la NADPH oxydase (Nox2). Par ailleurs,
une analyse structurale, par microscopie électronique à transmission, de la membrane
du phagosome contenant L. monocytogenes a permis de mettre en
évidence le fait que la majorité des bactéries internalisées sont entourées d’une
membrane unique et non d’une double membrane, comme c’est le cas pour l’autophagie
canonique. L’ensemble de ces résultats a permis de consolider l’hypothèse selon
laquelle la bactérie L. monocytogenes est principalement
internalisée par la LAP, un mécanisme d’autophagie caractérisé par le recrutement de
LC3 à la membrane des phagosomes, la production de ROS et la présence d’une membrane
unique [3]. |
Mac-1, élément indispensable au processus de la LAP De précédentes études ayant mis en évidence le rôle essentiel de l’activation de Nox2
lors du recrutement de LC3-II à la membrane du phagosome [4], les auteurs ont étudié le mécanisme
d’activation de Nox2 en se concentrant sur l’intégrine b2 Mac-1
(aMb2). Mac-1 qui fonctionne à la fois comme une molécule
d’adhérence et comme un récepteur de certains ligands bactériens, est exprimé à la
surface des macrophages [5]
et est constitué des sous-unités CD18 (b2) et CD11β (aM). Mac1
reconnaît et interagit avec L. monocytogenes. La production de ROS
par les macrophages infectés est significativement diminuée dans des souris
déficientes pour la sous-unité CD11β. Cette diminution de la production de ROS est
également associée à un moindre recrutement de LC3 dans les phagosomes contenant la
bactérie pathogène. Zhang et al. avaient démontré en 2008 [6] que la production de ROS
était dépendante de l’activation de Nox2, résultant elle-même du rapprochement des
différentes sous-unités de Nox2 à la membrane plasmique dans des zones membranaires
enrichies en céramides. Il est important de noter que ces zones sont créées par
l’action de la sphingomyélinase acide (ASMase), dégradant la sphingomyéline en
céramides [7]. Soulignons le
fait qu’une déficience de la sous-unité CD11β de Mac-1 dans les macrophages provoque
une diminution de l’activité d’ASMase, qui se traduit par une baisse de la
production de ROS. Cela permet de conclure que, dans ces conditions, l’activation de
Nox2 dépend de celle de l’ASMase, elle-même dépendante de Mac-1. Les auteurs ont pu
mettre en évidence, par différents systèmes expérimentaux, l’existence d’une boucle
de rétroaction positive entre Nox2 et ASMase, activée par Mac-1, en invalidant le
gène de Nox2 (souris Nox2-/-), ou en inhibant spécifiquement Nox2 avec
l’inhibiteur spécifique VAS-2780, ou encore en piégeant les ROS produits par Nox2
avec de la N-acétylcystéine. Ils ont ainsi mis en évidence le fait que les ROS
produits amplifient l’activité ASMase, qui permettra ainsi alors de fournir une
production optimale de ROS. L’ASMase est donc aussi impliquée, via
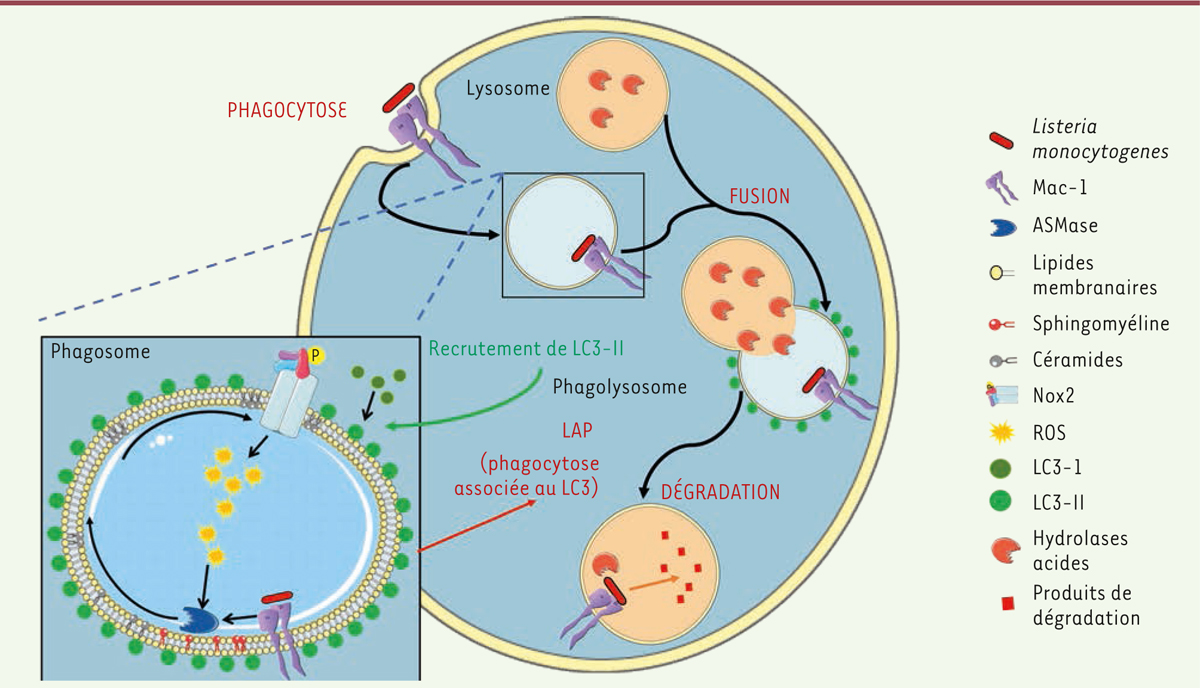
Nox2, dans le recrutement de LC3-II sur le phagosome (Figure 1).
 | Figure 1. Mécanisme de la phagocytose associée au LC3 lors d’une
infection par la bactérie L. monocytogenes. La
bactérie se fixe sur le récepteur Mac-1, activant la conversion par
l’ASMase des sphingomyélines en céramides et entraînant la production de
ROS par Nox2. Cela permet le recrutement de LC3 sur le phagosome, et
favorise ainsi la fusion du phagosome et du lysosome, suivie de la
dégradation de la bactérie par les hydrolases acides. |
|
L’élimination de L. monocytogenes se fait par la LAP L’ASMase a un rôle indispensable lors de la fusion des lysosomes avec les phagosomes
[8]. La fusion de ces
deux compartiments est nécessaire pour la dégradation de L.
monocytogenes par les hydrolases acides des lysosomes, ce qui contribue
à l’immunité anti-listeria [9]. Gluschko et al. ont étudié la possibilité que LC3, en
aval de l’ASMase, puisse favoriser la fusion des lysosomes avec les phagosomes
contenant L. monocytogenes et permettre ainsi la dégradation de la
bactérie. Pour cela, ils se sont intéressés au transfert de la cargaison lysosomale
lors de la fusion d’un lysosome avec un phagosome LC3+. En pré-chargeant
des lysosomes avec des billes de latex fluorescentes, ils ont pu établir une
corrélation entre la présence de LC3 sur le phagosome et l’acquisition de la
cargaison lysosomale. De surcroît, lorsque les macrophages des souris sont
déficients en Atg7, une protéine activatrice de l’autophagie, ou en Nox2, il n’y a
pas de conversion de LC3-I en LC3-II, forme impliquée dans la fusion du phagosome,
ni de recrutement de LC3-II sur les phagosomes contenant la bactérie. Les auteurs
observent donc ici une réduction de la colocalisation entre L.
monocytogenes et la cargaison lysosomale dans le phagolysosome.
L’ensemble de ces observations met en évidence le fait que l’autophagie de type LAP
permet d’augmenter l’exposition de L. monocytogenes aux hydrolases
acides des lysosomes en favorisant la fusion, via la présence de
LC3-II, des phagosomes contenant L. monocytogenes avec les
lysosomes [10]. À la suite
de cette fusion favorisée par la LAP, les hydrolases acides lysosomales vont pouvoir
venir dégrader la bactérie pathogène et ainsi contrôler l’infection de manière
efficace. Dans ce processus de mise en place d’une immunité anti-listeria, seule
l’autophagie non canonique (LAP), via son induction par Mac-1,
participe efficacement à l’élimination de L. monocytogenes par les
macrophages. La LAP va favoriser la réponse immunitaire anti-listeria au détriment
de la capacité du pathogène à persister dans ces cellules. |
Le début de la fin pour la Listeria ? Gluschko et al. ont donc montré que lors d’une infection par la
bactérie L. monocytogenes, la cellule hôte détruit ce pathogène par
un mécanisme d’autophagie non canonique, appelé LAP. La caractérisation des
mécanismes impliqués dans la réponse immunitaire anti-listeria a révélé l’importance
de la production de ROS par activation de Nox2 et de l’ASMase, toutes deux
dépendantes de Mac-1. Il est probable que la fonction de PRR (pattern
recognition receptor) de Mac-1, lui permette d’interagir avec d’autres
bactéries pathogènes que L. monocytogenes [11] et que Mac-1 soit également impliqué dans
l’activation de la LAP suite à l’infection par ces pathogènes. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
1. RayK,
MarteynB,
SansonettiPJ,
TangCM.
Life on the inside the intracellular lifestyle of cytosolic
bacteria . Nat Rev Microbiol.
2009; ; 7 :
:333.–340. 2. GluschkoA,
HerbM,
WiegmannK.
et al The β2 integrin Mac-1 induces protective LC3-associated
phagocytosis of Listeria monocytogenes . Cell Host
Microbe.
2018; ; 23 :
(324–337):e5.. 3. HuangJ,
CanadienV,
LamGY,
et al.
Activation of antibacterial autophagy by NADPH
oxidases . Proc Natl Acad Sci USA.
2009; ; 106 :
:6226.–6231. 4. LamGY,
CemmaM,
MuiseAM,
et al.
Host and bacterial factors that regulate LC3 recruitment to
Listeria monocytogenes during the early stages of macrophage
infection . Autophagy.
2013; ; 9 :
:985.–995. 5. KösterS,
UpadhyayS,
ChandraP,
et al.
Mycobacterium tuberculosis is protected from NADPH oxidase and
LC3-associated phagocytosis by the LCP protein CpsA .
Proc Natl Acad Sci USA.
2017; ; 114 :
:E8711.–E8720. 6. EhlersMRW.
CR3: a general purpose adhesion-recognition receptor
essential for innate immunity . Microbes
Infect.
2000; ; 2 :
:289.–294. 7. ZhangY,
LiX,
CarpinteiroA,
GulbinsE.
Acid sphingomyelinase amplifies redox signaling in
Pseudomonas aeruginosa-induced macrophage apoptosis .
J Immunol.
2008; ; 181 :
:4247.–4254. 8. SchrammM,
HerzJ,
HaasA,
et al.
Acid sphingomyelinase is required for efficient phago-lysosomal
fusion . Cell Microbiol.
2008; ; 10 :
:1839.–1853. 9. del
Cerro-VadilloE,
Madrazo-TocaF,
Carrasco-MarínE,
et al.
Cutting edge: a novel nonoxidative phagosomal mechanism exerted
by cathepsin-D controls Listeria monocytogenes intracellular
growth . J Immunol.
2006; ; 176 :
:1321.–1325. 10. BoonhokR,
RachaphaewN,
DuangmaneeA,
et al.
LAP-like process as an immune mechanism downstream of IFN-γ in
control of the human malaria Plasmodium vivax liver stage .
Proc Natl Acad Sci USA.
2016; ; 113 :
:E3519.–E3528. 11. PodolnikovaNP,
PodolnikovAV,
HaasTA,
et al.
Ligand recognition specificity of leukocyte integrin αMβ2 (Mac-1,
CD11β/CD18) and its functional consequences .
Biochemistry.
2015; ; 54 :
:1408.–1420. |