| |
| Med Sci (Paris). 36(6-7): 562–565. doi: 10.1051/medsci/2020103.ERα orchestre les mécanismes épigénétiques qui
déclenchent l’expression du gène Sf-1 au cours de la
différenciation du lignage gonadotrope hypophysaire Vincent Pacini,1** Florence Petit,1 Bruno Quérat,1 Jean-Noël Laverrière,1 Joëlle Cohen-Tannoudji,1 and David L’hôte1* 1Équipe Physiologie de l’axe gonadotrope de l’unité Biologie
fonctionnelle et adaptative, université de Paris, BFA, UMR 8251, CNRS, ERL
U1133, Inserm, 4 rue
Marie Andrée Lagroua Weill-Hallée, 75013Paris,
France MeSH keywords: Animaux, Différenciation cellulaire, Lignage cellulaire, Épigenèse génétique, Récepteur alpha des oestrogènes, Régulation de l'expression des gènes au cours du développement, Cellules gonadotropes, Humains, Souris, Facteur stéroïdogène-1, génétique, physiologie |
L’hypophyse est une glande endocrine située à l’interface entre le système nerveux
central et différents tissus cibles. Elle comporte six types cellulaires endocrines
différents contrôlant des fonctions essentielles du vivant. La fonction de reproduction
est sous le contrôle des cellules gonadotropes hypophysaires qui, en réponse à la
neuro-hormone hypothalamique GnRH (gonadotropin-releasing hormone),
synthétisent et sécrètent les deux hormones gonadotropes, LH (luteinizing
hormone) et FSH (follicle-stimulating hormone). Ces
hormones contrôlent à leur tour la stéroïdogenèse et la gamétogenèse dans les gonades,
ovaires ou testicules. Les différents lignages endocrines de l’hypophyse se différencient au cours de
l’embryogenèse à partir des mêmes cellules souches. Sous l’action de gradients
morphogénétiques, différents facteurs de transcription sont synthétisés par ces
cellules, permettant la différenciation en l’un ou l’autre des types cellulaires
endocrines. Pour les cellules gonadotropes, le facteur de transcription inducteur de la
différenciation est le récepteur nucléaire SF-1 (steroidogenic
factor-1) [1].
L’expression du gène Sf-1 dans les cellules gonadotropes débute à
partir de 13,5 jours de développement embryonnaire chez la souris (E13,5). Elle permet
notamment de déclencher l’expression des gènes clefs de la fonction gonadotrope, tels
que le gène codant le récepteur de la GnRH et ceux codant les sous-unités b spécifiques
des hormones gonadotropes. Ainsi, des mutations du gène SF-1 humain ou
une extinction spécifique de l’expression de Sf-1 dans l’hypophyse chez
la souris entraîne une stérilité [2,3]. L’expression du gène Sf-1 n’est pas restreinte aux cellules
gonadotropes. Elle dépend d’un promoteur, 1A ou 1G, ainsi que de séquences régulatrices
distales, ou enhancers, qui diffèrent selon le type cellulaire. Dans
les cellules gonadotropes, l’expression de Sf-1 est contrôlée
essentiellement par le promoteur 1G [4] et par un enhancer pituitaire, localisé dans le
6e intron du gène [5]. Nous avons effectué une étude épigénétique des séquences régulatrices de
Sf-1 au cours de la différenciation du lignage gonadotrope [6]. Si cette étude a confirmé que
l’enhancer pituitaire est actif dans les cellules gonadotropes
matures, elle a également révélé qu’il ne l’est pas à des stades précoces de la
différenciation de ce lignage, ce qui remettait en question son rôle dans l’émergence de
l’expression de Sf-1 au cours du développement hypophysaire. |
Identification de l’enhancer le plus précocement impliqué dans l’expression de
Sf-1 dans les cellules gonadotropes hypophysaires Dans un premier temps, nous avons identifié l’ensemble des régions régulatrices
potentielles du génome en mesurant l’accessibilité de la chromatine par la technique
ATAC-seq (assay for transposase-accessible chromatin using
sequencing) [7].
Nous avons utilisé trois modèles de cellules murines immortalisées, qui reproduisent
trois stades phénotypiques de la différenciation du lignage gonadotrope : les
cellules αT1-1, dérivées de cellules précurseurs de l’hypophyse à E11,5 et
n’exprimant pas encore Sf-1, les cellules αT3-1, « immatures »,
dérivées de cellules déjà engagées dans la différenciation gonadotrope, qui
expriment Sf-1 mais pas encore l’ensemble des gènes marqueurs du
lignage, et les cellules LβT2, dérivées de cellules gonadotropes différenciées,
exprimant Sf-1 et l’ensemble des gènes clefs du lignage [8]. Cette étude a confirmé
l’absence d’accessibilité de l’enhancer pituitaire dans les
cellules gonadotropes immatures, et nous a permis de découvrir une autre région
potentiellement régulatrice de Sf-1, localisée dans le
4e intron, dont la chromatine est accessible spécifiquement à ce
stade de développement (Figure
1A).
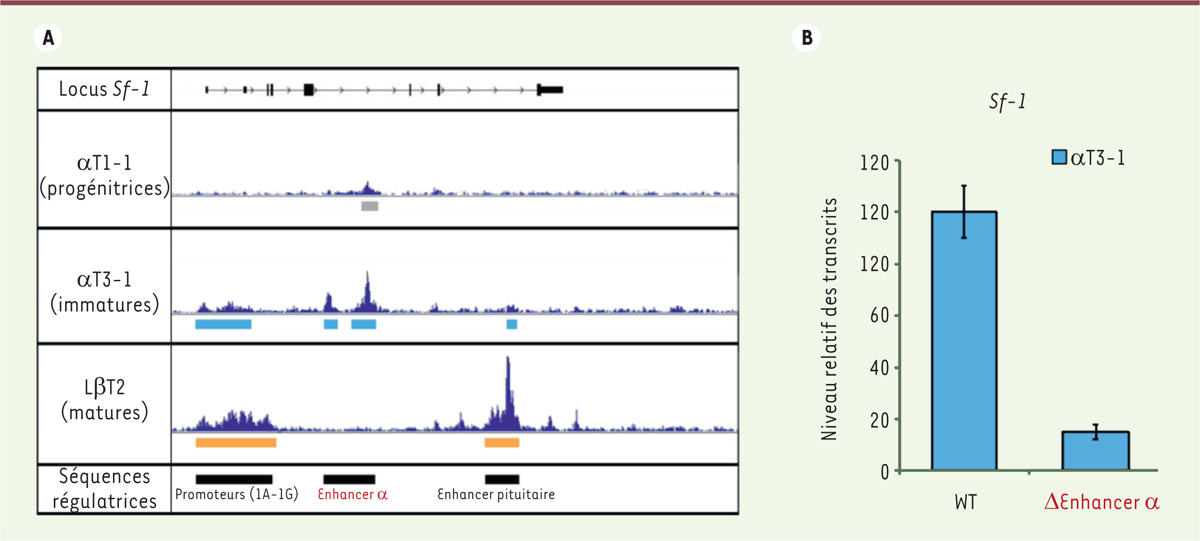
 | Figure 1. Identification de l’enhancer a, le plus précocement
impliqué dans l’expression de Sf-1 au cours de la
différenciation du lignage gonadotrope hypophysaire.
A. « Accessibilité » de la chromatine mesurée par la
technique ATAC-seq (assay for transposase accessible chromatine
with high-throughput sequencing) pour le locus du gène
Sf-1 dans les trois lignées modèles de cellules
gonadotropes murines immortalisées : αT1-1, αT3-1 et LβT2. La hauteur
des pics reflète le « degré d’ouverture » de la chromatine. Les régions
accessibles de la chromatine ainsi identifiées sont soulignées sous
chacune des lignées cellulaires (respectivement en gris, bleu, et
jaune). La dernière ligne récapitule, en noir, l’ensemble des régions
accessibles de la chromatine identifiées pour l’ensemble des lignées. B. Niveaux relatifs des transcrits de
Sf-1 dans les cellules gonadotropes immatures αT3-1
témoins (wild-type, WT) ou ayant subi la délétion de
l’enhancer α (DEnhancer a) mesurés
par RT-PCR (reverse transcriptase-polymERαse chain
reaction) après normalisation par le taux de transcrits
d’un gène de ménage (Gapdh, glycERαldehyde 3-phosphate
dehydrogenase). Les données correspondent à la moyenne ±
SEM (standard error of the mean, ou erreur type de la
moyenne) de six expériences indépendantes. Différence statistiquement
significative par rapport aux cellules témoins (WT) : p < 0,001. |
Nous avons également montré que cette région est transitoirement mobilisée,
in vivo, au cours de l’ontogenèse hypophysaire, à E13,5 chez la
souris [7]. La caractérisation des marques
épigénétiques de la chromatine de cette région a montré qu’elle était un
enhancer actif, que nous avons nommé «
enhancer a », dans les cellules gonadotropes immatures. Afin de
déterminer l’importance de cet enhancer dans la régulation de
l’expression de Sf-1, nous avons réalisé la délétion de sa séquence
génomique dans les cellules gonadotropes immatures par la technique CRISPR/Cas9
(clustered regularly interspaced short palindromic
repeats/CRISPR-associated protein 9). La délétion de
cette séquence entraîne une réduction majeure de l’expression de
Sf-1, ce qui montre que cet enhancer est très
important pour l’expression de Sf-1 dans les cellules gonadotropes
immatures (Figure 1B). Il
s’agit de l’enhancer le plus précocement impliqué dans le contrôle
de l’expression du gène Sf-1 au cours de la différenciation du
lignage gonadotrope, et dont le recrutement précède celui de
l’enhancer pituitaire [5]. |
Quels sont les mécanismes épigénétiques contrôlant l’activité de l’enhancer a du
gène Sf-1 ? L’analyse bio-informatique de la séquence génomique de cet enhancer
a révélé un site de fixation de type ERE (estrogen response
element) très conservé chez les mammifères. Nous avons déterminé que seul
le récepteur a des œstrogènes (ERα) est exprimé dans les cellules gonadotropes
immatures et vérifié, par immunoprécipitation de la chromatine, qu’il se fixait
effectivement sur cet enhancer (Figure
2A). Nous avons par ailleurs montré que ERα est un facteur
de transcription indispensable à l’activité de l’enhancer a puisque
la diminution de son expression par des ARN interférents inactive totalement cet
enhancer. De plus, nous avons mis en évidence, par des
approches pharmacologiques, que l’action de ERα est dépendante de l’activation par
son ligand, l’œstradiol [7].
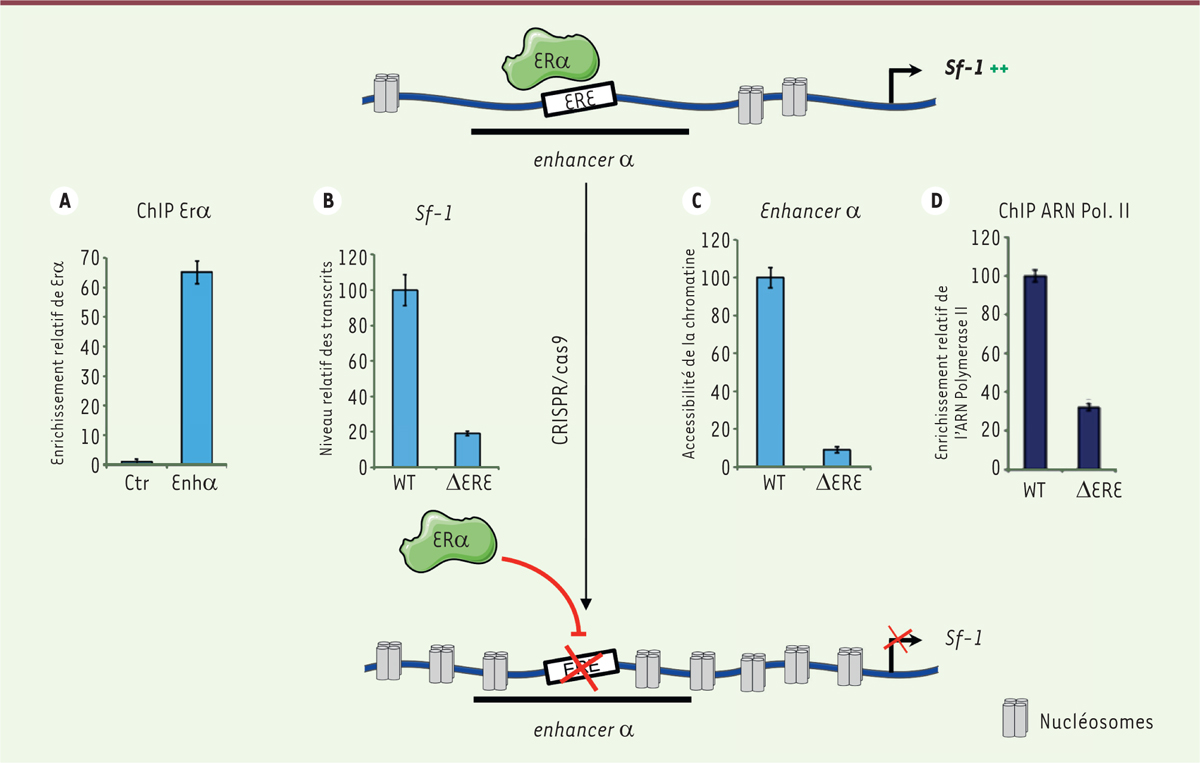
 | Figure 2. ERα est essentiel aux mécanismes épigénétiques contrôlant
l’expression du gène Sf-1 dans les cellules gonadotropes
immatures. A. Enrichissement relatif de ERα sur
l’enhancer α (Enhα), déterminé par immunoprécipitation de la chromatine
(ChIP) suivie d’une PCR quantitative (polymerase chain reaction) dans
les cellules gonadotropes immatures αT3-1. Chaque valeur correspond à la
moyenne ± SEM (erreur type de la moyenne) de quatre expériences
indépendantes. Différence statistiquement significative par rapport à
l’enrichissement sur une région chromatinienne témoin (control, Ctr) : p
< 0,001. B. Niveau relatif des
transcrits du gène Sf-1 dans les cellules gonadotropes immatures αT3-1
témoins (wild-type, WT) ou délétées pour l’ERE identifié dans la
séquence de l’enhancer α (ERE), obtenu par RT (reverse
transcriptase)-PCR et normalisation par le taux de transcrits d’un gène
de ménage (Gapdh, glyceraldehyde 3-phosphate dehydrogenase). Les données
correspondent à la moyenne ± SEM de six expériences indépendantes.
Différence statistiquement significative par rapport aux cellules
témoins (WT) : p < 0,001. C.
Accessibilité de la chromatine de l’enhancer α mesurée dans les cellules
gonadotropes immatures αT3-1 WT ou ΔERE par PCR quantitative, exprimée
par rapport aux cellules WT. Chaque valeur correspond à la moyenne ± SEM
de quatre expériences indépendantes. Différence statistiquement
significative par rapport aux cellules WT : p < 0,001.
D. Enrichissement relatif de l’ARN
polymérase II (ARN Pol. II) sur le promoteur pituitaire de Sf-1, mesuré
par ChIP-PCR quantitative dans les cellules gonadotropes immatures αT3-1
WT et ΔERE, exprimé par rapport aux cellules WT. Chaque valeur
correspond à la moyenne ± SEM de six expériences
indépendantes.Différence statistiquement significative par rapport aux
cellules WT : p < 0,001. |
L’excision de l’ERE de l’enhancer a dans des cellules gonadotropes
immatures par la stratégie CRISPR/Cas9 bloque la fixation de ERα sur cet
enhancer, et nous avons montré que cette fixation est
strictement nécessaire au maintien de l’expression de Sf-1 par le
biais d’un remodelage important des marques épigénétiques de la chromatine
(Figure 2B). Lorsque
ERα ne peut plus se fixer sur l’enhancer a, on observe notamment la
fermeture de la chromatine à cet emplacement, ainsi que la reméthylation totale de
l’ensemble des sites cytosine-phosphate-guanine (CpG) de l’ADN, suggérant une
inactivation complète de cet enhancer (Figure
2C). Parallèlement à ces modifications, nous avons mis en
évidence une nette diminution de la fixation de l’ARN polymérase II sur le promoteur
du gène Sf-1 (Figure 2D),
attestant l’effet régulateur, à distance, de l’enhancer a sur
l’expression de ce gène. |
Cette étude nous a permis d’identifier l’enhancer le plus
précocement impliqué dans l’activation du gène Sf-1 au cours de la
spécification du lignage gonadotrope dans l’hypophyse. Elle a également permis de
découvrir le rôle essentiel du récepteur nucléaire des œstrogènes ERα dans le
maintien des mécanismes épigénétiques impliqués dans l’expression de
Sf-1 par les cellules gonadotropes immatures, un rôle qui
s’inscrit dans le concept émergent de l’implication de ce facteur dans les processus
épigénétiques de différenciation cellulaire. Une diminution de l’expression de ERα
ou une altération de la signalisation œstrogénique, par exemple par des
perturbateurs endocriniens, pourrait ainsi expliquer certains défauts précoces de la
mise en place du lignage gonadotrope, conduisant à terme à des troubles de la
reproduction chez l’adulte. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Nous remercions les co-auteurs de la publication originale. Ces travaux ont bénéficié
du soutien logistique et financier du CEA, de l’Inserm (UMR 967), et du
Genopole-Évry, ainsi que de financements de la délégation générale de l’armement
(DGA), du fonds unique interministériel (FUI-AAP13) et du conseil général de
l’Essonne (consortium STEMSAFE), de l’AFM-Téléthon, et de fonds de l’union
européenne (RISK-IR, FP7, n° 323267).
|
Footnotes |
1. Ingraham
HA,
Lala
DS,
Ikeda
Y, et al.
The nuclear receptor steroidogenic factor 1 acts at multiple
levels of the reproductive axis . Genes Dev.
1994; ; 8 :
:2302.–2312. 2. Lin
L,
Philibert
P,
Ferraz-de-Souza
B, et al.
Heterozygous missense mutations in steroidogenic factor 1
(SF1/Ad4BP, NR5A1) are associated with 46, XY disorders of sex development
with normal adrenal function . J Clin Endocrinol
Metab.
2007; ; 92 :
:991.–999. 3. Zhao
L,
Bakke
M,
Parker
KL.
Pituitary-specific knockout of steroidogenic factor
1 . Mol Cell Endocrinol.
2001; ; 185 :
:27.–32. 4. Kimura
R,
Yoshii
H,
Nomura
M, et al.
Identification of novel first exons in Ad4BP/SF-1 (NR5A1) gene
and their tissue- and species-specific usage .
Biochem Bioph Res Commun.
2000; ; 278 :
:63.–71. 5. Shima
Y,
Zubair
M,
Komatsu
T, et al.
Pituitary homeobox 2 regulates adrenal4 binding
protein/steroidogenic factor-1 gene transcription in the pituitary
gonadotrope through intERαction with the intronic enhancer .
Mol Endocrinol.
2008; ; 22 :
:1633.–1646. 6. Laverrière
JN,
L’Hôte
D,
Tabouy
L, et al.
Epigenetic regulation of alternative promoters and enhancers in
progenitor, immature, and mature gonadotrope cell lines .
Mol Cell Endocrinol.
2016; ; 434 :
:250.–265. 7. Pacini
V,
Petit
F,
Quérat
B, et al.
Identification of a pituitary ERα-activated enhancer triggering
the expression of Nr5a1, the earliest gonadotrope lineage-specific
transcription factor . Epigenet Chromatin.
2019; ; 12 : :48.. 8. Ooi
GT,
Tawadros
N,
Escalona
RM. Pituitary cell
lines and their endocrine applications . Mol Cell
Endocrinol.
2004; ; 228 :
:1.–21. |