| |
| Med Sci (Paris). 36(6-7): 565–568. doi: 10.1051/medsci/2020101.Gènes stemness et bioingénierie des
greffons cutanés Focus sur KLF4 Nicolas O. Fortunel1* and Michèle T. Martin1** 1Laboratoire de génomique et radiobiologie de la
kératinopoïèse, CEA/DRF/IBFJ/IRCM, 2 rue Gaston Crémieux, 91000Évry,
FranceInserm U967, Fontenay-aux-Roses ; Université Paris-Diderot,
Université Paris-Saclay, France MeSH keywords: Cellules souches adultes, Animaux, Bioingénierie, Cellules souches embryonnaires, Humains, Kératinocytes, Facteurs de transcription Krüppel-like, Transplantation de peau, Peau artificielle, Niche de cellules souches, cytologie, physiologie, méthodes, tendances, métabolisme, génétique |
Le travail de notre laboratoire publié dans la revue Nature Biomedical
Engineering [1]
identifie le facteur de transcription KLF4 comme un régulateur du statut de cellule
souche dans le lignage des kératinocytes humains. Maintenir l’expression de ce facteur à
un faible niveau par répression pharmacologique constitue une approche prometteuse pour
favoriser l’amplification ex vivo de deux types de cellules d’intérêt
pour la thérapie cellulaire cutanée : les cellules souches et progéniteurs
kératinocytaires natifs issus d’épiderme adulte, utilisés depuis plus de trois décennies
pour la bioingénierie des greffons cliniques, et les kératinocytes générés par
différenciation ciblée de cellules souches embryonnaires (CSE), qui font actuellement
l’objet d’explorations pour le développement de biopansements cutanés. |
L’épiderme humain est naturellement doté de remarquables capacités de renouvellement
et de régénération, dues à la présence de cellules souches au sein de sa couche
basale. Ces capacités ont permis l’obtention d’organoïdes de peau en culture ainsi
que le développement clinique des greffes autologues, notamment pour le traitement
des grands brûlés [2, 3]. Plus récemment, une
approche combinant thérapies cellulaire et génique a permis la régénération de
l’épiderme entier d’un patient atteint d’une génodermatose1 [4].
La bioingénierie de grandes surfaces de substituts cutanés nécessite une phase
d’expansion ex vivo massive des kératinocytes du patient, durant
laquelle la préservation des cellules souches constitue un point critique pour
assurer la pérennité des greffes. L’étude des acteurs moléculaires impliqués dans le
maintien de cellules souches kératinocytaires fonctionnelles constitue donc une
étape nécessaire à la conception des prochaines générations de greffons cutanés. Ces
nouvelles générations de greffons pourraient utiliser un matériel cellulaire
complémentaire des kératinocytes natifs, puisque les kératinocytes produits par
orientation ciblée de CSE ou de cellules souches pluripotentes induites (CSPi) sont
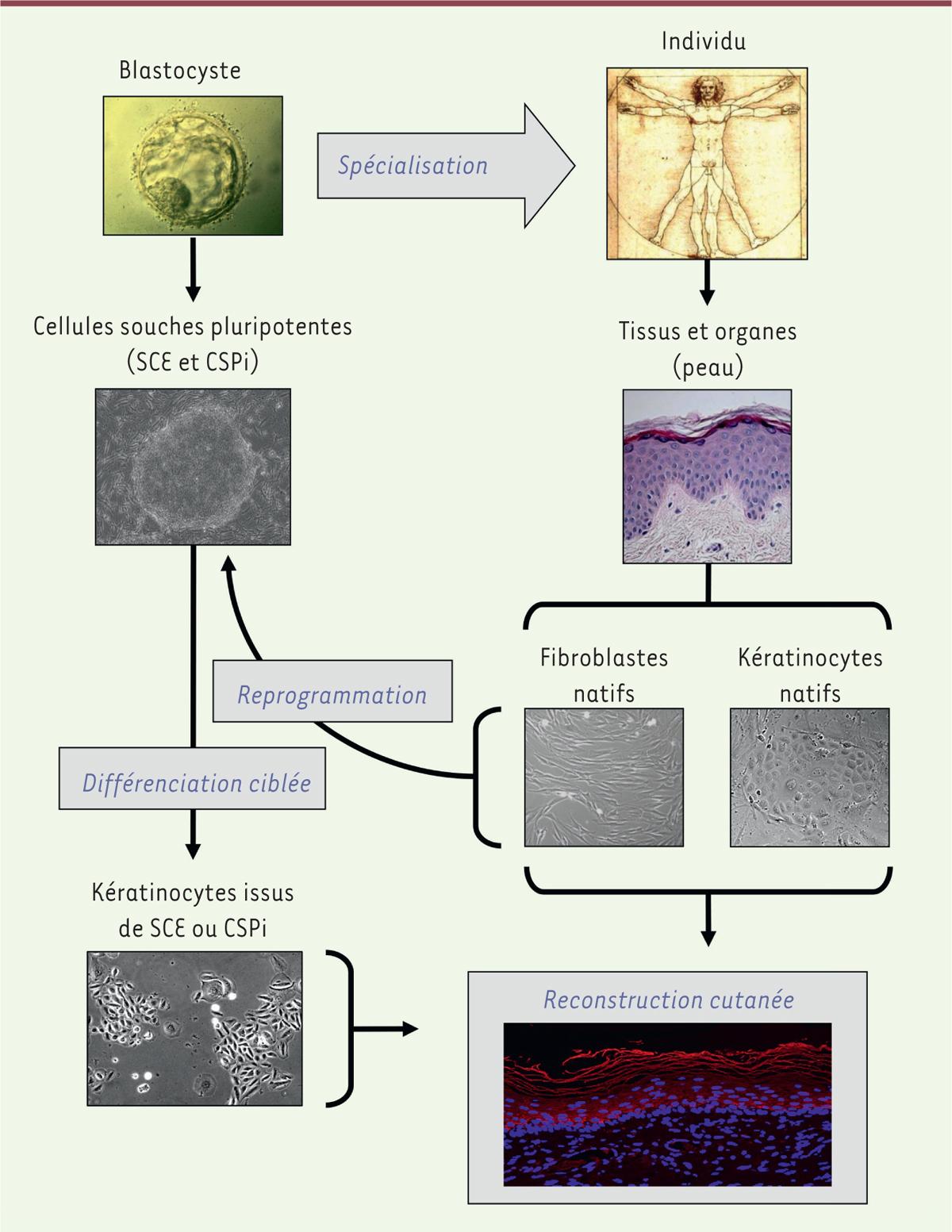
capables de générer des organoïdes cutanés [5] (Figure
1). L’efficacité de cette source alternative de kératinocytes
dépendra de la robustesse des méthodes de leur production et de la possibilité
d’obtenir des kératinocytes à l’état de précurseurs immatures.
 | Figure 1. Différentes origines de kératinocytes d’intérêt pour la
reconstruction cutanée. Les kératinocytes natifs
extraits de biopsies de peau adulte constituent à ce jour la source
majeure de kératinocytes pour les utilisations médicales, puisqu’ils
sont utilisés depuis plus de trois décennies pour la bioingénierie de
greffons destinés au traitement des grands brûlés, et plus récemment
pour la thérapie génique. Les kératinocytes produits par différenciation
ciblée de cellules souches pluripotentes sont actuellement évalués comme
source complémentaire pour le développement de biopansements cutanés.
Les cellules souches embryonnaires (CSE) peuvent être différenciées en
kératinocytes capables de reconstruire un épiderme. Les cellules souches
induites à la pluripotence (CSPi), qui sont obtenues par reprogrammation
de cellules adultes (par exemple fibroblastes ou kératinocytes cutanés),
peuvent également être différenciées en kératinocytes. |
|
Le facteur de transcription KLF4 (Kruppel-like factor 4) n’est pas
un inconnu dans le domaine des cellules souches. La famille KLF est impliquée dans
l’autorenouvellement des CSE, et KLF4 est utilisé dans le procédé original de
reprogrammation de cellules somatiques vers un état CSPi [6]. On connaissait également l’implication de
KLF4 dans les processus de différenciation terminale des kératinocytes de l’épiderme
de souris et son importance pour la mise en place de la fonction barrière de cet
épithélium. En revanche, l’exploration des fonctions de KLF4 dans les cellules
souches tissulaires natives constitue un pan peu exploré de la biologie de ce
facteur. En nous fondant sur des cribles transcriptomiques réalisés sur des
sous-populations de précurseurs kératinocytaires humains, enrichies en cellules
souches ou en progéniteurs, nous avons posé comme hypothèse que KLF4 était impliqué
dans la régulation des cellules souches de l’épiderme, et particulièrement de leur
capacité régénératrice. |
Étude de la fonction de KLF4 dans les kératinocytes natifs adultes La fonction régulatrice du facteur de transcription KLF4 a tout d’abord été étudiée
dans le modèle des holoclones, qui correspond à la descendance clonale de cellules
souches kératinocytaires, maintenue et amplifiée en culture [7]. Dans le cadre d’une approche de génomique
fonctionnelle, des holoclones présentant une diminution du niveau constitutif
d’expression de KLF4 (knock-down, KD) par rapport au contexte
cellulaire témoin (wild-type, WT) ont été générés par expression
stable d’ARN interférents (shARN). La mise en œuvre de tests de clonalité et de
cultures à long terme a permis de montrer qu’une réduction du niveau d’expression de
KLF4 préserve le statut de précurseurs kératinocytaires et favorise leur
autorenouvellement. Cet effet se traduit par le maintien d’un niveau élevé de
nombreux marqueurs caractéristiques d’un état immature de ces cellules, dont
l’intégrine-α6, et par une augmentation de l’expansion cellulaire en culture
bidimensionnelle. De plus, la capacité régénératrice des cultures de kératinocytes
[KLF4KD] est supérieure à celle d’une culture de kératinocytes
[KLF4WT]. Ce gain a été démontré d’une part par une meilleure
production d’organoïdes en culture, et, d’autre part, par la capacité de substituts
cutanés humains à assurer une prise de greffe itérative chez la souris [8]. Lors d’un premier cycle de
xénogreffe, l’aptitude des kératinocytes [KLF4WT] et [KLF4KD]
s’est avérée équivalente, indiquant une absence d’effet délétère de la répression de
KLF4 sur l’organogenèse épidermique. En revanche, lorsque les cellules sont
extraites de greffons primaires afin d’assurer un second cycle de reconstruction
épidermique et de xénogreffe, le taux de succès observé avec les kératinocytes
[KLF4KD] est trois fois supérieur à celui des kératinocytes
[KLF4WT], indiquant un meilleur maintien à long terme de cellules
souches kératinocytaires fonctionnelles après répression de KLF4. |
Afin d’expliquer les effets bénéfiques obtenus par inhibition de KLF4, les profils
d’expression génique de kératinocytes [KLF4WT] et de kératinocytes
[KLF4KD] ont été caractérisés par séquençage du transcriptome et
comparés. Cette analyse a permis de mettre en évidence une modulation des voies de
signalisation du TGF-β1 (transforming growth factor β1) et de Wnt,
qui sont centrales pour la biologie des cellules souches. Nous avons notamment
détecté une répression globale de la voie du TGF-β1 dans les kératinocytes
[KLF4KD], et en particulier de son axe ALK1 (activin
receptor-like kinase 1)/Smad1/5/9 (Figure 2). Comme le TGF-β1 est connu pour induire
la différenciation des précurseurs kératinocytaires, nous avons exploré la relation
fonctionnelle entre ce facteur et KLF4. Nous montrons que la répression de KLF4
permet aux kératinocytes de résister à l’effet différenciateur du TGF-β1 et de mieux
conserver les caractéristiques de cellules souches.
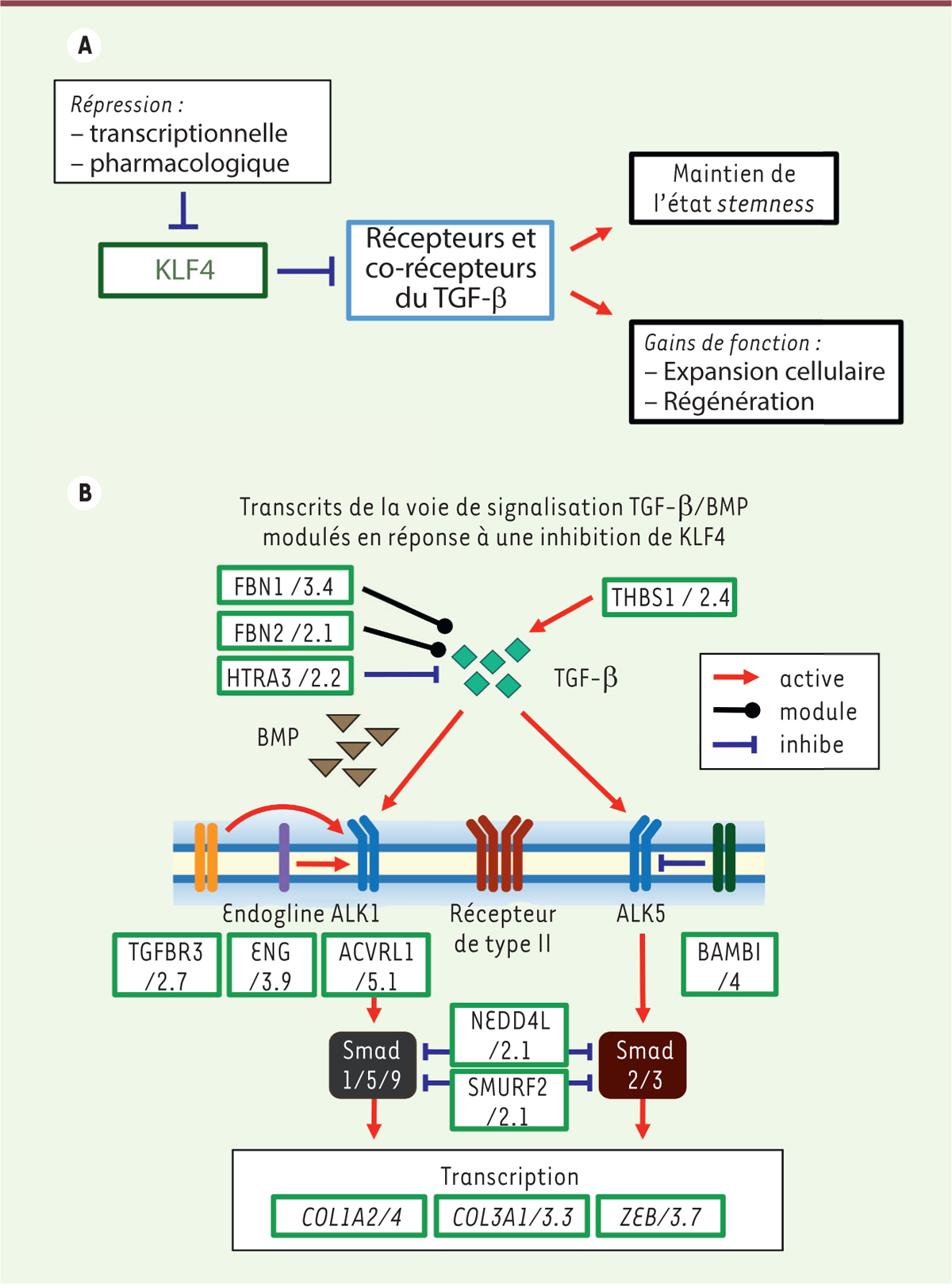
 | Figure 2. La répression de KLF4 impacte les voies de signalisation du
TGF-b. La comparaison des profils
transcriptionnels de kératinocytes [KLF4WT] et
[KLF4KD], caractérisés par séquençage (RNA-seq), montre
que la répression de KLF4 diminue l’expression de nombreux gènes codant
des effecteurs des voies de signalisation du TGF-β (A), incluant des modulateurs
extracellulaires, des récepteurs membranaires et des composants
intracellulaires (B). Les chiffres indiqués correspondent au
différentiel d’expression dans les kératinocytes [KLF4KD]
versus [KLF4WT]. |
|
De la recherche fondamentale aux modèles précliniques Pour nous approcher de conditions applicables en clinique, nous avons exploré les
effets d’une répression transitoire de KLF4 sur des kératinocytes issus de
l’ensemble de la couche basale de l’épiderme [9], plus représentatifs des cellules utilisées pour la
génération des greffons que les holoclones. Le traitement de kératinocytes par des
petits ARN interférents (siARN) ciblant KLF4 a permis de montrer qu’une inhibition
transitoire spécifique est efficace pour promouvoir le maintien de caractères
associés à un état de cellule souche. L’étape suivante a été l’obtention d’une
inhibition transitoire par voie pharmacologique. En effet, un traitement par la
kenpaullone2 permet de diminuer
l’expression de KLF4, ce qui augmente la capacité clonogénique et la croissance des
kératinocytes. Sur le plan de la biosécurité, le séquençage de l’exome des
kératinocytes n’a pas détecté d’effet délétère de cette répression de KLF4 sur
l’intégrité de leur génome. |
Extrapolation aux kératinocytes issus de cellules souches pluripotentes Afin d’élargir la portée de ce travail, nous avons étudié la possibilité d’appliquer
la stratégie de la répression de KLF4 aux kératinocytes dérivés de cellules souches
embryonnaires (Ker-CSE). Bien que ces kératinocytes possèdent la capacité de
reconstruire un épiderme fonctionnel [5], ils
ne présentent pas l’ensemble des caractéristiques des cellules souches
kératinocytaires, et leur capacité de prolifération en culture est notamment très
réduite. La kenpaullone s’est également avérée efficace pour réprimer KLF4 dans ces
cellules et pour induire un effet bénéfique sur la prolifération cellulaire,
similaire à celui obtenu avec les kératinocytes natifs. En effet, nous avons montré
que les Ker-CSE traités avec cette molécule ont un phénotype plus immature, qui se
traduit par un gain de croissance en culture bidimensionnelle et un gain de qualité
pour la génération d’épidermes tridimensionnels. |
Cette étude a permis d’identifier le facteur de transcription KLF4 comme un
régulateur du statut de cellule souche dans le lignage des kératinocytes humains,
impliquant notamment un contrôle des voies de signalisation du TGF-β1. Maintenir
l’expression de ce facteur à un niveau faible par une répression pharmacologique
constitue une approche prometteuse pour favoriser l’amplification ex
vivo de kératinocytes natifs de l’épiderme humain ou dérivés de
cellules souches pluripotentes, deux stratégies d’intérêt pour la thérapie
cellulaire cutanée. Par ailleurs, l’expansion des kératinocytes à des fins médicales
utilisant actuellement des milieux de culture non définis [10], et notamment du sérum bovin, les instances
de règlementation demandent la mise en œuvre de milieux mieux définis et sans
composés d’origine animale. La substitution des composés non définis par des
molécules actives promotrices du caractère souche, telles que des inhibiteurs de
KLF4 ou des voies de signalisation TGF-β ou ROCK (Rho-associated,
coiled-coil domain kinase), comme cela a été récemment proposé [11], constitue donc un
progrès attendu de l’ingénierie cellulaire (Figure 3).
 | Figure 3. Améliorer l’amplification cellulaire ex vivo
par l’utilisation de molécules promotrices d’un état de
cellule souche (stemness). Les travaux de notre
laboratoire ont permis d’identifier le facteur de transcription KLF4
comme une cible pertinente (A), qui
pourrait être utilisée de manière combinée avec d’autres cibles
candidates (B), afin de mettre au point
des milieux de culture de composition définie pour une utilisation
biomédicale. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Nous remercions les co-auteurs de la publication originale. Ces travaux ont bénéficié
du soutien logistique et financier du CEA, de l’Inserm (UMR 967), et du
Genopole-Évry, ainsi que de financements de la délégation générale de l’armement
(DGA), du fonds unique interministériel (FUI-AAP13) et du conseil général de
l’Essonne (consortium STEMSAFE), de l’AFM-Téléthon, et de fonds de l’union
européenne (RISK-IR, FP7, n° 323267).
|
Footnotes |
1. Fortunel
NO,
Chadli
L,
Coutier
J, et al.
KLF4 inhibition promotes the expansion of keratinocyte precursors
from adult human skin and of embryonic-stem-cell-derived
keratinocytes . Nat Biomed Eng.
2019; ; 3 :
:985.–997. 2. Gallico
GG,
O’Connor
NE,
Compton
CC, et al.
Permanent coverage of large burn wounds with autologous cultured
human epithelium . N Engl J Med.
1984; ; 311 :
:448.–451. 3. Ronfard
V,
Rives
JM,
Neveux
Y, et al.
Long-term regeneration of human epidermis on third degree burns
transplanted with autologous cultured epithelium grown on a fibrin
matrix . Transplantation.
2000; ; 70 :
:1588.–1598. 4. Hirsch
T,
Rothoeft
T,
Teig
N, et al.
Regeneration of the entire human epidermis using transgenic stem
cells . Nature.
2017; ; 551 :
:327.–332. 5. Guenou
H,
Nissan
X,
Larcher
F, et al.
Human embryonic stem-cell derivatives for full reconstruction of
the pluristratified epidermis: a preclinical study .
Lancet.
2009; ; 374 :
:1745.–1753. 6. Takahashi
K,
Tanabe
K,
Ohnuki
M, et al.
Induction of pluripotent stem cells from adult human fibroblasts
by defined factors . Cell.
2007; ; 131 :
:861.–872. 7. Fortunel
NO,
Cadio
E,
Vaigot
P, et al.
Exploration of the functional hierarchy of the basal layer of
human epidermis at the single-cell level using parallel clonal microcultures
of keratinocytes . Exp Dermatol.
2010; ; 19 :
:387.–392. 8. Fortunel
NO,
Bouissou-Cadio
E,
Coutier
J,
Martin
MT. Iterative
three-dimensional epidermis bioengineering and xenografting to assess
long-term regenerative potential in human keratinocyte precursor
cells . Methods Mol Biol.
2020;; 2109 :
:155.–67. 9. Fortunel
NO,
Chadli
L,
Bourreau
E, et al.
Cellular adhesion on collagen: a simple method to select human
basal keratinocytes which preserves their high growth
capacity . Eur J Dermatol.
2011;; (Suppl 2) :
:12.–20. 10. Alexaline
MM,
Trouillas
M,
Nivet
M, et al.
Bioengineering a human plasma-based epidermal substitute with
efficient grafting capacity and high content in clonogenic
cells . Stem Cells Transl Med.
2015; ; 4 :
:643.–654. 11. Zhang
C,
Lee
HJ,
Shrivastava
A, et al.
Long-term in vitro expansion of epithelial stem cells enabled by
pharmacological inhibition of PAK1-ROCK-Myosin II and TGF-β
signaling . Cell Rep.
2018; ; 25 :
:598.–610. |