Le cortex cérébral n’est-il pas le support organique principal de notre humanité ? Cette partie du cerveau est la source de nos pensées, nous permettant de communiquer des émotions et des concepts à travers le langage, et de résoudre des problèmes complexes. Chez les mammifères, le cortex est composé de plusieurs couches de cellules qui agissent ensemble de manière organisée pour effectuer des « calculs » complexes. Les informations sensorielles provenant du thalamus parviennent aux neurones de la couche 4, qui les transmettent à ceux de la couche 2/3, puis à ceux de la couche 5, qui communiquent avec le thalamus ou d’autres régions corticales. Comparé à celui des autres mammifères, le cortex humain est plus épais et sa couche 2/3 bien plus épaisse encore. De plus, les neurones pyramidaux de cette couche corticale sont de grande taille et possèdent un large arbre dendritique [1] qui résulte de la division dichotomique des troncs dendritiques (Figure 1). Les synapses que ces dendrites établissent avec les afférences provenant d’autres neurones constituent des dizaines de milliers d’entrées excitatrices ou inhibitrices, qui s’additionnent tout le long de l’arbre dendritique et conduisent éventuellement à la création d’un potentiel d’action au niveau du soma.
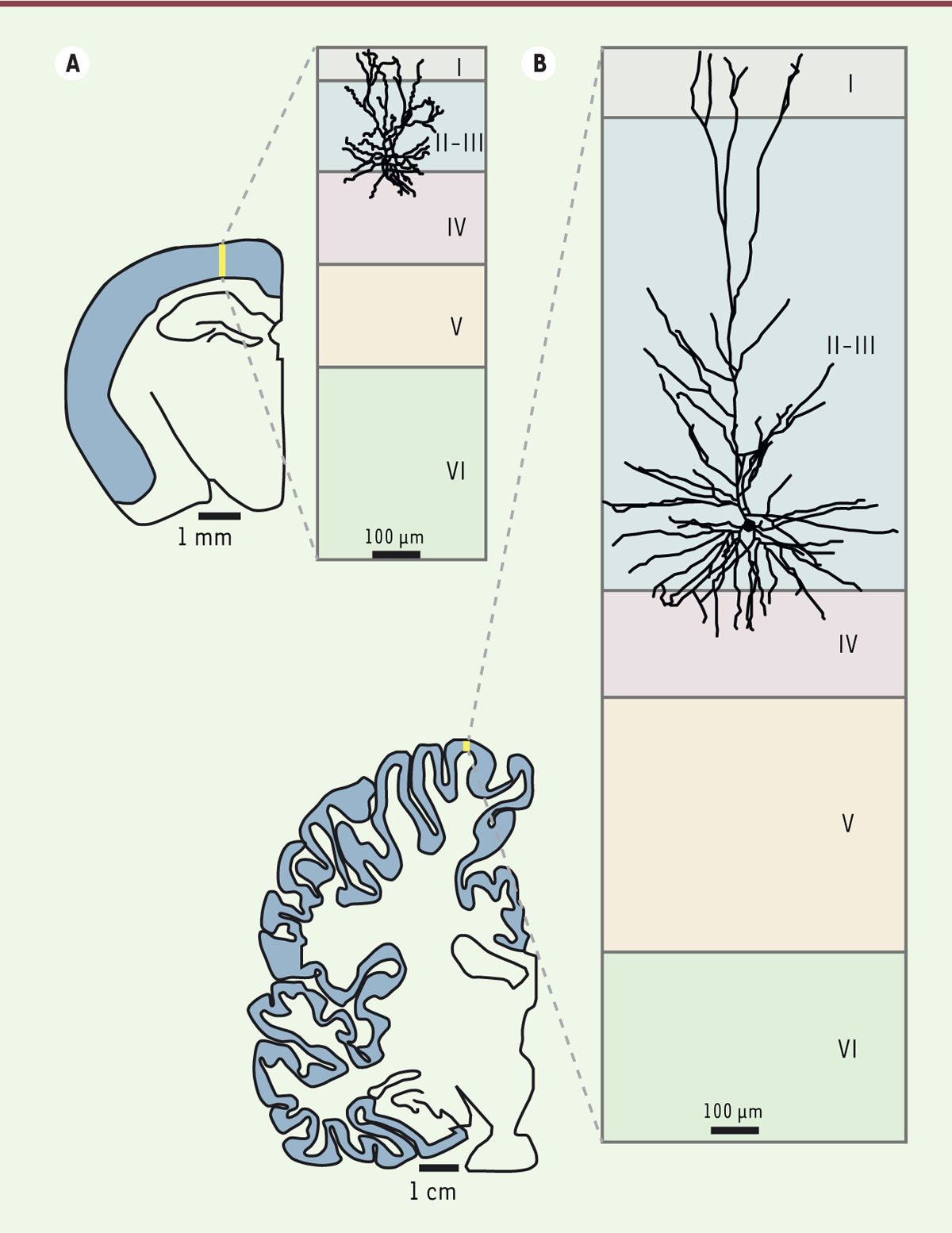
| Figure 1. Comparaison de l’épaisseur du cortex cérébral entre la souris
et l’homme. A. Coupe coronale d’une moitié d’un
cerveau de rongeur. Le cortex est coloré en gris. L’agrandissement est un
diagramme des différentes couches corticales avec la représentation d’un
neurone de la couche II-III du cortex cérébral de la souris. B. Coupe coronale de la moitié d’un cerveau
humain. Notez la différence d’échelle entre l’homme et la souris.
L’épaisseur de la couche II-III du cortex humain est beaucoup plus grande
que chez la souris, et cela d’une façon disproportionnée par rapport à
l’augmentation d’épaisseur des autres couches. Le neurone humain
représentatif de la couche II-III est à la même échelle que le neurone
murin. Grâce aux canaux calcium dépendant du voltage qui peuvent produire
des potentiels d’action dendritiques spécifiques aux neurones humains de la
couche II-III, ces neurones sont capables de combiner des milliers d’entrées
et d’effectuer des opérations complexes. |
Une étude récente, réalisée dans le laboratoire dirigé par Matthew Larkum à l’institut de biologie de l’université Humboldt à Berlin, a révélé les propriétés singulières des dendrites de ces neurones dans l’espèce humaine [2]. Les auteurs, Albert Gidon et ses collègues, ont utilisé du tissu cérébral prélevé chez des individus ayant subi une intervention chirurgicale pour une épilepsie ou pour l’ablation d’une tumeur, afin d’examiner les propriétés électriques des dendrites de la couche 2/3 du cortex cérébral humain. La diversité des sites d’extraction des échantillons, issus de différentes régions corticales, a permis aux auteurs de généraliser leurs résultats à l’ensemble de la couche 2/3 du cortex humain. Le tissu cérébral a été découpé en tranches minces et maintenu dans une solution oxygénée de composition similaire à celle du liquide céphalo-rachidien. Deux électrodes d’enregistrement en patch clamp, l’une dendritique et l’autre somatique (patch clamp double, somato-dendritique), ont permis de caractériser les propriétés électriques des dendrites et du soma des neurones de la couche 2/3. Les chercheurs ont d’abord constaté que la propagation de courants d’intensité inférieure au seuil de déclenchement des potentiels d’action appliqués aux dendrites était fortement atténuée dans les très longues dendrites (une atténuation similaire à la dissipation de chaleur à l’extrémité d’un long câble métallique). Cette propriété des dendrites est universelle, présente chez tous les animaux, et plus les dendrites sont longues, plus l’atténuation est importante. Ainsi, par elles-mêmes, les synapses aux entrées les plus distales (i.e., éloignées du soma) ont probablement un impact « direct » minimal sur l’activité électrique du soma. Cependant, la conduction le long des dendrites n’est pas toujours passive. Les dendrites contiennent en effet des canaux ioniques dépendant du voltage, qui s’ouvrent lorsque la dépolarisation locale est suffisante, ce qui permet d’amplifier le signal électrique lorsque celui-ci se propage jusqu’au corps cellulaire, et ainsi d’induire un potentiel d’action somatique.
Cette activité électrique de la dendrite chez les rongeurs a été attribuée aux canaux sodiques et/ou aux récepteurs NMDA (N-méthyl-D-aspartate) du glutamate [3-5]. Généralement, le potentiel d’action dendritique induit un potentiel d’action somatique, qui peut alors être rétro-propagé vers la dendrite. Cette rétro-propagation peut amplifier le signal produit par l’activité des synapses dendritiques, lorsque ce signal est produit dans une fenêtre de temps spécifique. Ainsi, lorsque l’activité synaptique de la dendrite se produit juste avant ou en même temps que le potentiel d’action somatique, la « force » de ces synapses peut être augmentée pendant très longtemps (plusieurs semaines ou mois), un phénomène considéré comme un des mécanismes permettant la formation de la mémoire à un niveau cellulaire.
Cependant, lorsque les chercheurs ont appliqué des courants de plus grande intensité aux dendrites des neurones de la couche 2/3 du cortex cérébral humain, ils ont observé une activité électrique nouvelle et inattendue. Lors de l’application d’un courant sur les dendrites éloignées du soma, ils ont en effet enregistré, sur ces dendrites, une série de potentiels d’action uniques. Ces enregistrements ont également révélé une singularité d’Homo sapiens : les potentiels d’action dendritiques enregistrés n’étaient pas bloqués par la tétrodotoxine, qui bloque les canaux sodiques, mais par l’ion cadmium (Cd2+), un agent bloqueur de canaux calciques. Afin de distinguer ce potentiel d’action dendritique des autres déjà connus, les auteurs l’ont nommé potentiel d’action dendritique calcique (dendritic Ca2+-driven action potential, dCaAP).
Des dCaAP ont été mis en évidence pour presque tous les neurones corticaux de la couche 2/3 dont l’activité électrique a été enregistrée par ces chercheurs. Environ deux tiers des neurones enregistrés ont produit plusieurs potentiels d’action dans les dendrites où le courant était appliqué, tandis que les autres n’en ont produit qu’un seul. Chaque dCaAP a déclenché un et un seul potentiel d’action somatique (et non un train de potentiels d’action). Étonnamment, les résultats montrent que les dCaAP induits par l’électrode dendritique ont une amplitude maximale au seuil d’activation (rhéobase1) et diminuent en amplitude lorsque l’intensité du courant de stimulation augmente, une autre singularité d’Homo sapiens. De plus, les dCaAP déclenchent des potentiels d’action somatiques pour des intensités du stimulus au seuil d’activation, mais disparaissent pour des intensités du stimulus plus élevées. Ces dCaAP constituent donc une réponse très sélective à la force de la stimulation d’entrée
Quelle est l’importance physiologique de cette propriété ? Elle permet à un neurone cortical humain unique d’effectuer des « calculs » complexes, qui nécessiteraient un réseau de cellules dans un cerveau de rongeur, en rapport avec la transformation entrée-sortie effectuée par les dendrites de ces cellules. Classiquement, la fréquence de potentiels d’action somatiques augmente avec l’intensité d’un courant imposé dans le soma. Dans le cortex cérébral des rongeurs, les multiples entrées sur un arbre dendritique s’additionnent, et pour un courant suffisant, à la rhéobase, produiront un potentiel d’action somatique. Plus les entrées d’amplitude supérieure à la rhéobase sont nombreuses et de grande amplitude, plus nombreux seront les potentiels d’action somatiques. Or environ un tiers des neurones de la couche 2/3 du cortex humain produisant des dCaAP répétés lors de la stimulation électrique de leurs dendrites distales avaient un comportement inverse : l’augmentation de l’intensité du courant injecté dans les dendrites a entraîné une diminution de la fréquence des potentiels d’action somatiques. Ces résultats indiquent que la production de dCaAP est étroitement dépendante d’une fenêtre spécifique d’intensité de la stimulation, car elle n’est pas observée en dessous ou au-dessus de certaines valeurs de cette intensité. Dans ces neurones, l’augmentation de l’intensité d’un courant de stimulation appliqué directement au corps cellulaire entraînait par ailleurs l’augmentation « typique » du nombre de potentiels d’action somatiques.
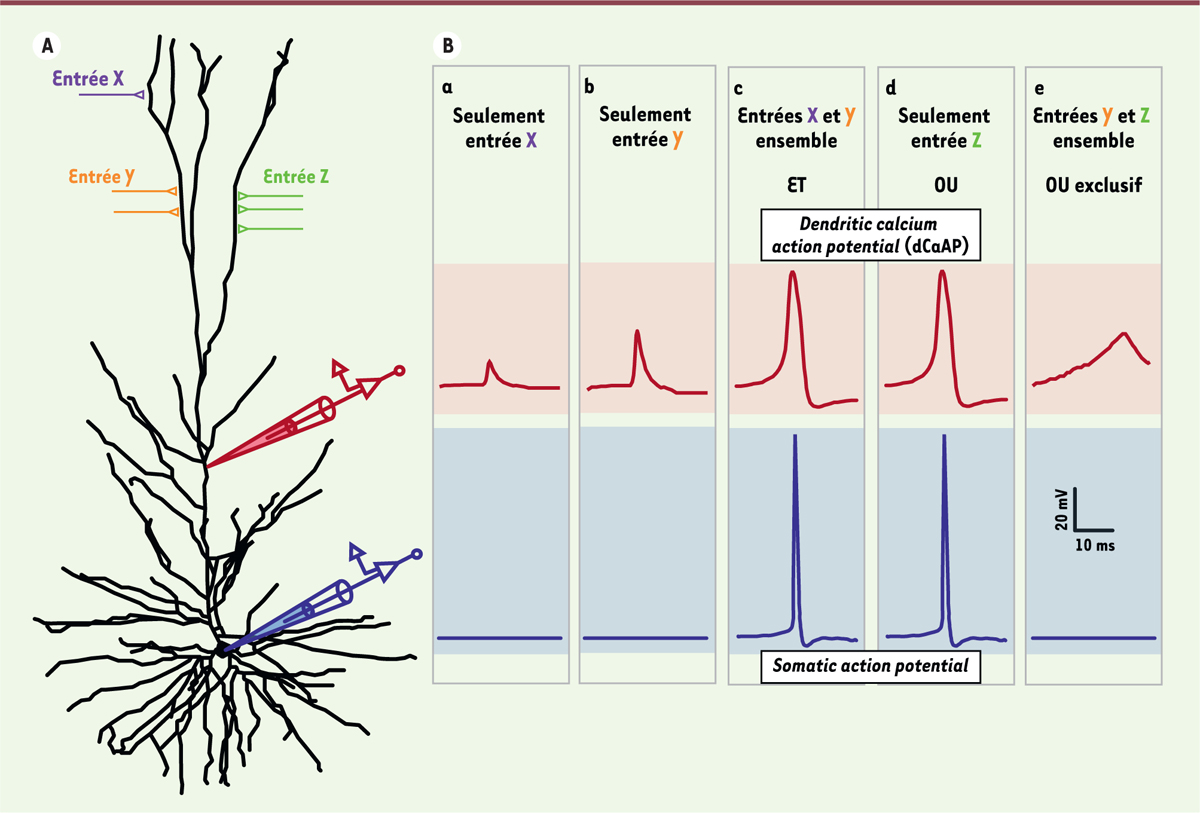
La plupart des entrées synaptiques sont en elles-mêmes trop faibles pour induire un potentiel d’action (e.g., entrées X et Y du neurone de la Figure 2 ). Cependant, lorsque plusieurs entrées sont activées simultanément, leurs capacités individuelles de dépolarisation de la dendrite s’additionnent, ce qui peut conduire à la production d’un potentiel d’action dans le soma ( Figure 2B(c)). Ce fonctionnement peut être modélisé comme un mode de calcul additif, du type « ET » : un potentiel d’action somatique est produit lorsque les entrées X ET Y sont simultanément actives. Il existe aussi un mode de calcul de type « OU »: un potentiel d’action somatique est produit si les entrées X et Y, OU l’entrée Z sont activées ( Figure 2B(d)). En utilisant ces deux modes de calcul et des réseaux de neurones connectés, il est possible de modéliser des opérations complexes réalisées par le cortex, comme le filtrage d’un signal auditif ou la discrimination visuelle des mouvements [6].
| Figure 2. Diagramme illustrant la capacité de calcul avancée des
dendrites de la couche II-III du cortex cérébral humain.
A. Un neurone représentatif de la couche II-III du
cortex cérébral humain. Les potentiels électriques membranaires de deux
sites d’enregistrement, sur le soma (en bleu) et sur la dendrite apicale (en
rouge), sont montrés en B. Ce neurone a trois entrées synaptiques
excitatrices théoriques, X, Y, et Z, sur l’arbre dendritique apical.
L’entrée X ou l’entrée Y produit des évènements synaptiques inférieurs au
seuil d’activation, qui n’entraînent ni potentiel d’action calcique
dendritique, ni potentiel d’action somatique. Les entrées X et Y simultanées
(opération logique ET) entraînent une dépolarisation dendritique au-dessus
du seuil et produisent un potentiel d’action calcique dendritique (dCaAP),
provoquant le déclenchement d’un potentiel d’action somatique. Le même
phénomène se produit avec l’activation d’une entrée plus forte unique Z.
Ainsi, le neurone peut être activé par la combinaison X ET Y, OU par Z.
Cependant, à cause des propriétés des canaux calciques, activés par le
potentiel électrique, qui sous-tendent le potentiel d’action dendritique,
l’activation simultanée des entrées Y et Z entraîne une dépolarisation
dendritique au-dessous du seuil d’activation de la dendrite et ne déclenche
donc aucun potentiel d’action somatique. Ainsi, les propriétés dendritiques
de ce neurone unique permettent de sélectionner les entrées qui se situent
dans une gamme spécifique d’intensité, un processus jamais observé jusqu’à
présent dans d’autres espèces. |
Les auteurs de l’étude apportent la première indication que les dendrites de certains neurones humains sont capables de réaliser un calcul de type « OU exclusif » (XOR), en montrant pour la première fois que, chez l’homme, les dCaAP et par conséquent les potentiels d’action somatiques ne sont pas produits lorsque les entrées synaptiques sont trop fortes. Avant cette découverte des propriétés électriques singulières des neurones de la couche 2/3 du cortex cérébral humain, on pensait que l’opération XOR nécessitait de nombreux neurones interconnectés. Ces résultats indiquent cependant qu’une seule dendrite d’un neurone cortical humain est capable d’effectuer ce calcul indépendamment. Un seul neurone humain aurait donc une capacité de calcul similaire à celle d’un petit réseau de neurones chez les rongeurs.
Pour tester cette hypothèse, les auteurs reconstruisent digitalement un neurone pyramidal de la couche 2/3 du cortex cérébral humain avec le logiciel NEURONE [7], et étudient, par simulation, l’effet de deux entrées synaptiques excitatrices situées sur des dendrites distinctes (Figure 2A). Chaque voie activée seule (i.e., X et Y ensemble, ou Z), déclenche des dCaAP et des potentiels d’action somatiques ; cependant, l’activation simultanée des deux voies (Y+Z) diminue l’amplitude des dCaAP, ou même les fait disparaître ainsi que les potentiels d’action somatiques (Figure 2B). De plus, en ajoutant une entrée synaptique inhibitrice (synapses GABAergiques) aux deux autres entrées excitatrices sur les dendrites, on restaure l’amplitude des dCaAP, ce qui montre le rôle de l’équilibre entre excitation et inhibition dans la production des dCaAP.
Cette découverte de l’importance d’un mécanisme dendritique particulier, méconnu jusqu’alors, pour le fonctionnement de certains neurones du cortex cérébral humain, constitue un indéniable progrès dans la compréhension de la capacité de calcul exceptionnelle de notre cerveau.