| |
| Med Sci (Paris). 36(6-7): 577–579. doi: 10.1051/medsci/2020102.Du glycogène à la gouttelette lipidique Une intime connexion dans l’adipocyte brun Alicia Mayeuf-Louchart1* and Hélène Duez1 1Université de Lille, Inserm, CHU Lille, Institut Pasteur de
Lille, U1011- Institut Européen de Génomique du Diabète
(EGID), 1 rue du Pr
Calmette, F-59019Lille,
France MeSH keywords: Adipocytes bruns, Tissu adipeux brun, Animaux, Différenciation cellulaire, Métabolisme énergétique, Glycogène, Humains, Gouttelettes lipidiques, Métabolisme lipidique, Maladies métaboliques, physiologie, transplantation, métabolisme, thérapie |
Les adipocytes : lieux de stockage énergétique Chez les mammifères, le sucre et les lipides sont stockés dans les cellules comme
réserves énergétiques pouvant être utilisées lors des périodes de jeûne. Le sucre
est conservé sous forme de glycogène dans le cytoplasme, et les lipides, sous forme
de triglycérides dans des gouttelettes lipidiques. Alors que les cellules du foie et
du muscle squelettique contiennent ces deux types de stockage énergétique, d’autres
cellules, comme les adipocytes, sont spécialisées dans un seul : celui des lipides.
Il existe deux types d’adipocytes : les adipocytes blancs, qui contiennent une seule
gouttelette lipidique, et les adipocytes bruns, qui en contiennent de nombreuses
[1] (→).
(→) Voir la Nouvelle de A. Bouloumié et al.,
m/s n° 2, février 2009, page 123
La localisation et le métabolisme de ces deux types cellulaires sont différents. Les
adipocytes blancs sont considérés comme des lieux de stockage à part entière, alors
que les adipocytes bruns utilisent les stocks de lipides pour produire de la
chaleur. La thermogenèse du tissu adipeux brun est notamment activée à la suite
d’une exposition au froid. Au niveau cellulaire, il existe un découplage de la
chaîne respiratoire mitochondriale par la protéine Ucp1 (uncoupling protein
1), qui est à l’origine de la production de chaleur. La présence de tissu adipeux brun chez l’homme adulte est connue depuis une dizaine
d’années. De nombreuses études ont montré l’importance de ce tissu dans le contrôle
du métabolisme, et il existe une relation étroite entre l’activation du tissu
adipeux brun et les désordres métaboliques associés à l’obésité et au diabète [2]. En effet, l’activité du
tissu adipeux brun est inversement corrélée à l’adiposité corporelle chez l’homme,
et son rôle protecteur, face à l’induction de l’obésité et de la résistance à
l’insuline induites par un régime alimentaire riche en graisses, a été démontré chez
l’animal. Ainsi, l’activation du tissu adipeux brun ou la transplantation
d’adipocytes bruns pourraient représenter des stratégies thérapeutiques
intéressantes contre les maladies métaboliques [3] (→).
(→) Voir la synthèse de A. Carrière et al.,
m/s n° 8-9, août-septembre 2013, page 729
Pour pouvoir développer de telles stratégies, il est essentiel de comprendre les
mécanismes de différenciation et d’activation du tissu adipeux brun. |
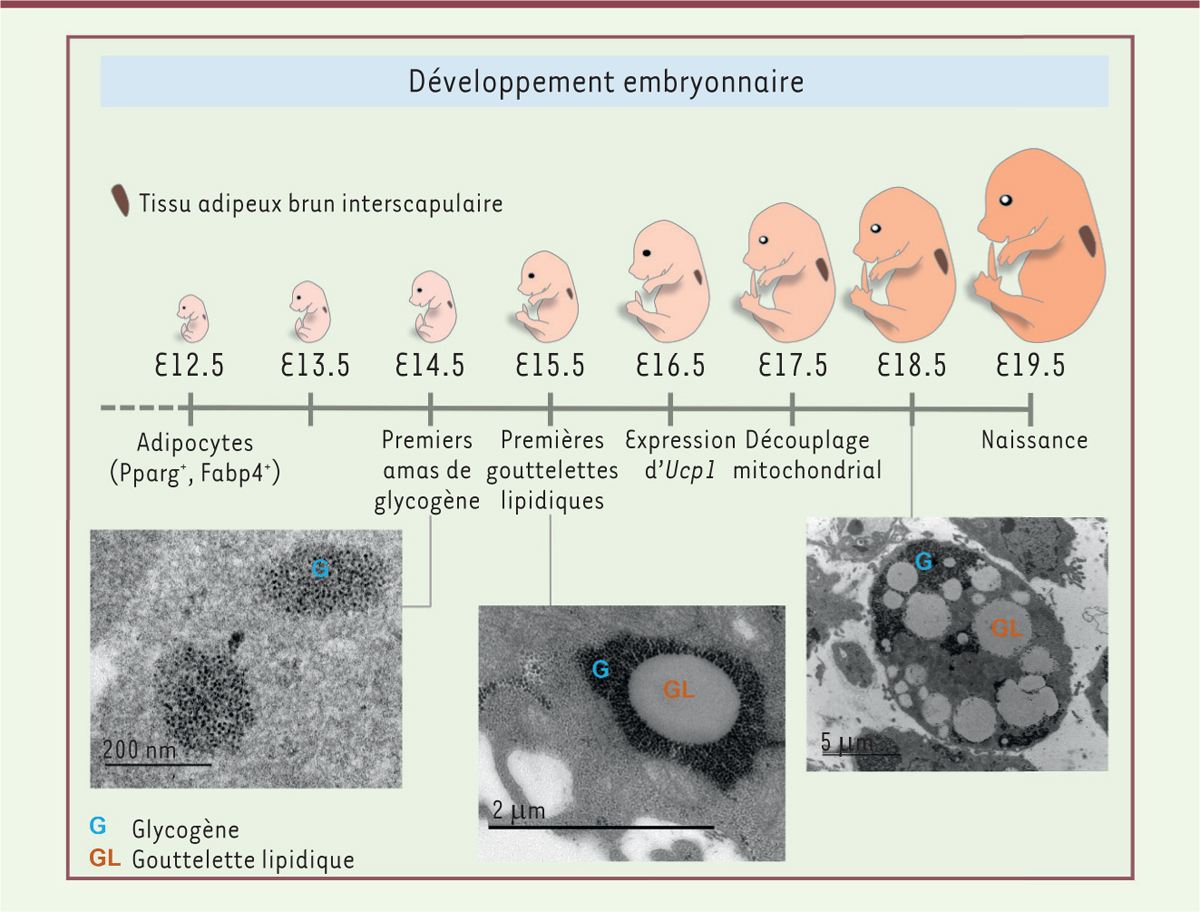
Origine et formation des adipocytes bruns chez l’embryon Les adipocytes bruns ont une origine embryonnaire commune avec les cellules
musculaires squelettiques du tronc et des membres [4]. Ils dérivent en effet de cellules
mésodermiques progénitrices du somite1. Chez la
souris de fonds génétique C57Bl/J, le développement embryonnaire dure environ 19
jours. Dès le 12e jour de développement, il est possible de détecter des
adipocytes dans les territoires du futur tissu adipeux brun situé entre les
omoplates (Figure 1) [5]. À ce stade, ces cellules
n’expriment que des marqueurs communs à tous les adipocytes (bruns et blancs), tels
que Pparg (peroxisome proliferator-activated
receptor g) et Fabp4 (fatty acid-binding
protein 4). Ce n’est qu’à partir du 16e jour de
développement embryonnaire que le caractère génétique « brun » apparaît, avec
notamment l’expression d’Ucp1, le marqueur caractéristique du tissu adipeux brun,
essentiel à la fonction de thermogenèse. Des études de respirométrie réalisées
ex vivo à partir de tissu adipeux brun isolé à différents
stades du développement embryonnaire chez les souris ont montré que la chaîne
respiratoire est découplée à partir du 17e jour de développement [5]. Si les adipocytes bruns possèdent, à ce
stade, toutes les capacités pour produire de la chaleur, la difficulté d’accès au
tissu adipeux brun de l’embryon, in utero, ne permet toutefois pas,
à ce jour, de déterminer s’il en produit effectivement. En revanche, il est
fonctionnellement prêt à répondre à une exposition au froid, notamment lors de la
naissance.
 | Figure 1. Différenciation du tissu adipeux brun au cours du
développement embryonnaire chez la souris
C57Bl/J. Les premiers amas de glycogène (G)
apparaissent avant l’expression d’Ucp1 dans l’adipocyte
brun. Les gouttelettes lipidiques (GL) se forment au sein des amas de
glycogène à partir du 15e jour de développement embryonnaire
(E, embryonic day). Les gouttelettes lipidiques matures
ne sont plus encerclées par du glycogène. Les images sont des
photographies de microscopie électronique de tissu adipeux brun à
différents stades du développement embryonnaire. |
|
Biogenèse des gouttelettes lipidiques dans l’adipocyte brun Les gouttelettes lipidiques sont des organites composés de triglycérides, entourés
d’une membrane composée d’une monocouche de phospholipides, dans laquelle sont
incorporées des protéines spécifiques, telles que celles de la famille des
périlipines. Les gouttelettes lipidiques apparaissent à partir du 15e
jour de développement embryonnaire dans l’adipocyte brun (Figure 1) [5]. En étudiant précisément cet organite en microscopie
électronique, nous avons constaté que la gouttelette lipidique apparaît au sein
d’amas de glycogène dont la formation précède celle des gouttelettes lipidiques
(Figure 1). Au cours
du développement du tissu adipeux brun, de nouvelles gouttelettes lipidiques
apparaissent au sein d’amas de glycogène nouvellement formés, et leur croissance est
associée à une diminution de la quantité de glycogène qui les entoure. Cette
association spatiale du glycogène et de la gouttelette lipidique avait été observée,
dans les années 1960, dans le tissu adipeux brun de souris et de rats nouveau-nés
[6, 7], mais depuis, aucune étude n’avait
déterminé le rôle que pouvait jouer le glycogène dans ces cellules. |
Le glycogène essentiel à la formation des gouttelettes lipidiques Pour tenter de résoudre cette énigme, nous avons étudié les embryons de souris
mutantes déficientes pour la glycogène synthase (souris Gys1-/-
) [5]. Ces embryons, qui ne
synthétisent pas de glycogène, ne présentent pas de gouttelettes lipidiques dans
leurs adipocytes bruns, démontrant ainsi que le glycogène est essentiel à la
formation de ces gouttelettes. Ces résultats ont été confirmés par des expériences
d’interférence ARN ciblant la glycogène synthase dans des cellules humaines
différenciées en adipocytes bruns in vitro. Une analyse transcriptomique d’adipocytes bruns en cours de différenciation a permis
de mettre en évidence l’augmentation de l’expression des gènes impliqués dans le
métabolisme du glucose, l’activation du cycle de Krebs ainsi que la lipogenèse
de novo, suggérant ainsi l’utilisation du glycogène au profit
de la synthèse de nouveaux acides gras (Figure
2). La dégradation du glycogène s’effectue classiquement par
des voies enzymatiques, dont la première étape est catalysée par la glycogène
phosphorylase. Cependant, il existe un autre mécanisme, moins bien connu, de
dégradation du glycogène : la glycophagie, c’est-à-dire l’autophagie du glycogène.
La glycophagie a été décrite dans le foie, le muscle squelettique, et le cœur. Dans
cette voie de dégradation du glycogène, la protéine Stbd1 (Starch-binding
domain-containing protein 1) s’associe au glycogène et est reconnue par
la protéine Gabarapl1 (gamma-aminobutyric acid receptor-associated
protein-like 1) localisée à la surface de l’autophagosome
(Figure 2). Le
glycogène est ainsi autophagocyté, puis dégradé en glucose 1-phosphate. Au cours de
la différenciation des adipocytes bruns, la glycophagie joue un rôle important
puisque des expériences d’ARN interférence ciblant le gène Stbd1
entraînent une diminution de la biogenèse des gouttelettes lipidiques. Le cycle de
synthèse et de dégradation du glycogène est donc essentiel à la formation des
gouttelettes lipidiques au cours de la différenciation de l’adipocyte brun. Qu’en
est-il pour l’adipocyte blanc ?
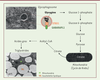 | Figure 2. Voies métaboliques allant du glycogène aux triglycérides
stockés dans les gouttelettes lipidiques. Le
glycogène est dégradé par glycophagie dans des glycophagosomes,
observables dans les adipocytes bruns au cours du développement
embryonnaire, de E15.5 à E18.5. Les images sont des photographies de
microscopie électronique du tissu adipeux brun. |
|
Un rôle différent du glycogène dans l’adipocyte blanc ? La plupart des études qui ont été effectuées pour identifier les mécanismes de
formation de la gouttelette lipidique l’ont été dans l’adipocyte blanc. Ces études
ont montré que les gouttelettes lipidiques se forment par bourgeonnement à partir du
réticulum endoplasmique [8].
Alors que nos analyses en microscopie électronique ne montrent pas la présence du
réticulum endoplasmique autour des gouttelettes lipidiques en formation au sein des
amas de glycogène dans les adipocytes bruns, le bourgeonnement de la gouttelette
lipidique à partir du réticulum endoplasmique est visible dans les adipocytes blancs
en cours de différenciation chez l’embryon. Le glycogène est également présent dans
ces cellules, mais il ne se localise pas autour des gouttelettes lipidiques, comme
c’est le cas dans l’adipocyte brun. De même, l’absence de glycogène chez les
embryons Gys1-/-
n’empêche pas la formation des gouttelettes lipidiques dans les adipocytes
blancs. Ces données montrent donc que les mécanismes impliqués dans la biogenèse des
gouttelettes lipidiques sont différents entre adipocytes bruns et adipocytes
blancs. |
Jusqu’à présent, le glycogène et les gouttelettes lipidiques avaient été considérés
comme des moyens de stockage énergétique indépendants. Nos travaux ont révélé
l’existence d’une interaction spatiale et fonctionnelle dans l’adipocyte brun en
cours de différenciation. Dans le tissu adipeux brun chez l’adulte, une exposition
au froid entraîne une accumulation transitoire de glycogène [9]. L’étude du métabolisme du glycogène dans les
adipocytes du tissu adipeux brun chez l’adulte pourrait permettre d’identifier de
nouvelles cibles thérapeutiques contre l’obésité. |
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Cette recherche a bénéficié de soutiens financiers de l’ANR-labex-EGID
(ANR-10-LABX-46), de la région des Hauts de France/FEDER (Chronoregeneration), de
l’Association Française contre les Myopathies (AFM-Téléthon), de la Fondation de
France et de la Fondation Francophone pour la recherche sur le diabète (FFRD),
soutenu par la Fédération Française des Diabétiques (AFD), AstraZeneca, Eli Lilly,
Merck Sharp & Dohme (MSD), Novo Nordisk et Sanofi.
|
Footnotes |
1. Bouloumié
A,
Sengenès
C,
Galitzky
J. Les progéniteurs
adipeux blancs et bruns : pourra-t-on transformer la fourmi en cigale
? . Med Sci (Paris).
2009; ; 25 :
:123.–125. 2. van Marken
Lichtenbelt
WD,
Vanhommerig
JW,
Smulders
NM, et al.
Cold-activated brown adipose tissue in healthy
men . N Engl J Med.
2009; ; 360 :
:1500.–1508. 3. Carrière
A,
Jeanson
Y,
Cousin
B, et al.
Le recrutement et l’activation d’adipocytes bruns et/ou BRITE :
une perspective réelle pour le traitement des maladies métaboliques
? . Med Sci (Paris).
2013; ; 29 :
:729.–735. 4. Wang
W,
Seale
P. Control of brown
and beige fat development . Nat Rev Mol Cell
Biol.
2016; ; 17 :
:691.–702. 5. Mayeuf-Louchart
A,
Lancel
S,
Sebti
Y, et al.
Glycogen dynamics drives lipid droplet biogenesis during brown
adipocyte differentiation . Cell Rep.
2019; ; 29 : (1410–8)
:e6.. 6. Revel
JP,
Napolitano
L,
Fawcett
DW. Identification
of glycogen in electron micrographs of thin tissue sections .
J Biophys Biochem Cytol.
1960; ; 8 :
:575.–589. 7. Napolitano
L,
Fawcett
D. The fine
structure of brown adipose tissue in the newborn mouse and
rat . J Biophys Biochem Cytol.
1958; ; 4 :
:685.–692. 8. Walther
TC,
Chung
J,
Farese
RV. Lipid droplet
biogenesis . Annu Rev Cell Dev Biol.
2017; ; 33 :
:491.–510. 9. Jakus
PB,
Sandor
A,
Janaky
T, et al.
Cooperation between BAT and WAT of rats in thermogenesis in
response to cold, and the mechanism of glycogen accumulation in BAT during
reacclimation . J Lipid Res.
2008; ; 49 :
:332.–339. |