| |
| Med Sci (Paris). 36(6-7): 600–606. doi: 10.1051/medsci/2020097.Nouvelle approche thérapeutique pour les rétinites
pigmentaires La transplantation de photorécepteurs dérivés de cellules
souches Olivier Goureau1* and Gaël Orieux1 1Institut de la Vision, Sorbonne Université, Inserm,
CNRS, 17 rue
Moreau, F-75012Paris,
France |

Vignette (Photo © Inserm - Marion Vincent). La vision est, chez l’homme, un des sens les plus importants permettant des activités
majeures de la vie quotidienne, et faisant des déficiences visuelles, partielles ou
totales, un handicap majeur qui impacte profondément la vie de plus de 200 millions de
personnes dans le monde [1]. La
plupart des formes de cécité incurable résultent de la mort de certains types de
neurones rétiniens, comme les cellules ganglionnaires de la rétine, dans le cas des
neuropathies optiques, telles que le glaucome, ou comme les photorécepteurs, dans le cas
de la dégénérescence maculaire liée à l’âge (DMLA) ou des rétinites pigmentaires (RP).
Comme pour les maladies neurodégénératives du système nerveux central, la perte de ces
neurones et les déficits associés sont irréversibles. Les traitements cliniques actuels
se limitant à retarder ou à ralentir la progression de la déficience visuelle, les
efforts de recherche se sont concentrés ces dernières années sur le développement de
nouvelles stratégies plus ambitieuses visant à restaurer, au moins partiellement, la
vision perdue [2]. Dans ce
contexte, la thérapie cellulaire (par remplacement des cellules altérées) est considérée
comme une véritable stratégie d’avenir pour la restauration visuelle [3,4]. L’un des principaux avantages de cette approche est qu’elle est
indépendante des mutations responsables de la maladie, puisqu’elle utilise des cellules
qui ne sont pas mutées, et qu’elle offre la possibilité de restaurer la structure
naturelle et l’intégrité fonctionnelle de la rétine, même aux stades avancés des
maladies. La rétine est un tissu dont les caractéristiques structurales et
fonctionnelles présentent, en plus, plusieurs atouts dans le contexte de la thérapie
cellulaire. Elle est facilement accessible et sa petite taille ne requiert qu’un faible
nombre de cellules pour la transplantation. L’œil est également un organe très
compartimenté (ce qui permet de cibler individuellement différents tissus oculaires,
tels que le vitré ou l’espace sous-rétinien) et le milieu intraoculaire est isolé du
reste du corps par la barrière hémato-rétinienne (qui garantit le privilège immunitaire
oculaire1 et un risque de dissémination
systémique minimal des cellules transplantées). Enfin, le développement d’approches
d’imagerie non invasives, telles que la tomographie par cohérence optique et l’optique
adaptative, de même que l’existence de tests fonctionnels simples, présentent un grand
intérêt pour le suivi du greffon après la transplantation et son impact d’un point de
vue fonctionnel. |
Quelles sources de cellules ? Au cours des deux dernières décennies, les cellules souches pluripotentes sont
apparues comme une source intéressante de cellules en médecine dite régénérative,
car elles peuvent être maintenues indéfiniment in vitro dans un
état indifférencié et peuvent se différencier en tout type de cellules de
l’organisme adulte. Les cellules souches embryonnaires humaines (ou cellules ES),
naturellement pluripotentes, ont été les mieux étudiées depuis les premiers travaux
ayant permis leur isolement à partir de la masse cellulaire interne d’un blastocyste
humain [5]. En 2007, le
groupe de S. Yamanaka au Japon, a rapporté une méthode permettant d’obtenir des
cellules souches pluripotentes par reprogrammation génétique de cellules somatiques
adultes humaines [6]. Ces
cellules souches induites à la pluripotence (ou cellules iPS) possèdent des
caractéristiques en tout point similaires à celles des cellules ES, fournissant
ainsi une source immense de cellules différenciées. La maîtrise des processus de différenciation in vitro des cellules
pluripotentes (ES ou iPS) murines et humaines en différents types de cellules
rétiniennes a progressé rapidement au cours de la dernière décennie [4, 7, 8].
Des essais cliniques ont même débuté afin de remplacer l’épithélium pigmentaire
rétinien (EPR) partiellement endommagé ou non-fonctionnel chez les patients atteints
de DMLA, par des cellules d’EPR saines dérivées de cellules ES ou iPS [9, 10]. Ces premières études de phase I/II visent
à garantir l’innocuité et la tolérance d’injections sous-rétiniennes de ce type de
cellules. Si le remplacement de l’EPR seul est pertinent, notamment lorsque le
processus pathologique l’affecte dans un premier temps et que les photorécepteurs ne
sont pas encore trop atteints, la transplantation de photorécepteurs – sous forme de
feuille rétinienne ou de suspension de cellules dissociées – s’avère quant à elle
nécessaire si le processus dégénératif des photorécepteurs est trop engagé.
L’intégration dans la rétine de l’hôte et le rétablissement des circuits neuronaux
fonctionnels sont les principaux obstacles à la réussite de la transplantation des
cellules. Des études antérieures réalisées sur des modèles animaux ont révélé que la
transplantation de photorécepteurs matures (adultes) était inopérante, les
photorécepteurs devant être à un stade ontogénétique précis (précurseurs immatures)
au moment de la transplantation [11, 12]. Les
premières études de transplantation de ces précurseurs de photorécepteurs isolés à
partir de rétine de rongeurs nouveau-nés dans différents modèles de rongeurs
aveugles ont conduit les chercheurs à conclure que les cellules transplantées
pouvaient survivre dans la rétine en dégénérescence, se différencier en
photorécepteurs matures photosensibles et établir certaines connexions synaptiques
avec les partenaires adéquats, permettant une récupération partielle de la fonction
visuelle [11, 12]. Cependant, ces résultats spectaculaires ont dû être réinterprétés à
la suite de l’identification récente d’un processus cellulaire dit d’échange de
contenu cellulaire entre les cellules transplantées et celles de l’hôte (voir plus
loin). |
Comment produire des cellules rétiniennes à partir de cellules souches humaines
? Nos connaissances des mécanismes moléculaires et cellulaires du développement
oculaire constituent les fondements de la médecine régénérative dédiée aux maladies
de la rétine. Des protocoles permettant de guider la différenciation des cellules
souches pluripotentes humaines ont été mis au point au cours de la dernière décennie
avec pour principe fondateur la reproduction in vitro des étapes
successives du développement embryonnaire afin de produire des neurones et même des
tissus rétiniens (organoïdes). L’application de ce concept consistait à déterminer
les conditions de culture permettant aux cellules ES et iPS d’adopter une identité
neuroectodermique, puis celle du territoire oculaire pour s’engager ensuite vers un
lignage de rétine neurale ou d’EPR ; la dernière étape visant à différencier les
progéniteurs rétiniens multipotents qui composent cette rétine neurale en
photorécepteurs. Actuellement, la communauté scientifique privilégie les méthodes
permettant la production de photorécepteurs grâce à la formation d’organoïdes
rétiniens plutôt que les méthodes plus anciennes visant à obtenir directement des
photorécepteurs, moins efficaces (Figure
1) [4,13,14] (→).
(→) Voir la Nouvelle de S. Reichman et al.,
m/s n° 10, octobre 2014, page 845
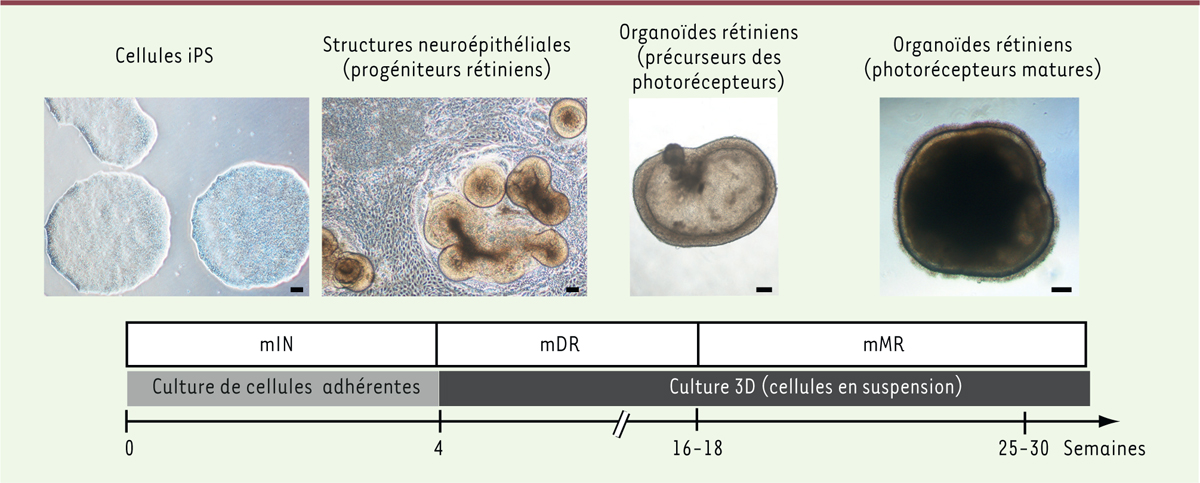
 | Figure 1. Illustration des étapes clés pour la génération
d’organoïdes rétiniens à partir de cellules souches
pluripotentes humaines. Après 4 semaines de
culture en présence d’un milieu d’induction neurale (mIN), les
structures neuroépithéliales issues des cellules iPS adhérentes sont
détachées et cultivées en suspension d’abord dans un milieu de
différenciation rétinienne (mDR) puis dans un milieu de maturation
rétinienne (mMR) pour générer des organoïdes contenant des
photorécepteurs. Barres d’échelle : 100 µm. |
|
Quels sont les critères nécessaires pour un transfert vers la clinique ? Pour une application clinique, toutes les phases de la production de cellules
rétiniennes doivent être réalisées conformément aux lignes directrices actuelles des
bonnes pratiques de fabrication (ou BPF, en anglais, GMP, pour
good manufacturing practices) et à partir de cellules ES ou iPS
humaines de grade clinique, c’est-à-dire autorisées par les agences réglementaires
pour une utilisation en clinique. Il est également indispensable que ces méthodes de production incluent des étapes de
stockage et de purification des dérivés rétiniens issus de cellules ES ou iPS
humaines. En effet, le développement de méthodes de cryoconservation adaptées aux
précurseurs de photorécepteurs sera important afin que les étapes de production du
produit de thérapie cellulaire et l’acte médical de transplantation soient
indépendants. L’obtention d’une population cellulaire homogène et sûre2,, composée uniquement des cellules d’intérêt
(précurseurs de photorécepteurs dérivés de cellules ES/iPS humaines) est
fondamentale. Il est notamment indispensable d’éliminer toute population résiduelle
de cellules indifférenciées. Dans le cadre expérimental, une stratégie d’isolement
couramment utilisée consiste à marquer génétiquement les cellules d’intérêt. Mais
ces manipulations sont incompatibles avec une application clinique. Plusieurs études
se sont donc concentrées sur l’identification de marqueurs de surface cellulaire
caractéristiques des précurseurs des photorécepteurs en vue de leur sélection
future. Le ciblage de la seule protéine CD73
(ecto-5′-nucleotidase)3,, ou combiné avec celui de CD24 (ou nectadrine), s’est révélé
très efficace pour la sélection de précurseurs de photorécepteurs compétents pour
des approches de transplantation [4, 15, 16]. Jusqu’à présent, la plupart des travaux de transplantation ciblant les
photorécepteurs ont été réalisés dans des modèles murins. Ces xénogreffes,
responsables de réponses immunitaires importantes à l’origine de rejet du greffon,
constituent un obstacle majeur à l’intégration durable des cellules dérivées de
cellules ES/iPS humaines. Même si la xénotransplantation chez les rongeurs
immunodéprimés permet de contourner cet obstacle, elle ne permet pas de modéliser la
réponse immunitaire de l’hôte vis-à-vis des greffes allogéniques spécifiques et
n’est donc pas prédictive, sur ce point, de l’efficacité de la transplantation chez
l’homme. Les études chez le primate non-humain représentent une alternative pour
valider la pertinence d’une future approche utilisant des photorécepteurs dérivés de
cellules iPS compatibles entre donneurs et receveurs. En plus de permettre d’étudier
les problèmes d’immunogénicité, les similitudes structurales et fonctionnelles, la
présence d’une fovéa4 (région ciblée pour des
approches de thérapie cellulaire visant à remplacer les photorécepteurs et
inexistante chez les rongeurs) font du primate non-humain, un modèle beaucoup plus
pertinent. |
Transfert du contenu cellulaire ou réelle intégration après transplantation
? La capacité d’intégration fonctionnelle des photorécepteurs immatures après
transplantation dans la couche des photorécepteurs de la rétine hôte a été récemment
remise en cause et les résultats des premières études réinterprétés. En effet, grâce
à différentes stratégies permettant de distinguer sans équivoque les cellules
donneuses des cellules receveuses, plusieurs équipes, y compris certaines à
l’origine de ces travaux précurseurs, ont rapporté que les cellules identifiées lors
des premiers travaux comme des cellules transplantées étaient en réalité des
photorécepteurs de l’hôte ayant intégré une partie du contenu des cellules
transplantées, par transfert de matériel cytoplasmique, plutôt que des cellules du
donneur différenciées et parfaitement intégrées au tissu hôte [17-19]. Il est ainsi probable que la
transplantation de photorécepteurs, réalisée dans un modèle animal qui présente une
couche résiduelle de photorécepteurs, conduise à des améliorations fonctionnelles et
à un sauvetage phénotypique par échange du contenu cellulaire, notamment
cytoplasmique, entre les photorécepteurs de l’hôte et ceux du donneur. Suite à cette
découverte, plusieurs scénarios peuvent être envisagés après une transplantation
sous-rétinienne de photorécepteurs : 1) les cellules migrent dans la couche des
photorécepteurs et forment des synapses avec les cellules de la rétine interne hôte
; 2) les cellules restent dans l’espace sous-rétinien et un transfert de matériel
cytoplasmique s’opère ; ou 3) les cellules ne forment pas de connexions synaptiques
et aucun transfert de matériel cytoplasmique ne survient. Aucun cas de transfert de
matériel n’ayant été observé entre types cellulaires différents, la situation des
patients présentant une dégénérescence avancée et une rétine dépourvue de la
quasi-totalité des photorécepteurs est donc différente, le risque de transfert de
matériel n’étant a priori pas possible. Les photorécepteurs
greffés, présents dans l’espace sous-rétinien, peuvent, en plus, se connecter plus
facilement avec les interneurones de la rétine hôte (voir plus loin) (Figure 2).
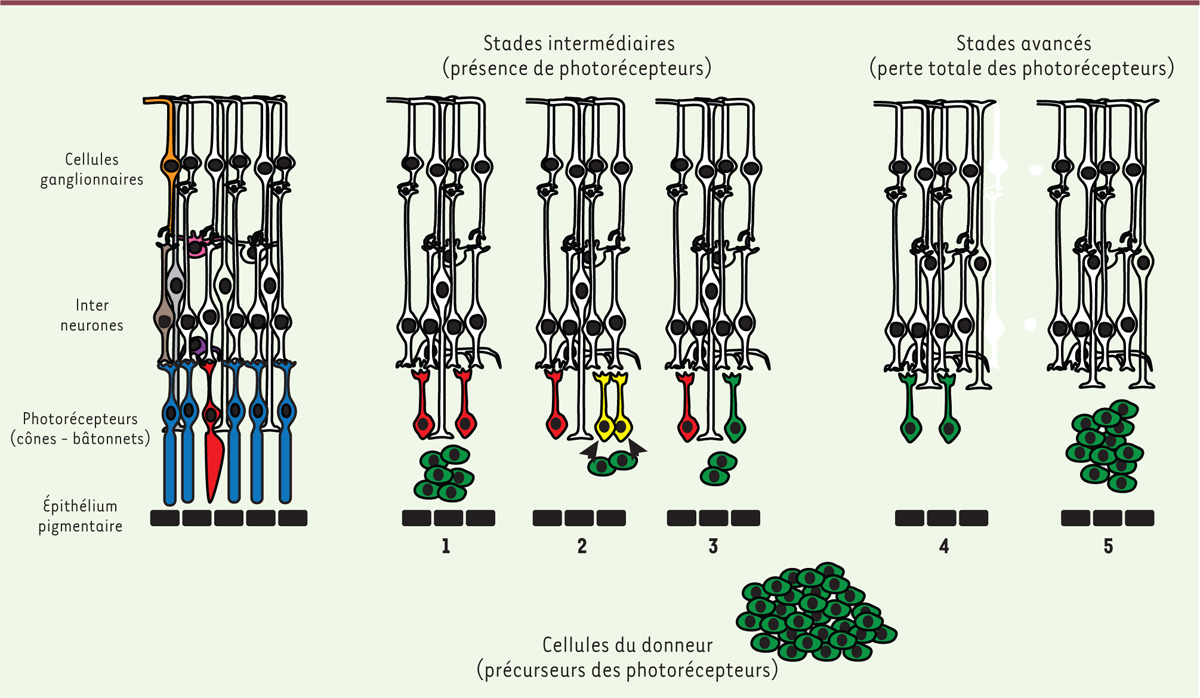
 | Figure 2. Scénarios possibles à la suite d’une transplantation de
photorécepteurs dans l’espace sous-rétinien.
Dans les stades intermédiaires de dégénérescence (présence résiduelle de
photorécepteurs hôtes, en rouge sur le schéma), les photorécepteurs
donneurs transplantés (en vert) dans l’espace sous-rétinien peuvent se
comporter selon différents scénarios : les cellules restent dans
l’espace sous-rétinien sans aucune connexion avec la rétine hôte
(1) ; un transfert de matériel
cytoplasmique survient entre les cellules donneuses et les
photorécepteurs hôtes (2) ; ou certaines
cellules migrent dans la couche de photorécepteurs de l’hôte et forment
des synapses avec les interneurones hôtes
(3). En absence de photorécepteurs
hôtes (stades avancés), les cellules transplantées se connectent aux
interneurones hôtes (4) ou restent
non-connectées dans l’espace sous-rétinien
(5). Les scénarios 1 à 3 ne sont pas
mutuellement exclusifs et sont représentés séparément pour clarifier la
représentation visuelle. |
L’élucidation des processus d’échange de matériel pourrait conduire à de nouvelles
options thérapeutiques pour des applications de thérapie cellulaire dans lesquelles
les cellules du donneur peuvent être considérées comme un vecteur qui délivre une
protéine manquante, ou d’autres molécules, aux photorécepteurs endogènes porteurs
d’une mutation. Pour la réparation du tissu cardiaque, des composants acellulaires,
tels que les exosomes, sont les principaux médiateurs des réponses régénératives
dans les cellules cibles [20]. Une approche similaire peut donc être envisagée pour le traitement
de certains stades de dystrophie rétinienne, au cours desquels la couche des
photorécepteurs est totalement ou partiellement intacte. |
Quelle stratégie pour des stades avancés de rétinite pigmentaire ? Ainsi donc, les stratégies actuelles de remplacement des photorécepteurs par des
dérivés de cellules souches pluripotentes, transplantés sous forme de feuillet/tissu
de rétine, ou d’une suspension de photorécepteurs, ont montré certaines limites,
surtout après réinterprétation de certaines études, à la suite de la découverte du
phénomène de transfert de matériel. La greffe de feuillets de rétine issu
d’organoïdes rétiniens pourrait conduire à une restauration fonctionnelle [21, 22]. Néanmoins, la présence de cellules
rétiniennes autres que les photorécepteurs greffés, ainsi que l’organisation de ces
photorécepteurs sous forme de rosettes au sein de ces feuillets entravent leur
capacité à se reconnecter dans le tissu hôte et à restaurer la fonction visuelle
(Figure 3).
L’injection dans l’espace sous-rétinien d’une suspension cellulaire de précurseurs
de photorécepteurs, après une sélection appropriée, permet en revanche de
transplanter une population homogène de photorécepteurs et facilite les contacts
avec les neurones du tissu hôte [15, 23]. La maturation
morphologique et fonctionnelle des photorécepteurs immatures greffés, qui nécessite
le développement des segments externes sensibles à la lumière, demeure, à ce jour,
un obstacle à surmonter. Ceci nécessite une interaction avec l’EPR sous-jacent qui
maintient la structure et la fonction des photorécepteurs via le
renouvellement continu des segments externes, y compris la régénération des pigments
visuels afin de maintenir la sensibilité à la lumière [24].
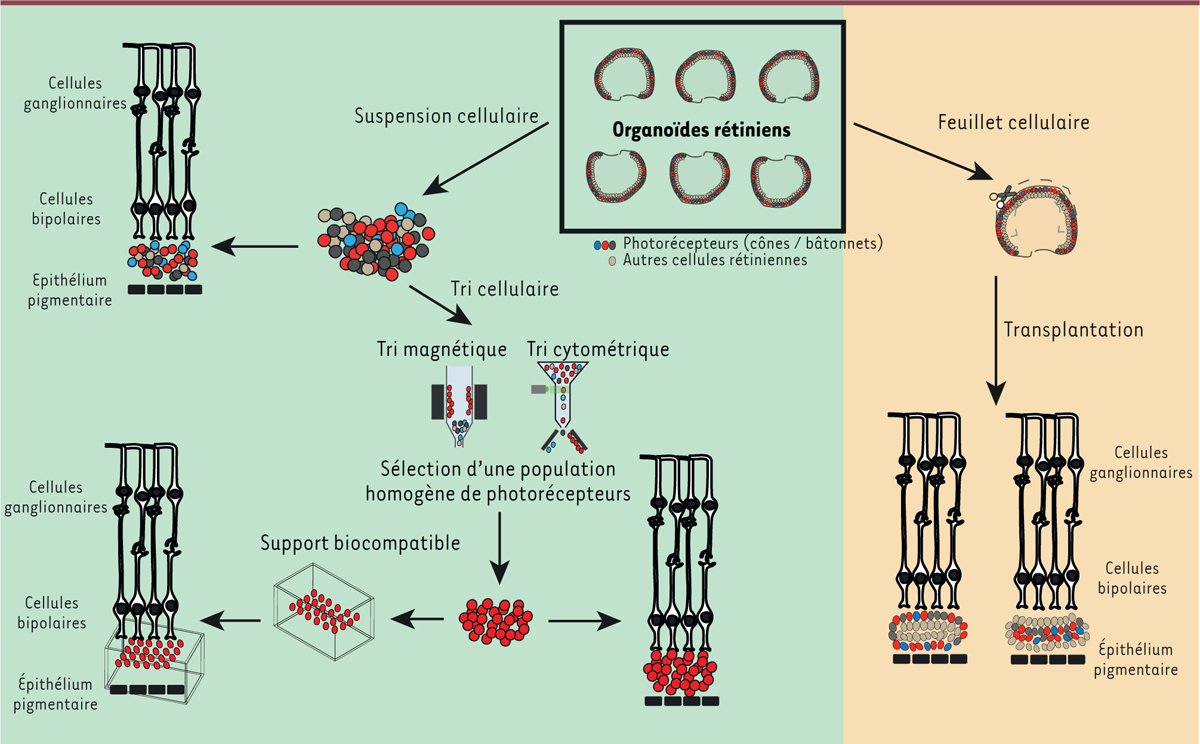
 | Figure 3. Schéma illustrant les principales stratégies adoptées pour
la transplantation de photorécepteurs à partir d’organoïdes
rétiniens dérivés de cellules souches
pluripotentes. Des approches de transplantation sous
forme de feuillet de rétine ou de suspensions cellulaires (cellules
rétiniennes versus photorécepteurs isolés) sont
actuellement développées à partir d’organoïdes rétiniens. La maturation
fonctionnelle des cellules greffées et leur interaction avec la rétine
hôte peuvent être améliorées avec l’utilisation de supports
biocompatibles. |
À ce jour, si l’expression de marqueurs de photorécepteurs matures permettant la
photosensibilité (protéines impliquées dans la cascade de phototransduction par
exemple) est décrite dans la littérature, la maturation morphologique et
fonctionnelle des cellules transplantées est souvent décevante, voire absente [3]. Des systèmes de matrice à base de polymères
biocompatibles (scaffolds ou échafaudages), déjà largement
développés pour les stratégies de remplacement des cellules de l’EPR [9, 25], sont désormais expérimentés afin de surmonter ces
problèmes et soutenir la maturation et la polarisation des photorécepteurs
(Figure 3). Les
progrès des technologies d’impression 3D ont rendu possible la création de polymères
avec un parfait contrôle de leur structure et de leurs caractéristiques chimiques et
mécaniques. La polymérisation de photons, une technique d’impression 3D à haute
résolution, a, par exemple, été utilisée pour créer des structures facilitant
l’alignement de cellules rétiniennes non différenciées (progéniteurs), optimisant
leur densité à la surface et facilitant leur diffusion dans la matrice [26]. Valider la capacité de
ces cellules à se différencier en photorécepteurs matures, avec la formation d’une
ébauche suffisante de segment externe, ainsi que leur fonctionnalité in
vivo, sera le prochain défi. L’utilisation d’un nouveau type de
micromatrice en forme de verre à vin, conçu par Jung et ses collaborateurs, a permis
de favoriser l’organisation et la polarisation de photorécepteurs dérivés de
cellules souches pluripotentes humaines [27]. La « bio-impression » tridimensionnelle devrait permettre
de contrôler avec précision la distribution des cellules au sein des matrices de
support et d’obtenir des structures stratifiées combinant des cellules de l’EPR et
des photorécepteurs [28].
Cette approche pourrait fournir un traitement plus approprié pour les stades avancés
de DMLA, lorsque l’EPR et les photorécepteurs doivent être conjointement
remplacés. Compte tenu de la difficulté des photorécepteurs transplantés à former des segments
externes fonctionnels et devenir photosensibles, une stratégie alternative a
consisté à combiner la thérapie cellulaire et l’optogénétique, en conférant
artificiellement une photosensibilité aux cellules du donneur [29]. En s’inspirant de la stratégie
visant, chez des patients atteints de rétinite pigmentaire, à rendre photosensibles
les cellules rétiniennes survivantes (cônes dormants dépourvus de segments externes
ou cellules de la rétine interne) [30], une opsine5, microbienne
hyperpolarisante a été introduite à l’aide d’un vecteur viral du type AAV dans les
précurseurs de photorécepteurs dérivés de cellules iPS humaines. L’insertion de tels
capteurs de lumière a permis de rendre les précurseurs de photorécepteurs greffés
photosensibles, indépendamment de la formation de segments externes, de l’expression
de l’ensemble des acteurs de la phototransduction naturelle, et de la présence
d’EPR. L’optimisation des principaux éléments clés (type de vecteurs AAV, promoteur,
trafic des opsines microbiennes) afin d’assurer la sécurité et l’efficacité des
opsines microbiennes pour mettre en place des traitements fiables pour les maladies
de la rétine est déjà bien avancée [30].
L’obstacle majeur à la transposition clinique de cette technologie reste la faible
photosensibilité des opsines microbiennes qui sont actuellement utilisées. Ce défaut
nécessitera un éclairage à des longueurs d’onde spécifiques, et des intensités
particulièrement élevées, souvent toxiques. Bien que des optimisations
technologiques soient nécessaires, la combinaison de ces deux approches reste
néanmoins particulièrement séduisante. |
Le succès du remplacement des photorécepteurs reposera sur la mise en œuvre conjointe
de stratégies multiples au cours des différentes étapes menant à une application de
thérapie cellulaire : de la fabrication de produits cellulaires à la délivrance
chirurgicale et à la restauration fonctionnelle. Bien que des obstacles importants
doivent être surmontés avant d’atteindre des objectifs thérapeutiques, la plupart de
ces défis ne sont pas spécifiques des thérapies cellulaires ciblant la rétine
externe, mais intéressent tous les traitements à base de cellules souches. Les
efforts de collaboration entre domaines distincts utilisant les cellules souches,
mais également entre différentes disciplines scientifiques (biologistes, ingénieurs
et cliniciens) devraient accélérer les progrès de cette médecine, dite régénérative.
L’ensemble de ces développements devraient permettre la mise en place d’essais
cliniques utilisant des cellules dérivées de cellules souches pluripotentes et, si
de nombreux défis restent à relever, il offre un espoir aux patients atteints de
maladies rétiniennes incurables de préserver, d’améliorer, voire même de restaurer,
la fonction visuelle. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Les auteurs remercient Oriane Rabesandratana et Amélie Rodrigues pour avoir fourni
certaines images présentées dans cet article.
|
Footnotes |
1.
Flaxman
SR
, Bourne
RRA
, Resnikoff
S
, et al.
Global causes of blindness and distance vision impairment
1990–2020: a systematic review and meta-analysis .
Lancet Glob Health.
2017; ; 5 :
:e1221.–e1234. 2.
Roska
B
, Sahel
JA
. Restoring vision .
Nature.
2018; ; 557 :
:359.–367. 3.
Gasparini
SJ
, Llonch
S
, Borsch
O
, et al.
Transplantation of photoreceptors into the degenerative retina:
current state and future perspectives . Prog Retin
Eye Res.
2019; ; 69 :
:1.–37. 4.
Gagliardi
G
, M’Barek
K
. Ben, Goureau O. Photoreceptor cell replacement in
macular degeneration and retinitis pigmentosa: a pluripotent stem cell-based
approach . Prog Retin Eye Res.
2019; ; 71 :
:1.–25. 5.
Thomson
JA
, Itskovitz-Eldor
J
, Shapiro
SS
, et al.
Embryonic stem cell lines derived from human
blastocysts . Science.
1998; ; 282 :
:1145.–1147. 6.
Takahashi
K
, Tanabe
K
, Ohnuki
M
, et al.
Induction of pluripotent stem cells from adult human fibroblasts
by defined factors . Cell.
2007; ; 131 :
:861.–872. 7.
Jin
ZB
, Gao
ML
, Deng
WL
, et al.
Stemming retinal regeneration with pluripotent stem
cells . Prog Retin Eye Res.
2019; ; 69 :
:38.–56. 8.
Zhao
C
, Wang
Q
, Temple
S
. Stem cell therapies for retinal diseases:
recapitulating development to replace degenerated cells .
Development.
2017; ; 144 :
:1368.–1381. 9.
M’Barek
K Ben,
Monville
C. Cell therapy for
retinal dystrophies: from cell suspension formulation to complex retinal
tissue bioengineering . Stem Cells Int.
2019;; 2019 :
:1.–14. 10.
Sharma
R,
Bose
D,
Maminishkis
A, et al. Retinal
pigment epithelium replacement therapy for age-related macular degeneration:
are we there yet?
Annu Rev Pharmacol Toxicol.
2020;; 60 :
:553.–72. 11.
MacLaren
RE
, Pearson
RA
, MacNeil
A
, et al.
Retinal repair by transplantation of photoreceptor
precursors . Nature.
2006; ; 444 :
:203.–207. 12.
Pearson
RA
, Barber
AC
, Rizzi
M
, et al.
Restoration of vision after transplantation of
photoreceptors . Nature.
2012; ; 485 :
:99.–103. 13.
Llonch
S
, Carido
M
, Ader
M
. Organoid technology for retinal
repair . Dev Biol.
2018; ; 433 :
:132.–143. 14.
Reichman
S
, Sahel
J-A
, Goureau
O
. Production de rétines in vitro à partir de
cellules pluripotentes humaines . Med Sci
(Paris).
2014; ; 30 :
:845.–848. 15.
Gagliardi
G
, Ben
M’Barek K
, Chaffiol
A
, et al.
Characterization and transplantation of CD73-positive
photoreceptors isolated from human iPSC-derived retinal
organoids . Stem Cell Rep.
2018; ; 11 :
:665.–680. 16.
Lakowski
J
, Welby
E
, Budinger
D
, et al.
Isolation of human photoreceptor precursors via a cell surface
marker panel from stem cell-derived retinal organoids and fetal
retinae . Stem Cells.
2018; ; 36 :
:709.–722. 17.
Santos-Ferreira
T
, Llonch
S
, Borsch
O
, et al.
Retinal transplantation of photoreceptors results in donor–host
cytoplasmic exchange . Nat Commun.
2016; ; 7 : :13028.. 18.
Pearson
RA
, Gonzalez-Cordero
A
, West
EL
, et al.
Donor and host photoreceptors engage in material transfer
following transplantation of post-mitotic photoreceptor
precursors . Nat Commun.
2016; ; 7 : :13029.. 19.
Singh
MS
, Balmer
J
, Barnard
AR
, et al.
Transplanted photoreceptor precursors transfer proteins to host
photoreceptors by a mechanism of cytoplasmic fusion .
Nat Commun.
2016; ; 7 : :13537.. 20.
Singla
DK
. Stem cells and exosomes in cardiac
repair . Curr Opin Pharmacol.
2016; ; 27 :
:19.–23. 21.
Tu
HY
, Watanabe
T
, Shirai
H
, et al.
Medium- to long-term survival and functional examination of human
iPSC-derived retinas in rat and primate models of retinal
degeneration . EBio Medicine.
2019; ; 39 :
:562.–574. 22.
McLelland
BT
, Lin
B
, Mathur
A
, et al.
Transplanted hESC-derived retina organoid sheets differentiate,
integrate, and improve visual function in retinal degenerate
rats . Investig Ophthalmol Vis Sci.
2018; ; 59 :
:2586.–2603. 23.
Lakowski
J
, Gonzalez-Cordero
A
, West
EL
, et al.
Transplantation of photoreceptor precursors isolated via a cell
surface biomarker panel from embryonic stem cell-derived self-forming
retina . Stem Cells.
2015; ; 33 :
:2469.–2482. 24.
Strauss
O.
. The retinal pigment epithelium in visual
function . Physiol Rev.
2005; ; 85 :
:845.–881. 25.
M’Barek
K Ben,
Habeler
W,
Plancheron
A, et al. Human
ESC–derived retinal epithelial cell sheets potentiate rescue of
photoreceptor cell loss in rats with retinal degeneration .
Sci Transl Med.
2017;; 9 :
:eaai7471.. 26.
Worthington
KS
, Wiley
LA
, Kaalberg
EE
, et al.
Two-photon polymerization for production of human iPSC-derived
retinal cell grafts . Acta Biomater.
2017; ; 55 :
:385.–395. 27.
Jung
YH
, Phillips
MJ
, Lee
J
, et al.
3D Microstructured scaffolds to support photoreceptor
polarization and maturation . Adv Mater.
2018; ; 30 :
:1803550.. 28.
Masaeli
E,
Forster
V,
Picaud
S, et al. Tissue
engineering of retina through high resolution 3-dimensional inkjet
bioprinting . Biofabrication.
2020;; 12 : :025006.. 29.
Garita-Hernandez
M
, Lampicˇ
M
, Chaffiol
A
, et al.
Restoration of visual function by transplantation of
optogenetically engineered photoreceptors . Nat
Commun.
2019; ; 10 : :4524.. 30.
Chaffiol
A
, Duebel
J
. Mini-review: cell type-specific optogenetic
vision restoration approaches . Adv Exp Med
Biol.
2018; ; 1074 :
:69.–73. |