| |
| Med Sci (Paris). 36(6-7): 626–632. doi: 10.1051/medsci/2020098.Les organoïdes de rétine Un nouvel outil pour comprendre et traiter les maladies
rétiniennes Olivier Goureau,1* Sacha Reichman,1 and Gaël Orieux1 1Institut de la Vision, Sorbonne Université, Inserm,
CNRS, 17 rue
Moreau, F-75012Paris,
France |

Vignette (Photo © Olivier Goureau). La possibilité de reprogrammer les cellules somatiques en cellules souches induites à la
pluripotence (cellules iPS) et d’orienter ensuite ces cellules vers un destin cellulaire
spécifique a ouvert un nouveau champ de recherches pour l’étude du développement
anténatal humain, et celle des maladies humaines [1]. Les progrès concernant notre compréhension des programmes de
développement, notamment grâce à la disponibilité de modèles animaux, et la maîtrise des
protocoles in vitro de différenciation contrôlée des cellules souches
pluripotentes humaines, permettent depuis quelques années de produire des structures
tridimensionnelles présentant une organisation cellulaire et des propriétés proches de
celle des organes. La formation de ces structures complexes, appelées organoïdes, repose
sur la remarquable capacité des cellules souches pluripotentes à s’auto-organiser
spatialement au cours de leur différenciation [2, 3]
(→).
(→) Voir la Synthèse de J.L. Galzi et al., m/s
n° 5, mai 2019, page 467
Si la fonctionnalité des organoïdes rétiniens obtenus à partir des protocoles actuels
reste limitée en raison d’une relative immaturité, la rétinogenèse est en revanche assez
fidèlement reproduite [4, 5]. Ces nouveaux modèles sont donc
très intéressants pour l’étude du développement de la rétine dans un contexte humain et
ouvrent de nouveaux champs d’investigation pour comprendre des maladies de la rétine
difficilement modélisables chez l’animal, ainsi que des perspectives encourageantes dans
le domaine de la thérapie cellulaire ou le criblage de molécules thérapeutiques. |
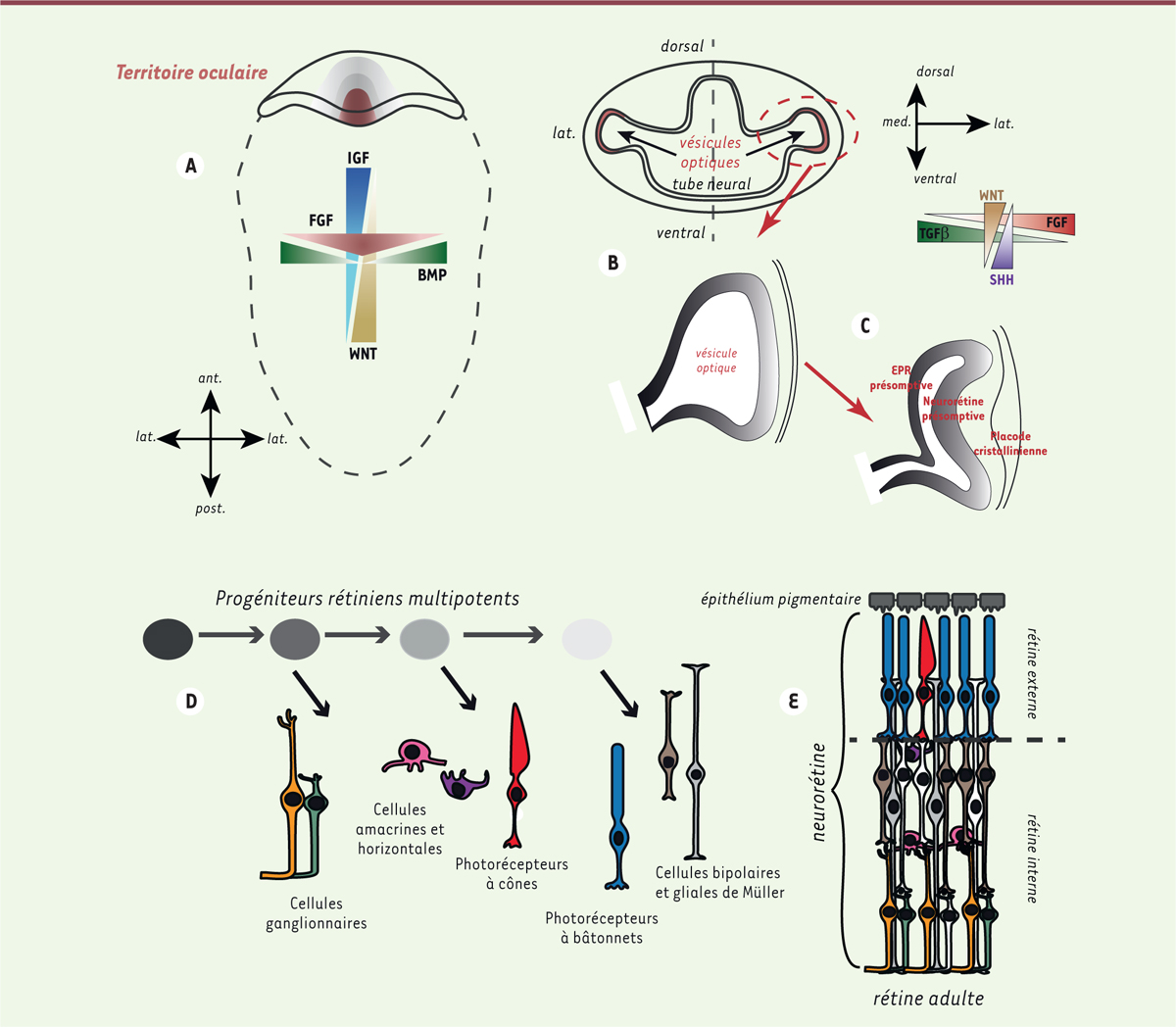
Origine de l’œil et de la rétine Les connaissances concernant le développement oculaire sont indispensables pour
l’établissement de protocoles permettant de guider la différenciation des cellules
souches pluripotentes humaines en cellules rétiniennes en conduisant à la formation
d’organoïdes de rétine. Au cours de l’embryogenèse, la rétine neurale et l’épithélium pigmentaire rétinien
(EPR) dérivent du neurectoderme, la cornée et le cristallin de l’ectoderme de
surface, et la sclère du mésoderme. La formation de l’œil s’amorce lors de la
gastrulation par une série d’événements structuraux régis par des signaux
moléculaires spécifiques qui confèrent à un groupe de cellules du neuroépithélium
médian et antérieur une identité oculaire [6]. La délimitation de ce territoire dépend de l’activation des
voies de signalisation du facteur de croissance des fibroblastes (FGF), du facteur
de croissance apparenté à l’insuline (IGF-1) et de la répression de deux autres
voies de transduction : la voie commune au facteur de croissance transformant bêta
(TGF-β) et aux protéines morphogénétiques osseuses (BMP) et celle impliquant la
signalisation du ligand Wnt (Figure
1A). La mise en place de ce territoire est orchestrée par la
régulation temporelle et spatiale de gènes codant des facteurs de transcription
spécifiques appelés « facteurs de transcription du champ oculaire » [6, 7] : six protéines homeobox différentes (LHX2,
OTX2, PAX6, RAX, SIX3 et SIX6)1, un récepteur
nucléaire (NR2E1 [nuclear receptor subfamily 2 group E member 1],
aussi appelé TLX, pour tailless) et une protéine T-box (TBX3 pour
T-box transcription factor 3). Sous l’influence de différents
signaux, cette région va se scinder en deux pour former deux zones symétriques
latérales. Ce remodelage se traduit par une évagination du neuroépithélium
conduisant à la formation des vésicules optiques qui formeront, par la suite, la
rétine et le nerf optique. Une étape d’invagination de ce neuroépithélium donnera
naissance à la cupule optique, constituée désormais de deux couches (Figure 1B). Ces couches externe et
interne formeront respectivement l’EPR et la neurorétine (aussi appelée rétine
neurale) sous l’influence de signaux exogènes provenant de tissus adjacents, tels
que le FGF, des agonistes de la voie TGF-β/BMP et le morphogène Sonic hedgehog (Shh)
(Figure 1C). À ce
stade, la future neurorétine est constituée de progéniteurs rétiniens multipotents,
capables de donner naissance à tous les types cellulaires rétiniens selon une
séquence temporelle qui est similaire chez tous les vertébrés [8]. Les types cellulaires précoces,
comme les cellules ganglionnaires, les cellules amacrines et les cellules
horizontales2, apparaissent tôt au cours du
développement, tandis que les photorécepteurs, les cellules bipolaires et les
cellules gliales de Müller sont générés à un stade plus avancé (Figure 1D–E).
 | Figure 1. Les étapes du développement de la rétine des
vertébrés. Au stade très précoce
(A), sous l’influence de plusieurs
gradients de facteurs morphogéniques, un territoire antérieur et médian
de la plaque neurale dorsale acquiert une « identité oculaire ». Après
formation du tube neural, ce territoire va se scinder en deux
(B) et s’évaginer pour former les
vésicules optiques. L’invagination de ces vésicules aboutit ensuite à la
formation d’une structure présentant deux feuillets
(C) qui formeront la future
neurorétine et l’épithélium pigmentaire. À ce stade, la future
neurorétine est constituée de progéniteurs multipotents
(D) qui vont, par vagues
successives, donner naissance aux différents types cellulaires qui
constituent la neurorétine adulte (E). |
|
Produire des cellules et des tissus rétiniens à partir de cellules souches
pluripotentes humaines Cellules souches pluripotentes humaines Les cellules souches pluripotentes sont caractérisées par l’association unique de
deux propriétés qui sont mises à profit dans les domaines de l’ingénierie
tissulaire et de la thérapie cellulaire : leur capacité d’auto-renouvellement
(amplification clonale théoriquement infinie) et leur caractère pluripotent
(potentiel de différenciation en n’importe quels types cellulaires constitutifs
de l’organisme adulte). Depuis l’isolement des cellules souches embryonnaires
(ES) humaines à la fin des années 1990 [ 9], et la mise au point de la technique dite des cellules
iPS, dans les années 2006-2007 [ 10], la maîtrise des procédés permettant de guider le
destin de ces cellules a progressé de façon spectaculaire. Mimer le développement de l’œil En utilisant le potentiel de différenciation des cellules ES et iPS humaines, il
est possible de reproduire in vitro, de manière simplifiée, les
mécanismes impliqués dans le développement de la rétine et de conduire les
cellules pluripotentes à adopter une identité neuro-ectodermique, puis celle du
territoire oculaire et, finalement, d’orienter leur différenciation vers un
lignage rétinien (vers l’EPR ou vers la neurorétine). Cela a été rendu possible
par l’utilisation séquentielle de composés chimiques ou de facteurs protéiques
permettant l’activation successive des voies de signalisation du FGF et de
l’IGF-1 ainsi que l’inhibition des deux voies de signalisation TGF-b/BMP et Wnt
[ 4, 5]. Vers des mini-rétines en trois dimensions : les organoïdes rétiniens Les premiers organoïdes de rétine ont été obtenus au début des années 2010 dans
le laboratoire dirigé par Yoshiki Sasai au Ryken Center for
Developmental Biology à Kobe au Japon [ 11]. L’un des éléments clés qui a permis à
ces chercheurs d’obtenir non pas de « simples » cellules rétiniennes, mais des
structures tridimensionnelles auto-organisées, a été la culture en suspension
d’agrégats de cellules ES de souris dans des matrices extracellulaires
artificielles. Une fois le processus de différenciation entamé, ces amas forment
des corps embryonnaires. Ces chercheurs ont alors observé, en périphérie de ces
corps embryonnaires, l’émergence de structures de type vésicule optique,
contenant des progéniteurs rétiniens multipotents. Ces structures
neurorétiniennes, après avoir été séparées des agrégats, peuvent poursuivre leur
développement, laissant apparaître l’ensemble des types cellulaires rétiniens
avec une organisation et une orientation semblables à celles observées
in vivo. Ces auteurs ont obtenu des résultats similaires à
partir de cellules ES humaines en 2012 [ 12]. Les organoïdes rétiniens ainsi obtenus présentaient
une organisation en trois couches cellulaires regroupant des photorécepteurs à
côté de plusieurs autres types neuronaux rétiniens et de cellules gliales de
Müller. La relativement faible efficacité associée au coût élevé de cette
méthode, en raison notamment du manque de contrôle de certains paramètres
expérimentaux, a conduit plusieurs groupes à réduire cette hétérogénéité
cellulaire initiale [ 13, 14]. Une
approche alternative a consisté à contourner la formation des corps
embryonnaires, en maintenant les cellules pluripotentes en conditions
d’adhérence. Notre équipe a ainsi montré que les cellules iPS humaines à
confluence, et en l’absence du facteur de pluripotence FGF2, pouvaient, une fois
le processus de différenciation engagé, produire elles-mêmes des inhibiteurs des
voies de signalisation TGF-β/BMP et Wnt, une situation favorable à la
différenciation neuronale, et notamment rétinienne [ 15] ( →).
(→) Voir la Nouvelle de S. Reichman et al.,
m/s n° 10, octobre 2014, page 845
L’utilisation de milieux classiquement utilisés pour la culture des neurones
favorise également l’émergence de structures auto-organisées de type vésicule
optique. La mise en culture en suspension de ces structures permet, dans un
second temps, la formation d’organoïdes rétiniens contenant l’ensemble des types
cellulaires de la rétine [16, 17].
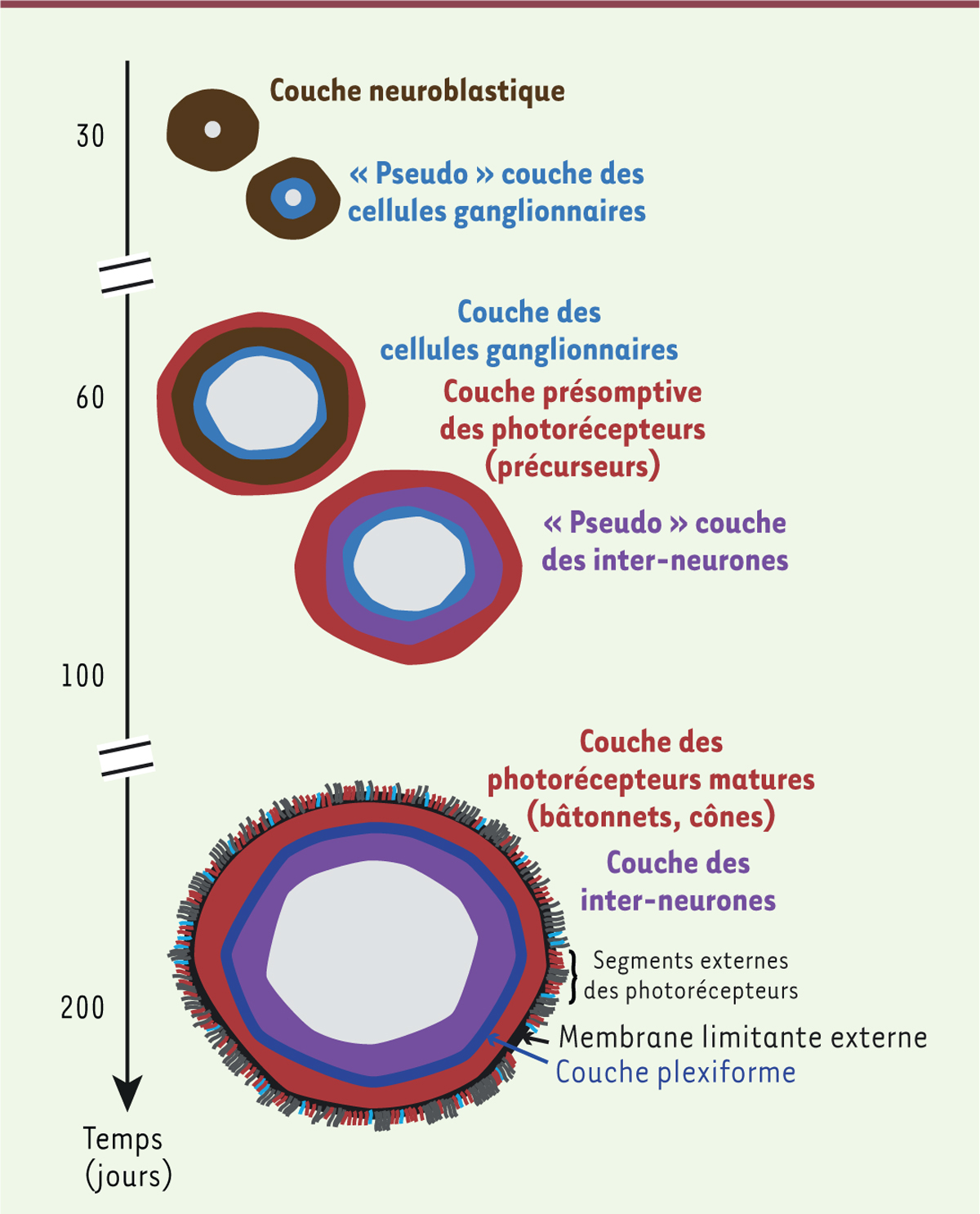
Comme dans de nombreux protocoles de différenciation en trois dimensions (3D),
on peut distinguer trois étapes successives dans l’évolution structurale des
organoïdes rétiniens (Figure
2). Les premiers organoïdes, âgés de 35-40 jours, sont
constitués d’un neuro-épithélium contenant des progéniteurs rétiniens en
prolifération. Aux stades intermédiaires (entre 60 et 100 jours), une séparation
nette entre une couche nucléaire externe et une couche interne présomptives,
correspondant à la différenciation des photorécepteurs et des populations de
neurones de la rétine interne, est observée. Enfin, dans les organoïdes
rétiniens d’âge tardif (après 150-175 jours), les photorécepteurs peuvent
atteindre un stade avancé de développement, comme l’illustre la formation de
segments internes et externes. On peut souligner le fait que cette cinétique est
assez proche de celle observée au cours du développement fœtal humain (entre les
semaines 23 et 30). Certaines limites persistent toutefois, notamment lorsqu’il
s’agit de maintenir à long terme ces organoïdes. Une désorganisation progressive
de la région interne des organoïdes aux stades tardifs est en effet observée,
ainsi qu’une perte des cellules ganglionnaires, prévisible dans ce type de
cultures en l’absence des cibles cérébrales naturelles de ces neurones.
 | Figure 2. Les différents stades des organoïdes rétiniens générés
à partir de cellules souches pluripotentes
humaines. Diagramme montrant l’évolution
structurale, la stratification et la composition cellulaire des
organoïdes au cours du temps. |
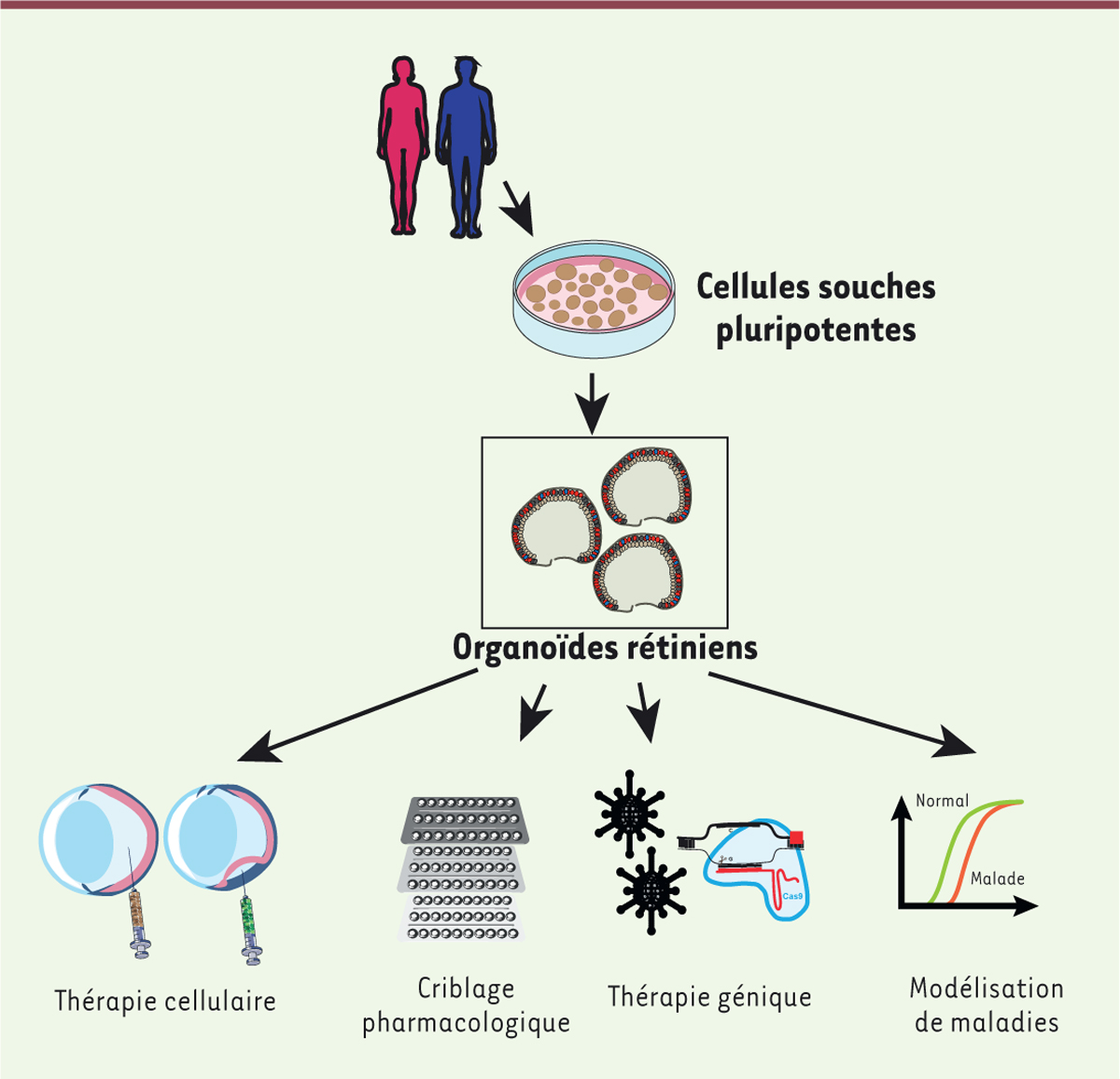
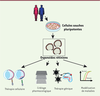 | Figure 3. Les principales applications d’organoïdes rétiniens
dérivés de cellules souches pluripotentes.
L’utilisation d’organoïdes peut répondre à différentes
problématiques en recherche fondamentale et en médecine réparatrice
(thérapie cellulaire et génique). La génération de modèles associés
aux maladies génétiques permet d’étudier le développement de ces
maladies (modélisation) et leur réponse à différents traitements
(criblage pharmacologique). |
Les progrès récents réalisés dans les approches de séquençage des ARN messagers à
l’échelle d’une seule cellule ont permis de caractériser précisément les
différentes populations rétiniennes au cours de la différenciation des
organoïdes et de montrer la similarité entre la rétinogenèse in
vitro (organoïdes) et in vivo (tissus fœtaux
humains) [18, 19]. Plusieurs études ont
montré la capacité des cellules ganglionnaires présentes dans des organoïdes
relativement jeunes à émettre des potentiels d’action traduisant une certaine
maturité fonctionnelle [20, 21].
D’autres études ont rapporté l’existence de réponse à la lumière par les
photorécepteurs dans les organoïdes de plus de 25 semaines [14], ou une modification des niveaux de
calcium au sein des photorécepteurs après application de nucléotides cycliques
dérivés du GTP (GMPc), une caractéristique de la photo-transduction, indiquant
dans les deux cas, une maturation fonctionnelle des photorécepteurs [17, 22]. |
Organoïdes de rétines comme sources de cellules pour la thérapie
cellulaire Outre leur intérêt pour étudier le développement humain, les organoïdes rétiniens
représentent une source très intéressante de cellules d’intérêt thérapeutique. Dans
une démarche de médecine dite régénérative, ou thérapie cellulaire, on peut
envisager la production de cellules spécifiques qui pourraient être implantées chez
des patients souffrant d’une perte de ces cellules. Des publications récentes
décrivent la transplantation dans différents modèles animaux de photorécepteurs
issus d’organoïdes, en suivant différentes stratégies [5, 22-25]. Certaines approches consistent à transplanter une population purifiée
de photorécepteurs immatures, après une étape de sélection (tri cellulaire par
cytométrie en flux ou magnétique) [22, 24] ; d’autres proposent la
greffe d’un feuillet de rétine issu d’organoïdes rétiniens dans des modèles animaux
où l’ensemble des photorécepteurs ont dégénéré [24, 25]. Toutefois, la capacité
des photorécepteurs greffés à se reconnecter dans le tissu hôte est très réduite en
raison de la présence, au sein de ces feuillets, de cellules rétiniennes autres que
les photorécepteurs. Quelle que soit la stratégie employée, la capacité limitée des
cellules greffées à se développer en photorécepteurs fonctionnels (sensibles à la
lumière) connectés à la fois à la rétine interne et à l’EPR de l’hôte reste un
obstacle majeur. De nouvelles voies de recherche, visant à combiner la thérapie
cellulaire et l’optogénétique ou la bio-ingénierie (polymères structuraux
biocompatibles ou échaffaudages [scaffold]), commencent à émerger.
L’utilisation de scaffold a pour but de favoriser la maturation et
la polarisation des photorécepteurs afin de transplanter des photorécepteurs avec
des segments externes sensibles à la lumière [26]. L’approche optogénétique permet de rendre
les cellules artificiellement sensibles à la lumière, grâce à l’expression
d’opsines3 microbiennes spécifiques, même
en l’absence de maturation fonctionnelle des photorécepteurs [27]. |
Organoïdes de rétines comme outils de modélisation pour la compréhension de
maladies et pour le criblage de médicaments Dans la mesure où les organoïdes peuvent être obtenus à partir de cellules iPS de
patients atteints de maladies génétiques, ils peuvent être utilisés pour comprendre
le processus pathologique conduisant à la maladie, et comme outil pour le
développement de nouvelles thérapies pharmacologiques ou géniques. Concernant les maladies de la rétine, la technique des cellules iPS est
particulièrement intéressante dans le cas des maladies dégénératives héréditaires,
telles que les rétinites pigmentaires. Bien que des modèles murins puissent être
utilisés pour étudier certains aspects de ces maladies, ils ne présentent pas
toujours les signes cliniques de la maladie ou ne reproduisent pas fidèlement le
processus pathologique, et leur rétine ne possèdent pas toutes les caractéristiques
d’une rétine humaine. Ainsi, les cellules iPS obtenues à partir de patients ont
permis de produire des organoïdes présentant des phénotypes pathologiques, comme une
perte prématurée des photorécepteurs comparable à celle observée chez les sujets
atteints [28]. Ces
organoïdes sont aujourd’hui utilisés pour comprendre les mécanismes moléculaires et
cellulaires responsables de la mort des photorécepteurs menant à la cécité chez les
patients. L’accès à des biopsies de patients volontaires n’est pas toujours facile, notamment
pour les maladies rares. La nouvelle technique d’édition du génome CRISPR/Cas9 peut
permettre aujourd’hui de s’en affranchir. La palette d’outils liée à cette technique
rend en effet possible la modification ciblée, in vitro, du génome
pour reproduire au sein de cellules iPS « normales » des mutations connues pour être
responsables de maladies [29], et ainsi de générer des organoïdes rétiniens porteurs de
mutation(s) avec un phénotype pathologique. Il est aussi possible d’utiliser cette
technique pour corriger le(s) mutation(s) et valider la réversion d’un phénotype au
sein des organoïdes [29, 30]. Une autre application intéressante consiste à utiliser des organoïdes de rétine pour
le criblage automatisé à haut débit de centaines de milliers de composés chimiques,
afin d’identifier des molécules d’intérêt « thérapeutique », à une échelle qui ne
pourrait pas être réalisée sur des modèles animaux. Toutefois, le défi de
miniaturisation et d’automatisation reste important en raison de la complexité des
cultures d’organoïdes (longues étapes de différenciation, traitements nécessaires
pour l’imagerie, etc.). |
Se rapprocher d’une vraie rétine en augmentant le degré de complexité des
organoïdes rétiniens Malgré les similitudes qui ont pu être obtenues entre les organoïdes rétiniens et une
rétine adulte, les niveaux d’organisation et de fonctionnalité de ces deux entités
sont loin d’être identiques ; ce qui est tout à fait compréhensible étant donné les
différences marquées entre les environnements in vitro et
in vivo. Des améliorations futures pourraient reposer sur
l’enrichissement des systèmes de culture. Par exemple, les organoïdes rétiniens
isolés ne forment pas une véritable cupule optique et ne présentent pas un EPR
correctement localisé, en face des photorécepteurs. La coculture d’organoïdes en
présence d’EPR pourrait améliorer la morphogenèse des segments externes des
photorécepteurs [31] et, au
final, leur fonction (réponse à la lumière), ou permettre de modéliser des maladies
caractérisées par des défauts d’interaction entre ces deux tissus. Les organoïdes ne
sont pas non plus reliés au cerveau antérieur, ou à d’autres structures
non-rétiniennes importantes pour le développement rétinien. Le maintien de
connexions rétine-cerveau par l’intermédiaire de cocultures (ou « assembloïdes »)
d’organoïdes rétiniens et d’organoïdes cérébraux pourrait faciliter la survie des
cellules ganglionnaires et ainsi permettre la formation d’une structure semblable au
nerf optique. Une des limites des protocoles développés pour la formation des organoïdes de rétine,
comme pour ceux utilisés pour les organoïdes cérébraux, est qu’ils dirigent les
cellules iPS dans un lignage neurectodermique, en inhibant la formation du mésoderme
et de l’endoderme. Les organoïdes rétiniens ne présentent donc pas la combinaison
complète de cellules dérivées des différentes couches germinales qui sont présentes
in vivo dans une rétine, telles que les cellules microgliales
et les cellules vasculaires. Cette absence de vascularisation des organoïdes
rétiniens limite ainsi le soutien métabolique au centre des structures à des stades
avancés (lorsque leur taille est supérieure à 250 µm) et pourrait expliquer la
nécrose observée, au fil du temps, au cœur des organoïdes. Des approches de
cocultures avec des cellules vasculaires, ou de bio-ingénierie tissulaire
(échafaudages biologiques, bio-impression, etc.) pourraient permettre la formation
de néo-vaisseaux dans les organoïdes. Une approche alternative peut être la greffe
de ces organoïdes produits in vitro dans un animal hôte, qui
permettra l’approvisionnement en nutriments dans un environnement adéquat, comme
cela a été rapporté récemment pour des organoïdes cérébraux [32]. L’ensemble de ces considérations doit être pris en compte, notamment pour les
approches de modélisation, qui, par définition, cherchent à reproduire le plus
fidèlement possible la situation naturelle in vivo. À titre
d’exemple, la distribution spatiale particulière des différents sous-types de
photorécepteurs chez l’homme, qui se caractérise par un regroupement des cônes au
sein de la partie centrale de la rétine, dans la région maculaire (ou fovéa), n’est
actuellement pas observée dans les organoïdes rétiniens humains. |
L’émergence de protocoles fondés sur la différenciation des cellules iPS en
organoïdes de rétine qui regroupent, in vitro, les principaux
évènements moléculaires et cellulaires de la rétinogenèse humaine a ouvert
d’immenses possibilités de recherche sur le développement, la modélisation et
l’étude de processus pathologiques ou la production de cellules pertinentes en
clinique. Encore imparfaits à ce jour, ils sont néanmoins complémentaires des
modèles animaux, qui présentent d’autres avantages mais ont leurs limites. La mise
au point d’assembloïdes, en combinant plusieurs types cellulaires ou d’organoïdes
(rétine, cerveau, EPR, vaisseaux, etc.) constitue une piste intéressante pour le
développement de modèles 3D ex vivo encore plus fidèles à la
réalité complexe in vivo. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Footnotes |
1.
Karagiannis
P
, Takahashi
K
, Saito
M
, et al.
Induced pluripotent stem cells and their use in human models of
disease and development . Physiol Rev.
2019; ; 99 :
:79.–114. 2.
Rossi
G
, Manfrin
A
, Lutolf
MP
. Progress and potential in organoid
research . Nat Rev Genet.
2018; ; 19 :
:671.–687. 3.
Galzi
J
, Jouault
T
, Amédée
J
. Les organoïdes : des mini-organes au service de
la biomédecine . Med Sci (paris).
2019; ; 35 :
:467.–469. 4.
Llonch
S
, Carido
M
, Ader
M
. Organoid technology for retinal
repair . Dev Biol.
2018; ; 433 :
:132.–143. 5.
Gagliardi
G
, M’Barek
K
. Ben, Goureau O. Photoreceptor cell replacement in
macular degeneration and retinitis pigmentosa: a pluripotent stem cell-based
approach . Prog. Retin. Eye Res.
2019; ; 71 :
:1.–25. 6.
Graw
J.
Eye development. Curr Top Dev Biol.
2010; ; 90 :
:343.–386. 7.
Zuber
ME
,
Cagan
RL
, Ross
L
, Reh
TA
. Eye Field specification in Xenopus
laevis . Current topics in developmental
biology.
2010 ; New York:
Elsevier Inc;
:29.–60. 8.
Cepko
C.
. Intrinsically different retinal progenitor cells
produce specific types of progeny . Nat Rev
Neurosci.
2014; ; 15 :
:615.–627. 9.
Thomson
JA
, Itskovitz-Eldor
J
, Shapiro
SS
, et al.
Embryonic stem cell lines derived from human
blastocysts . Science.
1998; ; 282 :
:1145.–1147. 10.
Takahashi
K
, Tanabe
K
, Ohnuki
M
, et al.
Induction of pluripotent stem cells from adult human fibroblasts
by defined factors . Cell.
2007; ; 131 :
:861.–872. 11.
Eiraku
M
, Takata
N
, Ishibashi
H
, et al.
Self-organizing optic-cup morphogenesis in three-dimensional
culture . Nature.
2011; ; 472 :
:51.–56. 12.
Nakano
T
, Ando
S
, Takata
N
, et al.
Self-formation of optic cups and storable stratified neural
retina from human ESCs . Cell Stem Cell.
2012; ; 10 :
:771.–785. 13.
Meyer
JS
, Howden
SE
, Wallace
KA
, et al.
Optic vesicle-like structures derived from human pluripotent stem
cells facilitate a customized approach to retinal disease
treatment . Stem Cells.
2011; ; 29 :
:1206.–1218. 14.
Zhong
X
, Gutierrez
C
, Xue
T
, et al.
Generation of three-dimensional retinal tissue with functional
photoreceptors from human iPSCs . Nat Commun.
2014; ; 5 : :4047.. 15.
Reichman
S
, Sahel
JA
, Goureau
O
. Production de rétines in vitro à partir de
cellules pluripotentes humaines . Med Sci
(Paris).
2014; ; 30 :
:845.–848. 16.
Reichman
S
, Terray
A
, Slembrouck
A
, et al.
From confluent human iPS cells to self-forming neural retina and
retinal pigmented epithelium . Proc Natl Acad Sci
USA.
2014; ; 111 :
:8518.–8523. 17.
Reichman
S
, Slembrouck
A
, Gagliardi
G
, et al.
Generation of storable retinal organoids and retinal pigmented
epithelium from adherent human iPS cells in xeno-free and feeder-free
conditions . Stem Cells.
2017; ; 35 :
:1176.–1188. 18.
Mao
X
, An
Q
, Xi
H
, et al.
Single-cell RNA sequencing of hESC-derived 3D retinal organoids
reveals novel genes regulating RPC commitment in early human
retinogenesis . Stem Cell Rep.
2019; ; 13 :
:747.–760. 19.
Kim
S
, Lowe
A
, Dharmat
R
, et al.
Generation, transcriptome profiling, and functional validation of
cone-rich human retinal organoids . Proc Natl Acad
Sci USA.
2019; ; 116 :
:10824.–10133. 20.
Rabesandratana
O
, Goureau
O
, Orieux
G
. Pluripotent stem cell-based approaches to explore
and treat optic neuropathies . Front
Neurosci.
2018; ; 12 : :651.. 21.
VanderWall
KB
, Vij
R
, Ohlemacher
SK
, et al.
Astrocytes regulate the development and maturation of retinal
ganglion cells derived from human pluripotent stem cells .
Stem Cell Rep.
2019; ; 12 :
:201.–212. 22.
Gagliardi
G
, Ben
M’Barek K
, Chaffiol
A
, et al.
Characterization and transplantation of cd73-positive
photoreceptors isolated from human iPSc-derived retinal
organoids . Stem Cell Rep.
2018; ; 11 :
:665.–680. 23.
Gonzalez-Cordero
A
, Kruczek
K
, Naeem
A
, et al.
Recapitulation of human retinal development from human
pluripotent stem cells generates transplantable populations of cone
photoreceptors . Stem Cell Rep.
2017; ; 9 :
:820.–837. 24.
Gasparini
SJ
, Llonch
S
, Borsch
O
, et al.
Transplantation of photoreceptors into the degenerative retina:
current state and future perspectives . Prog Retin
Eye Res.
2019; ; 69 :
:1.–37. 25.
Shirai
H
, Mandai
M
, Matsushita
K
, et al.
Transplantation of human embryonic stem cell-derived retinal
tissue in two primate models of retinal degeneration .
Proc Natl Acad Sci USA.
2016; ; 113 :
:E81.–E90. 26.
Jung
YH
, Phillips
MJ
, Lee
J
, et al.
3D microstructured scaffolds to support photoreceptor
polarization and maturation . Adv Mater.
2018; ; 30 :
:1803550.. 27.
Garita-Hernandez
M
, Lampicˇ
M
, Chaffiol
A
, et al.
Restoration of visual function by transplantation of
optogenetically engineered photoreceptors . Nat
Commun.
2019; ; 10 : :4524.. 28.
Artero Castro
A,
Lukovic
D,
Jendelova
P, et al. Concise
review: human induced pluripotent stem cell models of retinitis
pigmentosa . Stem Cells.
2018;; 36 :
:474.–81. 29.
Burnight
ER
, Giacalone
JC
, Cooke
JA
, et al.
CRISPR-Cas9 genome engineering: treating inherited retinal
degeneration . Prog Retin Eye Res.
2018; ; 65 :
:28.–49. 30.
Deng
WL
, Gao
ML
, Lei
XL
, et al.
Gene correction reverses ciliopathy and photoreceptor loss in
ipsc-derived retinal organoids from retinitis pigmentosa
patients . Stem Cell Rep.
2018; ; 10 :
:1267.–1281. 31.
Achberger
K,
Probst
C,
Haderspeck
J, et al. Merging
organoid and organ-on-a-chip technology to generate complex multi-layer
tissue models in a human retina-on-a-chip platform .
Elife.
2019; :8. 32.
Mansour
AA
, Gonçalves
JT
, Bloyd
CW
, et al.
An in vivo model of functional and vascularized human brain
organoids . Nat Biotechnol.
2018; ; 36 :
:432.–441. |