| |
| Med Sci (Paris). 36(6-7): 655–658. doi: 10.1051/medsci/2020116.Allier les capacités anti-tumorales des CAR-T
cells aux propriétés des exosomes : une approche innovante pour
combattre le cancer Zoé Fusilier1* and Hermine Ferran1** 1Master 2 Immunologie Translationnelle et Biothérapies,
Mention BMC, Sorbonne Université, Paris,
France |
L’actualité scientifique vue par les étudiants du Master 2 « Immunologie
Translationnelle et Biothérapies » (ITB) et « Immunologie Intégrative et Systémique
» (I2S) (Mention Biologie Moléculaire et Cellulaire, Parcours Immunologie, Sorbonne
Université)

Équipe pédagogique
Jonathan Pol (Chercheur, Centre de Recherche des Cordeliers)
Encarnita Mariotti-Ferrandiz (Maître de Conférences, Sorbonne Université)
Véronique Mateo (Maître de Conférences, Sorbonne Université)
Pierre-Emmanuel Joubert (Maître de Conférences, Sorbonne Université)
Sophie Sibéril (Maître de Conférences, Sorbonne Université)
Isabelle Cremer (Professeur, Sorbonne Université)
Jules Russick (Attaché Temporaire d’Enseignement et de Recherche, Sorbonne
Université)
Signe Hässler (Attaché Temporaire d’Enseignement et de Recherche, Sorbonne
Université)
Série coordonnée par Sophie Sibéril. |
Du principe au développement des immunothérapies « CAR-T cells » Le principe de l’immunosurveillance repose sur la capacité du système immunitaire à
reconnaître et à éradiquer les cellules tumorales dès l’émergence du processus de
transformation cellulaire [1]
(→).
(→) Voir la Synthèse de M. Bruchard et F. Ghiringhelli, m/s n° 4, avril 2014,
page 429
Ainsi, lors de la tumorigenèse, une réponse immunitaire locale se met en place,
impliquant principalement les lymphocytes T cytotoxiques (LTc) et les lymphocytes T
mémoires, afin de contrôler la croissance tumorale et prévenir l’apparition de
cancers. Les lymphocytes T (LT) sont capables de reconnaître spécifiquement des
peptides dérivés d’antigènes tumoraux présentés par les molécules du complexe majeur
d’histocompatibilité de classe I (CMH I) à la surface des cellules tumorales, par
leur récepteur spécifique d’antigène (ou TCR) et d’induire la mort de ces cellules
[2] (→).
(→) Voir la Synthèse de W.H. Fridman et C. Sautès-Fridman, m/s n° 4, avril
2014, page 359
Cependant, les cellules transformées sont des adversaires de taille et le système
immunitaire est bien souvent incapable de contrer la tumorigenèse. En effet, les
cellules tumorales évoluent dans un microenvironnement tissulaire et cellulaire
hétérogène où se mettent en place des mécanismes immunosuppresseurs leur permettant
d’échapper à la surveillance immunitaire, contribuant ainsi à la progression de la
maladie. Par exemple, les cellules tumorales peuvent diminuer l’expression à leur
surface des molécules de présentation antigénique (comme le CMH I) ou exprimer des
molécules inhibitrices, altérant le mécanisme de reconnaissance ou les fonctions
effectrices des LTc [1, 3]. C’est pourquoi, depuis de nombreuses années,
la communauté scientifique s’est attelée à comprendre les mécanismes impliqués dans
l’inhibition de la réponse immunitaire pour développer des approches thérapeutiques
innovantes, appelées immunothérapies, permettant d’induire une réponse immunitaire
anti-tumorale fonctionnelle. En 1989, Zelig Eshhar et ses collègues ont proposé une
stratégie thérapeutique alliant les propriétés cytotoxiques des LTc et la capacité
de reconnaissance spécifique des anticorps monoclonaux [4]. Ces chercheurs ont mis au point un récepteur
hybride, appelé récepteur antigénique chimérique (CAR, initialement appelé
T-body), pouvant être introduit par transduction génétique
in vitro dans les LTc d’un patient. Depuis, cette stratégie a
connu de nombreuses améliorations grâce aux avancées scientifiques et techniques,
conduisant au développement de plusieurs générations de CAR possédant toutes trois
modules distincts : 1) un module extracellulaire dérivé d’un anticorps monoclonal
appelé scFv (pour single chain fragment variable), contenant un
domaine VH et un domaine VL associés par un polypeptide, et assurant la
reconnaissance spécifique de l’antigène tumoral natif ; 2) un module d’ancrage à la
membrane ; et 3) un ou plusieurs modules de signalisation intracellulaire permettant
l’activation des LTc (Figure
1) [5,
6] (→).
(→) Voir la Synthèse de V. Catros, m/s n° 4, avril 2019, page 316
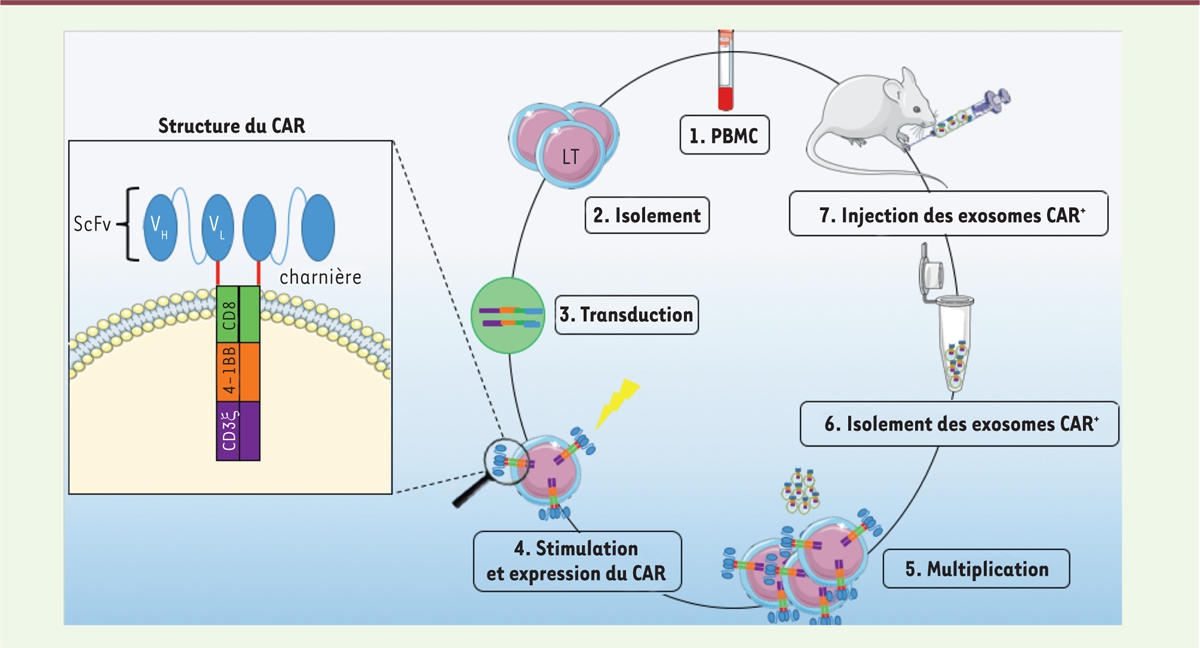
 | Figure 1.Grandes étapes du modèle expérimental de la thérapie
cellulaire mise en place par Wen Yan Fu et al. [8]. 1
et 2. Les lymphocytes T sont isolés à partir
d’un prélèvement sanguin de patients donneurs sains.
3. Les lymphocytes T sont ensuite
transduits in vitro avec un vecteur lentiviral
contenant les gènes codant le récepteur CAR. 4 et
5. Les cellules T CAR + en culture
sont stimulées afin qu’elles se multiplient et libèrent leurs exosomes.
6. Les exosomes CAR +
sont isolés à partir du surnageant de culture des CAR-T
cells par centrifugation. 7.
Les exosomes CAR + sont injectés par voie intraveineuse dans
des souris ayant reçu une xenogreffe de cellules tumorales exprimant
l’antigène pour lequel ces exosomes sont spécifiques. |
Les cellules ainsi modifiées sont appelées CAR-T cells et ont la
capacité de reconnaître spécifiquement un antigène à la surface de la cellule
tumorale induisant leur activation et la destruction de la tumeur, indépendamment de
toute autre interaction cellulaire. Les premières CAR T-cells à avoir fait l’objet d’un développement
clinique ont été utilisées pour le traitement de tumeurs hématologiques et étaient
dirigées contre la molécule CD19 exprimée par les lymphocytes B (CAR-T
cells anti-CD19). Les résultats obtenus montrant un taux de réponse
globale de l’ordre de 50 à 90 % chez les patients réfractaires aux autres lignes de
traitement ont conduit à l’approbation par la FDA (Food and Drug
Administration), en 2017 et 2018, de deux thérapies utilisant des
CAR-T cells anti-CD19 [6]. Malgré une efficacité démontrée pour ces types de tumeurs, l’application
des CAR-T cells aux tumeurs solides s’avère plus difficile en
raison des nombreuses contraintes associées au microenvironnement tumoral (MET). Les
tumeurs solides sont effectivement protégées par des barrières physiques, limitant
la migration et l’infiltration in situ des CAR-T
cells. De plus, le pH acide, l’hypoxie et le manque de nutriments au
cœur de la tumeur, associés à l’établissement d’un microenvironnement
immunosuppresseur, s’opposent à la multiplication et à l’activité de ces lymphocytes
modifiés [6,7]. En conséquence, une meilleure compréhension
de la biologie des CAR-T cells pour accroître leur potentiel
thérapeutique dans les tumeurs solides et, par ailleurs, la limitation des toxicités
sévères de cette thérapie sont des objectifs poursuivis par de nombreux chercheurs
aujourd’hui. |
Les exosomes dérivés des CAR-T cells comme mini-versions de ces cellules
tueuses Dernièrement, Wen Yan Fu et ses collaborateurs ont découvert et démontré que les
CAR-T cells libèrent dans le milieu extracellulaire des
vésicules, ou exosomes, contenant le récepteur CAR et dotés d’une activité
cytotoxique. Cela leur a permis d’envisager ces exosomes comme une alternative aux
thérapies cellulaires [8]. Les exosomes sont
un type de petites vésicules extracellulaires d’origine endosomale, normalement
impliquées dans la communication intercellulaire. Ils ont récemment été définis
comme de « mini-versions » de leurs cellules mères car leur contenu est fortement
corrélé avec l’état physiologique de la cellule dont ils sont issus [9]. Leur rôle dans la réponse
immunitaire cytotoxique a par ailleurs été mis en évidence récemment. Dans cette étude, l’équipe a construit deux types de CAR reconnaissant les antigènes
tumoraux, Her2 (human epidermal growth factor receptor 2) et EGFR
(epidermal growth factor receptor), et les ont transduits dans
des LTc humains (Figure 1, étapes 1 à
3). Leurs domaines extracellulaires sont composés d’un scFv dérivé
d’anticorps monoclonaux reconnaissant Her2 (trastuzumab) ou EGFR (cetuximab). Une
région charnière et un domaine transmembranaire dérivés de la molécule CD8 font le
lien avec deux domaines, 4-1BB et CD3ζ, nécessaires à l’activation du LTc
(Figure 1, étape 4).
Après avoir validé la spécificité et le potentiel anti-tumoral de leurs
CAR-T cells in vitro, les auteurs ont isolé les exosomes à
partir du surnageant de culture de ces cellules. Ils ont observé que ces exosomes,
que nous nommerons exosomes CAR+, portent le CAR issu des CAR-T
cells d’origine, et que leur production par les CAR-T
cells est dépendante de l’activation et de la stimulation de ces
dernières par les antigènes Her2 ou EGFR. Se questionnant sur l’activité de ces
exosomes face aux cellules tumorales, ils ont constaté, d’abord in
vitro, que ces exosomes exerçaient une activité cytotoxique
antigène-dépendante, comparable à celle des CAR-T cells. De plus,
l’injection répétée de différentes doses des exosomes in vivo à des
souris portant des tumeurs exprimant Her2 ou EGFR, sur une période de 13 semaines
suivie de 4 semaines de récupération (Figure
1, étapes 6-7), leur a permis de valider non seulement
l’efficacité anti-tumorale du traitement mais également l’absence de toxicité, même
à la dose la plus élevée. |
Une efficacité similaire, la toxicité en moins L’équipe s’est ensuite interrogée sur les avantages de l’utilisation d’exosomes
dérivés de CAR-T cells par rapport à l’utilisation de cellules
entières. Précédemment, il avait été montré que le potentiel cytotoxique des
CAR-T cells pouvait être influencé par le MET. En effet, tout
comme les cellules tumorales, certaines cellules immunitaires du MET (telles que les
tumor-associated macrophages et les myeloid-derived
suppressor cells) expriment un ligand, PD-L1 (programmed
death-ligand 1) qui interagit avec son récepteur inhibiteur, PD-1
(programmed death-1), présent à la surface des LTc et des
CAR-T cells (Figure 2, encadré du
haut). Une telle interaction provoque l’anergie de ces CAR-T
cells et donc l’inhibition de leur effet thérapeutique. Les auteurs ont
découvert que les exosomes n’expriment pas PD-1 à leur surface (Figure 2, encadré du bas). La
présence de son ligand PD-L1, dans le MET, n’a donc aucun effet sur leur
cytotoxicité.
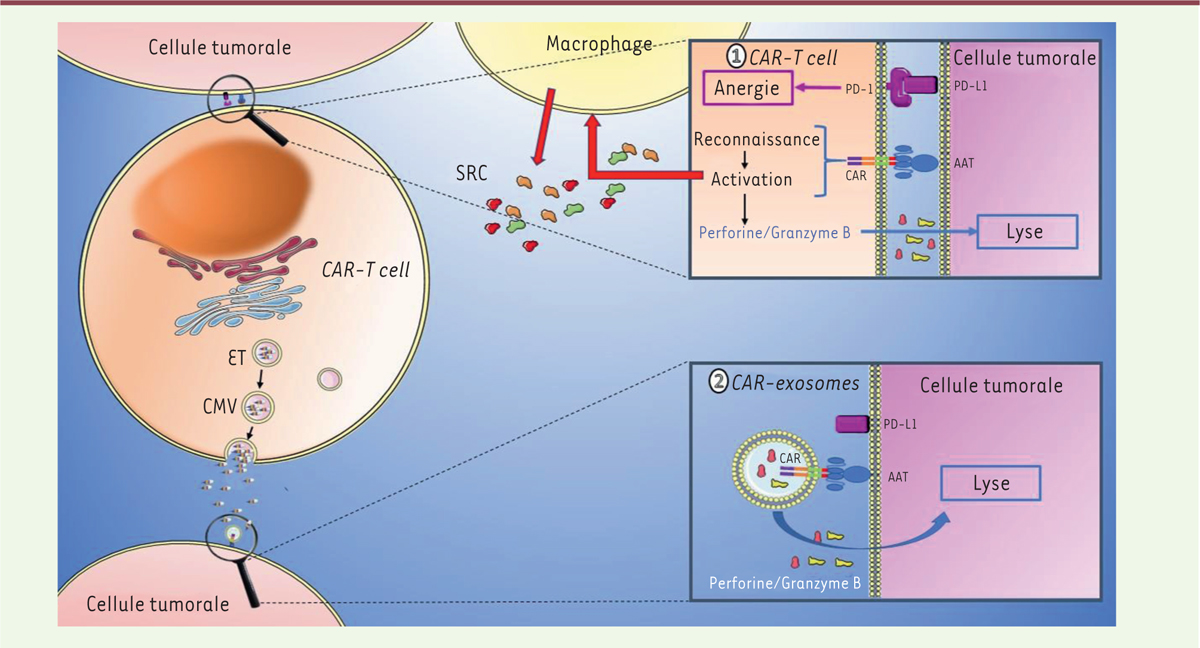
 | Figure 2. CAR-T cells versus CAR-exosomes. 1. Les
CAR-T cells reconnaissent l’antigène associé à la
tumeur (AAT) via leur récepteur antigénique chimérique
(CAR). Cette interaction entraîne, d’une part, leur activation et la
libération de perforine et granzyme B induisant la mort des cellules
tumorales et, d’autre part, la sécrétion de cytokines pro-inflammatoires
dans le microenvironnement tumoral. Ces cytokines pro-inflammatoires
activent les macrophages qui en produiront davantage, induisant ainsi un
syndrome de relargage de cytokine (SRC). Les cellules tumorales
expriment PD-L1 qui se lie à PD-1 présent à la surface des CAR-T
cells induisant une anergie de ceux-ci. 2. Les exosomes-CAR+ proviennent
d’invaginations de la membrane de l’endosome tardif (ET) qui formera le
corps multivésiculaire (CMV) avant de fusionner avec la membrane
plasmique et relarguer les exosomes dans le microenvironnement tumoral.
Ils provoquent la lyse des cellules tumorales après reconnaissance de
l’antigène associé à la tumeur (AAT) via leur CAR et la
libération de molécules cytotoxiques, la perforine et le granzyme B. Les
exosomes CAR n’entraînent pas de SRC et n’expriment pas le récepteur
inhibiteur PD-1. |
L’injection de CAR-T cells est à l’origine du syndrome de relargage
de cytokines (SRC), d’une toxicité majeure, caractérisé par la libération massive de
cytokines pro-inflammatoires (IFN[interféron]-γ, IL[interleukine]-2 et IL-6, entre
autres) par les CAR-T cells et les cellules du MET (Figure 2, encadré du haut). Le SRC
entraîne des effets variables allant de symptômes pseudo-grippaux jusqu’à la mort
[6]. Utilisant un modèle de tumeur
exprimant l’antigène ErBb, les auteurs de l’étude ont observé que l’injection de
CAR-T cells anti-ErBb induit une toxicité aiguë conduisant à la
mort des souris 48h après l’injection, associée à de fortes concentrations sériques
d’IL-6, IL-2 et d’IFN-γ, confirmant l’établissement d’un SRC causé par les
CAR-T cells. En revanche, le traitement des souris avec les
exosomes issus de ces mêmes CAR-T cells anti ErBb n’est associé à
aucun signe visible de toxicité, ce qui confirme l’intérêt thérapeutique que
représente l’utilisation des exosomes dérivés de CAR-T cells (Figure 2, encadré du bas). |
Les exosomes CAR+ : une perspective encourageante pour le traitement des tumeurs
solides La thérapie CAR-T cells est une approche efficace pour le traitement
des tumeurs hématologiques mais, en raison d’un succès modéré dans les tumeurs
solides, elle nécessite de nouveaux développements. L’utilisation des propriétés des
exosomes produits par les CAR-T cells, exerçant les mêmes fonctions
effectrices que les cellules dont ils sont issus, pourrait être une alternative de
choix pour contrer les limites des cellules CAR-T grâce à leur
toxicité plus faible et à leur capacité à éviter certains mécanismes suppressifs
exercés par la tumeur (Figure
2). Plus généralement, un grand nombre de chercheurs
s’intéressent aux possibilités qu’ouvre l’étude de la structure et de la fonction
des exosomes à visée thérapeutique ou diagnostique dans différents contextes
pathologiques [10]. En
effet, plusieurs études ont identifié les exosomes comme de véritables entités
effectrices ou comme de potentiels systèmes de délivrance de médicaments qui, grâce
à leur taille nanométrique et à leur spécificité cellulaire, peuvent infiltrer de
manière ciblée des milieux non permissifs aux cellules. Par ailleurs, leurs contenus
s’imposent comme des biomarqueurs de maladies facilement identifiables dans divers
liquides biologiques. Cependant, bien qu’utiliser les exosomes en thérapie
cellulaire semble très séduisant, de nombreux points restent à éclaircir concernant
leur biologie. Alors, à vos pipettes ! |
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
1. Bruchard
M,
Ghiringhelli
F.
Microenvironnement tumoral : cellules régulatrices et
cytokines immunosuppressives . Med Sci
(Paris).
2014; ; 30 :
:429.–435. 2. Fridman
WH,
Sautès-Fridman
C. Le
microenvironnement tumoral : matrice nourricière, champ de bataille et cible
thérapeutique des cancers . Med Sci (Paris).
2014; ; 30 :
:359.–365. 3. Fu
C,
Jiang
A. Dendritic cells
and CD8 T cell immunity in tumor microenvironment .
Front Immunol.
2018; ; 9 : :3059.. 4. Gross
G,
Waks
T,
Eshhar
Z. Expression of
immunoglobulin-T-cell receptor chimeric molecules as functional receptors
with antibody-type specificity . Proc Natl Acad Sci
USA.
1989; ; 86 :
:10024.–10028. 5. Srivastava
S,
Riddell
SR. Engineering
CAR-T cells: design concepts . Trends
Immunol.
2015; ; 36 :
:494.–502. 6. Catros
V. Les CAR-T cells,
des cellules tueuses spécifiques d’antigènes tumoraux : de nouvelles
générations pour le traitement des tumeurs solides .
Med Sci (Paris).
2019; ; 35 :
:316.–326. 7. Bagley
SJ,
O’Rourke
DM. Clinical
investigation of CAR T cells for solid tumors: lessons learned and future
directions . Pharmacol Ther.
2020;; 205 :
:107419.. 8. Fu
W,
Lei
C,
Liu
S, et al.
CAR exosomes derived from effector CAR-T cells have potent
antitumour effects and low toxicity . Nat
Commun.
2019; ; 10 :
:1.–12. 9. Zhang
Y,
Liu
Y,
Liu
H,
Tang
WH. Exosomes:
biogenesis, biologic function and clinical potential .
Cell Biosci.
2019;; 9. 10. Barile
L,
Vassalli
G. Exosomes: therapy
delivery tools and biomarkers of diseases . Pharmacol
Ther.
2017; ; 174 :
:63.–78. |