| |
| Med Sci (Paris). 36(6-7): 659–661. doi: 10.1051/medsci/2020117.Le microbiote : promoteur de la différenciation des
lymphocytes T CD8 mémoires Anthony Mainguy,1a Clara-Eva Paquereau,2b Paul Stys,1c and Signe Hässler3d 1Master 2 Immunologie Systémique et Intégrative (i2s),
Mention BMC, Sorbonne Université, Paris,
France. 2Master 2 Immunologie Translationnelle et Biothérapie (ITB),
Mention BMC, Sorbonne Université, Paris,
France. 3Sorbonne Université, UFR927 et Sorbonne Université, Inserm
UMR 959, Immunologie-Immunopathologie-Immunotherapie (i3),
Paris,
France. MeSH keywords: Animaux, Acide butyrique, Lymphocytes T CD8+, Différenciation cellulaire, Régime alimentaire, Fibre alimentaire, Humains, Immunité innée, Mémoire immunologique, Activation des lymphocytes, Souris, Microbiote, sang, métabolisme, effets des médicaments et substances chimiques, immunologie, physiologie, pharmacologie |
Le microbiote désigne l’ensemble des micro-organismes tels que les bactéries, les
champignons, les virus et les parasites non pathogènes qui colonisent les surfaces de
l’hôte en contact avec le milieu extérieur. L’émergence des études du microbiote a
permis de mettre en avant son influence sur le fonctionnement des défenses immunitaires
de l’hôte. Le système immunitaire (SI) est divisé en deux parties : l’immunité innée,
immédiate mais peu spécifique, ainsi que l’immunité adaptative, plus lente à se mettre
en place mais plus efficace par son mécanisme d’action, le ciblage antigénique. Les lymphocytes T (LT) forment une population hétérogène de cellules immunitaires
impliquées dans les réponses adaptatives. Les précurseurs hématopoïétiques sont issus de
la moelle osseuse, ils poursuivent leur développement dans le thymus puis résident à
l’état naïf dans les organes lymphoïdes secondaires, en attente d’une activation
antigénique. Les LT se subdivisent en deux grands groupes cellulaires : les LT CD4+
auxiliaires qui participent à l’activation de certaines cellules de l’immunité
(lymphocytes B, LT CD8+, macrophages, etc.) ainsi qu’à l’enclenchement de
l’immunité à médiation humorale, tandis que les LT CD8+ sont impliqués dans
la réponse à médiation cellulaire grâce à leur activité cytotoxique. De nombreuses
sous-populations existent au sein de ces deux groupes, comme les LT CD4+
régulateurs (TREG) issus du développement thymique ou d’une différenciation
plus tardive en périphérie, ainsi que les LT mémoires (TM) issus des cellules
effectrices. Les TREG ont un rôle immunosuppresseur et peuvent être assimilés
à des modulateurs du système immunitaire. Les TM sont des cellules à longue
durée de vie, indispensables à l’activation du SI en cas de seconde infection par le
même agent pathogène. |
Relation entre immunité et microbiote La comparaison entre des modèles murins dépourvus de la totalité de leur microbiote
(GF pour germ-free), ou d’un seul ou plusieurs pathogènes
spécifiques (SPF pour specific pathogen-free) a permis d’étudier
les interactions entre le microbiote et l’immunité de l’hôte. Une absence de flore
intestinale est associée à un déficit immunitaire, caractérisé par un défaut de
différenciation et de prolifération des TREG CD4+ [1,2]. De plus, le microbiote est impliqué dans
l’activation et l’activité cytotoxique des LT CD8+ [3] ainsi que dans la différenciation et
le métabolisme des TM CD8+ [4]. Afin d’expliquer cet impact sur le SI,
certaines études se sont intéressées en particulier aux fonctions métaboliques
assurées par le microbiote. Ainsi, il a été démontré que la fermentation de fibres
alimentaires impliquait l’intervention de souches bactériennes particulières et
aboutissait à la formation de certains métabolites, dont les acides gras à chaîne
courte (AGCC) [1]. Une étude récente s’est particulièrement intéressée au potentiel rôle des AGCC dans
la différenciation des LT CD8+ en cellules mémoires [5]. Dans cette étude, des LT spécifiques
d’une glycoprotéine du virus Herpès simplex (HSV) et activés préalablement
in vitro avec l’antigène correspondant, sont injectés par voie
sanguine dans des souris SPF soumises ou non à un régime riche en fibres pendant les
cinq semaines précédant l’injection des LT. La poursuite d’un régime riche en fibres
intensifie la réponse mémoire développée après une restimulation avec l’antigène
HSV. Chez les souris suivant ce régime particulier, cette réponse mémoire est
caractérisée par une meilleure prolifération des LT CD8+ effecteurs
dérivant des TM CD8+, ainsi que par une production accrue de
médiateurs solubles tels que l’IFN(interféron)-g, une cytokine impliquée dans la
réponse antivirale [5]. De plus, d’autres
expériences in vivo effectuées dans le cadre de cette étude
montrent que la réponse mémoire de LT CD8+ déficients pour les récepteurs
GPR (G protein-coupled receptors) 41 et GPR43, spécifiques des
AGCC, est plus faible que celle de LT CD8+ exprimant ces récepteurs. Ces
expériences suggèrent ainsi que les effets cellulaires des AGCC nécessitent une
interaction avec ces récepteurs [5]. |
Le butyrate favorise la différenciation des LT CD8+ en cellules mémoires Le suivi d’un régime riche en fibres a pour conséquence d’augmenter d’un facteur 100
la concentration sanguine du butyrate, un AGCC. Pour mimer les conditions observées
in vivo, des LT CD8+ ont été exposés in
vitro à un taux élevé de butyrate. Les cellules ainsi stimulées
montrent une meilleure capacité de réponse à l’IL(interleukine)-15 et sur-expriment
le facteur de transcription FoxO1. Ce facteur est impliqué dans la modulation du
métabolisme énergétique cellulaire et est caractéristique de la différenciation en
cellules mémoires [4]. Simultanément, la
prolifération des T CD8+ activés est réduite. Ces différentes
caractéristiques correspondent à la description d’un phénotype de cellules mémoires
[5].
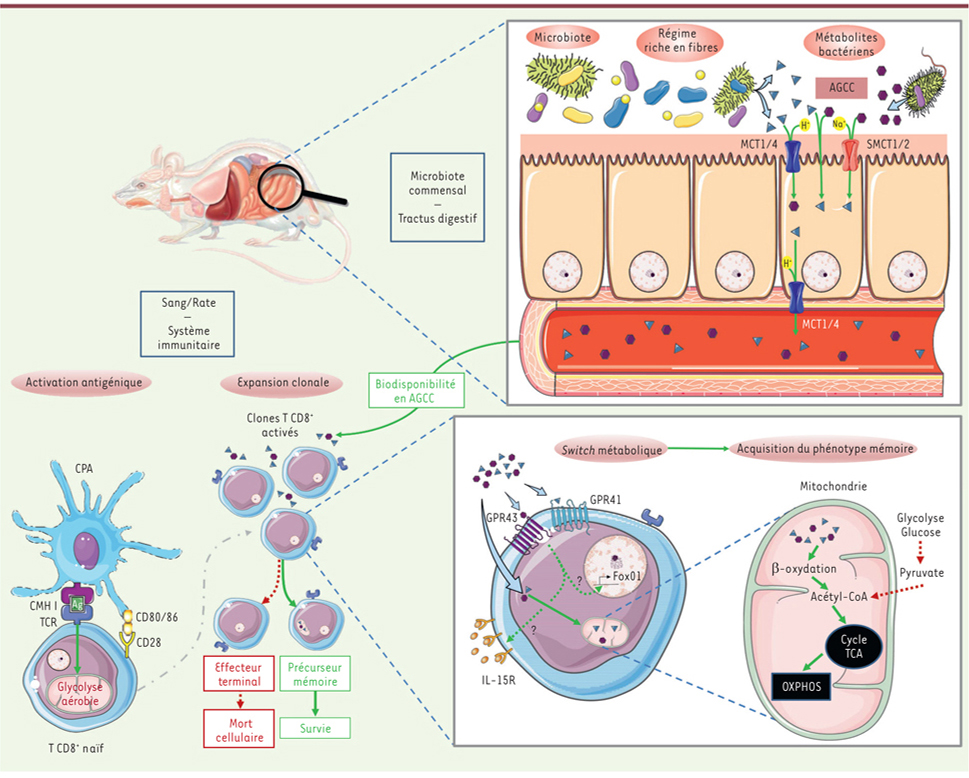
 | Figure 1. Implication des acides gras à chaînes courtes issus du
métabolisme des bactéries microbiotiques dans l’induction d’un
phénotype mémoire des lymphocytes T
CD8+. Les AGCC peuvent passer
l’épithélium intestinal et se retrouver dans la circulation sanguine où
ils peuvent être utilisés par les cellules. Cette absorption s’effectue
de manière passive au travers de la membrane épithéliale, ou active par
le biais des co-transporteurs ioniques. Les AGCC assimilés par les LT
CD8+ induisent des modifications métaboliques
privilégiant la β-oxydation des acides gras. Ce switch métabolique
participe à la différenciation en LT mémoire. AGCC : acide gras à
chaînes courtes ; MCT1 et MCT4 : monocarboxylate transporter 1 et 4 ;
SMCT1 et SMCT2 : sodium-coupled monocarboxylate transporter 1 et 2 ; CPA
: cellule présentatrice d’antigène ; GPR43 et GPR41 : récepteur aux AGCC
43/41 ; cycle TCA : cycle de Krebs ; OXPHOS : phosphorylation
oxydative. |
Des analyses transcriptomiques comparant les profils d’expression génique des LT
CD8+ spécifiques activés transférés dans des souris SPF ou des LT
CD8+ transférés dans des souris GF ont montré qu’une centaine de
gènes impliqués dans la différenciation mémoire sont significativement surexprimés
dans les T CD8+ transférés dans les souris SPF. En lien avec ce résultat,
le transcriptome des LT CD8+ cultivés dans un milieu enrichi en butyrate
montre également une augmentation de l’expression de ces gènes. Une partie des gènes
surexprimés dans les LT CD8+ transférés dans les souris SPF codent
notamment des protéines de complexes mitochondriaux et des transporteurs
d’électrons, ce qui suggère un lien entre le microbiote (et par extension la
présence d’AGCC) et la différenciation des LT CD8+ en cellules mémoires
via une modulation du métabolisme énergétique de ces cellules
[5]. |
Profil T et signature métabolique La production d’adénosine triphosphate (ATP) est une fonction essentielle de toutes
les cellules de notre organisme, y compris des LT. Cette production est issue de
différentes voies métaboliques en fonction de la biodisponibilité des substrats
énergétiques dans le microenvironnement cellulaire. De nombreuses études ont
démontré l’existence de changements dynamiques dans le métabolisme énergétique des
lymphocytes T selon leur état d’activation et leur stade de différenciation. Ainsi,
une cellule activée à la suite d’une rencontre antigénique va privilégier un
métabolisme centré sur l’utilisation du glucose et l’accumulation d’une biomasse
nécessaire à la prolifération cellulaire (glycolyse aérobie), tandis qu’une cellule
naïve quiescente sera caractérisée par un métabolisme basal globalement
non-glycolytique [6]. Après résolution d’une infection, le système immunitaire subit une phase de
contraction correspondant à une réduction significative du nombre de lymphoytes T
effecteurs (TEFF). Il s’ensuit une transition vers le phénotype
TM, gouvernée par des mécanismes complexes partiellement élucidés à
l’heure actuelle. Cependant, des études ont apporté quelques précisions quant au
rôle du métabolisme énergétique dans l’induction des TM. En effet, une
communication (switch), métabolique, passant d’une production
quasi-exclusivement glucose-dépendante (biosynthèse) à un métabolisme fondé sur
l’oxydation d’acide gras (AG) (β-oxydation ou FAO, fat acid
oxydation) faciliterait cette transition. La FAO permet la production
d’un substrat énergétique directement incorporable dans le cycle de Krebs :
l’acétyl-CoA. Ce substrat est indispensable pour générer les transporteurs
d’électrons, le FADH2 et le NADH utilisés dans la chaîne respiratoire mitochondriale
lors de la phosphorylation oxydative, réaction aboutissant à la bio-synthèse d’ATP
[7]. Comme nous l’avons présenté auparavant, la β-oxydation des AG est une voie
privilégiée dans la transition des TEFF en TM. De ce fait, le
microbiote pourrait fournir une source de substrat à base d’AGCC, facilitant cette
transition TEFF en TM. Pour tester cette hypothèse, des LT
CD8+ activés ont été mis en culture avec du butyrate marqué au
13C afin de suivre son incorporation dans les différentes voies
métaboliques cellulaires. Ce dernier est retrouvé en quantité importante dans tous
les métabolites intermédiaires du cycle de Krebs [5]. Cela confirme donc que le butyrate, et par extension les AGCC,
peuvent servir de substrat énergétique aux LT CD8+ et induire de façon
directe ou indirecte un switch métabolique participant à la
différenciation des TEFF en TM comme décrit précédemment. Le microbiote est un système complexe assurant l’immuno-modulation des réponses
immunitaires des LT. En effet, ces récents résultats démontrent son implication dans
la différenciation et la prolifération des lymphocytes T CD8+ mémoires
via les AGCC issus de la fermentation microbiotique de fibres.
Cette propriété des médiateurs solubles offre des pistes intéressantes pour
l’optimisation des stratégies vaccinales. Alors que la recherche actuelle se
focalise principalement sur l’évolution des vecteurs vaccinaux ou l’usage
d’adjuvants, les produits du microbiote pourraient jouer un rôle dans
l’établissement d’une mémoire T CD8+ protectrice durable suite à une
vaccination [5]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
1. Arpaia
N,
Campbell
C,
Fan
X, et al.
Metabolites produced by commensal bacteria promote peripheral
regulatory T-cell generation . Nature.
2013; ; 504 :
:451.–455. 2. Smith
PM,
Howitt
MR,
Panikov
N, et al.
The microbial metabolites, short-chain fatty acids, regulate
colonic Treg cell homeostasis . Science.
2013; ; 341 :
:569.–573. 3. Trompette
A,
Gollwitzer
ES,
Pattaroni
C, et al.
Dietary fiber confers protection against flu by shaping Ly6c-
patrolling monocyte hematopoiesis and CD8+ T cell
metabolism . Immunity.
2018; ; 48 :
:992.–1005. 4. Kazuo
T,
Sadaaki
S,
Satoh
T, et al.
Role of the indigenous microbiota in maintaining the
virus-specific CD8 memory T cells in the lung of mice infected with murine
cytomegalovirus . J Immunol.
2007; ; 178 :
:5209.–5216. 5. Bachem
A,
Makhlouf
C,
Binger
KJ, et al.
Microbiota-derived short-chain fatty acids promote the memory
potential of antigen-activated CD8+ T cells .
Immunity.
2019; ; 51 :
:285.–297. 6. Greiner
EF,
Guppy
M,
Brand
K. Glucose is
essential for proliferation and the glycolytic enzyme induction that
provokes a transition to glycolytic energy production .
J Biol Chem.
1994; ; 269 :
:31484.–31490. 7. Pearce
EL,
Walsh
MC,
Cejas
PJ, et al.
Enhancing CD8 T-cell memory by modulating fatty acid
metabolism . Nature.
2009; ; 460 :
:103.–107. |