| |
| Med Sci (Paris). 36(6-7): 662–664. doi: 10.1051/medsci/2020118.Les CAR-T cells à NKG2D en
immunothérapie contre le carcinome hépatocellulaire Gilles Roussine Codo1* and Sarra Khennas1** 1Master 2 Immunologie Intégrative et Systémique, Mention BMC,
Sorbonne Université, Paris, France. 2Master 2 Immunologie Translationnelle et Biothérapies,
Mention BMC, Sorbonne Université, Paris,
France. MeSH keywords: Animaux, Carcinome hépatocellulaire, Humains, Immunothérapie adoptive, Tumeurs du foie, Sous-famille K des récepteurs de cellules NK de type lectine, Récepteurs chimériques pour l'antigène, Lymphocytes T, Résultat thérapeutique, immunologie, métabolisme, thérapie, méthodes, génétique, physiologie |
Cellules CAR-T dans les cancers : quelles avancées ? Les CAR-T cells, pour chimeric antigen receptor T
cells, sont des lymphocytes T (LT) autologues portant un récepteur
construit par ingénierie génétique, spécifique d’un antigène tumoral. Le CAR est une
protéine de fusion comportant 1) un domaine extracellulaire de fixation à l’antigène
(Ag) composé d’un fragment d’anticorps appelé scFv (pour single chain
fragment variable), contenant un domaine VH et un domaine VL associés
par un polypeptide ; 2) un domaine intracellulaire composé d’un ou de deux domaines
de co-stimulation activatrice CD28, OX40/CD134 ou 4-1BB/CD137, associés à un domaine
de signalisation, la chaîne ζ du CD3 [1]. Les CAR-T cells peuvent reconnaître
l’antigène indépendamment d’un processus de présentation de peptides par les
molécules du CMH (complexe majeur d’histocompatibilité), ce qui est avantageux pour
les défenses contre les tumeurs, qui peuvent exprimer des niveaux faibles des
molécules du CMH [1]. Depuis leur génération en 1989 [2] (→) les CAR-T cells ont fait leurs
preuves, particulièrement dans les hémopathies malignes avec l’approbation en 2017
par la FDA (food and drug administration) de la commercialisation
du tisagenlecleucel pour le traitement des leucémies aiguës lymphoblastiques chez
l’enfant et le jeune adulte, et de l’axicabtagene ciloleucel dans les lymphomes
diffus à grandes cellules B [3,4]. Dans les
tumeurs solides, les effets bénéfiques des CAR-T cells sont limités
en raison d’une hétérogénéité antigénique tumorale rendant difficile la sélection
d’une cible anti-tumorale pertinente, de la présence de LT du patient
dysfonctionnels et surtout d’un microenvironnement tumoral (MET) défavorable au
déclenchement d’une réponse anti-tumorale efficace, en empêchant la migration et
l’infiltration de cellules immunocompétentes au sein de la tumeur et en favorisant
en parallèle le recrutement de cellules immunosuppressives [3,4]. Autant d’obstacles
qu’il faudra franchir afin de rendre ces CAR-T cells fonctionnelles
dans les cancers solides, notamment par l’amélioration du ciblage des cellules, la
définition d’une structure CAR adaptée et d’une cible antigénique adéquate [4]. Dans cette optique, la technologie CAR-T
NKG2D ciblant des ligands de NKG2D, des Ag surexprimés par une grande variété de
tumeurs, a été développée (Tableau
I) [5].
Des études précliniques ont démontré l’efficacité de ces cellules modifiées à
détruire les cellules tumorales issues de différents types de cancers [4]. Cette cytotoxicité est associée à une
production de cytokines pro-inflammatoires, telle que l’IFN(interféron)-γ et
l’IL(interleukine)-13 par les LT cytotoxiques et les cellules NK (natural
killer), dans le MET [5].
(→) Voir la synthèse de V. Catros, m/s n° 4, avril 2019, page 316
Tableau I
| Tumeurs solides |
NKG2DL |
| Gliomes primaires |
↑↑ MICA, ↑↑ ULBP1-3, MICB |
| Carcinome ovarien |
↑↑ ULBP2, MICA, ULBP1, 3 |
| Les tumeurs primaires de carcinomes (poumon, sein,
rein, foie, prostate, ovaire et colon), melanome |
↑↑ MICA |
Profil d’expression des ligands de NKGD2 (NKG2DL) sur certaines tumeurs
solides [ 7, 8]. |
|
NKG2D/NKG2DL dans la surveillance immunologique des tumeurs solides NKG2D est un récepteur activateur, exprimé par les cellules cytotoxiques de
l’immunité innée et adaptative telles que les cellules NK, NKT, les LT
CD8+ et les LTγδ. Parmi ses ligands, on trouve, chez l’homme, les
protéines ULBP (UL-16-binding proteins) et les molécules MIC
(MHC class-I-related molecule) A et B [6]. Généralement, ces ligands sont absents ou
très peu exprimés à la surface des cellules normales. En cas de stress cellulaire,
d’inflammation ou de transformation tumorale, on observe une surexpression de ces
ligands conduisant à l’activation de cellules effectrices NK et de certaines
sous-populations de LT CD8+
via NKG2D [7]. Cependant, les
tumeurs mettent en place un mécanisme d’échappement au système immunitaire, en
clivant et en libérant les NKG2DL. En effet, il a été observé une augmentation de la
concentration des NKG2DL dans le sérum de patients atteints de diverses tumeurs. Ces
ligands circulants se lient aux récepteurs présents à la surface des cellules NK et
CD8+, limitant ainsi leur effet cytotoxique direct sur la cellule
tumorale [7]. |
NKG2D/NKG2DL dans le carcinome hépatocellulaire : une cible anti-tumorale Le carcinome hépatocellulaire (CHC) est un cancer primitif du foie très agressif, qui
se développe dans 75 à 80 % des cas sur une maladie chronique comme la cirrhose
[9]. Il correspond à la
deuxième cause de mortalité liée au cancer dans le monde. Dans les premiers stades
de la maladie, la chirurgie a un effet bénéfique pour les patients, mais avec une
médiane de survie aux environs de 60 mois [10]. Aux stades plus avancés, la FDA a approuvé des inhibiteurs
de tyrosine kinases (ITK) dont le sorafénib en première ligne, le régorafénib ou le
cabozantinib en deuxième ligne. D’autres thérapies sont en cours d’approbation et
d’évaluation dans des essais cliniques. La stratégie de l’utilisation des
CAR-T cells, pour laquelle il est nécessaire d’identifier des
biomarqueurs candidats pour une prise en charge efficace du CHC, demeure peu
explorée. L’analyse comparative de profils transcriptomiques d’échantillons de foie
cancéreux de 32 patients et de tissus normaux, provenant de la base de données
The Cancer Genome Atlas, a révélé une surexpression du MICA/B
et ULBP 1, 2, 4 et 5 (NKG2DL) dans les échantillons de foie cancéreux. La
surexpression du MICA a été observée chez 23 patients (72 %) et celle de l’ULBP2
chez 31 patients (97 %), avec absence de ces marqueurs dans les tissus de patients
cirrhotiques non cancéreux [10]. Jusqu’à
présent, aucun des Ag cibles associés aux tumeurs hépatiques évalués dans le cadre
de thérapie à base de CAR-T cells n’a permis d’obtenir des réponses
thérapeutiques [10]. Cependant, les
observations décrites ci-dessus suggèrent que les NKGD2L pourraient être des
candidats intéressants pour une immunothérapie à base de CAR-T
cells NKG2D dans le CHC. En se fondant sur ces observations, une étude
récente de Sun et al., en 2019, a exploré l’efficacité d’une
construction particulière de CAR-T cells ciblant les ligands de
NKG2D dans un modèle préclinique de souris porteuses de xénogreffes de cellules
tumorales de CHC [10]. Les LT ayant servi à
la génération de CAR-T cells ont été isolés à partir de trois
donneurs sains et de deux patients présentant un CHC. Dans cette étude, les cellules
générées comportent le domaine extracellulaire du récepteur NKG2D pour les
CAR-T cells NKG2D, ou un scFv anti-CD19 pour les CAR-T
cells CD19 (témoins négatifs). Les deux constructions de CAR-T
cells NKGD2D et CAR-T anti-CD19 portent les mêmes domaines
intracellulaires composés du domaine de costimulation 4-1BB et du domaine de
signalisation ζ CD3 (Figure
1).
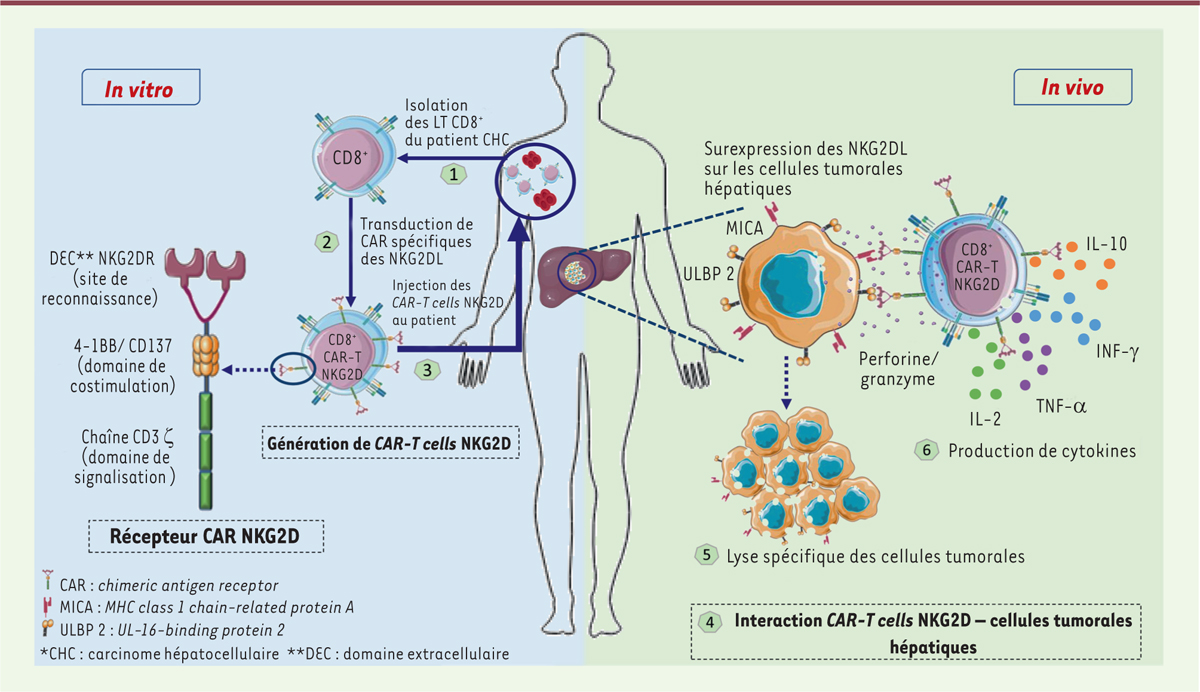
 | Figure 1. Génération, structure et interaction des CAR-T NKG2D avec
les cellules tumorales hépatiques dans le traitement du
carcinome hépatocellulaire (CHC). 1. Les LT
CD8+ du patient CHC sont isolés à partir du sang
périphérique. 2. Ces LT CD8+ sont modifiés
génétiquement afin d’exprimer un récepteur chimérique qui reconnaît
spécifiquement les ligands du récepteur NKG2D. Ce récepteur chimérique
est composé d’un domaine extracellulaire (le récepteur NKG2D) et deux
domaines intracellulaires (domaine de costimulation 4-1BB et domaine de
signalisation ζ CD3) 3. Une fois générés,
ces CAR-T cells NKG2D sont réinjectées au patient.
4. Les CAR-T
cells NKG2D vont ensuite interagir spécifiquement avec les
cellules tumorales hépatiques qui surexpriment NKG2DL au cours du
carcinome hépatocellulaire. 5. L’action
cytotoxique des CAR-T cells induit la lyse des cellules
tumorales. 6. Les CAR-T
cells vont produire également des cytokines telles que
l’IL-2, le TNF-α, l’IL-6, l’IL-10 et l’IFN-γ. |
|
Preuves expérimentales de l’efficacité des CAR-T cells NKG2D dans le carcinome
hépatocellulaire L’effet cytotoxique des différentes constructions de CAR T cells
générées a ensuite été analysé in vitro, en présence de trois
lignées cellulaires de CHC : SMMC-7721 et MHCC97H qui expriment fortement MICA et
ULBP2, et Hep3b qui les exprime faiblement. Les résultats révèlent que pour un ratio
effecteur : cible (E:T) de 8:1, les CAR-T cells CD19 n’induisent
aucune lyse des cellules des lignées testées alors que les CAR-T
cells NKG2D conduisent à la lyse de 100 % des cellules SMMC-7721 et
MHCC97H et de 30 % des cellules Hep3b NKG2DLlow. Une augmentation
significative de la production des cytokines TNF-α (tumor necrosis factor
alpha), IL-10, IL-2 et IFN-γ est observée quand les cellules de la
lignée SMMC-7721 sont mises en contact avec les CAR-T cells
NKG2D. Les résultats du test de cytotoxicité suggèrent que l’effet thérapeutique des
CAR-T cells NKG2D serait fortement dépendant du niveau
d’expression des NKG2DL. Dans le but de confirmer cette hypothèse, une surexpression
ectopique de NKG2DL a été induite à la surface des cellules Hep3b. Il a été observé
une lyse de 60 % contre 10 % pour les cellules de la lignée sauvage au même ratio
E:T. En parallèle, l’inhibition de l’expression des ligands, par transduction de
séquences tronquées shMICA et ULBP2 dans les cellules des lignées SMMC-7721 et
MHCC97H, diminue considérablement l’action cytotoxique des CAR-T
cells NKG2D. Cependant, cette activité cytotoxique reste conservée dans
le cas où un seul des deux ligands est absent. Les CAR-T cells
NKG2D ciblent donc directement les cellules malignes qui surexpriment un ou
plusieurs types de NKG2DL, couvrant ainsi l’hétérogénéité antigénique qui est
observée dans les tumeurs, tout en protégeant les cellules saines qui expriment
faiblement ces ligands. L’effet thérapeutique in vivo des CAR-T cells NKG2D
a ensuite été évalué dans des modèles de souris portant une xénogreffe de cellules
tumorales SMMC-7721. Les résultats ont montré que 100 % des souris ayant reçu la
thérapie CAR-T cells CD19 n’ont pas survécu plus de 27 jours, alors
que 100 % des souris traitées par les CAR-T cells NKG2D survivent
au-delà de 53 jours, avec plus de la moitié des souris traitées en complète
rémission et les autres présentant un faible résiduel de la masse tumorale. Parce
qu’une interaction directe entre les CAR-T cells et les cellules
tumorales est nécessaire à l’efficacité de la thérapie, la détection des CAR-T NKG2D
par marquage immunohistochimique (IHC) du domaine CD3-ζ, qu’elles expriment, réalisé
sur les xénogreffes et les tissus sains, a révélé une localisation préférentielle
des CAR-T cells NKG2D au sein de la tumeur. Partant de l’hypothèse que les lymphocytes des patients CHC peuvent présenter des
anomalies fonctionnelles, les auteurs ont testé dans un second temps les
CAR-T cells NKG2D générés à partir des LT de patients CHC,
in vitro sur les lignées cellulaires et in
vivo dans les souris portant les xénogreffes tumorales. Une activité
cytotoxique et un effet thérapeutique, comparables à ceux obtenus avec des
CAR-T cells des donneurs sains, ont été observés. En conclusion, les CAR-T cells NKG2D ciblent les antigènes (NKG2DL)
surexprimés presque exclusivement par les hépatocytes tumoraux au cours du CHC,
permettant d’obtenir un effet cytotoxique spécifique, et par conséquent moins de
toxicité et une protection des tissus sains, associée à une inhibition de la
prolifération tumorale. Ces résultats décrivent dans leur globalité l’activité
anti-tumorale de CAR-T cells NKG2D contre des cellules de lignées
de cellules hépato-carcinomateuses. Cependant, l’utilisation élargie de ce type
d’approche thérapeutique nécessite d’analyser plus amplement la toxicité des
CAR-T cells NKGD2 et leurs effets secondaires. De plus, il
s’avère nécessaire de prendre en considération les mécanismes d’échappement des
tumeurs, qui ont la capacité de cliver et de libérer les NKG2DL dans le sang, qui en
interagissant avec les récepteurs NKG2D des cellules cytotoxiques limitent leurs
actions, ce qui constitue une limite à l’utilisation thérapeutique des CAR-T
cells NKG2D [7]. Néanmoins, cette
étude est intéressante car elle vient contourner certains obstacles qui s’opposaient
à l’utilisation des CAR-T cells conventionnelles dans les tumeurs
solides, et offre une preuve scientifique de l’efficacité de ce type d’approche dans
le carcinome hépatocellulaire, ce qui ouvre un champ thérapeutique prometteur pour
le traitement de ce type de cancer très agressif. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
1. June
CH,
O’Connor
RS,
Kawalekar
OU, et al.
CAR-T cell immunotherapy for human cancer .
Science.
2018; ; 359 :
:1361.–1365. 2. Catros
V. Les CAR-T cells,
des cellules tueuses spécifiques d’antigènes tumoraux : de nouvelles
générations pour le traitement des tumeurs solides .
Med Sci (Paris).
2019; ; 35 :
:316.–326. 3. Schultz
L,
Mackall
C. Driving CAR T
cell translation forward . Sci Transl Med.
2019;; 11. 4. Castellarin
M,
Watanabe
K,
June
CH, et al.
Driving cars to the clinic for solid tumors .
Gene Ther.
2018; ; 25 :
:165.–175. 5. Sentman
CL,
Meehan
KR. NKG2D CARs as
cell therapy for cancer . Cancer J.
2014; ; 20 :
:156.–159. 6. El-Gazzar
A,
Groh
V,
Spies
T. Immunobiology and
conflicting roles of the human NKG2D lymphocyte receptor and its ligands in
cancer . J Immunol.
2013; ; 191 :
:1509.–1515. 7. Spear
P,
Wu
MR,
Sentman
ML, et al.
NKG2D ligands as therapeutic targets .
Cancer Immun.
2013; ; 13 : :8.. 8. Liu
H,
Wang
S,
Xin
J, et al.
Role of NKG2D and its ligands in cancer
immunotherapy . Am J Cancer Res.
2019; ; 9 :
:2064.–2078. 9. Blanc
JF,
Barbare
JC,
Baumann
AS, et al.
Carcinome hepatocellulaire . Thésaurus
National de Cancérologie Digestive.
2019. 10. Sun
B,
Yang
D,
Dai
H, et al.
NKG2D-BBz CAR-T eliminates hepatocellular cancer .
Cancer Immunol Res.
2019; ; 7 :
:1.–11. |