| |
| Med Sci (Paris). 36(6-7): 668–671. doi: 10.1051/medsci/2020120.Don’t worry, be healthy! Les effets
délétères du stress psychique sur la réponse aux thérapies
anti-tumorales Nassim Salem1* and Pierre-Emmanuel Foy2** 1Master 2 Immunologie Translationnelle et Biothérapies,
Mention BMC, Sorbonne Université, Paris,
France. 2Master 2 Immunologie Intégrative et Systémique, Mention BMC,
Sorbonne Université, Paris, France. MeSH keywords: Animaux, Anxiété, État de santé, Humains, Phénomènes du système immunitaire, Tolérance immunitaire, Souris, Tumeurs, Stress psychologique, Résultat thérapeutique |
Le système immunitaire, un élément clé de la réponse aux thérapies
anti-cancéreuses Depuis quelques années, cibler le système immunitaire afin de le rendre plus efficace
contre les tumeurs est une approche innovante et particulièrement prometteuse en
thérapie anti-cancéreuse. Dès le début du xx
e siècle, les travaux de Coley consistant à utiliser des extraits
bactériens chez des patients atteints de sarcome afin de stimuler leur réponse
anti-tumorale, ont mis en évidence le rôle clé de l’immunité adaptative dans le
contrôle de la croissance tumorale. Pour autant, il faut attendre les travaux de J.
Allison et T. Honjo sur les points de contrôle immunitaire ou immune
checkpoints pour voir apparaître une nouvelle classe d’immunothérapie
ciblant directement les cellules immunitaires afin de réactiver l’immunité
anti-tumorale. Ces deux chercheurs ont tous les deux été récompensés par le prix
Nobel de physiologie ou médecine en 2018 pour leur travaux sur les molécules CTLA-4
(cloné à Marseille en 1987) [1] et PD-1, les deux immune checkpoints les plus ciblés
en immunothérapie des cancers [11, 12]
(→). Malgré une efficacité chez des patients non répondeurs aux
thérapies conventionnelles dans des cancers de mauvais pronostic comme le mélanome
métastatique, moins de 20 % des patients répondent généralement à ces
immunothérapies. De nombreux défis restent donc à relever afin d’augmenter
l’efficacité de cette stratégie thérapeutique [2].
(→) Voir Les Repères (Nobel 2018) de J.L. Teillaud et W.H. Fridman et J.L.
Teillaud, m/s n° 4, avril 2019, pages 365 t 367
Récemment, des études ont montré que l’efficacité de certains traitements
conventionnels tumoricides (chimiothérapie, radiothérapie) repose aussi en partie
sur l’induction d’une réponse immunitaire anti-tumorale. En effet, ces traitements,
en induisant la destruction des cellules tumorales, peuvent entraîner la libération
de signaux de danger (ou DAMP, damage-associated molecular
patterns) qui activent eux-mêmes différents acteurs du système immunitaire,
notamment les cellules dendritiques : on parle de mort cellulaire immunogène [3]. L’homéostasie du système immunitaire est influencée par des facteurs intrinsèques
mais également extrinsèques dépendant de l’environnement. L’étude de ces
interactions permettrait d’optimiser l’efficacité des traitements utilisés dans le
cancer. Le système nerveux central et le système neuroendocrinien peuvent également
influencer le système immunitaire. En effet, l’expression de récepteurs de
neuropeptides par les cellules immunitaires ainsi que celle de récepteurs de
cytokines dans le cerveau illustrent bien cette communication bi-directionnelle. Les
hormones sexuelles, certaines hormones du métabolisme, les peptides opioïdes sont
autant de facteurs connus pour réguler le système immunitaire. Parmi toutes ces
substances biologiques, les médiateurs du stress psychique ont un impact non
négligeable qui semble délétère pour le système immunitaire [4]. Une récente méta-analyse montre que le
stress psychique pourrait constituer un facteur de risque dans l’apparition des
cancers [5]. Pourtant les
mécanismes biologiques et immunologiques impliqués ne sont pas clairement définis.
Ainsi, l’évaluation chez l’homme des effets de l’anxiété sur les réponses
immunitaires anti-tumorales induites par différentes thérapies anticancéreuses et
l’identification de moyens permettant de maîtriser ces effets est une approche
innovante et encourageante. Dans une étude récente, Yang et al. ont
exploré dans des modèles animaux l’impact de l’anxiété et de la variation de ses
médiateurs sur la réponse immunitaire anti-tumorale [6].
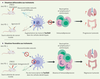 | Figure 1. Effets du stress psychique sur la réponse
anti-PD1. Impact de la surexpression du
transcrit Tsc22d3 sur la réponse immunitaire antitumorale. GC :
glucocorticoïdes |
|
Le stress induit une immunodépression favorable à la progression tumorale et
défavorable à l’efficacité des traitements anticancéreux Dans cette étude, la confrontation d’une souris agressive avec une souris normale
entraîne chez cette dernière un stress chronique de « défaite sociale » conduisant à
un état d’anxiété ou de dépression. Ce conditionnement semble provoquer un état
favorable à la progression tumorale dans les modèles étudiés (fibrosarcome, cancer
du poumon non à petites cellules et du côlon) et diminuer l’efficacité de certaines
chimiothérapies induisant une mort cellulaire immunogène, dont les sels de platine
ou les anthracyclines. La réduction de la progression tumorale après traitement avec
différentes immunothérapies, incluant l’utilisation d’un vaccin prophylactique
(composé de cellules tumorales mourantes) ou des anticorps bloquants anti-PD1, est
également diminuée chez les souris stressées par rapport aux souris contrôles. Ces résultats sont corroborés par l’analyse du microenvironnement tumoral. En effet,
l’analyse de l’infiltrat tumoral chez les souris stressées révèle une plus faible
infiltration des lymphoctyes T (LT) et des neutrophiles, deux populations
cellulaires dont le rôle anti-tumoral est clairement établi [7]. Les auteurs ont également observé chez ces
souris une augmentation des macrophages intra-tumoraux. En revanche, le nombre de
cellules dendritiques dans le microenvironnement tumoral ne semble pas impacté par
les conditions de stress. Les réponses Th1 et Th2 chez ces souris sont diminuées
alors qu’il n’y a pas de modification de la réponse régulatrice due aux lymphocytes
T régulateurs (Treg). Ce déséquilibre peut donc être à l’origine d’une réponse
immunosuppressive plus importante que la réponse effectrice anti-tumorale. De
manière plus globale, les taux de 46 médiateurs plasmatiques de la réponse
immunitaire incluant l’interféron gamma (IFN-g), qui est une cytokine
pro-inflammatoire importante dans la lutte anticancéreuse, sont diminués dans le
plasma des souris stressées, témoignant que l’immunodépression est systémique et
n’est pas restreinte au microenvironnement tumoral. |
L’augmentation du taux de glucocorticoïdes secondaire à un stress psychique
provoque une immunodépression Plusieurs médiateurs et neurotransmetteurs sont bien connus pour leur rôle dans la
physiopathologie du stress. Les taux de glucocorticoïdes1 augmentent lors d’un stress chronique ; à l’inverse, les taux
de sérotonine (hormone impliquée dans la régulation des humeurs et du sentiment de
bonheur) et de noradrénaline sont abaissés en situation de stress, chez l’homme et
chez la souris. Pour autant, Yang et al. ont montré que seule l’inhibition des
récepteurs des glucocorticoïdes chez les souris stressées (par injection d’un
antagoniste) permet de rétablir la réponse immunitaire anti-tumorale ainsi que
l’efficacité des immunothérapies et des chimiothérapies chez les souris stressées.
De plus, l’utilisation d’analogue des glucocorticoïdes chez des souris non stressées
réduit plusieurs fonctions immunitaires de manière similaire au stress décrit
précédemment, et semble avoir un effet négatif dans la survie de souris traitées par
différentes thérapies anticancéreuses. L’effet immunosuppresseur du stress psychique
semble donc spécifiquement lié aux voies de signalisation activées par les
glucocorticoïdes. |
Tsc22d3 : un facteur de transcription responsable de l’immunodépression induite
par le stress et les glucocorticoïdes Parallèlement, la défaite sociale modifie également la présentation antigénique,
mécanisme immunologique impliquant en particulier les cellules dendritiques et
nécessaire à l’initiation d’une réponse immunitaire adaptative. Des analyses
transcriptomiques par RNAseq ont révélé une signature génétique immunosuppressive
dans les cellules dendritiques (CD) infiltrant la tumeur des souris stressées avec
notamment une surexpression de Tsc22d3, un facteur de transcription inductible par
les glucocorticoïdes qui a un rôle anti-inflammatoire et immunosuppresseur. Cette
surexpression est perdue lorsque les souris sont traitées avec des antagonistes des
récepteurs des glucocorticoïdes, confirmant que la surexpression de Tsc22d3 est bien
régulée par ces derniers. Dans un modèle de souris ayant subi un stress et dans
lesquelles Tsc22D3 est absent, la réponse immunitaire est potentialisée : on observe
une meilleure efficacité des anti-PD1, une ré-expression d’IFN-g, une meilleure
capacité de présentation antigénique et une plus grande infiltration par des LT,
ainsi qu’une meilleure efficacité des immunothérapies ciblant PD-1. Remarquablement, une augmentation, dans les cellules du sang périphérique et dans les
CD intra-tumorales, de l’expression du facteur de transcription Tsc22d3 a également
été observée chez des patients atteints de cancers digestifs (œsophage, estomac,
côlon, rectum et pancréas), de cancer du poumon, ou de mélanome. Cette augmentation
est corrélée à un état psychique négatif, évalué par le questionnaire POMS
(Profile of Mood State) [8]. De plus, une forte expression de Tsc22d3 a été corrélée avec
un mauvais pronostic pour la survie des patients dans de nombreux types de cancer,
incluant le cancer du poumon et les carcinomes gastriques et colo-rectaux. On peut
donc penser que les résultats découverts chez la souris pourraient favoriser la mise
en place de stratégies thérapeutiques exploitables chez l’homme. |
Ces travaux, particulièrement précurseurs dans leur approche et leurs conclusions,
revêtent une importance particulière pour l’amélioration de la prise en charge des
patients cancéreux. Au-delà du bien être mental des patients, une prise en charge
psychologique de type psychothérapie ou par des moyens pharmacologiques pourrait
donc avoir un effet direct sur l’efficacité des traitements en diminuant l’impact
immunosuppresseur du stress. Ces approches ont d’ailleurs été évaluées dans des
modèles de lymphomes avec des résultats encourageants [9]. Ces résultats posent également la question
de la pertinence des glucocorticoïdes comme traitement adjuvant dans certains
cancers non hématologiques. En effet, les glucocorticoïdes sont classiquement
utilisés en complément des chimiothérapies pour réduire les douleurs et les
vomissements [10]. Les
données exposées ici laissent penser que la prise en charge de ces effets
secondaires par des glucocorticoïdes pourrait avoir un réel impact négatif sur le
traitement du cancer. Par ailleurs, il pourrait être intéressant d’évaluer l’effet
chez des patients atteints de cancer de certains antagonistes des récepteurs des
glucocorticoïdes déjà validés dans la maladie de Cushing (maladie caractérisée par
un hypercortisolisme chronique). Bloquer ce récepteur sur les cellules dendritiques
empêcherait les effets immunosuppresseurs des glucocorticoïdes. Cependant, les
glucocorticoïdes étant des hormones pléiotropiques, bloquer leurs récepteurs
pourrait conduire à des effets secondaires non négligeables. Enfin, pour identifier
de nouvelles cibles thérapeutiques, le transcrit Tsc22d3 peut être envisagé comme un
point de contrôle immunitaire (immune checkpoint) et son ciblage
(inactivation ou élimination) pourrait améliorer l’immunosurveillance anticancéreuse
et la réponse aux traitements. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Footnotes |
1. Brunet
JF,
Denizot
F,
Luciani
MF, et al.
A new member of the immunoglobulin
superfamily-CTLA-4 . Nature.
1987; ; 328 :
:267.–270. 2. Hodi
FS,
O’Day
SJ,
McDermott
DF, et al.
Improved survival with ipilimumab in patients with metastatic
melanoma . N Engl J Med.
2010; ; 363 :
:711.–723. 3. Kroemer
G,
Galluzzi
L,
Kepp
O,
Zitvogel
L. Immunogenic cell
death in cancer therapy . Annu Rev Immunol.
2012; ; 31 :
:51.–72. 4. Taub
D. Neuroendocrine
interactions in the immune system . Cell
Immunol.
2008; ; 252 :
:1.–6. 5. Batty
GD,
Russ
TC,
Stamatakis
E,
Kivimäki
M. Psychological
distress in relation to site specific cancer mortality: pooling of
unpublished data from 16 prospective cohort studies .
BMJ.
2017; ; 356 : :j108.. 6. Yang
H,
Xia
L,
Chien
J, et al.
Stress-glucocorticoid-TSC22D3 axis compromises therapy-induced
antitumor immunity . Nat Med.
2019; ; 25 :
:1428.–1441. 7. Schreiber
RD,
Old
LJ,
Smyth
MJ. Cancer
immunoediting: integrating immunity’s roles in cancer suppression and
promotion . Science.
2011; ; 331 :
:1565.–1570. 8. Baker
F,
Denniston
M,
Zabora
J, et al.
A POMS short form for cancer patients: psychometric and
structural evaluation . Psychooncology.
2002; ; 11 :
:273.–281. 9. Di Rosso
ME,
Sterle
HA,
Cremaschi
GA,
Genaro
AM. Beneficial
effect of fluoxetine and sertraline on chronic stress-induced tumor growth
and cell dissemination in a mouse model of lymphoma: crucial role of
antitumor immunity . Front Immunol.
2018; ; 9 : :1341.. 10. Pufall
MA. Glucocorticoids
and cancer . Adv Exp Med Biol.
2015; ; 872 :
:315.–333. 11. Teillaud
JL. L’immunothérapie
des cancers couronnée avec l’attribution du prix Nobel de Physiologie ou
Médecine à James Allison et Tasuku Honjo . Med Sci
(Paris).
2019; ; 35 :
:365.–366. 12. Fridman
WH,
Teillaud
JL. De la traversée
du désert au prix Nobel de Physiologie ou Médecine décerné à James Allison
et Tasuku Honjo : la longue marche de l’immunothérapie des cancers.
Entretien avec Wolf Hervé Fridman . Med Sci
(Paris).
2019;; 35 :
:367.–73. |


