Réduction des dommages associés à la consommation d’alcool
I. Consommations d’alcool : les risques, les dommages et leur environnement
2021
| ANALYSE |
2-
Mortalité, faibles consommations
et effets biologiques
Chaque année dans le monde, approximativement 3,3 millions de décès sont
imputables à la consommation nocive d’alcool, correspondant à 5,9 % de la
mortalité globale (World Health Organization,
2014 ). La
consommation d’alcool est l’un des principaux facteurs de risque de
morbidité dans le monde, représentant près de 10 % des décès parmi les
populations âgées de 15 à 49 ans (Griswold et coll.,
2018
). La
consommation d’alcool est l’un des principaux facteurs de risque de
morbidité dans le monde, représentant près de 10 % des décès parmi les
populations âgées de 15 à 49 ans (Griswold et coll.,
2018 ).
).
 ). La
consommation d’alcool est l’un des principaux facteurs de risque de
morbidité dans le monde, représentant près de 10 % des décès parmi les
populations âgées de 15 à 49 ans (Griswold et coll.,
2018
). La
consommation d’alcool est l’un des principaux facteurs de risque de
morbidité dans le monde, représentant près de 10 % des décès parmi les
populations âgées de 15 à 49 ans (Griswold et coll.,
2018 ).
).Le lien entre consommation d’alcool et santé est complexe car il dépend
notamment de la quantité consommée et du profil de consommation (Rehm et
coll., 2003a ; Naimi
et coll., 2013
; Naimi
et coll., 2013 ).
Ainsi, des effets sont observés après la consommation aiguë (l’intoxication)
et aussi après la consommation cumulée et chronique qui peut également être
rythmée par des épisodes d’intoxications de type binge drinking.
Selon l’OMS, la consommation épisodique et forte d’alcool correspond à la
consommation de 60 g d’éthanol pur (6 verres) en une occasion. Selon le
National Institute on Alcohol Abuse and Alcoholism (NIAAA), le
binge drinking correspond à la consommation rapide d’alcool avec
la recherche d’ivresse et a été défini plus précisément comme la
consommation entraînant une alcoolémie d’au moins 0,8 g/L en moins de deux
heures (National Institute on Alcohol Abuse and Alcoholism,
2004
).
Ainsi, des effets sont observés après la consommation aiguë (l’intoxication)
et aussi après la consommation cumulée et chronique qui peut également être
rythmée par des épisodes d’intoxications de type binge drinking.
Selon l’OMS, la consommation épisodique et forte d’alcool correspond à la
consommation de 60 g d’éthanol pur (6 verres) en une occasion. Selon le
National Institute on Alcohol Abuse and Alcoholism (NIAAA), le
binge drinking correspond à la consommation rapide d’alcool avec
la recherche d’ivresse et a été défini plus précisément comme la
consommation entraînant une alcoolémie d’au moins 0,8 g/L en moins de deux
heures (National Institute on Alcohol Abuse and Alcoholism,
2004 ). Les effets
de l’alcool sur la santé dépendent aussi de nombreux facteurs individuels
comme des facteurs génétiques, l’âge, le sexe ou encore l’état de santé des
sujets. La mesure des effets de l’alcool sur la santé nécessite la prise en
compte de ces nombreux facteurs.
). Les effets
de l’alcool sur la santé dépendent aussi de nombreux facteurs individuels
comme des facteurs génétiques, l’âge, le sexe ou encore l’état de santé des
sujets. La mesure des effets de l’alcool sur la santé nécessite la prise en
compte de ces nombreux facteurs.
 ; Naimi
et coll., 2013
; Naimi
et coll., 2013 ).
Ainsi, des effets sont observés après la consommation aiguë (l’intoxication)
et aussi après la consommation cumulée et chronique qui peut également être
rythmée par des épisodes d’intoxications de type binge drinking.
Selon l’OMS, la consommation épisodique et forte d’alcool correspond à la
consommation de 60 g d’éthanol pur (6 verres) en une occasion. Selon le
National Institute on Alcohol Abuse and Alcoholism (NIAAA), le
binge drinking correspond à la consommation rapide d’alcool avec
la recherche d’ivresse et a été défini plus précisément comme la
consommation entraînant une alcoolémie d’au moins 0,8 g/L en moins de deux
heures (National Institute on Alcohol Abuse and Alcoholism,
2004
).
Ainsi, des effets sont observés après la consommation aiguë (l’intoxication)
et aussi après la consommation cumulée et chronique qui peut également être
rythmée par des épisodes d’intoxications de type binge drinking.
Selon l’OMS, la consommation épisodique et forte d’alcool correspond à la
consommation de 60 g d’éthanol pur (6 verres) en une occasion. Selon le
National Institute on Alcohol Abuse and Alcoholism (NIAAA), le
binge drinking correspond à la consommation rapide d’alcool avec
la recherche d’ivresse et a été défini plus précisément comme la
consommation entraînant une alcoolémie d’au moins 0,8 g/L en moins de deux
heures (National Institute on Alcohol Abuse and Alcoholism,
2004 ). Les effets
de l’alcool sur la santé dépendent aussi de nombreux facteurs individuels
comme des facteurs génétiques, l’âge, le sexe ou encore l’état de santé des
sujets. La mesure des effets de l’alcool sur la santé nécessite la prise en
compte de ces nombreux facteurs.
). Les effets
de l’alcool sur la santé dépendent aussi de nombreux facteurs individuels
comme des facteurs génétiques, l’âge, le sexe ou encore l’état de santé des
sujets. La mesure des effets de l’alcool sur la santé nécessite la prise en
compte de ces nombreux facteurs.À ce jour, des liens solides ont été établis entre consommation d’alcool et
cirrhose hépatique et certains cancers (foie, colorectal, sein et voies
aérodigestives supérieures) (Rehm et coll.,
2010b ) alors que
le lien avec d’autres pathologies, comme les accidents vasculaires cérébraux
(AVC) et les maladies coronariennes (Toma et coll.,
2017
) alors que
le lien avec d’autres pathologies, comme les accidents vasculaires cérébraux
(AVC) et les maladies coronariennes (Toma et coll.,
2017 ), reste
débattu et notamment en ce qui concerne l’impact de faibles niveaux de
consommation. De nouvelles analyses qui intègrent les nombreux facteurs de
confusion potentiels dans les études épidémiologiques observationnelles
classiques ainsi que les nouvelles méthodologies comme la randomisation
mendélienne apportent des nouvelles données qui viennent étayer les
connaissances dans ce domaine.
), reste
débattu et notamment en ce qui concerne l’impact de faibles niveaux de
consommation. De nouvelles analyses qui intègrent les nombreux facteurs de
confusion potentiels dans les études épidémiologiques observationnelles
classiques ainsi que les nouvelles méthodologies comme la randomisation
mendélienne apportent des nouvelles données qui viennent étayer les
connaissances dans ce domaine.
 ) alors que
le lien avec d’autres pathologies, comme les accidents vasculaires cérébraux
(AVC) et les maladies coronariennes (Toma et coll.,
2017
) alors que
le lien avec d’autres pathologies, comme les accidents vasculaires cérébraux
(AVC) et les maladies coronariennes (Toma et coll.,
2017 ), reste
débattu et notamment en ce qui concerne l’impact de faibles niveaux de
consommation. De nouvelles analyses qui intègrent les nombreux facteurs de
confusion potentiels dans les études épidémiologiques observationnelles
classiques ainsi que les nouvelles méthodologies comme la randomisation
mendélienne apportent des nouvelles données qui viennent étayer les
connaissances dans ce domaine.
), reste
débattu et notamment en ce qui concerne l’impact de faibles niveaux de
consommation. De nouvelles analyses qui intègrent les nombreux facteurs de
confusion potentiels dans les études épidémiologiques observationnelles
classiques ainsi que les nouvelles méthodologies comme la randomisation
mendélienne apportent des nouvelles données qui viennent étayer les
connaissances dans ce domaine.S’il est clair que les risques de développer certaines pathologies sont
corrélés avec la quantité d’alcool consommé (Lelbach,
1975 ) et avec la
durée et l’histoire de cette consommation, il est plus difficile d’évaluer
les risques encourus avec des consommations épisodiques comme celles du
binge drinking.
) et avec la
durée et l’histoire de cette consommation, il est plus difficile d’évaluer
les risques encourus avec des consommations épisodiques comme celles du
binge drinking.
 ) et avec la
durée et l’histoire de cette consommation, il est plus difficile d’évaluer
les risques encourus avec des consommations épisodiques comme celles du
binge drinking.
) et avec la
durée et l’histoire de cette consommation, il est plus difficile d’évaluer
les risques encourus avec des consommations épisodiques comme celles du
binge drinking.Si les effets sur la santé des niveaux élevés de consommation d’alcool sont
aujourd’hui bien établis, ceux des faibles niveaux de consommation
commencent à être mieux estimés depuis quelques années. Par exemple, la
maladie du foie liée à l’alcool a longtemps été considérée comme une maladie
apparaissant après des années de consommation d’alcool à des niveaux élevés,
c’est-à-dire plus de 4 verres standards (soit 40 g d’éthanol) par jour
(Bellentani et Tiribelli, 2001 ; Rehm et coll.,
2010a
; Rehm et coll.,
2010a ).
Cependant, une méta-analyse récente a montré que même la consommation
chronique de niveaux plus faibles, de 12 à 24 g d’alcool par jour (1 à 2,5
verres standards par jour) augmente le risque de cirrhose (un stade avancé
de maladie du foie liée à l’alcool) (Rehm et coll.,
2010a
).
Cependant, une méta-analyse récente a montré que même la consommation
chronique de niveaux plus faibles, de 12 à 24 g d’alcool par jour (1 à 2,5
verres standards par jour) augmente le risque de cirrhose (un stade avancé
de maladie du foie liée à l’alcool) (Rehm et coll.,
2010a ). Selon
ces données, le seuil auquel la consommation chronique d’alcool augmente le
risque de pathologies est plutôt faible et donc plus difficile à repérer. Il
existe aussi des facteurs individuels de vulnérabilité car si 90-100 % des
consommateurs chroniques d’alcool développent une fibrose hépatique
alcoolique, seulement 10-20 % développeront une forme avancée de maladie du
foie liée à l’alcool (Seitz et coll., 2018
). Selon
ces données, le seuil auquel la consommation chronique d’alcool augmente le
risque de pathologies est plutôt faible et donc plus difficile à repérer. Il
existe aussi des facteurs individuels de vulnérabilité car si 90-100 % des
consommateurs chroniques d’alcool développent une fibrose hépatique
alcoolique, seulement 10-20 % développeront une forme avancée de maladie du
foie liée à l’alcool (Seitz et coll., 2018 ). Les femmes par exemple développent une maladie
du foie liée à l’alcool à des niveaux de consommation plus faibles et plus
rapidement comparativement aux hommes (Becker,
1996
). Les femmes par exemple développent une maladie
du foie liée à l’alcool à des niveaux de consommation plus faibles et plus
rapidement comparativement aux hommes (Becker,
1996 ). La moitié
de la mortalité due à la cirrhose est attribuable à la consommation d’alcool
(Rehm et coll., 2013
). La moitié
de la mortalité due à la cirrhose est attribuable à la consommation d’alcool
(Rehm et coll., 2013 ).
).
 ; Rehm et coll.,
2010a
; Rehm et coll.,
2010a ).
Cependant, une méta-analyse récente a montré que même la consommation
chronique de niveaux plus faibles, de 12 à 24 g d’alcool par jour (1 à 2,5
verres standards par jour) augmente le risque de cirrhose (un stade avancé
de maladie du foie liée à l’alcool) (Rehm et coll.,
2010a
).
Cependant, une méta-analyse récente a montré que même la consommation
chronique de niveaux plus faibles, de 12 à 24 g d’alcool par jour (1 à 2,5
verres standards par jour) augmente le risque de cirrhose (un stade avancé
de maladie du foie liée à l’alcool) (Rehm et coll.,
2010a ). Selon
ces données, le seuil auquel la consommation chronique d’alcool augmente le
risque de pathologies est plutôt faible et donc plus difficile à repérer. Il
existe aussi des facteurs individuels de vulnérabilité car si 90-100 % des
consommateurs chroniques d’alcool développent une fibrose hépatique
alcoolique, seulement 10-20 % développeront une forme avancée de maladie du
foie liée à l’alcool (Seitz et coll., 2018
). Selon
ces données, le seuil auquel la consommation chronique d’alcool augmente le
risque de pathologies est plutôt faible et donc plus difficile à repérer. Il
existe aussi des facteurs individuels de vulnérabilité car si 90-100 % des
consommateurs chroniques d’alcool développent une fibrose hépatique
alcoolique, seulement 10-20 % développeront une forme avancée de maladie du
foie liée à l’alcool (Seitz et coll., 2018 ). Les femmes par exemple développent une maladie
du foie liée à l’alcool à des niveaux de consommation plus faibles et plus
rapidement comparativement aux hommes (Becker,
1996
). Les femmes par exemple développent une maladie
du foie liée à l’alcool à des niveaux de consommation plus faibles et plus
rapidement comparativement aux hommes (Becker,
1996 ). La moitié
de la mortalité due à la cirrhose est attribuable à la consommation d’alcool
(Rehm et coll., 2013
). La moitié
de la mortalité due à la cirrhose est attribuable à la consommation d’alcool
(Rehm et coll., 2013 ).
).Données écologiques et expériences naturelles
Historiquement des exemples frappants ont montré de manière évidente le
lien entre la consommation d’alcool et la santé des populations. Par
exemple, il faut se rappeler de la crise de mortalité en Union
soviétique où l’alcool était le principal facteur de cette augmentation
dans les années 1980 et était responsable de 75 % de la mortalité chez
les hommes âgés de 15 à 55 ans (Chikritzhs et coll.,
2015 ). La
réforme entamée par le Président Gorbatchev dans les années 1980 a
consisté à diminuer largement la production d’alcool. Même si la
consommation d’alcool produit illégalement a augmenté, la consommation
globale annuelle d’éthanol pur est passée d’après les estimations les
plus fiables de 14,1 litres per capita en 1984 à 10,7 litres en
1987 (25 % de réduction) (Nemtsov, 2002
). La
réforme entamée par le Président Gorbatchev dans les années 1980 a
consisté à diminuer largement la production d’alcool. Même si la
consommation d’alcool produit illégalement a augmenté, la consommation
globale annuelle d’éthanol pur est passée d’après les estimations les
plus fiables de 14,1 litres per capita en 1984 à 10,7 litres en
1987 (25 % de réduction) (Nemtsov, 2002 ). Pendant cette période, la mortalité toutes
causes chez les 40-44 ans a diminué de 39 % chez les hommes et de 29 %
chez les femmes. Entre 1987 et 1994, après l’arrêt de cette réforme en
1987, la consommation d’alcool a augmenté à nouveau pour atteindre 14,5
litres per capita et la mortalité toutes causes chez les hommes a
doublé chez les 40-44 ans (Leon et coll.,
1997
). Pendant cette période, la mortalité toutes
causes chez les 40-44 ans a diminué de 39 % chez les hommes et de 29 %
chez les femmes. Entre 1987 et 1994, après l’arrêt de cette réforme en
1987, la consommation d’alcool a augmenté à nouveau pour atteindre 14,5
litres per capita et la mortalité toutes causes chez les hommes a
doublé chez les 40-44 ans (Leon et coll.,
1997 ). En
2007, le gouvernement russe a durci les régulations de l’industrie de
l’alcool ce qui a entraîné une diminution significative de la mortalité
cardiovasculaire liée à l’alcool (Neufeld et Rehm,
2013
). En
2007, le gouvernement russe a durci les régulations de l’industrie de
l’alcool ce qui a entraîné une diminution significative de la mortalité
cardiovasculaire liée à l’alcool (Neufeld et Rehm,
2013 ). À
l’inverse, le gouvernement de Hong Kong qui a diminué de 50 % les taxes
sur l’alcool en 2007 a vu la mortalité cardiovasculaire augmenter de
13 % chez les hommes (Pun et coll.,
2013
). À
l’inverse, le gouvernement de Hong Kong qui a diminué de 50 % les taxes
sur l’alcool en 2007 a vu la mortalité cardiovasculaire augmenter de
13 % chez les hommes (Pun et coll.,
2013 ). Un
autre exemple est celui du déclin du nombre de décès par cirrhose à
Paris lors de la deuxième guerre mondiale avec un rationnement strict du
vin (1/2 à 1 litre par semaine) de 1942 à 1947 et une diminution de la
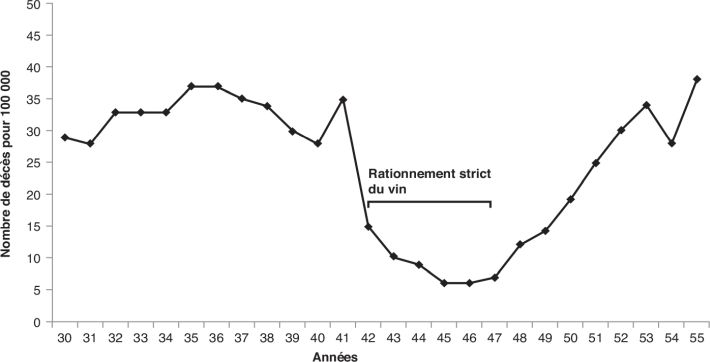
disponibilité du vin pendant la guerre (figure 2.1
). Un
autre exemple est celui du déclin du nombre de décès par cirrhose à
Paris lors de la deuxième guerre mondiale avec un rationnement strict du
vin (1/2 à 1 litre par semaine) de 1942 à 1947 et une diminution de la
disponibilité du vin pendant la guerre (figure 2.1 ). Même s’il est tentant d’associer la chute du
nombre de cirrhoses à la diminution de la consommation de vin, plusieurs
autres hypothèses ont été avancées et restent débattues comme des
changements de population (mouvements, composition), la malnutrition, le
froid, les autres causes de mortalité et la certitude sur la cause de
mortalité (Fillmore et coll., 2002
). Même s’il est tentant d’associer la chute du
nombre de cirrhoses à la diminution de la consommation de vin, plusieurs
autres hypothèses ont été avancées et restent débattues comme des
changements de population (mouvements, composition), la malnutrition, le
froid, les autres causes de mortalité et la certitude sur la cause de
mortalité (Fillmore et coll., 2002 ).
).
 ). La
réforme entamée par le Président Gorbatchev dans les années 1980 a
consisté à diminuer largement la production d’alcool. Même si la
consommation d’alcool produit illégalement a augmenté, la consommation
globale annuelle d’éthanol pur est passée d’après les estimations les
plus fiables de 14,1 litres per capita en 1984 à 10,7 litres en
1987 (25 % de réduction) (Nemtsov, 2002
). La
réforme entamée par le Président Gorbatchev dans les années 1980 a
consisté à diminuer largement la production d’alcool. Même si la
consommation d’alcool produit illégalement a augmenté, la consommation
globale annuelle d’éthanol pur est passée d’après les estimations les
plus fiables de 14,1 litres per capita en 1984 à 10,7 litres en
1987 (25 % de réduction) (Nemtsov, 2002 ). Pendant cette période, la mortalité toutes
causes chez les 40-44 ans a diminué de 39 % chez les hommes et de 29 %
chez les femmes. Entre 1987 et 1994, après l’arrêt de cette réforme en
1987, la consommation d’alcool a augmenté à nouveau pour atteindre 14,5
litres per capita et la mortalité toutes causes chez les hommes a
doublé chez les 40-44 ans (Leon et coll.,
1997
). Pendant cette période, la mortalité toutes
causes chez les 40-44 ans a diminué de 39 % chez les hommes et de 29 %
chez les femmes. Entre 1987 et 1994, après l’arrêt de cette réforme en
1987, la consommation d’alcool a augmenté à nouveau pour atteindre 14,5
litres per capita et la mortalité toutes causes chez les hommes a
doublé chez les 40-44 ans (Leon et coll.,
1997 ). En
2007, le gouvernement russe a durci les régulations de l’industrie de
l’alcool ce qui a entraîné une diminution significative de la mortalité
cardiovasculaire liée à l’alcool (Neufeld et Rehm,
2013
). En
2007, le gouvernement russe a durci les régulations de l’industrie de
l’alcool ce qui a entraîné une diminution significative de la mortalité
cardiovasculaire liée à l’alcool (Neufeld et Rehm,
2013 ). À
l’inverse, le gouvernement de Hong Kong qui a diminué de 50 % les taxes
sur l’alcool en 2007 a vu la mortalité cardiovasculaire augmenter de
13 % chez les hommes (Pun et coll.,
2013
). À
l’inverse, le gouvernement de Hong Kong qui a diminué de 50 % les taxes
sur l’alcool en 2007 a vu la mortalité cardiovasculaire augmenter de
13 % chez les hommes (Pun et coll.,
2013 ). Un
autre exemple est celui du déclin du nombre de décès par cirrhose à
Paris lors de la deuxième guerre mondiale avec un rationnement strict du
vin (1/2 à 1 litre par semaine) de 1942 à 1947 et une diminution de la
disponibilité du vin pendant la guerre (figure 2.1
). Un
autre exemple est celui du déclin du nombre de décès par cirrhose à
Paris lors de la deuxième guerre mondiale avec un rationnement strict du
vin (1/2 à 1 litre par semaine) de 1942 à 1947 et une diminution de la
disponibilité du vin pendant la guerre (figure 2.1 ). Même s’il est tentant d’associer la chute du
nombre de cirrhoses à la diminution de la consommation de vin, plusieurs
autres hypothèses ont été avancées et restent débattues comme des
changements de population (mouvements, composition), la malnutrition, le
froid, les autres causes de mortalité et la certitude sur la cause de
mortalité (Fillmore et coll., 2002
). Même s’il est tentant d’associer la chute du
nombre de cirrhoses à la diminution de la consommation de vin, plusieurs
autres hypothèses ont été avancées et restent débattues comme des
changements de population (mouvements, composition), la malnutrition, le
froid, les autres causes de mortalité et la certitude sur la cause de
mortalité (Fillmore et coll., 2002 ).
). | Figure 2.1 : Nombre de décès par cirrhose pour 100 000
dans la ville de Paris entre 1930 et 1955 (d’après Schwartz et
coll., 2019 ) ) |
Ces expériences naturelles nous donnent une idée de l’impact de l’alcool
sur les populations mais ne nous informent pas sur les relations
dose-effet au niveau individuel, ni sur les mécanismes des effets de
l’alcool, ni non plus sur le rôle des facteurs modérateurs.
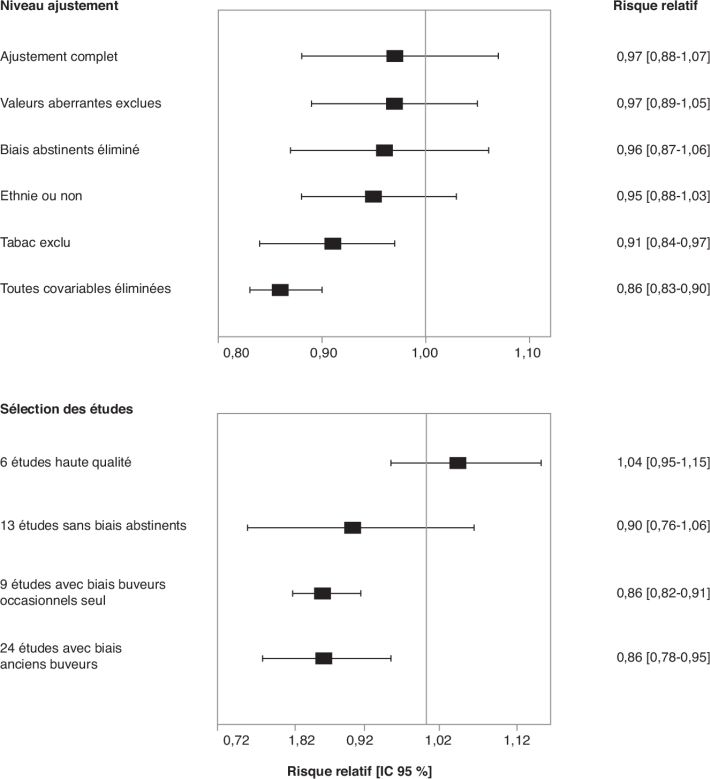
Une étude parue en 2017 a analysé le lien entre les tendances des
consommations d’alcool dans 17 pays et la mortalité liée aux cancers
(Schwartz et coll., 2017). Les résultats montrent qu’il existe une
association statistiquement significative entre les ventes d’alcool et
la mortalité liée aux cancers dans la plupart des pays qui persiste
après correction de la consommation de tabac. Par exemple pour la
France, l’Angleterre et la Roumanie, les auteurs montrent une
corrélation et obtiennent respectivement une diminution, une stagnation
ou une augmentation à la fois des ventes d’alcool et de la mortalité due
aux cancers de la cavité buccale, du pharynx et du larynx.
Données françaises de mortalité attribuable à l’alcool
La consommation d’alcool est reconnue comme un facteur de risque majeur
contribuant au fardeau des maladies et plusieurs études relient cette
consommation à 60 maladies aiguës et chroniques (Rehm et coll.,
2003b ; Rehm
et coll., 2003a
; Rehm
et coll., 2003a ; Ezzati et coll., 2006
; Ezzati et coll., 2006 ). L’alcool est retrouvé dans 200 items de la
Classification internationale des maladies (CIM-10) qui sont utilisés
dans les hôpitaux à des fins de diagnostic et dans le programme de
médicalisation des systèmes d’information (PMSI) (Rehm et coll.,
2003b
). L’alcool est retrouvé dans 200 items de la
Classification internationale des maladies (CIM-10) qui sont utilisés
dans les hôpitaux à des fins de diagnostic et dans le programme de
médicalisation des systèmes d’information (PMSI) (Rehm et coll.,
2003b ).
).
 ; Rehm
et coll., 2003a
; Rehm
et coll., 2003a ; Ezzati et coll., 2006
; Ezzati et coll., 2006 ). L’alcool est retrouvé dans 200 items de la
Classification internationale des maladies (CIM-10) qui sont utilisés
dans les hôpitaux à des fins de diagnostic et dans le programme de
médicalisation des systèmes d’information (PMSI) (Rehm et coll.,
2003b
). L’alcool est retrouvé dans 200 items de la
Classification internationale des maladies (CIM-10) qui sont utilisés
dans les hôpitaux à des fins de diagnostic et dans le programme de
médicalisation des systèmes d’information (PMSI) (Rehm et coll.,
2003b ).
).L’analyse des données PMSI a démontré que l’alcool était la première
cause d’hospitalisation en France en 2012 (Paille et Reynaud, 2015 ). Des
études récentes réalisées en France montrent que l’alcool contribue de
manière importante à la mortalité liée au virus de l’hépatite C
(Schwarzinger et coll., 2017
). Des
études récentes réalisées en France montrent que l’alcool contribue de
manière importante à la mortalité liée au virus de l’hépatite C
(Schwarzinger et coll., 2017 ) et aux démences (Schwarzinger et coll.,
2018
) et aux démences (Schwarzinger et coll.,
2018 ).
).
 ). Des
études récentes réalisées en France montrent que l’alcool contribue de
manière importante à la mortalité liée au virus de l’hépatite C
(Schwarzinger et coll., 2017
). Des
études récentes réalisées en France montrent que l’alcool contribue de
manière importante à la mortalité liée au virus de l’hépatite C
(Schwarzinger et coll., 2017 ) et aux démences (Schwarzinger et coll.,
2018
) et aux démences (Schwarzinger et coll.,
2018 ).
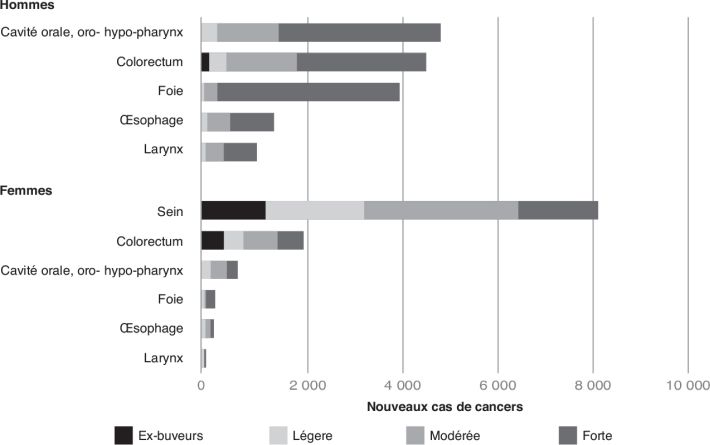
).Les derniers chiffres de la mortalité attribuable à l’alcool en France
sont ceux de 2015 (Bonaldi et Hill,
2019 ). Ils
sont de 41 000 décès dont 30 000 chez les hommes et 11 000 chez les
femmes, soit respectivement 11 % et 4 % de la mortalité des adultes de
quinze ans et plus. Ils comprennent 16 000 décès par cancers, 9 900
décès par maladies cardiovasculaires, 6 800 par maladies digestives,
5 400 pour une cause externe (accident ou suicide) et plus de 3 000 pour
une autre maladie (maladies mentales, troubles du comportement, etc.).
La mortalité attribuable à l’alcool par classe d’âge est de 7, 15 et 6 %
respectivement pour les 15-34, 35-64 et 65 ans et plus. Ces données de
mortalité ont pu être calculées grâce à l’estimation de la consommation
d’alcool à partir d’un échantillon représentatif de 20 178 individus
français âgés de 15 ans et plus et interviewés sur leurs habitudes de
consommation par l’Institut national de la statistique et des études
économiques (Insee). Le décalage entre la consommation d’alcool
rapportée dans cet échantillon (11 g/j) et les données sur les ventes
d’alcool (27 g/j en 2009) amène à une correction (facteur 2,4) de la
consommation déclarée d’alcool. L’étude de sensibilité (l’écart de la
consommation déclarée, la perte ou le gaspillage de l’alcool mis sur le
marché) indique que cette incertitude contribue à une estimation
comprise entre 28 000 et 49 000 décès attribuables à l’alcool en 2015 et
lorsque l’on prend on compte cette incertitude il est difficile de
comparer l’évolution des chiffres de mortalité dans le temps. Ainsi la
mortalité attribuable à l’alcool était estimée à 49 000 en 2009 (Guérin
et coll., 2013
). Ils
sont de 41 000 décès dont 30 000 chez les hommes et 11 000 chez les
femmes, soit respectivement 11 % et 4 % de la mortalité des adultes de
quinze ans et plus. Ils comprennent 16 000 décès par cancers, 9 900
décès par maladies cardiovasculaires, 6 800 par maladies digestives,
5 400 pour une cause externe (accident ou suicide) et plus de 3 000 pour
une autre maladie (maladies mentales, troubles du comportement, etc.).
La mortalité attribuable à l’alcool par classe d’âge est de 7, 15 et 6 %
respectivement pour les 15-34, 35-64 et 65 ans et plus. Ces données de
mortalité ont pu être calculées grâce à l’estimation de la consommation
d’alcool à partir d’un échantillon représentatif de 20 178 individus
français âgés de 15 ans et plus et interviewés sur leurs habitudes de
consommation par l’Institut national de la statistique et des études
économiques (Insee). Le décalage entre la consommation d’alcool
rapportée dans cet échantillon (11 g/j) et les données sur les ventes
d’alcool (27 g/j en 2009) amène à une correction (facteur 2,4) de la
consommation déclarée d’alcool. L’étude de sensibilité (l’écart de la
consommation déclarée, la perte ou le gaspillage de l’alcool mis sur le
marché) indique que cette incertitude contribue à une estimation
comprise entre 28 000 et 49 000 décès attribuables à l’alcool en 2015 et
lorsque l’on prend on compte cette incertitude il est difficile de
comparer l’évolution des chiffres de mortalité dans le temps. Ainsi la
mortalité attribuable à l’alcool était estimée à 49 000 en 2009 (Guérin
et coll., 2013 ),
33 000 en 2006, 45 000 en 1995 et 52 000 en 1985. Un autre facteur clé
est la méthode de calcul du nombre de décès attribuables à l’alcool. Il
s’agit ici de l’estimation de la fraction attribuable à l’alcool pour
une cause de décès donnée en fonction de l’âge et du sexe. La fraction
attribuable à l’alcool pour une pathologie est estimée en utilisant les
risques relatifs de la pathologie en prenant la consommation la plus
faible comme catégorie de référence (inférieure à 7 g d’éthanol pur par
jour soit moins de 5 verres standards par semaine). Il est en effet
important de prendre comme catégorie de référence une population qui est
aussi exposée au risque étudié. Les risques relatifs de décès sont
calculés en fonction des niveaux de consommation d’alcool selon des
relations dose-effet. Lorsque le lien entre certaines pathologies et
l’alcool est incertain, elles ne sont pas prises en compte. L’estimation
consiste pour chaque pathologie à multiplier le nombre de décès par la
fraction attribuable. Cette fraction attribuable varie donc en fonction
du sexe et peut être maximale (100 % par exemple pour les
cardiomyopathies alcooliques, les varices œsophagiennes, la gastrite
alcoolique, ou encore l’encéphalopathie de Wernicke) ou même négative
(par exemple -23,5 % pour la cholélithiase, -1,4 % pour le diabète de
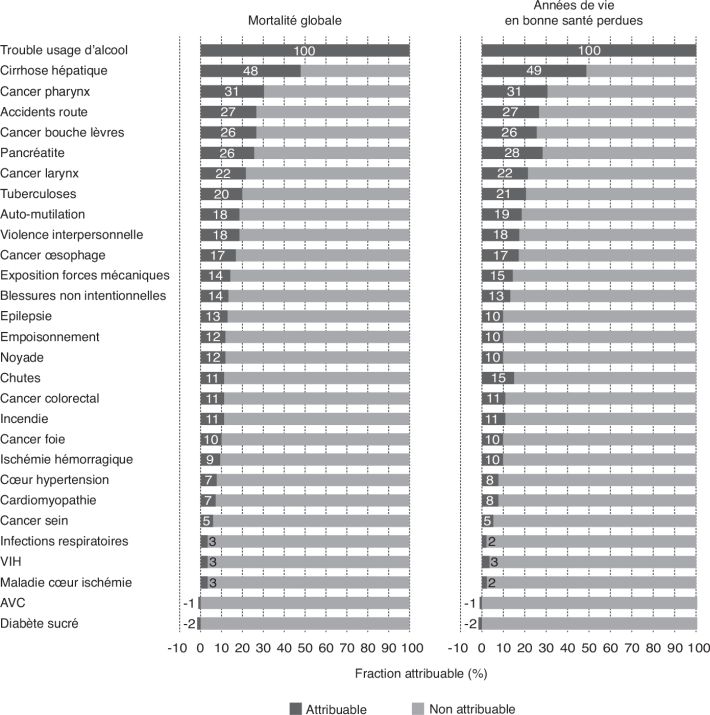
type 2) (figure 2.2
),
33 000 en 2006, 45 000 en 1995 et 52 000 en 1985. Un autre facteur clé
est la méthode de calcul du nombre de décès attribuables à l’alcool. Il
s’agit ici de l’estimation de la fraction attribuable à l’alcool pour
une cause de décès donnée en fonction de l’âge et du sexe. La fraction
attribuable à l’alcool pour une pathologie est estimée en utilisant les
risques relatifs de la pathologie en prenant la consommation la plus
faible comme catégorie de référence (inférieure à 7 g d’éthanol pur par
jour soit moins de 5 verres standards par semaine). Il est en effet
important de prendre comme catégorie de référence une population qui est
aussi exposée au risque étudié. Les risques relatifs de décès sont
calculés en fonction des niveaux de consommation d’alcool selon des
relations dose-effet. Lorsque le lien entre certaines pathologies et
l’alcool est incertain, elles ne sont pas prises en compte. L’estimation
consiste pour chaque pathologie à multiplier le nombre de décès par la
fraction attribuable. Cette fraction attribuable varie donc en fonction
du sexe et peut être maximale (100 % par exemple pour les
cardiomyopathies alcooliques, les varices œsophagiennes, la gastrite
alcoolique, ou encore l’encéphalopathie de Wernicke) ou même négative
(par exemple -23,5 % pour la cholélithiase, -1,4 % pour le diabète de
type 2) (figure 2.2 ).
).
 ). Ils
sont de 41 000 décès dont 30 000 chez les hommes et 11 000 chez les
femmes, soit respectivement 11 % et 4 % de la mortalité des adultes de
quinze ans et plus. Ils comprennent 16 000 décès par cancers, 9 900
décès par maladies cardiovasculaires, 6 800 par maladies digestives,
5 400 pour une cause externe (accident ou suicide) et plus de 3 000 pour
une autre maladie (maladies mentales, troubles du comportement, etc.).
La mortalité attribuable à l’alcool par classe d’âge est de 7, 15 et 6 %
respectivement pour les 15-34, 35-64 et 65 ans et plus. Ces données de
mortalité ont pu être calculées grâce à l’estimation de la consommation
d’alcool à partir d’un échantillon représentatif de 20 178 individus
français âgés de 15 ans et plus et interviewés sur leurs habitudes de
consommation par l’Institut national de la statistique et des études
économiques (Insee). Le décalage entre la consommation d’alcool
rapportée dans cet échantillon (11 g/j) et les données sur les ventes
d’alcool (27 g/j en 2009) amène à une correction (facteur 2,4) de la
consommation déclarée d’alcool. L’étude de sensibilité (l’écart de la
consommation déclarée, la perte ou le gaspillage de l’alcool mis sur le
marché) indique que cette incertitude contribue à une estimation
comprise entre 28 000 et 49 000 décès attribuables à l’alcool en 2015 et
lorsque l’on prend on compte cette incertitude il est difficile de
comparer l’évolution des chiffres de mortalité dans le temps. Ainsi la
mortalité attribuable à l’alcool était estimée à 49 000 en 2009 (Guérin
et coll., 2013
). Ils
sont de 41 000 décès dont 30 000 chez les hommes et 11 000 chez les
femmes, soit respectivement 11 % et 4 % de la mortalité des adultes de
quinze ans et plus. Ils comprennent 16 000 décès par cancers, 9 900
décès par maladies cardiovasculaires, 6 800 par maladies digestives,
5 400 pour une cause externe (accident ou suicide) et plus de 3 000 pour
une autre maladie (maladies mentales, troubles du comportement, etc.).
La mortalité attribuable à l’alcool par classe d’âge est de 7, 15 et 6 %
respectivement pour les 15-34, 35-64 et 65 ans et plus. Ces données de
mortalité ont pu être calculées grâce à l’estimation de la consommation
d’alcool à partir d’un échantillon représentatif de 20 178 individus
français âgés de 15 ans et plus et interviewés sur leurs habitudes de
consommation par l’Institut national de la statistique et des études
économiques (Insee). Le décalage entre la consommation d’alcool
rapportée dans cet échantillon (11 g/j) et les données sur les ventes
d’alcool (27 g/j en 2009) amène à une correction (facteur 2,4) de la
consommation déclarée d’alcool. L’étude de sensibilité (l’écart de la
consommation déclarée, la perte ou le gaspillage de l’alcool mis sur le
marché) indique que cette incertitude contribue à une estimation
comprise entre 28 000 et 49 000 décès attribuables à l’alcool en 2015 et
lorsque l’on prend on compte cette incertitude il est difficile de
comparer l’évolution des chiffres de mortalité dans le temps. Ainsi la
mortalité attribuable à l’alcool était estimée à 49 000 en 2009 (Guérin
et coll., 2013 ),
33 000 en 2006, 45 000 en 1995 et 52 000 en 1985. Un autre facteur clé
est la méthode de calcul du nombre de décès attribuables à l’alcool. Il
s’agit ici de l’estimation de la fraction attribuable à l’alcool pour
une cause de décès donnée en fonction de l’âge et du sexe. La fraction
attribuable à l’alcool pour une pathologie est estimée en utilisant les
risques relatifs de la pathologie en prenant la consommation la plus
faible comme catégorie de référence (inférieure à 7 g d’éthanol pur par
jour soit moins de 5 verres standards par semaine). Il est en effet
important de prendre comme catégorie de référence une population qui est
aussi exposée au risque étudié. Les risques relatifs de décès sont
calculés en fonction des niveaux de consommation d’alcool selon des
relations dose-effet. Lorsque le lien entre certaines pathologies et
l’alcool est incertain, elles ne sont pas prises en compte. L’estimation
consiste pour chaque pathologie à multiplier le nombre de décès par la
fraction attribuable. Cette fraction attribuable varie donc en fonction
du sexe et peut être maximale (100 % par exemple pour les
cardiomyopathies alcooliques, les varices œsophagiennes, la gastrite
alcoolique, ou encore l’encéphalopathie de Wernicke) ou même négative
(par exemple -23,5 % pour la cholélithiase, -1,4 % pour le diabète de
type 2) (figure 2.2
),
33 000 en 2006, 45 000 en 1995 et 52 000 en 1985. Un autre facteur clé
est la méthode de calcul du nombre de décès attribuables à l’alcool. Il
s’agit ici de l’estimation de la fraction attribuable à l’alcool pour
une cause de décès donnée en fonction de l’âge et du sexe. La fraction
attribuable à l’alcool pour une pathologie est estimée en utilisant les
risques relatifs de la pathologie en prenant la consommation la plus
faible comme catégorie de référence (inférieure à 7 g d’éthanol pur par
jour soit moins de 5 verres standards par semaine). Il est en effet
important de prendre comme catégorie de référence une population qui est
aussi exposée au risque étudié. Les risques relatifs de décès sont
calculés en fonction des niveaux de consommation d’alcool selon des
relations dose-effet. Lorsque le lien entre certaines pathologies et
l’alcool est incertain, elles ne sont pas prises en compte. L’estimation
consiste pour chaque pathologie à multiplier le nombre de décès par la
fraction attribuable. Cette fraction attribuable varie donc en fonction
du sexe et peut être maximale (100 % par exemple pour les
cardiomyopathies alcooliques, les varices œsophagiennes, la gastrite
alcoolique, ou encore l’encéphalopathie de Wernicke) ou même négative
(par exemple -23,5 % pour la cholélithiase, -1,4 % pour le diabète de
type 2) (figure 2.2 ).
).Les causes de décès totalement ou partiellement liées à l’alcool sont
identifiées grâce aux items de la Classification internationale des
maladies (CIM-10) qui en comprend 200 liées à l’alcool. Une mortalité
« évitable » liée à l’alcool, correspondant à une fraction attribuable
négative, est donc prise en compte dans les calculs de la mortalité
attribuable à l’alcool. Il s’agit donc théoriquement d’un nombre de
décès évités et liés à la consommation d’alcool. Il faut noter que cette
mortalité « évitable » est plus de 210 fois inférieure à la mortalité
attribuable à l’alcool (la mortalité « évitable » est inférieure à 5
pour mille) (Naassila, 2019 ). Concernant les classes d’âge, la mortalité
attribuable à l’alcool concerne respectivement 7,3 %, 14,7 % et 5,7 %
chez les 15-34, 35-64 et 65 ans et plus. La mortalité attribuable à
l’alcool est aussi proportionnelle à la quantité d’alcool consommée
quotidiennement (en gramme d’éthanol pur) [7-18[ : 0,2 %, [18-35[ :
1,3 %, [35-53[ : 2,5 % et ≥ 53 : 33,8 % chez les hommes et [7-18[ :
0,8 %, [18-35[ : 5,2 %, [35-53[ : 7,0 % et ≥ 53 : 41,5 % chez les
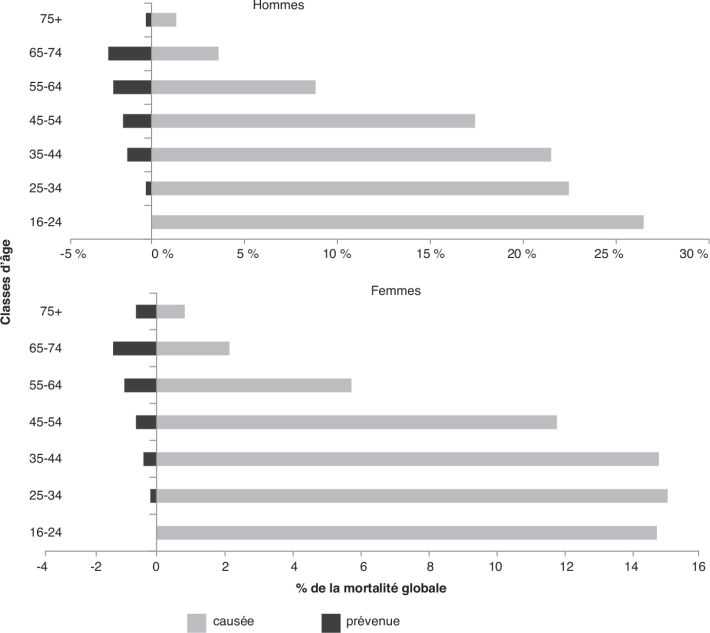
femmes. Un rapport publié en 2008 sur les données de mortalité de 2005
en Angleterre a calculé le pourcentage de mortalité globale causée ou
prévenue par la consommation d’alcool selon les classes d’âge. Les
résultats montrent que la mortalité qui serait prévenue par la
consommation est sans commune mesure par rapport à la mortalité
attribuable et que ce pourcentage augmente avec l’âge
(figure 2.3
). Concernant les classes d’âge, la mortalité
attribuable à l’alcool concerne respectivement 7,3 %, 14,7 % et 5,7 %
chez les 15-34, 35-64 et 65 ans et plus. La mortalité attribuable à
l’alcool est aussi proportionnelle à la quantité d’alcool consommée
quotidiennement (en gramme d’éthanol pur) [7-18[ : 0,2 %, [18-35[ :
1,3 %, [35-53[ : 2,5 % et ≥ 53 : 33,8 % chez les hommes et [7-18[ :
0,8 %, [18-35[ : 5,2 %, [35-53[ : 7,0 % et ≥ 53 : 41,5 % chez les
femmes. Un rapport publié en 2008 sur les données de mortalité de 2005
en Angleterre a calculé le pourcentage de mortalité globale causée ou
prévenue par la consommation d’alcool selon les classes d’âge. Les
résultats montrent que la mortalité qui serait prévenue par la
consommation est sans commune mesure par rapport à la mortalité
attribuable et que ce pourcentage augmente avec l’âge
(figure 2.3 ).
).
 ). Concernant les classes d’âge, la mortalité
attribuable à l’alcool concerne respectivement 7,3 %, 14,7 % et 5,7 %
chez les 15-34, 35-64 et 65 ans et plus. La mortalité attribuable à
l’alcool est aussi proportionnelle à la quantité d’alcool consommée
quotidiennement (en gramme d’éthanol pur) [7-18[ : 0,2 %, [18-35[ :
1,3 %, [35-53[ : 2,5 % et ≥ 53 : 33,8 % chez les hommes et [7-18[ :
0,8 %, [18-35[ : 5,2 %, [35-53[ : 7,0 % et ≥ 53 : 41,5 % chez les
femmes. Un rapport publié en 2008 sur les données de mortalité de 2005
en Angleterre a calculé le pourcentage de mortalité globale causée ou
prévenue par la consommation d’alcool selon les classes d’âge. Les
résultats montrent que la mortalité qui serait prévenue par la
consommation est sans commune mesure par rapport à la mortalité
attribuable et que ce pourcentage augmente avec l’âge
(figure 2.3
). Concernant les classes d’âge, la mortalité
attribuable à l’alcool concerne respectivement 7,3 %, 14,7 % et 5,7 %
chez les 15-34, 35-64 et 65 ans et plus. La mortalité attribuable à
l’alcool est aussi proportionnelle à la quantité d’alcool consommée
quotidiennement (en gramme d’éthanol pur) [7-18[ : 0,2 %, [18-35[ :
1,3 %, [35-53[ : 2,5 % et ≥ 53 : 33,8 % chez les hommes et [7-18[ :
0,8 %, [18-35[ : 5,2 %, [35-53[ : 7,0 % et ≥ 53 : 41,5 % chez les
femmes. Un rapport publié en 2008 sur les données de mortalité de 2005
en Angleterre a calculé le pourcentage de mortalité globale causée ou
prévenue par la consommation d’alcool selon les classes d’âge. Les
résultats montrent que la mortalité qui serait prévenue par la
consommation est sans commune mesure par rapport à la mortalité
attribuable et que ce pourcentage augmente avec l’âge
(figure 2.3 ).
). | Figure 2.3 : Pourcentage de la mortalité globale causée ou
prévenue par l’alcool en fonction de la classe d’âge (d’après Jones
et coll., 2008 ) ) |
Différences liées au sexe, exemple de la maladie du foie
liée
à l’alcool
La proportion de décès attribuables à l’alcool chez les hommes et les
femmes est bien plus élevée en France comparativement à d’autres pays
européens (Guérin et coll., 2013 ). Il faut garder à l’esprit que ces données
comportent beaucoup d’incertitudes avec l’ajustement des consommations
déclarées. Le possible décalage entre consommation et mortalité et la
consommation d’alcool qui est exprimée en quantité quotidienne et
n’inclut donc pas des profils de consommation de type binge
drinking par exemple. Enfin, il est intéressant de constater que
ces études de mortalité mettent aussi en lumière un effet néfaste de
l’alcool même à de faibles niveaux de consommation avec par exemple
1 100 décès attribuables à la consommation de 13 g d’éthanol pur (moins
d’un verre et demi) par jour en 2009 (Guérin et coll.,
2013
). Il faut garder à l’esprit que ces données
comportent beaucoup d’incertitudes avec l’ajustement des consommations
déclarées. Le possible décalage entre consommation et mortalité et la
consommation d’alcool qui est exprimée en quantité quotidienne et
n’inclut donc pas des profils de consommation de type binge
drinking par exemple. Enfin, il est intéressant de constater que
ces études de mortalité mettent aussi en lumière un effet néfaste de
l’alcool même à de faibles niveaux de consommation avec par exemple
1 100 décès attribuables à la consommation de 13 g d’éthanol pur (moins
d’un verre et demi) par jour en 2009 (Guérin et coll.,
2013 ).
).
 ). Il faut garder à l’esprit que ces données
comportent beaucoup d’incertitudes avec l’ajustement des consommations
déclarées. Le possible décalage entre consommation et mortalité et la
consommation d’alcool qui est exprimée en quantité quotidienne et
n’inclut donc pas des profils de consommation de type binge
drinking par exemple. Enfin, il est intéressant de constater que
ces études de mortalité mettent aussi en lumière un effet néfaste de
l’alcool même à de faibles niveaux de consommation avec par exemple
1 100 décès attribuables à la consommation de 13 g d’éthanol pur (moins
d’un verre et demi) par jour en 2009 (Guérin et coll.,
2013
). Il faut garder à l’esprit que ces données
comportent beaucoup d’incertitudes avec l’ajustement des consommations
déclarées. Le possible décalage entre consommation et mortalité et la
consommation d’alcool qui est exprimée en quantité quotidienne et
n’inclut donc pas des profils de consommation de type binge
drinking par exemple. Enfin, il est intéressant de constater que
ces études de mortalité mettent aussi en lumière un effet néfaste de
l’alcool même à de faibles niveaux de consommation avec par exemple
1 100 décès attribuables à la consommation de 13 g d’éthanol pur (moins
d’un verre et demi) par jour en 2009 (Guérin et coll.,
2013 ).
).Les risques de mortalité et morbidité sont-ils différents entre les
hommes et les femmes ?
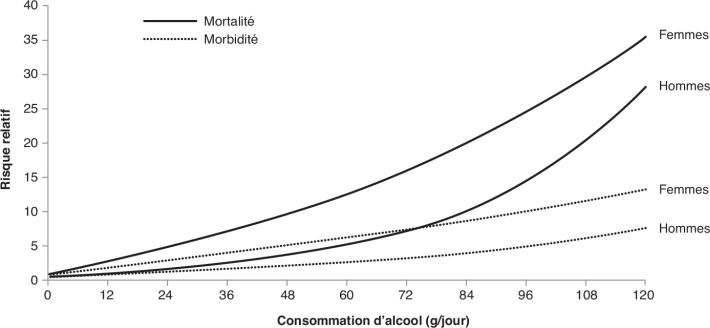
Par exemple, la figure 2.4 montre les
résultats d’une méta-analyse pour la cirrhose hépatique (Rehm et coll.,
2010a
montre les
résultats d’une méta-analyse pour la cirrhose hépatique (Rehm et coll.,
2010a ). À
consommation égale, même faible, les risques concernant la cirrhose
hépatique sont plus élevés chez les femmes comparativement aux hommes.
Le risque de mortalité est augmenté pour des consommations très
faibles : > 0-12 g/jour (soit dès le premier verre), risque relatif (RR)
de 1,9 [1,1-3,1] chez les femmes ; > 12-24 g/jour, RR de 1,6 [1,4-2,0]
chez les hommes. De manière intéressante, l’étude prospective anglaise
« Million Women » montre que le risque de cirrhose est moins
élevé lorsque les consommations d’alcool ont lieu pendant les repas
(Simpson et coll., 2019
). À
consommation égale, même faible, les risques concernant la cirrhose
hépatique sont plus élevés chez les femmes comparativement aux hommes.
Le risque de mortalité est augmenté pour des consommations très
faibles : > 0-12 g/jour (soit dès le premier verre), risque relatif (RR)
de 1,9 [1,1-3,1] chez les femmes ; > 12-24 g/jour, RR de 1,6 [1,4-2,0]
chez les hommes. De manière intéressante, l’étude prospective anglaise
« Million Women » montre que le risque de cirrhose est moins
élevé lorsque les consommations d’alcool ont lieu pendant les repas
(Simpson et coll., 2019 ).
).
 montre les
résultats d’une méta-analyse pour la cirrhose hépatique (Rehm et coll.,
2010a
montre les
résultats d’une méta-analyse pour la cirrhose hépatique (Rehm et coll.,
2010a ). À
consommation égale, même faible, les risques concernant la cirrhose
hépatique sont plus élevés chez les femmes comparativement aux hommes.
Le risque de mortalité est augmenté pour des consommations très
faibles : > 0-12 g/jour (soit dès le premier verre), risque relatif (RR)
de 1,9 [1,1-3,1] chez les femmes ; > 12-24 g/jour, RR de 1,6 [1,4-2,0]
chez les hommes. De manière intéressante, l’étude prospective anglaise
« Million Women » montre que le risque de cirrhose est moins
élevé lorsque les consommations d’alcool ont lieu pendant les repas
(Simpson et coll., 2019
). À
consommation égale, même faible, les risques concernant la cirrhose
hépatique sont plus élevés chez les femmes comparativement aux hommes.
Le risque de mortalité est augmenté pour des consommations très
faibles : > 0-12 g/jour (soit dès le premier verre), risque relatif (RR)
de 1,9 [1,1-3,1] chez les femmes ; > 12-24 g/jour, RR de 1,6 [1,4-2,0]
chez les hommes. De manière intéressante, l’étude prospective anglaise
« Million Women » montre que le risque de cirrhose est moins
élevé lorsque les consommations d’alcool ont lieu pendant les repas
(Simpson et coll., 2019 ).
). | Figure 2.4 : Risque relatif et courbe de méta-régression
de la cirrhose hépatique associée à la consommation d’alcool selon
le sexe et le paramètre mesuré (d’après Rehm et coll.,
2010a ) ) |
Les résultats sur la maladie hépatique liée à l’alcool suggèrent que si
un seuil de consommation existe, il est très faible et semble en fait
difficile à déterminer très précisément principalement à cause de la
difficulté à mesurer très précisément la consommation d’alcool. Dans ses
dernières recommandations de pratique clinique, l’Association européenne
pour l’étude sur le foie (EASL) précise que le seuil est très faible et
que pour des raisons pratiques il doit être recommandé que s’il y a
consommation d’alcool, elle doit être limitée à un maximum de deux
verres par jour pour les femmes et trois verres par jour pour les hommes
(Thursz et coll., 2018). Les résultats sur le profil de consommation
restent controversés et notamment concernant le binge drinking
avec la consommation d’au moins 6 verres par occasion. Une étude
rapporte par exemple que le plus haut risque de cirrhose hépatique est
atteint pour une consommation quotidienne (Askgaard et coll.,
2015 ) alors
qu’une autre étude (Åberg et coll.,
2017
) alors
qu’une autre étude (Åberg et coll.,
2017 ) rapporte
que le binge drinking est associé à un risque de maladie du foie
indépendamment de la consommation moyenne d’alcool (Thursz et coll.,
2018). Il est important de considérer qu’il y a une bonne preuve
clinique que l’arrêt de la consommation à n’importe quel moment de
l’évolution de la maladie réduit les risques de progression de la
maladie et l’apparition des complications de la cirrhose (Masson et
coll., 2014
) rapporte
que le binge drinking est associé à un risque de maladie du foie
indépendamment de la consommation moyenne d’alcool (Thursz et coll.,
2018). Il est important de considérer qu’il y a une bonne preuve
clinique que l’arrêt de la consommation à n’importe quel moment de
l’évolution de la maladie réduit les risques de progression de la
maladie et l’apparition des complications de la cirrhose (Masson et
coll., 2014 ).
).
 ) alors
qu’une autre étude (Åberg et coll.,
2017
) alors
qu’une autre étude (Åberg et coll.,
2017 ) rapporte
que le binge drinking est associé à un risque de maladie du foie
indépendamment de la consommation moyenne d’alcool (Thursz et coll.,
2018). Il est important de considérer qu’il y a une bonne preuve
clinique que l’arrêt de la consommation à n’importe quel moment de
l’évolution de la maladie réduit les risques de progression de la
maladie et l’apparition des complications de la cirrhose (Masson et
coll., 2014
) rapporte
que le binge drinking est associé à un risque de maladie du foie
indépendamment de la consommation moyenne d’alcool (Thursz et coll.,
2018). Il est important de considérer qu’il y a une bonne preuve
clinique que l’arrêt de la consommation à n’importe quel moment de
l’évolution de la maladie réduit les risques de progression de la
maladie et l’apparition des complications de la cirrhose (Masson et
coll., 2014 ).
).Consommation d’alcool et démences
La démence est un syndrome caractérisé par une détérioration progressive
des capacités cognitives et de la gestion de sa vie quotidienne (Rehm et
coll., 2019 ).
Elle touche la mémoire, la pensée et le comportement. Elle constitue une
cause majeure d’incapacité chez les personnes âgées et touche 5 à 7 %
des plus de 60 ans. Le nombre de personnes touchées par la démence
pourrait tripler d’ici à 2050 dans le monde selon l’OMS.
).
Elle touche la mémoire, la pensée et le comportement. Elle constitue une
cause majeure d’incapacité chez les personnes âgées et touche 5 à 7 %
des plus de 60 ans. Le nombre de personnes touchées par la démence
pourrait tripler d’ici à 2050 dans le monde selon l’OMS.
 ).
Elle touche la mémoire, la pensée et le comportement. Elle constitue une
cause majeure d’incapacité chez les personnes âgées et touche 5 à 7 %
des plus de 60 ans. Le nombre de personnes touchées par la démence
pourrait tripler d’ici à 2050 dans le monde selon l’OMS.
).
Elle touche la mémoire, la pensée et le comportement. Elle constitue une
cause majeure d’incapacité chez les personnes âgées et touche 5 à 7 %
des plus de 60 ans. Le nombre de personnes touchées par la démence
pourrait tripler d’ici à 2050 dans le monde selon l’OMS.Une étude récente française et rétrospective sur une cohorte de plus de
30 millions de patients hospitalisés suggère que la consommation
d’alcool jouerait un rôle majeur dans le développement de la démence à
début précoce (Schwarzinger et coll.,
2018 ). Dans
cette étude, la démence chez les patients de moins de 65 ans est liée à
l’alcool ou l’histoire positive d’une consommation à risque
d’alcool.
). Dans
cette étude, la démence chez les patients de moins de 65 ans est liée à
l’alcool ou l’histoire positive d’une consommation à risque
d’alcool.
 ). Dans
cette étude, la démence chez les patients de moins de 65 ans est liée à
l’alcool ou l’histoire positive d’une consommation à risque
d’alcool.
). Dans
cette étude, la démence chez les patients de moins de 65 ans est liée à
l’alcool ou l’histoire positive d’une consommation à risque
d’alcool.De nombreuses revues systématiques publiées après 2000, et analysées dans
une revue récente (Rehm et coll., 2019 ), ont rapporté l’existence d’une association
statistiquement significative entre la consommation légère à modérée
d’alcool (un à trois verres d’alcool par jour) et le plus faible risque
d’être diagnostiqué avec une atteinte cognitive et différents types de
démence ainsi que de mourir de démence. Cependant deux revues
systématiques ne confirment pas cette conclusion et indiquent que la
causalité ne peut pas être établie car il existe une grande
hétérogénéité des études qui présentent aussi une qualité méthodologique
modérée (Purnell et coll., 2009
), ont rapporté l’existence d’une association
statistiquement significative entre la consommation légère à modérée
d’alcool (un à trois verres d’alcool par jour) et le plus faible risque
d’être diagnostiqué avec une atteinte cognitive et différents types de
démence ainsi que de mourir de démence. Cependant deux revues
systématiques ne confirment pas cette conclusion et indiquent que la
causalité ne peut pas être établie car il existe une grande
hétérogénéité des études qui présentent aussi une qualité méthodologique
modérée (Purnell et coll., 2009 ; Piazza-Gardner et coll.,
2013
; Piazza-Gardner et coll.,
2013 ). Une
méta-analyse d’études prospectives montre un risque toute cause de
démence réduit d’environ 10 % pour une consommation de 6 g d’éthanol pur
par jour (moins d’un verre) et un risque accru d’environ 10 % pour une
consommation de 38 g d’éthanol pur par jour (23 verres par semaine) (Xu
et coll., 2017
). Une
méta-analyse d’études prospectives montre un risque toute cause de
démence réduit d’environ 10 % pour une consommation de 6 g d’éthanol pur
par jour (moins d’un verre) et un risque accru d’environ 10 % pour une
consommation de 38 g d’éthanol pur par jour (23 verres par semaine) (Xu
et coll., 2017 ).
Une étude japonaise récente rapporte aussi un risque réduit de démence
pour une consommation d’alcool inférieure ou égale à 2 verres par jour
(20 g d’éthanol pur) (Liu et coll.,
2019
).
Une étude japonaise récente rapporte aussi un risque réduit de démence
pour une consommation d’alcool inférieure ou égale à 2 verres par jour
(20 g d’éthanol pur) (Liu et coll.,
2019 ). Une
autre étude de cohorte avec un suivi sur 23 ans s’est attachée à
regarder l’association entre le risque de démence et la consommation
d’alcool en fonction de la trajectoire des consommations (Sabia et
coll., 2018
). Une
autre étude de cohorte avec un suivi sur 23 ans s’est attachée à
regarder l’association entre le risque de démence et la consommation
d’alcool en fonction de la trajectoire des consommations (Sabia et
coll., 2018 ).
Les résultats montrent que les adultes abstinents (du milieu de leur vie
et jusque l’âge de sénior) et les consommateurs de plus de 112 g
d’éthanol pur par semaine (11 verres) présentent un risque augmenté de
démence. Le risque de démence augmenté chez les abstinents serait
expliqué en partie à la maladie cardio-métabolique (Sabia et coll.,
2018
).
Les résultats montrent que les adultes abstinents (du milieu de leur vie
et jusque l’âge de sénior) et les consommateurs de plus de 112 g
d’éthanol pur par semaine (11 verres) présentent un risque augmenté de
démence. Le risque de démence augmenté chez les abstinents serait
expliqué en partie à la maladie cardio-métabolique (Sabia et coll.,
2018 ).
).
 ), ont rapporté l’existence d’une association
statistiquement significative entre la consommation légère à modérée
d’alcool (un à trois verres d’alcool par jour) et le plus faible risque
d’être diagnostiqué avec une atteinte cognitive et différents types de
démence ainsi que de mourir de démence. Cependant deux revues
systématiques ne confirment pas cette conclusion et indiquent que la
causalité ne peut pas être établie car il existe une grande
hétérogénéité des études qui présentent aussi une qualité méthodologique
modérée (Purnell et coll., 2009
), ont rapporté l’existence d’une association
statistiquement significative entre la consommation légère à modérée
d’alcool (un à trois verres d’alcool par jour) et le plus faible risque
d’être diagnostiqué avec une atteinte cognitive et différents types de
démence ainsi que de mourir de démence. Cependant deux revues
systématiques ne confirment pas cette conclusion et indiquent que la
causalité ne peut pas être établie car il existe une grande
hétérogénéité des études qui présentent aussi une qualité méthodologique
modérée (Purnell et coll., 2009 ; Piazza-Gardner et coll.,
2013
; Piazza-Gardner et coll.,
2013 ). Une
méta-analyse d’études prospectives montre un risque toute cause de
démence réduit d’environ 10 % pour une consommation de 6 g d’éthanol pur
par jour (moins d’un verre) et un risque accru d’environ 10 % pour une
consommation de 38 g d’éthanol pur par jour (23 verres par semaine) (Xu
et coll., 2017
). Une
méta-analyse d’études prospectives montre un risque toute cause de
démence réduit d’environ 10 % pour une consommation de 6 g d’éthanol pur
par jour (moins d’un verre) et un risque accru d’environ 10 % pour une
consommation de 38 g d’éthanol pur par jour (23 verres par semaine) (Xu
et coll., 2017 ).
Une étude japonaise récente rapporte aussi un risque réduit de démence
pour une consommation d’alcool inférieure ou égale à 2 verres par jour
(20 g d’éthanol pur) (Liu et coll.,
2019
).
Une étude japonaise récente rapporte aussi un risque réduit de démence
pour une consommation d’alcool inférieure ou égale à 2 verres par jour
(20 g d’éthanol pur) (Liu et coll.,
2019 ). Une
autre étude de cohorte avec un suivi sur 23 ans s’est attachée à
regarder l’association entre le risque de démence et la consommation
d’alcool en fonction de la trajectoire des consommations (Sabia et
coll., 2018
). Une
autre étude de cohorte avec un suivi sur 23 ans s’est attachée à
regarder l’association entre le risque de démence et la consommation
d’alcool en fonction de la trajectoire des consommations (Sabia et
coll., 2018 ).
Les résultats montrent que les adultes abstinents (du milieu de leur vie
et jusque l’âge de sénior) et les consommateurs de plus de 112 g
d’éthanol pur par semaine (11 verres) présentent un risque augmenté de
démence. Le risque de démence augmenté chez les abstinents serait
expliqué en partie à la maladie cardio-métabolique (Sabia et coll.,
2018
).
Les résultats montrent que les adultes abstinents (du milieu de leur vie
et jusque l’âge de sénior) et les consommateurs de plus de 112 g
d’éthanol pur par semaine (11 verres) présentent un risque augmenté de
démence. Le risque de démence augmenté chez les abstinents serait
expliqué en partie à la maladie cardio-métabolique (Sabia et coll.,
2018 ).
).Quand bien même des revues systématiques de qualité modérée suggèreraient
un effet « protecteur » des faibles niveaux de consommation d’alcool
contre la maladie d’Alzheimer et les démences, le niveau de preuve reste
insuffisant pour recommander à des personnes abstinentes d’initier une
consommation d’alcool (Piazza-Gardner et coll.,
2013 ;
Ilomaki et coll., 2015
;
Ilomaki et coll., 2015 ). Si les résultats restent sujet à controverse
pour les faibles niveaux de consommation, il en est différemment pour
les consommations fortes (plus de 6 verres par jour pour les hommes et 4
verres par jour pour les femmes) et chroniques ou irrégulières. Ces
dernières sont associées avec un risque accru de diagnostic d’une
atteinte cognitive ou de démence (Rehm,
2019
). Si les résultats restent sujet à controverse
pour les faibles niveaux de consommation, il en est différemment pour
les consommations fortes (plus de 6 verres par jour pour les hommes et 4
verres par jour pour les femmes) et chroniques ou irrégulières. Ces
dernières sont associées avec un risque accru de diagnostic d’une
atteinte cognitive ou de démence (Rehm,
2019 ).
).
 ;
Ilomaki et coll., 2015
;
Ilomaki et coll., 2015 ). Si les résultats restent sujet à controverse
pour les faibles niveaux de consommation, il en est différemment pour
les consommations fortes (plus de 6 verres par jour pour les hommes et 4
verres par jour pour les femmes) et chroniques ou irrégulières. Ces
dernières sont associées avec un risque accru de diagnostic d’une
atteinte cognitive ou de démence (Rehm,
2019
). Si les résultats restent sujet à controverse
pour les faibles niveaux de consommation, il en est différemment pour
les consommations fortes (plus de 6 verres par jour pour les hommes et 4
verres par jour pour les femmes) et chroniques ou irrégulières. Ces
dernières sont associées avec un risque accru de diagnostic d’une
atteinte cognitive ou de démence (Rehm,
2019 ).
).Une revue de la littérature portant sur 7 études d’imagerie cérébrale par
résonance magnétique (IRM) rapporte que même les faibles niveaux de
consommation d’alcool sont associés à une atrophie cérébrale avec une
diminution du volume de substance grise (neurones) (Verbaten,
2009 ). Ces
atteintes cérébrales pourraient relayer les atteintes cognitives
associées à la consommation d’alcool. Cette même étude rapporte une
association entre les faibles niveaux de consommation avec une
augmentation du volume de substance blanche (myéline) spécifiquement
chez les hommes et aussi avec une meilleure intégrité de la substance
blanche chez les buveurs de plus de 65 ans. Une autre étude d’imagerie
récente et prospective sur 30 ans avec une mesure de la consommation
d’alcool tous les 5 ans rapporte une atrophie de l’hippocampe associée à
une consommation d’alcool faible à modérée (Topiwala et coll.,
2017
). Ces
atteintes cérébrales pourraient relayer les atteintes cognitives
associées à la consommation d’alcool. Cette même étude rapporte une
association entre les faibles niveaux de consommation avec une
augmentation du volume de substance blanche (myéline) spécifiquement
chez les hommes et aussi avec une meilleure intégrité de la substance
blanche chez les buveurs de plus de 65 ans. Une autre étude d’imagerie
récente et prospective sur 30 ans avec une mesure de la consommation
d’alcool tous les 5 ans rapporte une atrophie de l’hippocampe associée à
une consommation d’alcool faible à modérée (Topiwala et coll.,
2017 ).
).
 ). Ces
atteintes cérébrales pourraient relayer les atteintes cognitives
associées à la consommation d’alcool. Cette même étude rapporte une
association entre les faibles niveaux de consommation avec une
augmentation du volume de substance blanche (myéline) spécifiquement
chez les hommes et aussi avec une meilleure intégrité de la substance
blanche chez les buveurs de plus de 65 ans. Une autre étude d’imagerie
récente et prospective sur 30 ans avec une mesure de la consommation
d’alcool tous les 5 ans rapporte une atrophie de l’hippocampe associée à
une consommation d’alcool faible à modérée (Topiwala et coll.,
2017
). Ces
atteintes cérébrales pourraient relayer les atteintes cognitives
associées à la consommation d’alcool. Cette même étude rapporte une
association entre les faibles niveaux de consommation avec une
augmentation du volume de substance blanche (myéline) spécifiquement
chez les hommes et aussi avec une meilleure intégrité de la substance
blanche chez les buveurs de plus de 65 ans. Une autre étude d’imagerie
récente et prospective sur 30 ans avec une mesure de la consommation
d’alcool tous les 5 ans rapporte une atrophie de l’hippocampe associée à
une consommation d’alcool faible à modérée (Topiwala et coll.,
2017 ).
).L’alcool et son métabolite l’acétaldéhyde sont directement toxiques pour
le cerveau et peuvent donc entraîner des dommages structurels et
fonctionnels. La consommation chronique d’alcool entraîne aussi une
déficience en thiamine (vitamine B1) liée à une carence nutritionnelle,
un défaut d’absorption intestinale ou encore un dysfonctionnement de son
utilisation par les cellules. La consommation d’alcool pourrait aussi
constituer un facteur de risque de la maladie d’Alzheimer par
l’induction de mécanismes neuro-inflammatoires (Venkataraman et coll.,
2017 ). Tous
ces mécanismes contribuant au syndrome de Wernicke-Korsakoff. Les
déficits cognitifs pourraient être une conséquence précoce de ce déficit
en thiamine (Dervaux et Laqueille, 2017
). Tous
ces mécanismes contribuant au syndrome de Wernicke-Korsakoff. Les
déficits cognitifs pourraient être une conséquence précoce de ce déficit
en thiamine (Dervaux et Laqueille, 2017 ). L’encéphalopathie de Wernicke est
sous-diagnostiquée et sous-traitée (Dervaux et Laqueille,
2017
). L’encéphalopathie de Wernicke est
sous-diagnostiquée et sous-traitée (Dervaux et Laqueille,
2017 ). La
consommation chronique d’alcool entraîne aussi des dommages cérébraux à
cause de l’encéphalopathie hépatique chez les patients présentant une
cirrhose, ou à cause de l’épilepsie ou encore de traumatisme crânien.
L’alcool est aussi responsable de démence vasculaire à cause d’un risque
cardiovasculaire accru associé à l’hypertension, l’ischémie cardiaque,
les cardiomyopathies et la fibrillation auriculaire.
). La
consommation chronique d’alcool entraîne aussi des dommages cérébraux à
cause de l’encéphalopathie hépatique chez les patients présentant une
cirrhose, ou à cause de l’épilepsie ou encore de traumatisme crânien.
L’alcool est aussi responsable de démence vasculaire à cause d’un risque
cardiovasculaire accru associé à l’hypertension, l’ischémie cardiaque,
les cardiomyopathies et la fibrillation auriculaire.
 ). Tous
ces mécanismes contribuant au syndrome de Wernicke-Korsakoff. Les
déficits cognitifs pourraient être une conséquence précoce de ce déficit
en thiamine (Dervaux et Laqueille, 2017
). Tous
ces mécanismes contribuant au syndrome de Wernicke-Korsakoff. Les
déficits cognitifs pourraient être une conséquence précoce de ce déficit
en thiamine (Dervaux et Laqueille, 2017 ). L’encéphalopathie de Wernicke est
sous-diagnostiquée et sous-traitée (Dervaux et Laqueille,
2017
). L’encéphalopathie de Wernicke est
sous-diagnostiquée et sous-traitée (Dervaux et Laqueille,
2017 ). La
consommation chronique d’alcool entraîne aussi des dommages cérébraux à
cause de l’encéphalopathie hépatique chez les patients présentant une
cirrhose, ou à cause de l’épilepsie ou encore de traumatisme crânien.
L’alcool est aussi responsable de démence vasculaire à cause d’un risque
cardiovasculaire accru associé à l’hypertension, l’ischémie cardiaque,
les cardiomyopathies et la fibrillation auriculaire.
). La
consommation chronique d’alcool entraîne aussi des dommages cérébraux à
cause de l’encéphalopathie hépatique chez les patients présentant une
cirrhose, ou à cause de l’épilepsie ou encore de traumatisme crânien.
L’alcool est aussi responsable de démence vasculaire à cause d’un risque
cardiovasculaire accru associé à l’hypertension, l’ischémie cardiaque,
les cardiomyopathies et la fibrillation auriculaire.Au total, de futures études rigoureuses avec des mesures standardisées et
objectives de la démence et des atteintes cognitives sont nécessaires
pour mieux déterminer les effets des faibles niveaux de consommation
d’alcool. Il semble aussi que le risque de démence associé à la
consommation d’alcool soit largement sous-estimé.
Consommation d’alcool et maladies cardiovasculaires
Des centaines d’études épidémiologiques se sont intéressées au lien entre
la consommation d’alcool et les maladies cardiovasculaires. Le projet
MONICA (1985-1994) a fait couler beaucoup d’encre notamment en France
avec les données suggérant un lien entre la consommation de vin et
d’aliments riches en graisse avec un nombre d’événements et de mortalité
coronaires réduits, qui a conduit au fameux « french paradox »
(Renaud et Lorgeril, 1992 ; Ferrieres,
2004
; Ferrieres,
2004 ). Cette
croyance de potentiels « bienfaits » de l’alcool sur la santé cardiaque
s’est vite installée, pouvant être rapportée par 30 % des patients
interrogés, ces mêmes patients déclarant boire jusqu’à 1,5 fois plus que
ceux ne croyant pas à ces potentiels « bienfaits » de l’alcool (Whitman
et coll., 2015
). Cette
croyance de potentiels « bienfaits » de l’alcool sur la santé cardiaque
s’est vite installée, pouvant être rapportée par 30 % des patients
interrogés, ces mêmes patients déclarant boire jusqu’à 1,5 fois plus que
ceux ne croyant pas à ces potentiels « bienfaits » de l’alcool (Whitman
et coll., 2015 ).
Ces effets ont été rapportés quel que soit le type de boisson, vin,
bière ou spiritueux et d’ailleurs aucune étude à ce jour n’a été pensée
pour démontrer l’effet d’un type de boisson bien spécifique (Dorans et
coll., 2015
).
Ces effets ont été rapportés quel que soit le type de boisson, vin,
bière ou spiritueux et d’ailleurs aucune étude à ce jour n’a été pensée
pour démontrer l’effet d’un type de boisson bien spécifique (Dorans et
coll., 2015 ;
Hange et coll., 2015
;
Hange et coll., 2015 ; Stockwell et coll.,
2016
; Stockwell et coll.,
2016 ). La
démonstration de tels effets, souvent appelés « protecteurs »,
nécessiterait la conduite d’un essai clinique contrôlé et randomisé, qui
n’existe pas à ce jour (Naimi et coll.,
2013
). La
démonstration de tels effets, souvent appelés « protecteurs »,
nécessiterait la conduite d’un essai clinique contrôlé et randomisé, qui
n’existe pas à ce jour (Naimi et coll.,
2013 ), et
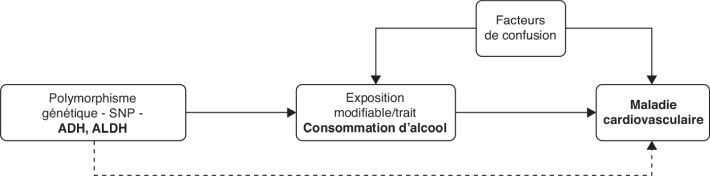
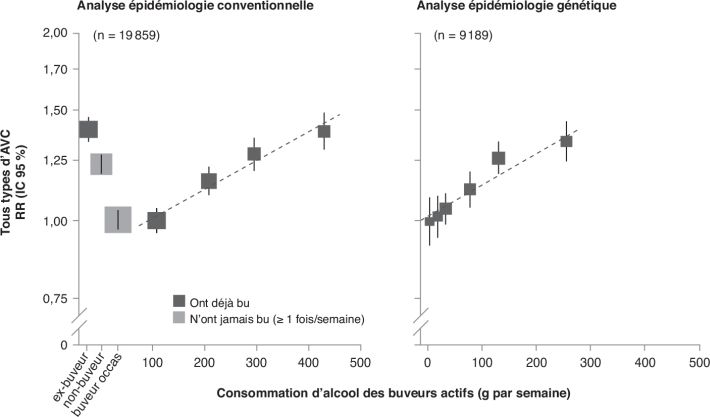
dont la faisabilité et les questions éthiques sont un frein majeur.
D’ailleurs en 2018, l’essai MACH du National Institute on Alcohol
Abuse and Alcoholism (NIAAA), financé à hauteur de $100 millions
principalement par l’industrie de l’alcool et visant à démontrer
l’existence d’effets « protecteurs » de l’alcool sur la santé
cardiovasculaire et le diabète grâce au suivi pendant 10 ans de 7 800
patients a été suspendu par le National Institutes of Health
(NIH) (Wadman, 2018
), et
dont la faisabilité et les questions éthiques sont un frein majeur.
D’ailleurs en 2018, l’essai MACH du National Institute on Alcohol
Abuse and Alcoholism (NIAAA), financé à hauteur de $100 millions
principalement par l’industrie de l’alcool et visant à démontrer
l’existence d’effets « protecteurs » de l’alcool sur la santé
cardiovasculaire et le diabète grâce au suivi pendant 10 ans de 7 800
patients a été suspendu par le National Institutes of Health
(NIH) (Wadman, 2018 ). En plus de confirmer que les problèmes
éthiques et les conflits d’intérêts viennent compliquer ce type d’étude,
il semble clair que la volonté de financer un tel essai clinique indique
l’absence de preuves encore aujourd’hui de ces potentiels effets
« protecteurs ».
). En plus de confirmer que les problèmes
éthiques et les conflits d’intérêts viennent compliquer ce type d’étude,
il semble clair que la volonté de financer un tel essai clinique indique
l’absence de preuves encore aujourd’hui de ces potentiels effets
« protecteurs ».
 ; Ferrieres,
2004
; Ferrieres,
2004 ). Cette
croyance de potentiels « bienfaits » de l’alcool sur la santé cardiaque
s’est vite installée, pouvant être rapportée par 30 % des patients
interrogés, ces mêmes patients déclarant boire jusqu’à 1,5 fois plus que
ceux ne croyant pas à ces potentiels « bienfaits » de l’alcool (Whitman
et coll., 2015
). Cette
croyance de potentiels « bienfaits » de l’alcool sur la santé cardiaque
s’est vite installée, pouvant être rapportée par 30 % des patients
interrogés, ces mêmes patients déclarant boire jusqu’à 1,5 fois plus que
ceux ne croyant pas à ces potentiels « bienfaits » de l’alcool (Whitman
et coll., 2015 ).
Ces effets ont été rapportés quel que soit le type de boisson, vin,
bière ou spiritueux et d’ailleurs aucune étude à ce jour n’a été pensée
pour démontrer l’effet d’un type de boisson bien spécifique (Dorans et
coll., 2015
).
Ces effets ont été rapportés quel que soit le type de boisson, vin,
bière ou spiritueux et d’ailleurs aucune étude à ce jour n’a été pensée
pour démontrer l’effet d’un type de boisson bien spécifique (Dorans et
coll., 2015 ;
Hange et coll., 2015
;
Hange et coll., 2015 ; Stockwell et coll.,
2016
; Stockwell et coll.,
2016 ). La
démonstration de tels effets, souvent appelés « protecteurs »,
nécessiterait la conduite d’un essai clinique contrôlé et randomisé, qui
n’existe pas à ce jour (Naimi et coll.,
2013
). La
démonstration de tels effets, souvent appelés « protecteurs »,
nécessiterait la conduite d’un essai clinique contrôlé et randomisé, qui
n’existe pas à ce jour (Naimi et coll.,
2013 ), et
dont la faisabilité et les questions éthiques sont un frein majeur.
D’ailleurs en 2018, l’essai MACH du National Institute on Alcohol
Abuse and Alcoholism (NIAAA), financé à hauteur de $100 millions
principalement par l’industrie de l’alcool et visant à démontrer
l’existence d’effets « protecteurs » de l’alcool sur la santé
cardiovasculaire et le diabète grâce au suivi pendant 10 ans de 7 800
patients a été suspendu par le National Institutes of Health
(NIH) (Wadman, 2018
), et
dont la faisabilité et les questions éthiques sont un frein majeur.
D’ailleurs en 2018, l’essai MACH du National Institute on Alcohol
Abuse and Alcoholism (NIAAA), financé à hauteur de $100 millions
principalement par l’industrie de l’alcool et visant à démontrer
l’existence d’effets « protecteurs » de l’alcool sur la santé
cardiovasculaire et le diabète grâce au suivi pendant 10 ans de 7 800
patients a été suspendu par le National Institutes of Health
(NIH) (Wadman, 2018 ). En plus de confirmer que les problèmes
éthiques et les conflits d’intérêts viennent compliquer ce type d’étude,
il semble clair que la volonté de financer un tel essai clinique indique
l’absence de preuves encore aujourd’hui de ces potentiels effets
« protecteurs ».
). En plus de confirmer que les problèmes
éthiques et les conflits d’intérêts viennent compliquer ce type d’étude,
il semble clair que la volonté de financer un tel essai clinique indique
l’absence de preuves encore aujourd’hui de ces potentiels effets
« protecteurs ».Les mécanismes par lesquels l’alcool agit sur le système cardiovasculaire
ne sont pas encore complètement connus mais plusieurs mécanismes
« protecteurs » ont été avancés avec notamment : l’augmentation du HDL
cholestérol (« bon cholestérol »), l’amélioration de la sensibilité à
l’insuline, la diminution de l’agrégation plaquettaire, la diminution du
taux de fibrinogène et la diminution de la réponse inflammatoire
systémique (Shirpoor, 2018 ). L’implication de ces mécanismes dans la
physiopathologie des maladies cardiovasculaires reste débattue (Toma et
coll., 2017
). L’implication de ces mécanismes dans la
physiopathologie des maladies cardiovasculaires reste débattue (Toma et
coll., 2017 ).
).
 ). L’implication de ces mécanismes dans la
physiopathologie des maladies cardiovasculaires reste débattue (Toma et
coll., 2017
). L’implication de ces mécanismes dans la
physiopathologie des maladies cardiovasculaires reste débattue (Toma et
coll., 2017 ).
).Concernant le risque de maladie cardiovasculaire, le binge
drinking est connu pour affecter le fonctionnement cardiaque. Le
binge drinking est connu pour provoquer des effets
arythmogènes, communément appelés « syndrome du cœur en vacances »
(Ettinger et coll., 1978 ). Ces effets seraient dus à une libération
importante de catécholamines et les études observationnelles rapportent
des perturbations du rythme cardiaque, une fréquence cardiaque au repos
plus élevée et une élévation de la pression artérielle (Toma et coll.,
2017
). Ces effets seraient dus à une libération
importante de catécholamines et les études observationnelles rapportent
des perturbations du rythme cardiaque, une fréquence cardiaque au repos
plus élevée et une élévation de la pression artérielle (Toma et coll.,
2017 ). Une
étude chez 14 787 jumeaux monozygotes suivis pendant 30 ans rapporte que
les jumeaux déclarant des épisodes de binge drinking présentent
un risque de mortalité accru de 2,82 [IC : 1,3-6,08] (Sipilä et coll.,
2016
). Une
étude chez 14 787 jumeaux monozygotes suivis pendant 30 ans rapporte que
les jumeaux déclarant des épisodes de binge drinking présentent
un risque de mortalité accru de 2,82 [IC : 1,3-6,08] (Sipilä et coll.,
2016 ). Dans
l’étude INTERHEART, une étude cas-contrôle sur l’infarctus du myocarde,
un épisode de binge drinking (≥ 60 g et ≥ 50 g d’alcool en 24 h
chez l’homme et la femme, respectivement) est associé à 40 %
d’augmentation du risque d’infarctus du myocarde dans les 24 h (Leong et
coll., 2014
). Dans
l’étude INTERHEART, une étude cas-contrôle sur l’infarctus du myocarde,
un épisode de binge drinking (≥ 60 g et ≥ 50 g d’alcool en 24 h
chez l’homme et la femme, respectivement) est associé à 40 %
d’augmentation du risque d’infarctus du myocarde dans les 24 h (Leong et
coll., 2014 ) ; ce
risque étant plus élevé la première heure après l’ingestion d’alcool
chez les buveurs non-réguliers (Mostofsky et coll.,
2016
) ; ce
risque étant plus élevé la première heure après l’ingestion d’alcool
chez les buveurs non-réguliers (Mostofsky et coll.,
2016 ).
L’étude de cohorte PURE (Prospective Urban Rural Epidemiological)
rapporte quant à elle que le binge drinking est un prédicteur de
la mortalité globale égal à 1,54 [IC : 1,27-1,87] (Smyth et coll.,
2015
).
L’étude de cohorte PURE (Prospective Urban Rural Epidemiological)
rapporte quant à elle que le binge drinking est un prédicteur de
la mortalité globale égal à 1,54 [IC : 1,27-1,87] (Smyth et coll.,
2015 ).
).
 ). Ces effets seraient dus à une libération
importante de catécholamines et les études observationnelles rapportent
des perturbations du rythme cardiaque, une fréquence cardiaque au repos
plus élevée et une élévation de la pression artérielle (Toma et coll.,
2017
). Ces effets seraient dus à une libération
importante de catécholamines et les études observationnelles rapportent
des perturbations du rythme cardiaque, une fréquence cardiaque au repos
plus élevée et une élévation de la pression artérielle (Toma et coll.,
2017 ). Une
étude chez 14 787 jumeaux monozygotes suivis pendant 30 ans rapporte que
les jumeaux déclarant des épisodes de binge drinking présentent
un risque de mortalité accru de 2,82 [IC : 1,3-6,08] (Sipilä et coll.,
2016
). Une
étude chez 14 787 jumeaux monozygotes suivis pendant 30 ans rapporte que
les jumeaux déclarant des épisodes de binge drinking présentent
un risque de mortalité accru de 2,82 [IC : 1,3-6,08] (Sipilä et coll.,
2016 ). Dans
l’étude INTERHEART, une étude cas-contrôle sur l’infarctus du myocarde,
un épisode de binge drinking (≥ 60 g et ≥ 50 g d’alcool en 24 h
chez l’homme et la femme, respectivement) est associé à 40 %
d’augmentation du risque d’infarctus du myocarde dans les 24 h (Leong et
coll., 2014
). Dans
l’étude INTERHEART, une étude cas-contrôle sur l’infarctus du myocarde,
un épisode de binge drinking (≥ 60 g et ≥ 50 g d’alcool en 24 h
chez l’homme et la femme, respectivement) est associé à 40 %
d’augmentation du risque d’infarctus du myocarde dans les 24 h (Leong et
coll., 2014 ) ; ce
risque étant plus élevé la première heure après l’ingestion d’alcool
chez les buveurs non-réguliers (Mostofsky et coll.,
2016
) ; ce
risque étant plus élevé la première heure après l’ingestion d’alcool
chez les buveurs non-réguliers (Mostofsky et coll.,
2016 ).
L’étude de cohorte PURE (Prospective Urban Rural Epidemiological)
rapporte quant à elle que le binge drinking est un prédicteur de
la mortalité globale égal à 1,54 [IC : 1,27-1,87] (Smyth et coll.,
2015
).
L’étude de cohorte PURE (Prospective Urban Rural Epidemiological)
rapporte quant à elle que le binge drinking est un prédicteur de
la mortalité globale égal à 1,54 [IC : 1,27-1,87] (Smyth et coll.,
2015 ).
).Il est bien établi que la consommation chronique d’alcool à des niveaux
élevés souvent décrite comme la consommation de plus de 6 et 4 verres
standards par jour pour les hommes et les femmes, respectivement, induit
des atteintes du système cardiovasculaire (Rehm et Roerecke,
2017 ). À ces
niveaux de consommation, l’alcool affaiblit directement le muscle
cardiaque, augmente la pression artérielle de manière dose-dépendante et
perturbe le fonctionnement vasculaire (vasomotricité, stress oxydatif).
Les épisodes de forte consommation (≥ 6/≥ 4 verres standards,
hommes/femmes) même chez les personnes qui boivent en moyenne peu
d’alcool augmentent le risque de maladie cardiaque ischémique,
d’accident vasculaire cérébral (AVC) et de troubles du rythme cardiaque
(Rehm et Roerecke, 2017
). À ces
niveaux de consommation, l’alcool affaiblit directement le muscle
cardiaque, augmente la pression artérielle de manière dose-dépendante et
perturbe le fonctionnement vasculaire (vasomotricité, stress oxydatif).
Les épisodes de forte consommation (≥ 6/≥ 4 verres standards,
hommes/femmes) même chez les personnes qui boivent en moyenne peu
d’alcool augmentent le risque de maladie cardiaque ischémique,
d’accident vasculaire cérébral (AVC) et de troubles du rythme cardiaque
(Rehm et Roerecke, 2017 ).
).
 ). À ces
niveaux de consommation, l’alcool affaiblit directement le muscle
cardiaque, augmente la pression artérielle de manière dose-dépendante et
perturbe le fonctionnement vasculaire (vasomotricité, stress oxydatif).
Les épisodes de forte consommation (≥ 6/≥ 4 verres standards,
hommes/femmes) même chez les personnes qui boivent en moyenne peu
d’alcool augmentent le risque de maladie cardiaque ischémique,
d’accident vasculaire cérébral (AVC) et de troubles du rythme cardiaque
(Rehm et Roerecke, 2017
). À ces
niveaux de consommation, l’alcool affaiblit directement le muscle
cardiaque, augmente la pression artérielle de manière dose-dépendante et
perturbe le fonctionnement vasculaire (vasomotricité, stress oxydatif).
Les épisodes de forte consommation (≥ 6/≥ 4 verres standards,
hommes/femmes) même chez les personnes qui boivent en moyenne peu
d’alcool augmentent le risque de maladie cardiaque ischémique,
d’accident vasculaire cérébral (AVC) et de troubles du rythme cardiaque
(Rehm et Roerecke, 2017 ).
).De très nombreuses études de cohortes rapportent des courbes en J (en
référence à la forme de la courbe) pour la relation entre la quantité
d’alcool consommée et les maladies cardiovasculaires indiquant que les
sujets qui ont de faibles niveaux de consommation d’alcool ont un taux
de maladies cardiovasculaires moindre comparativement aux sujets qui
sont abstinents ou qui consomment le plus, même chez les abstinents qui
ont arrêté de boire pour des raisons médicales (Smyth et coll.,
2015 ; Gémes
et coll., 2016
; Gémes
et coll., 2016 ).
Ces résultats ont été retrouvés dans des populations très différentes :
hommes et femmes avec antécédents d’infarctus du myocarde, patients
hypertendus, patients infectés par le VIH, populations de l’est de
l’Asie ou du nord de l’Europe par exemple (Toma et coll.,
2017
).
Ces résultats ont été retrouvés dans des populations très différentes :
hommes et femmes avec antécédents d’infarctus du myocarde, patients
hypertendus, patients infectés par le VIH, populations de l’est de
l’Asie ou du nord de l’Europe par exemple (Toma et coll.,
2017 ). Les
courbes en J sont retrouvées même après correction pour de nombreux
facteurs : âge, sexe, consommation de tabac, ethnie, niveau d’éducation,
revenus, comorbidités, activité physique, régime alimentaire, traitement
médicamenteux (Smyth et coll., 2015
). Les
courbes en J sont retrouvées même après correction pour de nombreux
facteurs : âge, sexe, consommation de tabac, ethnie, niveau d’éducation,
revenus, comorbidités, activité physique, régime alimentaire, traitement
médicamenteux (Smyth et coll., 2015 ). Des méta-analyses récentes rapportent un
risque plus faible de maladies coronariennes (-30 %) et d’insuffisance
cardiaque (-17 %) pour des consommations variables de 12 à 24 g
d’éthanol (1,2 à 2,4 verres standards) par jour comparativement aux
non-buveurs (Zhang et coll., 2014
). Des méta-analyses récentes rapportent un
risque plus faible de maladies coronariennes (-30 %) et d’insuffisance
cardiaque (-17 %) pour des consommations variables de 12 à 24 g
d’éthanol (1,2 à 2,4 verres standards) par jour comparativement aux
non-buveurs (Zhang et coll., 2014 ; Larsson et coll.,
2015
; Larsson et coll.,
2015 ). Cette
réduction du risque serait plus faible chez les femmes comparativement
aux hommes (Zheng et coll., 2015
). Cette
réduction du risque serait plus faible chez les femmes comparativement
aux hommes (Zheng et coll., 2015 ). La courbe en J rapportée pour le risque
d’ischémie cérébrovasculaire n’est cependant pas retrouvée dans deux
autres grandes études épidémiologiques (Smyth et coll.,
2015
). La courbe en J rapportée pour le risque
d’ischémie cérébrovasculaire n’est cependant pas retrouvée dans deux
autres grandes études épidémiologiques (Smyth et coll.,
2015 ;
O’Donnell et coll., 2016
;
O’Donnell et coll., 2016 ). Dans l’étude INTERSROKE incluant les données
de 32 pays, les OR pour l’AVC, l’AVC ischémique et l’AVC hémorragique
associés avec les consommations d’alcool ≤ 14 verres par semaine pour
les femmes et ≤ 21 verres par semaine pour les hommes sont
respectivement de 1,14 [IC : 1,01-1,28], 1,07 [IC : 0,93-1,23] et 1,43
[IC : 1,17-1,74], comparativement aux non-buveurs ou aux anciens buveurs
(O’Donnell et coll., 2016
). Dans l’étude INTERSROKE incluant les données
de 32 pays, les OR pour l’AVC, l’AVC ischémique et l’AVC hémorragique
associés avec les consommations d’alcool ≤ 14 verres par semaine pour
les femmes et ≤ 21 verres par semaine pour les hommes sont
respectivement de 1,14 [IC : 1,01-1,28], 1,07 [IC : 0,93-1,23] et 1,43
[IC : 1,17-1,74], comparativement aux non-buveurs ou aux anciens buveurs
(O’Donnell et coll., 2016 ). Il faut noter que dans cette étude, la
quantité d’éthanol par unité n’est pas précisée (10 g comme en France et
dans les données de l’OMS ou 8 g en Angleterre). Pour des consommations
plus élevées (> 14 verres par semaine pour les femmes et > 21 verres par
semaine pour les hommes, les OR sont respectivement de 2,09 [IC :
1,64-2,67], 2,14 [IC : 1,62-2,82] et 2,44 [IC : 1,64-3,63],
comparativement aux non-buveurs ou aux anciens buveurs (O’Donnell et
coll., 2016
). Il faut noter que dans cette étude, la
quantité d’éthanol par unité n’est pas précisée (10 g comme en France et
dans les données de l’OMS ou 8 g en Angleterre). Pour des consommations
plus élevées (> 14 verres par semaine pour les femmes et > 21 verres par
semaine pour les hommes, les OR sont respectivement de 2,09 [IC :
1,64-2,67], 2,14 [IC : 1,62-2,82] et 2,44 [IC : 1,64-3,63],
comparativement aux non-buveurs ou aux anciens buveurs (O’Donnell et
coll., 2016 ). Un
effet différentiel de l’alcool sur le risque d’AVC et le risque
d’infarctus du myocarde viendrait du fait que l’alcool augmente la
pression artérielle et l’hypertension jouerait un rôle plus important
dans la survenue des AVC. Concernant le risque de fibrillation
auriculaire, une étude a montré qu’il est augmenté de 5 % pour la
consommation de 10 g (1 verre standard) d’alcool : 1,05 [IC : 1,01-1,09]
(Larsson et coll., 2015
). Un
effet différentiel de l’alcool sur le risque d’AVC et le risque
d’infarctus du myocarde viendrait du fait que l’alcool augmente la
pression artérielle et l’hypertension jouerait un rôle plus important
dans la survenue des AVC. Concernant le risque de fibrillation
auriculaire, une étude a montré qu’il est augmenté de 5 % pour la
consommation de 10 g (1 verre standard) d’alcool : 1,05 [IC : 1,01-1,09]
(Larsson et coll., 2015 ). Une méta-analyse récente confirme cette
augmentation du risque de fibrillation auriculaire proportionnel à la
consommation d’alcool : 1,08 [IC : 1,06-1,10], 1,17 [IC : 1,13-1,21],
1,26 [IC : 1,19-1,33], 1,36 [IC : 1,27-1,46], 1,47 [IC : 1,34-1,61],
respectivement pour la consommation de 1, 2, 3, 4 ou 5 verres par jour
(Mcmanus et coll., 2016
). Une méta-analyse récente confirme cette
augmentation du risque de fibrillation auriculaire proportionnel à la
consommation d’alcool : 1,08 [IC : 1,06-1,10], 1,17 [IC : 1,13-1,21],
1,26 [IC : 1,19-1,33], 1,36 [IC : 1,27-1,46], 1,47 [IC : 1,34-1,61],
respectivement pour la consommation de 1, 2, 3, 4 ou 5 verres par jour
(Mcmanus et coll., 2016 ). Même si des voies biologiques ont été
suggérées comme impliquées dans les effets « protecteurs » de l’alcool,
les liens de causalité n’ont jamais été démontrés et ces effets semblent
surestimés (Rehm et Roerecke, 2017
). Même si des voies biologiques ont été
suggérées comme impliquées dans les effets « protecteurs » de l’alcool,
les liens de causalité n’ont jamais été démontrés et ces effets semblent
surestimés (Rehm et Roerecke, 2017 ).
).
 ; Gémes
et coll., 2016
; Gémes
et coll., 2016 ).
Ces résultats ont été retrouvés dans des populations très différentes :
hommes et femmes avec antécédents d’infarctus du myocarde, patients
hypertendus, patients infectés par le VIH, populations de l’est de
l’Asie ou du nord de l’Europe par exemple (Toma et coll.,
2017
).
Ces résultats ont été retrouvés dans des populations très différentes :
hommes et femmes avec antécédents d’infarctus du myocarde, patients
hypertendus, patients infectés par le VIH, populations de l’est de
l’Asie ou du nord de l’Europe par exemple (Toma et coll.,
2017 ). Les
courbes en J sont retrouvées même après correction pour de nombreux
facteurs : âge, sexe, consommation de tabac, ethnie, niveau d’éducation,
revenus, comorbidités, activité physique, régime alimentaire, traitement
médicamenteux (Smyth et coll., 2015
). Les
courbes en J sont retrouvées même après correction pour de nombreux
facteurs : âge, sexe, consommation de tabac, ethnie, niveau d’éducation,
revenus, comorbidités, activité physique, régime alimentaire, traitement
médicamenteux (Smyth et coll., 2015 ). Des méta-analyses récentes rapportent un
risque plus faible de maladies coronariennes (-30 %) et d’insuffisance
cardiaque (-17 %) pour des consommations variables de 12 à 24 g
d’éthanol (1,2 à 2,4 verres standards) par jour comparativement aux
non-buveurs (Zhang et coll., 2014
). Des méta-analyses récentes rapportent un
risque plus faible de maladies coronariennes (-30 %) et d’insuffisance
cardiaque (-17 %) pour des consommations variables de 12 à 24 g
d’éthanol (1,2 à 2,4 verres standards) par jour comparativement aux
non-buveurs (Zhang et coll., 2014 ; Larsson et coll.,
2015
; Larsson et coll.,
2015 ). Cette
réduction du risque serait plus faible chez les femmes comparativement
aux hommes (Zheng et coll., 2015
). Cette
réduction du risque serait plus faible chez les femmes comparativement
aux hommes (Zheng et coll., 2015 ). La courbe en J rapportée pour le risque
d’ischémie cérébrovasculaire n’est cependant pas retrouvée dans deux
autres grandes études épidémiologiques (Smyth et coll.,
2015
). La courbe en J rapportée pour le risque
d’ischémie cérébrovasculaire n’est cependant pas retrouvée dans deux
autres grandes études épidémiologiques (Smyth et coll.,
2015 ;
O’Donnell et coll., 2016
;
O’Donnell et coll., 2016 ). Dans l’étude INTERSROKE incluant les données
de 32 pays, les OR pour l’AVC, l’AVC ischémique et l’AVC hémorragique
associés avec les consommations d’alcool ≤ 14 verres par semaine pour
les femmes et ≤ 21 verres par semaine pour les hommes sont
respectivement de 1,14 [IC : 1,01-1,28], 1,07 [IC : 0,93-1,23] et 1,43
[IC : 1,17-1,74], comparativement aux non-buveurs ou aux anciens buveurs
(O’Donnell et coll., 2016
). Dans l’étude INTERSROKE incluant les données
de 32 pays, les OR pour l’AVC, l’AVC ischémique et l’AVC hémorragique
associés avec les consommations d’alcool ≤ 14 verres par semaine pour
les femmes et ≤ 21 verres par semaine pour les hommes sont
respectivement de 1,14 [IC : 1,01-1,28], 1,07 [IC : 0,93-1,23] et 1,43
[IC : 1,17-1,74], comparativement aux non-buveurs ou aux anciens buveurs
(O’Donnell et coll., 2016 ). Il faut noter que dans cette étude, la
quantité d’éthanol par unité n’est pas précisée (10 g comme en France et
dans les données de l’OMS ou 8 g en Angleterre). Pour des consommations
plus élevées (> 14 verres par semaine pour les femmes et > 21 verres par
semaine pour les hommes, les OR sont respectivement de 2,09 [IC :
1,64-2,67], 2,14 [IC : 1,62-2,82] et 2,44 [IC : 1,64-3,63],
comparativement aux non-buveurs ou aux anciens buveurs (O’Donnell et
coll., 2016
). Il faut noter que dans cette étude, la
quantité d’éthanol par unité n’est pas précisée (10 g comme en France et
dans les données de l’OMS ou 8 g en Angleterre). Pour des consommations
plus élevées (> 14 verres par semaine pour les femmes et > 21 verres par
semaine pour les hommes, les OR sont respectivement de 2,09 [IC :
1,64-2,67], 2,14 [IC : 1,62-2,82] et 2,44 [IC : 1,64-3,63],
comparativement aux non-buveurs ou aux anciens buveurs (O’Donnell et
coll., 2016 ). Un
effet différentiel de l’alcool sur le risque d’AVC et le risque
d’infarctus du myocarde viendrait du fait que l’alcool augmente la
pression artérielle et l’hypertension jouerait un rôle plus important
dans la survenue des AVC. Concernant le risque de fibrillation
auriculaire, une étude a montré qu’il est augmenté de 5 % pour la
consommation de 10 g (1 verre standard) d’alcool : 1,05 [IC : 1,01-1,09]
(Larsson et coll., 2015
). Un
effet différentiel de l’alcool sur le risque d’AVC et le risque
d’infarctus du myocarde viendrait du fait que l’alcool augmente la
pression artérielle et l’hypertension jouerait un rôle plus important
dans la survenue des AVC. Concernant le risque de fibrillation
auriculaire, une étude a montré qu’il est augmenté de 5 % pour la
consommation de 10 g (1 verre standard) d’alcool : 1,05 [IC : 1,01-1,09]
(Larsson et coll., 2015 ). Une méta-analyse récente confirme cette
augmentation du risque de fibrillation auriculaire proportionnel à la
consommation d’alcool : 1,08 [IC : 1,06-1,10], 1,17 [IC : 1,13-1,21],
1,26 [IC : 1,19-1,33], 1,36 [IC : 1,27-1,46], 1,47 [IC : 1,34-1,61],
respectivement pour la consommation de 1, 2, 3, 4 ou 5 verres par jour
(Mcmanus et coll., 2016
). Une méta-analyse récente confirme cette
augmentation du risque de fibrillation auriculaire proportionnel à la
consommation d’alcool : 1,08 [IC : 1,06-1,10], 1,17 [IC : 1,13-1,21],
1,26 [IC : 1,19-1,33], 1,36 [IC : 1,27-1,46], 1,47 [IC : 1,34-1,61],
respectivement pour la consommation de 1, 2, 3, 4 ou 5 verres par jour
(Mcmanus et coll., 2016 ). Même si des voies biologiques ont été
suggérées comme impliquées dans les effets « protecteurs » de l’alcool,
les liens de causalité n’ont jamais été démontrés et ces effets semblent
surestimés (Rehm et Roerecke, 2017
). Même si des voies biologiques ont été
suggérées comme impliquées dans les effets « protecteurs » de l’alcool,
les liens de causalité n’ont jamais été démontrés et ces effets semblent
surestimés (Rehm et Roerecke, 2017 ).
).Plusieurs études récentes remettent en cause l’existence d’une réduction
de risque de mortalité ou de maladie chez les buveurs présentant des
faibles niveaux de consommation d’alcool comparativement aux abstinents
vie-entière ou aux buveurs occasionnels (Knott et coll.,
2015 ;
Goulden, 2016
;
Goulden, 2016 ;
Stockwell et coll., 2016
;
Stockwell et coll., 2016 ; Griswold et coll.,
2018
; Griswold et coll.,
2018 ; Wood
et coll., 2018
; Wood
et coll., 2018 ).
Ainsi, les effets « protecteurs » des faibles consommations d’alcool
reposeraient sur des données erronées ayant abouti à des fausses
croyances (Daube, 2015
).
Ainsi, les effets « protecteurs » des faibles consommations d’alcool
reposeraient sur des données erronées ayant abouti à des fausses
croyances (Daube, 2015 ). Naimi et ses collaborateurs ont ainsi
rapporté en 2015 que 27 (90 %) des 30 potentiels facteurs confondants de
la maladie cardiaque coronarienne sont plus fréquents chez les
abstinents que chez les buveurs présentant de faibles niveaux de
consommation (Naimi et coll., 2005
). Naimi et ses collaborateurs ont ainsi
rapporté en 2015 que 27 (90 %) des 30 potentiels facteurs confondants de
la maladie cardiaque coronarienne sont plus fréquents chez les
abstinents que chez les buveurs présentant de faibles niveaux de
consommation (Naimi et coll., 2005 ). Selon Fillmore et ses collaborateurs,
l’abstinence vie-entière est définie strictement comme « zéro alcool »
et n’inclut donc aucune consommation occasionnelle sur la vie-entière
(même « rarement » ou « presque jamais ») (Fillmore et coll.,
2007
). Selon Fillmore et ses collaborateurs,
l’abstinence vie-entière est définie strictement comme « zéro alcool »
et n’inclut donc aucune consommation occasionnelle sur la vie-entière
(même « rarement » ou « presque jamais ») (Fillmore et coll.,
2007 ). Même
ce type de consommation a été montré être largement sous déclaré
(Stockwell et coll., 2014
). Même
ce type de consommation a été montré être largement sous déclaré
(Stockwell et coll., 2014 ).
).
 ;
Goulden, 2016
;
Goulden, 2016 ;
Stockwell et coll., 2016
;
Stockwell et coll., 2016 ; Griswold et coll.,
2018
; Griswold et coll.,
2018 ; Wood
et coll., 2018
; Wood
et coll., 2018 ).
Ainsi, les effets « protecteurs » des faibles consommations d’alcool
reposeraient sur des données erronées ayant abouti à des fausses
croyances (Daube, 2015
).
Ainsi, les effets « protecteurs » des faibles consommations d’alcool
reposeraient sur des données erronées ayant abouti à des fausses
croyances (Daube, 2015 ). Naimi et ses collaborateurs ont ainsi
rapporté en 2015 que 27 (90 %) des 30 potentiels facteurs confondants de
la maladie cardiaque coronarienne sont plus fréquents chez les
abstinents que chez les buveurs présentant de faibles niveaux de
consommation (Naimi et coll., 2005
). Naimi et ses collaborateurs ont ainsi
rapporté en 2015 que 27 (90 %) des 30 potentiels facteurs confondants de
la maladie cardiaque coronarienne sont plus fréquents chez les
abstinents que chez les buveurs présentant de faibles niveaux de
consommation (Naimi et coll., 2005 ). Selon Fillmore et ses collaborateurs,
l’abstinence vie-entière est définie strictement comme « zéro alcool »
et n’inclut donc aucune consommation occasionnelle sur la vie-entière
(même « rarement » ou « presque jamais ») (Fillmore et coll.,
2007
). Selon Fillmore et ses collaborateurs,
l’abstinence vie-entière est définie strictement comme « zéro alcool »
et n’inclut donc aucune consommation occasionnelle sur la vie-entière
(même « rarement » ou « presque jamais ») (Fillmore et coll.,
2007 ). Même
ce type de consommation a été montré être largement sous déclaré
(Stockwell et coll., 2014
). Même
ce type de consommation a été montré être largement sous déclaré
(Stockwell et coll., 2014 ).
).Parmi les premières critiques évoquées sur les résultats des études
observationnelles rapportant les associations de type courbe en J entre
maladie cardiovasculaire et consommation d’alcool, il y a les fameux
« sick-quitters », personnes qui se sont arrêté de boire pour
des raisons de santé. Cette théorie des « sick-quitters » a été
proposée en 1988 (Shaper et coll., 1988 ). Inclure les « sick-quitters » dans
le groupe de référence le rend artificiellement plus « malade » que le
groupe de buveurs actifs ou celui des abstinents vie-entière et apporte
de la confusion avec un effet de « protection » qui en fait un artéfact.
Les abstinents vie-entière dans les pays riches s’apparentent souvent à
un sous-groupe minoritaire qui diffère des buveurs sur beaucoup
d’aspects (statut socio-économique, religion, régime nutritionnel)
(Naimi et coll., 2005
). Inclure les « sick-quitters » dans
le groupe de référence le rend artificiellement plus « malade » que le
groupe de buveurs actifs ou celui des abstinents vie-entière et apporte
de la confusion avec un effet de « protection » qui en fait un artéfact.
Les abstinents vie-entière dans les pays riches s’apparentent souvent à
un sous-groupe minoritaire qui diffère des buveurs sur beaucoup
d’aspects (statut socio-économique, religion, régime nutritionnel)
(Naimi et coll., 2005 ). Concernant les caractéristiques de style de
vie, la possibilité d’une sur-représentation des buveurs en meilleure
santé, plus résilients et des buveurs avec une consommation à faible
risque dans les études de cohortes comparativement à la population
générale, a été avancée (Naimi et coll.,
2017
). Concernant les caractéristiques de style de
vie, la possibilité d’une sur-représentation des buveurs en meilleure
santé, plus résilients et des buveurs avec une consommation à faible
risque dans les études de cohortes comparativement à la population
générale, a été avancée (Naimi et coll.,
2017 ).
L’abstinence vie-entière est aussi difficilement mesurable dans les
études épidémiologiques. Par exemple, dans une enquête américaine, 53 %
des personnes qui se sont déclarées abstinentes vie-entière,
présentaient en fait une consommation d’alcool quelques années
auparavant et certains avec des niveaux de consommation non négligeables
(Rehm et coll., 2008
).
L’abstinence vie-entière est aussi difficilement mesurable dans les
études épidémiologiques. Par exemple, dans une enquête américaine, 53 %
des personnes qui se sont déclarées abstinentes vie-entière,
présentaient en fait une consommation d’alcool quelques années
auparavant et certains avec des niveaux de consommation non négligeables
(Rehm et coll., 2008 ). Les dernières études observationnelles qui
ont pris en compte les « sick-quitters » montrent que les
associations de type courbe en J sont maintenues même lorsque les
« sick-quitters » sont exclus du groupe de référence (Shaper
et coll., 1988
). Les dernières études observationnelles qui
ont pris en compte les « sick-quitters » montrent que les
associations de type courbe en J sont maintenues même lorsque les
« sick-quitters » sont exclus du groupe de référence (Shaper
et coll., 1988 ;
Larsson et coll., 2014
;
Larsson et coll., 2014 ; Roerecke et Rehm,
2014
; Roerecke et Rehm,
2014 ;
Stockwell et coll., 2016
;
Stockwell et coll., 2016 ). Ce qui est en contradiction avec une autre
étude qui avait suggéré que l’exclusion des anciens buveurs et des
buveurs occasionnels du groupe de référence constitué par les
abstinents, fait disparaître l’association de type courbe en J (Fillmore
et coll., 2007
). Ce qui est en contradiction avec une autre
étude qui avait suggéré que l’exclusion des anciens buveurs et des
buveurs occasionnels du groupe de référence constitué par les
abstinents, fait disparaître l’association de type courbe en J (Fillmore
et coll., 2007 ).
Inversement, re-classifier les anciens buveurs comme des abstinents et
donc les replacer dans le groupe des non-buveurs diminue le risque
relatif chez les buveurs actifs (Makelä et coll.,
2005
).
Inversement, re-classifier les anciens buveurs comme des abstinents et
donc les replacer dans le groupe des non-buveurs diminue le risque
relatif chez les buveurs actifs (Makelä et coll.,
2005 ). Ces
données ont poussé certains auteurs à recommander d’inclure les anciens
buveurs au groupe des buveurs actifs lorsque les buveurs sont comparés
aux abstinents vie-entière et ont proposé que l’exclusion seule des
anciens buveurs du groupe des abstinents ne suffisait pas (Liang et
coll., 2013
). Ces
données ont poussé certains auteurs à recommander d’inclure les anciens
buveurs au groupe des buveurs actifs lorsque les buveurs sont comparés
aux abstinents vie-entière et ont proposé que l’exclusion seule des
anciens buveurs du groupe des abstinents ne suffisait pas (Liang et
coll., 2013 ).
Certains épidémiologistes recommandent quant à eux de prendre le groupe
des buveurs occasionnels (< 1,30 g par jour, environ 1 verre par
semaine) comme groupe de référence (Rehm et coll.,
2008
).
Certains épidémiologistes recommandent quant à eux de prendre le groupe
des buveurs occasionnels (< 1,30 g par jour, environ 1 verre par
semaine) comme groupe de référence (Rehm et coll.,
2008 ;
Stockwell et coll., 2016
;
Stockwell et coll., 2016 ). Une autre étude rapporte un risque réduit
de mortalité liée à une maladie cardiovasculaire associé à la
consommation d’alcool mais seulement lorsque les sujets ne présentaient
pas de maladies chroniques (cardiovasculaires, cancers ou autres) au
moment du recrutement (Bergmann et coll.,
2013
). Une autre étude rapporte un risque réduit
de mortalité liée à une maladie cardiovasculaire associé à la
consommation d’alcool mais seulement lorsque les sujets ne présentaient
pas de maladies chroniques (cardiovasculaires, cancers ou autres) au
moment du recrutement (Bergmann et coll.,
2013 ). Ces
mêmes auteurs suggèrent ainsi que ces risques réduits sont largement dus
à des biais de sélection, aux risques concurrents (par exemple le faible
nombre de décès liés aux maladies coronariennes chez les femmes
consommant le plus d’alcool car les décès sont liés à d’autres causes)
ou encore à la mauvaise catégorisation des individus selon l’estimation
de leur consommation d’alcool (Bergmann et coll.,
2013
). Ces
mêmes auteurs suggèrent ainsi que ces risques réduits sont largement dus
à des biais de sélection, aux risques concurrents (par exemple le faible
nombre de décès liés aux maladies coronariennes chez les femmes
consommant le plus d’alcool car les décès sont liés à d’autres causes)
ou encore à la mauvaise catégorisation des individus selon l’estimation
de leur consommation d’alcool (Bergmann et coll.,
2013 ). Les
risques concurrents sont un problème dans les études de mortalité toute
cause car le risque comparé de différentes maladies varie avec l’âge (la
maladie coronarienne intervient habituellement plus tard dans la vie que
les cancers ou les maladies du foie par exemple). Cela crée donc un
biais dans les études de cohorte et donc particulièrement dans les
cohortes plus âgées (Stockwell et Chikritzhs,
2013
). Les
risques concurrents sont un problème dans les études de mortalité toute
cause car le risque comparé de différentes maladies varie avec l’âge (la
maladie coronarienne intervient habituellement plus tard dans la vie que
les cancers ou les maladies du foie par exemple). Cela crée donc un
biais dans les études de cohorte et donc particulièrement dans les
cohortes plus âgées (Stockwell et Chikritzhs,
2013 ). Il
est frappant de constater que ce biais de sélection dû à la mortalité
prématurée, lorsqu’il est pris en considération chez les 20-49 ans et
ajouté à la mortalité mesurée chez les plus de 50 ans, entraîne une
augmentation des chiffres de mortalité liée à l’alcool de 86 % et de la
perte des années de vie due à l’alcool de 250 % (Naimi et coll.,
2019
). Il
est frappant de constater que ce biais de sélection dû à la mortalité
prématurée, lorsqu’il est pris en considération chez les 20-49 ans et
ajouté à la mortalité mesurée chez les plus de 50 ans, entraîne une
augmentation des chiffres de mortalité liée à l’alcool de 86 % et de la
perte des années de vie due à l’alcool de 250 % (Naimi et coll.,
2019 ). Les
auteurs de cette dernière étude américaine rapportent que dans leurs
propres cohortes, l’âge moyen lors du recrutement est d’au moins 50 ans
(Naimi et coll., 2019
). Les
auteurs de cette dernière étude américaine rapportent que dans leurs
propres cohortes, l’âge moyen lors du recrutement est d’au moins 50 ans
(Naimi et coll., 2019 ). Il est important aussi de savoir que dans
cette dernière étude, les auteurs n’ont pas intégré la mortalité jusqu’à
l’âge de 19 ans car selon eux la mortalité est liée essentiellement à
des causes particulières comme par exemple les accidents de la route
liés à l’alcool et que les consommateurs d’alcool commencent en général
à boire à partir de 20 ans.
). Il est important aussi de savoir que dans
cette dernière étude, les auteurs n’ont pas intégré la mortalité jusqu’à
l’âge de 19 ans car selon eux la mortalité est liée essentiellement à
des causes particulières comme par exemple les accidents de la route
liés à l’alcool et que les consommateurs d’alcool commencent en général
à boire à partir de 20 ans.
 ). Inclure les « sick-quitters » dans
le groupe de référence le rend artificiellement plus « malade » que le
groupe de buveurs actifs ou celui des abstinents vie-entière et apporte
de la confusion avec un effet de « protection » qui en fait un artéfact.
Les abstinents vie-entière dans les pays riches s’apparentent souvent à
un sous-groupe minoritaire qui diffère des buveurs sur beaucoup
d’aspects (statut socio-économique, religion, régime nutritionnel)
(Naimi et coll., 2005
). Inclure les « sick-quitters » dans
le groupe de référence le rend artificiellement plus « malade » que le
groupe de buveurs actifs ou celui des abstinents vie-entière et apporte
de la confusion avec un effet de « protection » qui en fait un artéfact.
Les abstinents vie-entière dans les pays riches s’apparentent souvent à
un sous-groupe minoritaire qui diffère des buveurs sur beaucoup
d’aspects (statut socio-économique, religion, régime nutritionnel)
(Naimi et coll., 2005 ). Concernant les caractéristiques de style de
vie, la possibilité d’une sur-représentation des buveurs en meilleure
santé, plus résilients et des buveurs avec une consommation à faible
risque dans les études de cohortes comparativement à la population
générale, a été avancée (Naimi et coll.,
2017
). Concernant les caractéristiques de style de
vie, la possibilité d’une sur-représentation des buveurs en meilleure
santé, plus résilients et des buveurs avec une consommation à faible
risque dans les études de cohortes comparativement à la population
générale, a été avancée (Naimi et coll.,
2017 ).
L’abstinence vie-entière est aussi difficilement mesurable dans les
études épidémiologiques. Par exemple, dans une enquête américaine, 53 %
des personnes qui se sont déclarées abstinentes vie-entière,
présentaient en fait une consommation d’alcool quelques années
auparavant et certains avec des niveaux de consommation non négligeables
(Rehm et coll., 2008
).
L’abstinence vie-entière est aussi difficilement mesurable dans les
études épidémiologiques. Par exemple, dans une enquête américaine, 53 %
des personnes qui se sont déclarées abstinentes vie-entière,
présentaient en fait une consommation d’alcool quelques années
auparavant et certains avec des niveaux de consommation non négligeables
(Rehm et coll., 2008 ). Les dernières études observationnelles qui
ont pris en compte les « sick-quitters » montrent que les
associations de type courbe en J sont maintenues même lorsque les
« sick-quitters » sont exclus du groupe de référence (Shaper
et coll., 1988
). Les dernières études observationnelles qui
ont pris en compte les « sick-quitters » montrent que les
associations de type courbe en J sont maintenues même lorsque les
« sick-quitters » sont exclus du groupe de référence (Shaper
et coll., 1988 ;
Larsson et coll., 2014
;
Larsson et coll., 2014 ; Roerecke et Rehm,
2014
; Roerecke et Rehm,
2014 ;
Stockwell et coll., 2016
;
Stockwell et coll., 2016 ). Ce qui est en contradiction avec une autre
étude qui avait suggéré que l’exclusion des anciens buveurs et des
buveurs occasionnels du groupe de référence constitué par les
abstinents, fait disparaître l’association de type courbe en J (Fillmore
et coll., 2007
). Ce qui est en contradiction avec une autre
étude qui avait suggéré que l’exclusion des anciens buveurs et des
buveurs occasionnels du groupe de référence constitué par les
abstinents, fait disparaître l’association de type courbe en J (Fillmore
et coll., 2007 ).
Inversement, re-classifier les anciens buveurs comme des abstinents et
donc les replacer dans le groupe des non-buveurs diminue le risque
relatif chez les buveurs actifs (Makelä et coll.,
2005
).
Inversement, re-classifier les anciens buveurs comme des abstinents et
donc les replacer dans le groupe des non-buveurs diminue le risque
relatif chez les buveurs actifs (Makelä et coll.,
2005 ). Ces
données ont poussé certains auteurs à recommander d’inclure les anciens
buveurs au groupe des buveurs actifs lorsque les buveurs sont comparés
aux abstinents vie-entière et ont proposé que l’exclusion seule des
anciens buveurs du groupe des abstinents ne suffisait pas (Liang et
coll., 2013
). Ces
données ont poussé certains auteurs à recommander d’inclure les anciens
buveurs au groupe des buveurs actifs lorsque les buveurs sont comparés
aux abstinents vie-entière et ont proposé que l’exclusion seule des
anciens buveurs du groupe des abstinents ne suffisait pas (Liang et
coll., 2013 ).
Certains épidémiologistes recommandent quant à eux de prendre le groupe
des buveurs occasionnels (< 1,30 g par jour, environ 1 verre par
semaine) comme groupe de référence (Rehm et coll.,
2008
).
Certains épidémiologistes recommandent quant à eux de prendre le groupe
des buveurs occasionnels (< 1,30 g par jour, environ 1 verre par
semaine) comme groupe de référence (Rehm et coll.,
2008 ;
Stockwell et coll., 2016
;
Stockwell et coll., 2016 ). Une autre étude rapporte un risque réduit
de mortalité liée à une maladie cardiovasculaire associé à la
consommation d’alcool mais seulement lorsque les sujets ne présentaient
pas de maladies chroniques (cardiovasculaires, cancers ou autres) au
moment du recrutement (Bergmann et coll.,
2013
). Une autre étude rapporte un risque réduit
de mortalité liée à une maladie cardiovasculaire associé à la
consommation d’alcool mais seulement lorsque les sujets ne présentaient
pas de maladies chroniques (cardiovasculaires, cancers ou autres) au
moment du recrutement (Bergmann et coll.,
2013 ). Ces
mêmes auteurs suggèrent ainsi que ces risques réduits sont largement dus
à des biais de sélection, aux risques concurrents (par exemple le faible
nombre de décès liés aux maladies coronariennes chez les femmes
consommant le plus d’alcool car les décès sont liés à d’autres causes)
ou encore à la mauvaise catégorisation des individus selon l’estimation
de leur consommation d’alcool (Bergmann et coll.,
2013
). Ces
mêmes auteurs suggèrent ainsi que ces risques réduits sont largement dus
à des biais de sélection, aux risques concurrents (par exemple le faible
nombre de décès liés aux maladies coronariennes chez les femmes
consommant le plus d’alcool car les décès sont liés à d’autres causes)
ou encore à la mauvaise catégorisation des individus selon l’estimation
de leur consommation d’alcool (Bergmann et coll.,
2013 ). Les
risques concurrents sont un problème dans les études de mortalité toute
cause car le risque comparé de différentes maladies varie avec l’âge (la
maladie coronarienne intervient habituellement plus tard dans la vie que
les cancers ou les maladies du foie par exemple). Cela crée donc un
biais dans les études de cohorte et donc particulièrement dans les
cohortes plus âgées (Stockwell et Chikritzhs,
2013
). Les
risques concurrents sont un problème dans les études de mortalité toute
cause car le risque comparé de différentes maladies varie avec l’âge (la
maladie coronarienne intervient habituellement plus tard dans la vie que
les cancers ou les maladies du foie par exemple). Cela crée donc un
biais dans les études de cohorte et donc particulièrement dans les
cohortes plus âgées (Stockwell et Chikritzhs,
2013 ). Il
est frappant de constater que ce biais de sélection dû à la mortalité
prématurée, lorsqu’il est pris en considération chez les 20-49 ans et
ajouté à la mortalité mesurée chez les plus de 50 ans, entraîne une
augmentation des chiffres de mortalité liée à l’alcool de 86 % et de la
perte des années de vie due à l’alcool de 250 % (Naimi et coll.,
2019
). Il
est frappant de constater que ce biais de sélection dû à la mortalité
prématurée, lorsqu’il est pris en considération chez les 20-49 ans et
ajouté à la mortalité mesurée chez les plus de 50 ans, entraîne une
augmentation des chiffres de mortalité liée à l’alcool de 86 % et de la
perte des années de vie due à l’alcool de 250 % (Naimi et coll.,
2019 ). Les
auteurs de cette dernière étude américaine rapportent que dans leurs
propres cohortes, l’âge moyen lors du recrutement est d’au moins 50 ans
(Naimi et coll., 2019
). Les
auteurs de cette dernière étude américaine rapportent que dans leurs
propres cohortes, l’âge moyen lors du recrutement est d’au moins 50 ans
(Naimi et coll., 2019 ). Il est important aussi de savoir que dans
cette dernière étude, les auteurs n’ont pas intégré la mortalité jusqu’à
l’âge de 19 ans car selon eux la mortalité est liée essentiellement à
des causes particulières comme par exemple les accidents de la route
liés à l’alcool et que les consommateurs d’alcool commencent en général
à boire à partir de 20 ans.
). Il est important aussi de savoir que dans
cette dernière étude, les auteurs n’ont pas intégré la mortalité jusqu’à
l’âge de 19 ans car selon eux la mortalité est liée essentiellement à
des causes particulières comme par exemple les accidents de la route
liés à l’alcool et que les consommateurs d’alcool commencent en général
à boire à partir de 20 ans.Une méta-analyse récente sur plus de 4 millions de personnes a montré que
lorsque les anciens buveurs sont exclus du groupe de référence, et
lorsque les études sont contrôlées pour leur qualité, chez les sujets
présentant un faible niveau de consommation d’alcool (1,3 à 24,9 g
d’éthanol par jour soit moins de 2,5 verres standards par jour), aucune
association de type courbe en J pouvant laisser croire à des effets
« protecteurs », n’est obtenue (Stockwell et coll.,
2016 ). Sur
les 87 études retenues dans cette méta-analyse, 65 incluaient les
anciens buveurs dans le groupe de référence des abstinents, 50
incluaient les buveurs occasionnels et seulement 13 étaient exemptes de
ces biais de classification des abstinents. Cette dernière étude est une
des rares à avoir analysé non seulement les facteurs confondants
habituels mais à avoir aussi analysé l’influence du design des
études. Elle montre assez clairement que la prise en compte de la
plupart des facteurs de confusion (tabac, origine ethnique ou raciale,
abstinents, valeurs aberrantes) explique sur le plan statistique la
diminution du risque de mortalité chez les buveurs avec les faibles
niveaux de consommation (voir figure 2.5
). Sur
les 87 études retenues dans cette méta-analyse, 65 incluaient les
anciens buveurs dans le groupe de référence des abstinents, 50
incluaient les buveurs occasionnels et seulement 13 étaient exemptes de
ces biais de classification des abstinents. Cette dernière étude est une
des rares à avoir analysé non seulement les facteurs confondants
habituels mais à avoir aussi analysé l’influence du design des
études. Elle montre assez clairement que la prise en compte de la
plupart des facteurs de confusion (tabac, origine ethnique ou raciale,
abstinents, valeurs aberrantes) explique sur le plan statistique la
diminution du risque de mortalité chez les buveurs avec les faibles
niveaux de consommation (voir figure 2.5 ). De la même manière, cette étude montre aussi
que le design des études influence le risque et que, seules, les
études de meilleure qualité ne montrent aucune réduction du risque
(figure 2.5
). De la même manière, cette étude montre aussi
que le design des études influence le risque et que, seules, les
études de meilleure qualité ne montrent aucune réduction du risque
(figure 2.5 ). Des auteurs ont
cependant souligné que cette étude aurait exclu plusieurs études de
qualité (Barrett-Connor et coll., 2016
). Des auteurs ont
cependant souligné que cette étude aurait exclu plusieurs études de
qualité (Barrett-Connor et coll., 2016 ) et ont remis en cause la validité de la
méta-analyse (Ding et Mukamal, 2017
) et ont remis en cause la validité de la
méta-analyse (Ding et Mukamal, 2017 ).
).
 ). Sur
les 87 études retenues dans cette méta-analyse, 65 incluaient les
anciens buveurs dans le groupe de référence des abstinents, 50
incluaient les buveurs occasionnels et seulement 13 étaient exemptes de
ces biais de classification des abstinents. Cette dernière étude est une
des rares à avoir analysé non seulement les facteurs confondants
habituels mais à avoir aussi analysé l’influence du design des
études. Elle montre assez clairement que la prise en compte de la
plupart des facteurs de confusion (tabac, origine ethnique ou raciale,
abstinents, valeurs aberrantes) explique sur le plan statistique la
diminution du risque de mortalité chez les buveurs avec les faibles
niveaux de consommation (voir figure 2.5
). Sur
les 87 études retenues dans cette méta-analyse, 65 incluaient les
anciens buveurs dans le groupe de référence des abstinents, 50
incluaient les buveurs occasionnels et seulement 13 étaient exemptes de
ces biais de classification des abstinents. Cette dernière étude est une
des rares à avoir analysé non seulement les facteurs confondants
habituels mais à avoir aussi analysé l’influence du design des
études. Elle montre assez clairement que la prise en compte de la
plupart des facteurs de confusion (tabac, origine ethnique ou raciale,
abstinents, valeurs aberrantes) explique sur le plan statistique la
diminution du risque de mortalité chez les buveurs avec les faibles
niveaux de consommation (voir figure 2.5 ). De la même manière, cette étude montre aussi
que le design des études influence le risque et que, seules, les
études de meilleure qualité ne montrent aucune réduction du risque
(figure 2.5
). De la même manière, cette étude montre aussi
que le design des études influence le risque et que, seules, les
études de meilleure qualité ne montrent aucune réduction du risque
(figure 2.5 ). Des auteurs ont
cependant souligné que cette étude aurait exclu plusieurs études de
qualité (Barrett-Connor et coll., 2016
). Des auteurs ont
cependant souligné que cette étude aurait exclu plusieurs études de
qualité (Barrett-Connor et coll., 2016 ) et ont remis en cause la validité de la
méta-analyse (Ding et Mukamal, 2017
) et ont remis en cause la validité de la
méta-analyse (Ding et Mukamal, 2017 ).
).Ces résultats sont en accord avec ceux d’une étude de cohorte basée sur
dix populations différentes qui montre que lorsque le groupe de
référence des non-buveurs exclut les anciens buveurs et que l’analyse
est stratifiée sur l’âge, l’association de type courbe en J est
maintenue seulement chez les femmes de plus de 65 ans (Knott et coll.,
2015 ). Une
autre étude récente réalisée en Espagne chez 3 045 individus de plus de
60 ans non institutionnalisés ne montre aucun effet protecteur des
faibles niveaux de consommation d’alcool (selon les auteurs :
consommation occasionnelle (< 1,43 g/j), légère (≥ 1,43 et
< 20 g/j pour les hommes et ≥ 1,43 et < 10 g/j pour les femmes),
modérée (≥ 20 et < 40 g/j pour les hommes et ≥ 10 et < 20 g/j pour
les femmes) ou forte/binge (≥ 40 g/j pour les hommes et ≥ 24 g/j
pour les femmes) en contrôlant de nombreux facteurs de confusion dont le
biais des abstinents et de causalité inverse (Ortolá et coll.,
2019
). Une
autre étude récente réalisée en Espagne chez 3 045 individus de plus de
60 ans non institutionnalisés ne montre aucun effet protecteur des
faibles niveaux de consommation d’alcool (selon les auteurs :
consommation occasionnelle (< 1,43 g/j), légère (≥ 1,43 et
< 20 g/j pour les hommes et ≥ 1,43 et < 10 g/j pour les femmes),
modérée (≥ 20 et < 40 g/j pour les hommes et ≥ 10 et < 20 g/j pour
les femmes) ou forte/binge (≥ 40 g/j pour les hommes et ≥ 24 g/j
pour les femmes) en contrôlant de nombreux facteurs de confusion dont le
biais des abstinents et de causalité inverse (Ortolá et coll.,
2019 ). Sans
la prise en compte de la différence de facteurs de risques
cardiovasculaires entre les buveurs et les non-buveurs, il semble clair
que les facteurs de confusion constituent un sérieux problème dans la
méthodologie et les conclusions de telles études (Toma et coll.,
2017
). Sans
la prise en compte de la différence de facteurs de risques
cardiovasculaires entre les buveurs et les non-buveurs, il semble clair
que les facteurs de confusion constituent un sérieux problème dans la
méthodologie et les conclusions de telles études (Toma et coll.,
2017 ). La
plupart des facteurs de confusion ont de plus tendance à surestimer de
potentiels effets « protecteurs ». Cet effet « protecteur » est invalidé
par les études épidémiologiques génétiques, dites de randomisation
mendélienne (voir infra). D’autres questions sont soulevées dans
les études comme la sous-estimation de la consommation d’alcool par les
buveurs actifs et son impact sur l’estimation des risques (Butt et
coll., 2011
). La
plupart des facteurs de confusion ont de plus tendance à surestimer de
potentiels effets « protecteurs ». Cet effet « protecteur » est invalidé
par les études épidémiologiques génétiques, dites de randomisation
mendélienne (voir infra). D’autres questions sont soulevées dans
les études comme la sous-estimation de la consommation d’alcool par les
buveurs actifs et son impact sur l’estimation des risques (Butt et
coll., 2011 ;
Pflaum et coll., 2016
;
Pflaum et coll., 2016 ), ou encore la vente d’alcool et la
consommation d’alcool non enregistrée (Rehm et coll.,
2014
), ou encore la vente d’alcool et la
consommation d’alcool non enregistrée (Rehm et coll.,
2014 ), la
variation de la consommation d’alcool au cours de la vie (la
consommation d’alcool vie-entière pourrait être un meilleur critère)
(Britton et coll., 2015
), la
variation de la consommation d’alcool au cours de la vie (la
consommation d’alcool vie-entière pourrait être un meilleur critère)
(Britton et coll., 2015 ). La sous-déclaration de la consommation
d’alcool est fréquemment rapportée dans les études (Feunekes et coll.,
1999
). La sous-déclaration de la consommation
d’alcool est fréquemment rapportée dans les études (Feunekes et coll.,
1999 ;
Sommers et coll., 2000
;
Sommers et coll., 2000 ), comme par exemple celles sur l’hypertension
(Klatsky et coll., 2006
), comme par exemple celles sur l’hypertension
(Klatsky et coll., 2006 ) ou les cancers (Klatsky et coll.,
2014
) ou les cancers (Klatsky et coll.,
2014 ).
D’ailleurs, concernant les cancers il a été suggéré qu’un risque de
cancer accru dès les faibles niveaux de consommation d’alcool devrait
être considéré lorsqu’on s’interroge sur la balance bénéfice/risque de
la consommation d’alcool (Klatsky, 2015
).
D’ailleurs, concernant les cancers il a été suggéré qu’un risque de
cancer accru dès les faibles niveaux de consommation d’alcool devrait
être considéré lorsqu’on s’interroge sur la balance bénéfice/risque de
la consommation d’alcool (Klatsky, 2015 ).
).
 ). Une
autre étude récente réalisée en Espagne chez 3 045 individus de plus de
60 ans non institutionnalisés ne montre aucun effet protecteur des
faibles niveaux de consommation d’alcool (selon les auteurs :
consommation occasionnelle (< 1,43 g/j), légère (≥ 1,43 et
< 20 g/j pour les hommes et ≥ 1,43 et < 10 g/j pour les femmes),
modérée (≥ 20 et < 40 g/j pour les hommes et ≥ 10 et < 20 g/j pour
les femmes) ou forte/binge (≥ 40 g/j pour les hommes et ≥ 24 g/j
pour les femmes) en contrôlant de nombreux facteurs de confusion dont le
biais des abstinents et de causalité inverse (Ortolá et coll.,
2019
). Une
autre étude récente réalisée en Espagne chez 3 045 individus de plus de
60 ans non institutionnalisés ne montre aucun effet protecteur des
faibles niveaux de consommation d’alcool (selon les auteurs :
consommation occasionnelle (< 1,43 g/j), légère (≥ 1,43 et
< 20 g/j pour les hommes et ≥ 1,43 et < 10 g/j pour les femmes),
modérée (≥ 20 et < 40 g/j pour les hommes et ≥ 10 et < 20 g/j pour
les femmes) ou forte/binge (≥ 40 g/j pour les hommes et ≥ 24 g/j
pour les femmes) en contrôlant de nombreux facteurs de confusion dont le
biais des abstinents et de causalité inverse (Ortolá et coll.,
2019 ). Sans
la prise en compte de la différence de facteurs de risques
cardiovasculaires entre les buveurs et les non-buveurs, il semble clair
que les facteurs de confusion constituent un sérieux problème dans la
méthodologie et les conclusions de telles études (Toma et coll.,
2017
). Sans
la prise en compte de la différence de facteurs de risques
cardiovasculaires entre les buveurs et les non-buveurs, il semble clair
que les facteurs de confusion constituent un sérieux problème dans la
méthodologie et les conclusions de telles études (Toma et coll.,
2017 ). La
plupart des facteurs de confusion ont de plus tendance à surestimer de
potentiels effets « protecteurs ». Cet effet « protecteur » est invalidé
par les études épidémiologiques génétiques, dites de randomisation
mendélienne (voir infra). D’autres questions sont soulevées dans
les études comme la sous-estimation de la consommation d’alcool par les
buveurs actifs et son impact sur l’estimation des risques (Butt et
coll., 2011
). La
plupart des facteurs de confusion ont de plus tendance à surestimer de
potentiels effets « protecteurs ». Cet effet « protecteur » est invalidé
par les études épidémiologiques génétiques, dites de randomisation
mendélienne (voir infra). D’autres questions sont soulevées dans
les études comme la sous-estimation de la consommation d’alcool par les
buveurs actifs et son impact sur l’estimation des risques (Butt et
coll., 2011 ;
Pflaum et coll., 2016
;
Pflaum et coll., 2016 ), ou encore la vente d’alcool et la
consommation d’alcool non enregistrée (Rehm et coll.,
2014
), ou encore la vente d’alcool et la
consommation d’alcool non enregistrée (Rehm et coll.,
2014 ), la
variation de la consommation d’alcool au cours de la vie (la
consommation d’alcool vie-entière pourrait être un meilleur critère)
(Britton et coll., 2015
), la
variation de la consommation d’alcool au cours de la vie (la
consommation d’alcool vie-entière pourrait être un meilleur critère)
(Britton et coll., 2015 ). La sous-déclaration de la consommation
d’alcool est fréquemment rapportée dans les études (Feunekes et coll.,
1999
). La sous-déclaration de la consommation
d’alcool est fréquemment rapportée dans les études (Feunekes et coll.,
1999 ;
Sommers et coll., 2000
;
Sommers et coll., 2000 ), comme par exemple celles sur l’hypertension
(Klatsky et coll., 2006
), comme par exemple celles sur l’hypertension
(Klatsky et coll., 2006 ) ou les cancers (Klatsky et coll.,
2014
) ou les cancers (Klatsky et coll.,
2014 ).
D’ailleurs, concernant les cancers il a été suggéré qu’un risque de
cancer accru dès les faibles niveaux de consommation d’alcool devrait
être considéré lorsqu’on s’interroge sur la balance bénéfice/risque de
la consommation d’alcool (Klatsky, 2015
).
D’ailleurs, concernant les cancers il a été suggéré qu’un risque de
cancer accru dès les faibles niveaux de consommation d’alcool devrait
être considéré lorsqu’on s’interroge sur la balance bénéfice/risque de
la consommation d’alcool (Klatsky, 2015 ).
).Consommation d’alcool et cancers
L’éthanol fait partie du groupe 1 des carcinogènes selon l’agence
internationale de recherche sur le cancer (IARC) de l’OMS. Les cancers
liés à l’alcool ont un risque relatif d’incidence augmenté, en général
modeste, à de faibles niveaux de consommation (Hamajima et coll.,
2002 ; Corrao
et coll., 2004
; Corrao
et coll., 2004 ;
Allen et coll., 2009
;
Allen et coll., 2009 ; Cao et coll., 2015
; Cao et coll., 2015 ; Romieu et coll.,
2015
; Romieu et coll.,
2015 ). Les
effets cancérigènes de l’alcool et son métabolite, l’acétaldéhyde,
passent par différentes voies dont la modification du taux de certaines
hormones par exemple (Shield et coll., 2013
). Les
effets cancérigènes de l’alcool et son métabolite, l’acétaldéhyde,
passent par différentes voies dont la modification du taux de certaines
hormones par exemple (Shield et coll., 2013 ).
).
 ; Corrao
et coll., 2004
; Corrao
et coll., 2004 ;
Allen et coll., 2009
;
Allen et coll., 2009 ; Cao et coll., 2015
; Cao et coll., 2015 ; Romieu et coll.,
2015
; Romieu et coll.,
2015 ). Les
effets cancérigènes de l’alcool et son métabolite, l’acétaldéhyde,
passent par différentes voies dont la modification du taux de certaines
hormones par exemple (Shield et coll., 2013
). Les
effets cancérigènes de l’alcool et son métabolite, l’acétaldéhyde,
passent par différentes voies dont la modification du taux de certaines
hormones par exemple (Shield et coll., 2013 ).
).Le discours sur le risque de cancer dès les faibles niveaux de
consommation d’alcool a évolué ces deux dernières décennies. En 2003, la
3e édition de l’ECAC (European Code Against
Cancer) déclarait « Si vous buvez de l’alcool, bière, vin ou
spiritueux, limitez votre consommation à 2 verres/jour si vous êtes un
homme et à 1 verre/jour si vous êtes une femme ». En 2015, l’IARC dans
la 4e édition de l’ECAC déclarait « si vous buvez de
l’alcool, tout type de boisson alcoolisée, limitez votre consommation.
Ne pas boire est la meilleure option pour prévenir le cancer ». Ainsi,
l’IARC, le fonds de recherche mondial sur le cancer et l’institut
américain de la recherche sur le cancer ont tous déclaré qu’il n’existe
pas de niveau de consommation d’alcool sans risque pour la santé (Baan
et coll., 2007 ;
Miles, 2008
;
Miles, 2008 ;
Secretan et coll., 2009
;
Secretan et coll., 2009 ; Latino-Martel et coll.,
2011
; Latino-Martel et coll.,
2011 ). Cette
évolution a été prise en compte récemment dans les recommandations en
Angleterre qui stipulent que toute consommation d’alcool peut être
associée au risque de cancers et qu’il n’y aucune justification à
consommer de l’alcool pour des raisons de santé (Department of
Health, 2016
). Cette
évolution a été prise en compte récemment dans les recommandations en
Angleterre qui stipulent que toute consommation d’alcool peut être
associée au risque de cancers et qu’il n’y aucune justification à
consommer de l’alcool pour des raisons de santé (Department of
Health, 2016 ).
).
 ;
Miles, 2008
;
Miles, 2008 ;
Secretan et coll., 2009
;
Secretan et coll., 2009 ; Latino-Martel et coll.,
2011
; Latino-Martel et coll.,
2011 ). Cette
évolution a été prise en compte récemment dans les recommandations en
Angleterre qui stipulent que toute consommation d’alcool peut être
associée au risque de cancers et qu’il n’y aucune justification à
consommer de l’alcool pour des raisons de santé (Department of
Health, 2016
). Cette
évolution a été prise en compte récemment dans les recommandations en
Angleterre qui stipulent que toute consommation d’alcool peut être
associée au risque de cancers et qu’il n’y aucune justification à
consommer de l’alcool pour des raisons de santé (Department of
Health, 2016 ).
).L’alcool est généralement perçu comme une drogue moins dangereuse par le
grand public particulièrement en termes de cancers, et ceci en dépit
d’être directement lié à certains cancers : oropharynx, larynx,
œsophage, colorectum (particulièrement chez les hommes), foie et conduit
biliaire intra-hépatique et sein (Hill,
2003 ; IARC
Working Group on the Evaluation of Carcinogenic Risks to
Humans, 2010
; IARC
Working Group on the Evaluation of Carcinogenic Risks to
Humans, 2010 ; Bagnardi et coll.,
2015
; Bagnardi et coll.,
2015 ; Shield
et coll., 2018
; Shield
et coll., 2018 ).
D’autres cancers ont aussi été proposés comme ayant un risque augmenté
avec la consommation d’alcool, notamment les cancers de la vésicule
biliaire, l’estomac, le pancréas et la prostate alors que le risque de
cancer du rein serait diminué (World Cancer Research Fund,
2015
).
D’autres cancers ont aussi été proposés comme ayant un risque augmenté
avec la consommation d’alcool, notamment les cancers de la vésicule
biliaire, l’estomac, le pancréas et la prostate alors que le risque de
cancer du rein serait diminué (World Cancer Research Fund,
2015 ;
Wozniak et coll., 2015
;
Wozniak et coll., 2015 ; World Cancer Research
Fund/American Institute for Cancer Research,
2018
; World Cancer Research
Fund/American Institute for Cancer Research,
2018 ). Même
des faibles niveaux de consommation d’alcool (< 20 g/j soit 2 verres
standards) ont été associés à un risque accru de cancer (Cao et coll.,
2015
). Même
des faibles niveaux de consommation d’alcool (< 20 g/j soit 2 verres
standards) ont été associés à un risque accru de cancer (Cao et coll.,
2015 ).
).
 ; IARC
Working Group on the Evaluation of Carcinogenic Risks to
Humans, 2010
; IARC
Working Group on the Evaluation of Carcinogenic Risks to
Humans, 2010 ; Bagnardi et coll.,
2015
; Bagnardi et coll.,
2015 ; Shield
et coll., 2018
; Shield
et coll., 2018 ).
D’autres cancers ont aussi été proposés comme ayant un risque augmenté
avec la consommation d’alcool, notamment les cancers de la vésicule
biliaire, l’estomac, le pancréas et la prostate alors que le risque de
cancer du rein serait diminué (World Cancer Research Fund,
2015
).
D’autres cancers ont aussi été proposés comme ayant un risque augmenté
avec la consommation d’alcool, notamment les cancers de la vésicule
biliaire, l’estomac, le pancréas et la prostate alors que le risque de
cancer du rein serait diminué (World Cancer Research Fund,
2015 ;
Wozniak et coll., 2015
;
Wozniak et coll., 2015 ; World Cancer Research
Fund/American Institute for Cancer Research,
2018
; World Cancer Research
Fund/American Institute for Cancer Research,
2018 ). Même
des faibles niveaux de consommation d’alcool (< 20 g/j soit 2 verres
standards) ont été associés à un risque accru de cancer (Cao et coll.,
2015
). Même
des faibles niveaux de consommation d’alcool (< 20 g/j soit 2 verres
standards) ont été associés à un risque accru de cancer (Cao et coll.,
2015 ).
).Une étude récente en Angleterre montre que 19,5 % (40/205) des femmes
interrogées identifient l’alcool comme un facteur de risque du cancer du
sein, contre 48,5 % (16/33) des professionnels de santé interrogés
(Sinclair et coll., 2019 ). Une autre enquête anglaise en 2015 sur
2 100 adultes montrait déjà que seuls 13 % des interrogés nommaient la
consommation d’alcool comme facteur de risque des cancers (Buykx et
coll., 2016
). Une autre enquête anglaise en 2015 sur
2 100 adultes montrait déjà que seuls 13 % des interrogés nommaient la
consommation d’alcool comme facteur de risque des cancers (Buykx et
coll., 2016 ). De
manière intéressante, une étude visant à trouver des arguments pour
améliorer la communication sur les risques de cancer associés à la
consommation d’alcool, a mesuré le risque absolu de cancer lié à
l’alcool en « équivalent cigarette » (Hydes et coll.,
2019
). De
manière intéressante, une étude visant à trouver des arguments pour
améliorer la communication sur les risques de cancer associés à la
consommation d’alcool, a mesuré le risque absolu de cancer lié à
l’alcool en « équivalent cigarette » (Hydes et coll.,
2019 ). Ainsi
le risque absolu de cancer vie-entière chez les non-fumeurs consommant
une bouteille de vin (80 g d’éthanol ou 8 verres standards) par semaine
est de 1 % chez les hommes et 1,4 % chez les femmes. Les auteurs
rapportent que le risque absolu de cancer lié à la consommation de 8
verres standards par semaine est équivalent à celui lié à 5 et 10
cigarettes par semaine chez les hommes et les femmes, respectivement
(Hydes et coll., 2019
). Ainsi
le risque absolu de cancer vie-entière chez les non-fumeurs consommant
une bouteille de vin (80 g d’éthanol ou 8 verres standards) par semaine
est de 1 % chez les hommes et 1,4 % chez les femmes. Les auteurs
rapportent que le risque absolu de cancer lié à la consommation de 8
verres standards par semaine est équivalent à celui lié à 5 et 10
cigarettes par semaine chez les hommes et les femmes, respectivement
(Hydes et coll., 2019 ). Le risque passe à 1,9 % chez les hommes et
3,6 % chez les femmes pour la consommation de 24 verres standards par
semaine et il est alors équivalent à celui lié à 8 et 23 cigarettes par
semaine chez les hommes et les femmes, respectivement.
). Le risque passe à 1,9 % chez les hommes et
3,6 % chez les femmes pour la consommation de 24 verres standards par
semaine et il est alors équivalent à celui lié à 8 et 23 cigarettes par
semaine chez les hommes et les femmes, respectivement.
 ). Une autre enquête anglaise en 2015 sur
2 100 adultes montrait déjà que seuls 13 % des interrogés nommaient la
consommation d’alcool comme facteur de risque des cancers (Buykx et
coll., 2016
). Une autre enquête anglaise en 2015 sur
2 100 adultes montrait déjà que seuls 13 % des interrogés nommaient la
consommation d’alcool comme facteur de risque des cancers (Buykx et
coll., 2016 ). De
manière intéressante, une étude visant à trouver des arguments pour
améliorer la communication sur les risques de cancer associés à la
consommation d’alcool, a mesuré le risque absolu de cancer lié à
l’alcool en « équivalent cigarette » (Hydes et coll.,
2019
). De
manière intéressante, une étude visant à trouver des arguments pour
améliorer la communication sur les risques de cancer associés à la
consommation d’alcool, a mesuré le risque absolu de cancer lié à
l’alcool en « équivalent cigarette » (Hydes et coll.,
2019 ). Ainsi
le risque absolu de cancer vie-entière chez les non-fumeurs consommant
une bouteille de vin (80 g d’éthanol ou 8 verres standards) par semaine
est de 1 % chez les hommes et 1,4 % chez les femmes. Les auteurs
rapportent que le risque absolu de cancer lié à la consommation de 8
verres standards par semaine est équivalent à celui lié à 5 et 10
cigarettes par semaine chez les hommes et les femmes, respectivement
(Hydes et coll., 2019
). Ainsi
le risque absolu de cancer vie-entière chez les non-fumeurs consommant
une bouteille de vin (80 g d’éthanol ou 8 verres standards) par semaine
est de 1 % chez les hommes et 1,4 % chez les femmes. Les auteurs
rapportent que le risque absolu de cancer lié à la consommation de 8
verres standards par semaine est équivalent à celui lié à 5 et 10
cigarettes par semaine chez les hommes et les femmes, respectivement
(Hydes et coll., 2019 ). Le risque passe à 1,9 % chez les hommes et
3,6 % chez les femmes pour la consommation de 24 verres standards par
semaine et il est alors équivalent à celui lié à 8 et 23 cigarettes par
semaine chez les hommes et les femmes, respectivement.
). Le risque passe à 1,9 % chez les hommes et
3,6 % chez les femmes pour la consommation de 24 verres standards par
semaine et il est alors équivalent à celui lié à 8 et 23 cigarettes par
semaine chez les hommes et les femmes, respectivement.Une étude récente a estimé les nouveaux cas de cancers attribuables à
différents niveaux de consommation d’alcool en France en 2015 et a aussi
mesuré l’impact d’une diminution de 10 % de la consommation d’alcool
(Shield et coll., 2018 ). Dans cette étude, une période de latence de
10 ans a été choisie pour le délai entre l’exposition et le diagnostic.
Cette étude montre qu’environ 8 % de tous les nouveaux cas de cancers
sont liés à l’alcool et que la consommation à des niveaux faibles à
modérés contribue particulièrement à ce fardeau sanitaire. Les niveaux
de consommation d’alcool utilisés dans cette étude correspondent aux
niveaux de risque de consommation de l’OMS : faible (< 20 g/j pour
les femmes et < 40 g/j pour les hommes), modéré (20 à < 40 g/j
pour les femmes et 40 à < 60 g/j pour les hommes), fort (≥ 40 g/j
pour les femmes et ≥ 60 g/j pour les hommes). Les résultats montrent que
27 894 [IC 95 % : 24287-30996] ou 7,9 % de tous les nouveaux cas de
cancers sont attribuables à l’alcool. Les cancers du sein, de la cavité
orale, de l’oropharynx, de l’hypopharynx et colorectal contribuent le
plus aux nouveaux cas de cancers attribuables à l’alcool. La plus grande
proportion de cancers causés par l’alcool concerne l’œsophage et le
foie. L’incidence des cancers attribuables à l’alcool est similaire
entre hommes et femmes avec le cancer de l’œsophage qui présente la plus
grande fraction attribuable à l’alcool (57,7 %). Même si les hommes
consomment plus d’alcool que les femmes, l’incidence des cancers
attribuables à l’alcool est similaire à cause du nombre important de
nouveaux cas de cancers du sein. Chez les hommes, ce sont les cancers de
la cavité orale et du pharynx qui sont les plus nombreux. Les niveaux de
consommation d’alcool faible, modéré et fort sont responsables
respectivement de 1,5, 1,3 et 4,4 % des nouveaux cas de cancers. Les
anciens buveurs comptent pour 0,6 % des nouveaux cas de cancers.
). Dans cette étude, une période de latence de
10 ans a été choisie pour le délai entre l’exposition et le diagnostic.
Cette étude montre qu’environ 8 % de tous les nouveaux cas de cancers
sont liés à l’alcool et que la consommation à des niveaux faibles à
modérés contribue particulièrement à ce fardeau sanitaire. Les niveaux
de consommation d’alcool utilisés dans cette étude correspondent aux
niveaux de risque de consommation de l’OMS : faible (< 20 g/j pour
les femmes et < 40 g/j pour les hommes), modéré (20 à < 40 g/j
pour les femmes et 40 à < 60 g/j pour les hommes), fort (≥ 40 g/j
pour les femmes et ≥ 60 g/j pour les hommes). Les résultats montrent que
27 894 [IC 95 % : 24287-30996] ou 7,9 % de tous les nouveaux cas de
cancers sont attribuables à l’alcool. Les cancers du sein, de la cavité
orale, de l’oropharynx, de l’hypopharynx et colorectal contribuent le
plus aux nouveaux cas de cancers attribuables à l’alcool. La plus grande
proportion de cancers causés par l’alcool concerne l’œsophage et le
foie. L’incidence des cancers attribuables à l’alcool est similaire
entre hommes et femmes avec le cancer de l’œsophage qui présente la plus
grande fraction attribuable à l’alcool (57,7 %). Même si les hommes
consomment plus d’alcool que les femmes, l’incidence des cancers
attribuables à l’alcool est similaire à cause du nombre important de
nouveaux cas de cancers du sein. Chez les hommes, ce sont les cancers de
la cavité orale et du pharynx qui sont les plus nombreux. Les niveaux de
consommation d’alcool faible, modéré et fort sont responsables
respectivement de 1,5, 1,3 et 4,4 % des nouveaux cas de cancers. Les
anciens buveurs comptent pour 0,6 % des nouveaux cas de cancers.
 ). Dans cette étude, une période de latence de
10 ans a été choisie pour le délai entre l’exposition et le diagnostic.
Cette étude montre qu’environ 8 % de tous les nouveaux cas de cancers
sont liés à l’alcool et que la consommation à des niveaux faibles à
modérés contribue particulièrement à ce fardeau sanitaire. Les niveaux
de consommation d’alcool utilisés dans cette étude correspondent aux
niveaux de risque de consommation de l’OMS : faible (< 20 g/j pour
les femmes et < 40 g/j pour les hommes), modéré (20 à < 40 g/j
pour les femmes et 40 à < 60 g/j pour les hommes), fort (≥ 40 g/j
pour les femmes et ≥ 60 g/j pour les hommes). Les résultats montrent que
27 894 [IC 95 % : 24287-30996] ou 7,9 % de tous les nouveaux cas de
cancers sont attribuables à l’alcool. Les cancers du sein, de la cavité
orale, de l’oropharynx, de l’hypopharynx et colorectal contribuent le
plus aux nouveaux cas de cancers attribuables à l’alcool. La plus grande
proportion de cancers causés par l’alcool concerne l’œsophage et le
foie. L’incidence des cancers attribuables à l’alcool est similaire
entre hommes et femmes avec le cancer de l’œsophage qui présente la plus
grande fraction attribuable à l’alcool (57,7 %). Même si les hommes
consomment plus d’alcool que les femmes, l’incidence des cancers
attribuables à l’alcool est similaire à cause du nombre important de
nouveaux cas de cancers du sein. Chez les hommes, ce sont les cancers de
la cavité orale et du pharynx qui sont les plus nombreux. Les niveaux de
consommation d’alcool faible, modéré et fort sont responsables
respectivement de 1,5, 1,3 et 4,4 % des nouveaux cas de cancers. Les
anciens buveurs comptent pour 0,6 % des nouveaux cas de cancers.
). Dans cette étude, une période de latence de
10 ans a été choisie pour le délai entre l’exposition et le diagnostic.
Cette étude montre qu’environ 8 % de tous les nouveaux cas de cancers
sont liés à l’alcool et que la consommation à des niveaux faibles à
modérés contribue particulièrement à ce fardeau sanitaire. Les niveaux
de consommation d’alcool utilisés dans cette étude correspondent aux
niveaux de risque de consommation de l’OMS : faible (< 20 g/j pour
les femmes et < 40 g/j pour les hommes), modéré (20 à < 40 g/j
pour les femmes et 40 à < 60 g/j pour les hommes), fort (≥ 40 g/j
pour les femmes et ≥ 60 g/j pour les hommes). Les résultats montrent que
27 894 [IC 95 % : 24287-30996] ou 7,9 % de tous les nouveaux cas de
cancers sont attribuables à l’alcool. Les cancers du sein, de la cavité
orale, de l’oropharynx, de l’hypopharynx et colorectal contribuent le
plus aux nouveaux cas de cancers attribuables à l’alcool. La plus grande
proportion de cancers causés par l’alcool concerne l’œsophage et le
foie. L’incidence des cancers attribuables à l’alcool est similaire
entre hommes et femmes avec le cancer de l’œsophage qui présente la plus
grande fraction attribuable à l’alcool (57,7 %). Même si les hommes
consomment plus d’alcool que les femmes, l’incidence des cancers
attribuables à l’alcool est similaire à cause du nombre important de
nouveaux cas de cancers du sein. Chez les hommes, ce sont les cancers de
la cavité orale et du pharynx qui sont les plus nombreux. Les niveaux de
consommation d’alcool faible, modéré et fort sont responsables
respectivement de 1,5, 1,3 et 4,4 % des nouveaux cas de cancers. Les
anciens buveurs comptent pour 0,6 % des nouveaux cas de cancers.Cette étude révèle que les niveaux de consommation faibles à modérés
contribuent largement aux nouveaux cas de cancers en France en 2015
(figure 2.6 ). Les niveaux de
consommation faibles à modérés contribuent largement aux nouveaux cas de
cancers du sein alors que les niveaux de forte consommation contribuent
au cancer du foie.
). Les niveaux de
consommation faibles à modérés contribuent largement aux nouveaux cas de
cancers du sein alors que les niveaux de forte consommation contribuent
au cancer du foie.
 ). Les niveaux de
consommation faibles à modérés contribuent largement aux nouveaux cas de
cancers du sein alors que les niveaux de forte consommation contribuent
au cancer du foie.
). Les niveaux de
consommation faibles à modérés contribuent largement aux nouveaux cas de
cancers du sein alors que les niveaux de forte consommation contribuent
au cancer du foie. | Figure 2.6 : Nouveaux cas de cancers en fonction du niveau
de consommation chez les hommes et les femmes en 2015 (d’après
Shield et coll., 2018 ) ) |
Enfin, il est frappant de constater que la réduction de 10 % de la
consommation d’alcool permettrait d’éviter 2 178 [IC 95 % : 1687-2601]
nouveaux cancers en 2015 en France. Il faut rappeler que la France est
un des États membres à avoir ratifié un des objectifs du plan d’action
sur les maladies non transmissibles de l’OMS visant à diminuer la
consommation d’alcool de 10 % (World Health Organization,
2013 ). Une
autre étude, réalisée en Australie, suggère aussi que l’arrêt de la
consommation d’alcool et la diminution brutale de la consommation
d’alcool au niveau des repères de recommandations nationales concernant
l’alcool sur 5 ans, permettraient respectivement d’éviter 4 % ou 2 % des
cancers sur une période de 25 ans (Wilson et coll.,
2019
). Une
autre étude, réalisée en Australie, suggère aussi que l’arrêt de la
consommation d’alcool et la diminution brutale de la consommation
d’alcool au niveau des repères de recommandations nationales concernant
l’alcool sur 5 ans, permettraient respectivement d’éviter 4 % ou 2 % des
cancers sur une période de 25 ans (Wilson et coll.,
2019 ).
).
 ). Une
autre étude, réalisée en Australie, suggère aussi que l’arrêt de la
consommation d’alcool et la diminution brutale de la consommation
d’alcool au niveau des repères de recommandations nationales concernant
l’alcool sur 5 ans, permettraient respectivement d’éviter 4 % ou 2 % des
cancers sur une période de 25 ans (Wilson et coll.,
2019
). Une
autre étude, réalisée en Australie, suggère aussi que l’arrêt de la
consommation d’alcool et la diminution brutale de la consommation
d’alcool au niveau des repères de recommandations nationales concernant
l’alcool sur 5 ans, permettraient respectivement d’éviter 4 % ou 2 % des
cancers sur une période de 25 ans (Wilson et coll.,
2019 ).
).Une analyse poolée de 53 études avec 58 515 femmes présentant un cancer
du sein a été une des premières à révéler que la consommation de faibles
niveaux d’alcool est associée avec un risque augmenté de cancer du sein
indépendamment de la consommation de tabac (Hamajima et coll.,
2002 ).
L’étude anglaise « un million de femmes » montre un excès d’incidence de
15 pour 1 000 cas de cancers à chaque augmentation d’un verre standard
par jour, 11 pour 1 000 étant des cas de cancers du sein (Hydes et
coll., 2019
).
L’étude anglaise « un million de femmes » montre un excès d’incidence de
15 pour 1 000 cas de cancers à chaque augmentation d’un verre standard
par jour, 11 pour 1 000 étant des cas de cancers du sein (Hydes et
coll., 2019 ).
Cette augmentation du risque de certains cancers due à la consommation
de faibles niveaux d’alcool chez la femme est démontrée dans de
nombreuses études, dont certaines précisent que le cancer du sein
contribue fortement à cette augmentation (Cao et coll.,
2015
).
Cette augmentation du risque de certains cancers due à la consommation
de faibles niveaux d’alcool chez la femme est démontrée dans de
nombreuses études, dont certaines précisent que le cancer du sein
contribue fortement à cette augmentation (Cao et coll.,
2015 ). En
Angleterre, l’augmentation de la consommation d’alcool observée pendant
la dernière décennie a été proposée comme un facteur déterminant dans
l’augmentation de 30 % de l’incidence du cancer du sein (36 509 en 2003
versus 55 122 en 2015) (Cancer Research UK ; Hydes et
coll., 2019
). En
Angleterre, l’augmentation de la consommation d’alcool observée pendant
la dernière décennie a été proposée comme un facteur déterminant dans
l’augmentation de 30 % de l’incidence du cancer du sein (36 509 en 2003
versus 55 122 en 2015) (Cancer Research UK ; Hydes et
coll., 2019 ).
).
 ).
L’étude anglaise « un million de femmes » montre un excès d’incidence de
15 pour 1 000 cas de cancers à chaque augmentation d’un verre standard
par jour, 11 pour 1 000 étant des cas de cancers du sein (Hydes et
coll., 2019
).
L’étude anglaise « un million de femmes » montre un excès d’incidence de
15 pour 1 000 cas de cancers à chaque augmentation d’un verre standard
par jour, 11 pour 1 000 étant des cas de cancers du sein (Hydes et
coll., 2019 ).
Cette augmentation du risque de certains cancers due à la consommation
de faibles niveaux d’alcool chez la femme est démontrée dans de
nombreuses études, dont certaines précisent que le cancer du sein
contribue fortement à cette augmentation (Cao et coll.,
2015
).
Cette augmentation du risque de certains cancers due à la consommation
de faibles niveaux d’alcool chez la femme est démontrée dans de
nombreuses études, dont certaines précisent que le cancer du sein
contribue fortement à cette augmentation (Cao et coll.,
2015 ). En
Angleterre, l’augmentation de la consommation d’alcool observée pendant
la dernière décennie a été proposée comme un facteur déterminant dans
l’augmentation de 30 % de l’incidence du cancer du sein (36 509 en 2003
versus 55 122 en 2015) (Cancer Research UK ; Hydes et
coll., 2019
). En
Angleterre, l’augmentation de la consommation d’alcool observée pendant
la dernière décennie a été proposée comme un facteur déterminant dans
l’augmentation de 30 % de l’incidence du cancer du sein (36 509 en 2003
versus 55 122 en 2015) (Cancer Research UK ; Hydes et
coll., 2019 ).
).Une méta-analyse d’études de cohortes (60 cohortes et 135 publications)
s’est récemment intéressée à l’association entre les faibles, voire très
faibles, niveaux de consommation et le risque de cancer (Choi et coll.,
2018 ). Les
résultats des précédentes études apparaissent comme contradictoires en
fonction du type d’étude. En effet, alors que les méta-analyses des
études cas-contrôles mettent en évidence une association entre faibles
niveaux de consommation d’alcool et certains cancers, les méta-analyses
d’études de cohortes ne retrouvent pas une telle association
(oropharynx, larynx, œsophage, colorectum et foie), sauf pour le cancer
du sein (Bagnardi et coll., 2013
). Les
résultats des précédentes études apparaissent comme contradictoires en
fonction du type d’étude. En effet, alors que les méta-analyses des
études cas-contrôles mettent en évidence une association entre faibles
niveaux de consommation d’alcool et certains cancers, les méta-analyses
d’études de cohortes ne retrouvent pas une telle association
(oropharynx, larynx, œsophage, colorectum et foie), sauf pour le cancer
du sein (Bagnardi et coll., 2013 ; Myung, 2016
; Myung, 2016 ; Choi et coll.,
2018
; Choi et coll.,
2018 ).
Concernant le cancer du sein, une revue récente rapporte que les
méta-analyses montrent une association positive, non-linéaire (ou
linéaire pour certaines études) et faible entre consommation d’alcool et
risque de cancer du sein (Zakhari et Hoek,
2018
).
Concernant le cancer du sein, une revue récente rapporte que les
méta-analyses montrent une association positive, non-linéaire (ou
linéaire pour certaines études) et faible entre consommation d’alcool et
risque de cancer du sein (Zakhari et Hoek,
2018 ). La
prise en compte des « sick-quitters » a pour effet d’augmenter de
manière importante le risque relatif de certains cancers (Zhao et coll.,
2016
). La
prise en compte des « sick-quitters » a pour effet d’augmenter de
manière importante le risque relatif de certains cancers (Zhao et coll.,
2016 ).
).
 ). Les
résultats des précédentes études apparaissent comme contradictoires en
fonction du type d’étude. En effet, alors que les méta-analyses des
études cas-contrôles mettent en évidence une association entre faibles
niveaux de consommation d’alcool et certains cancers, les méta-analyses
d’études de cohortes ne retrouvent pas une telle association
(oropharynx, larynx, œsophage, colorectum et foie), sauf pour le cancer
du sein (Bagnardi et coll., 2013
). Les
résultats des précédentes études apparaissent comme contradictoires en
fonction du type d’étude. En effet, alors que les méta-analyses des
études cas-contrôles mettent en évidence une association entre faibles
niveaux de consommation d’alcool et certains cancers, les méta-analyses
d’études de cohortes ne retrouvent pas une telle association
(oropharynx, larynx, œsophage, colorectum et foie), sauf pour le cancer
du sein (Bagnardi et coll., 2013 ; Myung, 2016
; Myung, 2016 ; Choi et coll.,
2018
; Choi et coll.,
2018 ).
Concernant le cancer du sein, une revue récente rapporte que les
méta-analyses montrent une association positive, non-linéaire (ou
linéaire pour certaines études) et faible entre consommation d’alcool et
risque de cancer du sein (Zakhari et Hoek,
2018
).
Concernant le cancer du sein, une revue récente rapporte que les
méta-analyses montrent une association positive, non-linéaire (ou
linéaire pour certaines études) et faible entre consommation d’alcool et
risque de cancer du sein (Zakhari et Hoek,
2018 ). La
prise en compte des « sick-quitters » a pour effet d’augmenter de
manière importante le risque relatif de certains cancers (Zhao et coll.,
2016
). La
prise en compte des « sick-quitters » a pour effet d’augmenter de
manière importante le risque relatif de certains cancers (Zhao et coll.,
2016 ).
).L’étude de Choi et de ses collaborateurs (Choi et coll.,
2018 ) a
étudié le risque de différents cancers (incidence et mortalité) selon
différents niveaux de consommation d’alcool : très faible (≤ 0,5
verre/j), léger (≤ 1 verre/j) et modéré (1 à 2 verres/j), en prenant
12,5 g d’éthanol par verre. Les principaux résultats de cette étude
montrent que comparativement aux non-buveurs ou buveurs occasionnels,
les très faibles (≤ 0,5 verre/j) et faibles (≤ 1 verre/j) niveaux de
consommation d’alcool n’augmentent pas l’incidence de la plupart des
cancers sauf pour le cancer du sein et chez les hommes le cancer
colorectal qui est augmentée respectivement de 9 % (RR = 1,09 [IC 95 % :
1,06-1,12] et 6 % (RR = 1,06 [IC 95 % : 1,01-1,11]. À l’inverse, chez
les hommes et les femmes, le faible niveau de consommation est associé
de manière significative à une diminution de l’incidence du cancer du
poumon et une tendance est observée avec le cancer de la thyroïde. La
consommation de 1 à 2 verres standards par jour augmente de manière
significative l’incidence du cancer colorectal chez les hommes et du
cancer du sein alors qu’il réduit l’incidence du cancer du sang dans les
deux sexes. Concernant la mortalité, cette étude ne permet pas de
conclure car le nombre d’études incluses est insuffisant (Choi et coll.,
2018
) a
étudié le risque de différents cancers (incidence et mortalité) selon
différents niveaux de consommation d’alcool : très faible (≤ 0,5
verre/j), léger (≤ 1 verre/j) et modéré (1 à 2 verres/j), en prenant
12,5 g d’éthanol par verre. Les principaux résultats de cette étude
montrent que comparativement aux non-buveurs ou buveurs occasionnels,
les très faibles (≤ 0,5 verre/j) et faibles (≤ 1 verre/j) niveaux de
consommation d’alcool n’augmentent pas l’incidence de la plupart des
cancers sauf pour le cancer du sein et chez les hommes le cancer
colorectal qui est augmentée respectivement de 9 % (RR = 1,09 [IC 95 % :
1,06-1,12] et 6 % (RR = 1,06 [IC 95 % : 1,01-1,11]. À l’inverse, chez
les hommes et les femmes, le faible niveau de consommation est associé
de manière significative à une diminution de l’incidence du cancer du
poumon et une tendance est observée avec le cancer de la thyroïde. La
consommation de 1 à 2 verres standards par jour augmente de manière
significative l’incidence du cancer colorectal chez les hommes et du
cancer du sein alors qu’il réduit l’incidence du cancer du sang dans les
deux sexes. Concernant la mortalité, cette étude ne permet pas de
conclure car le nombre d’études incluses est insuffisant (Choi et coll.,
2018 ). Cette
étude met donc en lumière le fait que les faibles niveaux de
consommation d’alcool peuvent à la fois augmenter ou diminuer le risque
de certains cancers. Les auteurs suggèrent différents mécanismes
potentiellement impliqués dans les effets de l’alcool avec notamment un
effet sur les taux d’œstrogènes et de leurs récepteurs, les régulations
épigénétiques, les mécanismes de réparation de l’ADN. Relativement à la
diminution de l’incidence du cancer du poumon, un effet
anti-inflammatoire des faibles niveaux de consommation est suggéré.
). Cette
étude met donc en lumière le fait que les faibles niveaux de
consommation d’alcool peuvent à la fois augmenter ou diminuer le risque
de certains cancers. Les auteurs suggèrent différents mécanismes
potentiellement impliqués dans les effets de l’alcool avec notamment un
effet sur les taux d’œstrogènes et de leurs récepteurs, les régulations
épigénétiques, les mécanismes de réparation de l’ADN. Relativement à la
diminution de l’incidence du cancer du poumon, un effet
anti-inflammatoire des faibles niveaux de consommation est suggéré.
 ) a
étudié le risque de différents cancers (incidence et mortalité) selon
différents niveaux de consommation d’alcool : très faible (≤ 0,5
verre/j), léger (≤ 1 verre/j) et modéré (1 à 2 verres/j), en prenant
12,5 g d’éthanol par verre. Les principaux résultats de cette étude
montrent que comparativement aux non-buveurs ou buveurs occasionnels,
les très faibles (≤ 0,5 verre/j) et faibles (≤ 1 verre/j) niveaux de
consommation d’alcool n’augmentent pas l’incidence de la plupart des
cancers sauf pour le cancer du sein et chez les hommes le cancer
colorectal qui est augmentée respectivement de 9 % (RR = 1,09 [IC 95 % :
1,06-1,12] et 6 % (RR = 1,06 [IC 95 % : 1,01-1,11]. À l’inverse, chez
les hommes et les femmes, le faible niveau de consommation est associé
de manière significative à une diminution de l’incidence du cancer du
poumon et une tendance est observée avec le cancer de la thyroïde. La
consommation de 1 à 2 verres standards par jour augmente de manière
significative l’incidence du cancer colorectal chez les hommes et du
cancer du sein alors qu’il réduit l’incidence du cancer du sang dans les
deux sexes. Concernant la mortalité, cette étude ne permet pas de
conclure car le nombre d’études incluses est insuffisant (Choi et coll.,
2018
) a
étudié le risque de différents cancers (incidence et mortalité) selon
différents niveaux de consommation d’alcool : très faible (≤ 0,5
verre/j), léger (≤ 1 verre/j) et modéré (1 à 2 verres/j), en prenant
12,5 g d’éthanol par verre. Les principaux résultats de cette étude
montrent que comparativement aux non-buveurs ou buveurs occasionnels,
les très faibles (≤ 0,5 verre/j) et faibles (≤ 1 verre/j) niveaux de
consommation d’alcool n’augmentent pas l’incidence de la plupart des
cancers sauf pour le cancer du sein et chez les hommes le cancer
colorectal qui est augmentée respectivement de 9 % (RR = 1,09 [IC 95 % :
1,06-1,12] et 6 % (RR = 1,06 [IC 95 % : 1,01-1,11]. À l’inverse, chez
les hommes et les femmes, le faible niveau de consommation est associé
de manière significative à une diminution de l’incidence du cancer du
poumon et une tendance est observée avec le cancer de la thyroïde. La
consommation de 1 à 2 verres standards par jour augmente de manière
significative l’incidence du cancer colorectal chez les hommes et du
cancer du sein alors qu’il réduit l’incidence du cancer du sang dans les
deux sexes. Concernant la mortalité, cette étude ne permet pas de
conclure car le nombre d’études incluses est insuffisant (Choi et coll.,
2018 ). Cette
étude met donc en lumière le fait que les faibles niveaux de
consommation d’alcool peuvent à la fois augmenter ou diminuer le risque
de certains cancers. Les auteurs suggèrent différents mécanismes
potentiellement impliqués dans les effets de l’alcool avec notamment un
effet sur les taux d’œstrogènes et de leurs récepteurs, les régulations
épigénétiques, les mécanismes de réparation de l’ADN. Relativement à la
diminution de l’incidence du cancer du poumon, un effet
anti-inflammatoire des faibles niveaux de consommation est suggéré.
). Cette
étude met donc en lumière le fait que les faibles niveaux de
consommation d’alcool peuvent à la fois augmenter ou diminuer le risque
de certains cancers. Les auteurs suggèrent différents mécanismes
potentiellement impliqués dans les effets de l’alcool avec notamment un
effet sur les taux d’œstrogènes et de leurs récepteurs, les régulations
épigénétiques, les mécanismes de réparation de l’ADN. Relativement à la
diminution de l’incidence du cancer du poumon, un effet
anti-inflammatoire des faibles niveaux de consommation est suggéré.L’épidémiologie des cancers et des faibles niveaux de consommation
d’alcool ne permet pas encore à l’heure actuelle de conclure
définitivement sur l’existence d’un lien de causalité. Certains auteurs
proposent par exemple d’implémenter les connaissances avec des nouvelles
méthodologies telles que l’épidémiologie pathologique moléculaire qui
tient compte des caractéristiques des tumeurs de chaque patient ainsi
que des facteurs individuels et environnementaux, à l’instar de la
médecine personnalisée (Zakhari et Hoek,
2018 ).
).
 ).
).Risque de mortalité et faibles niveaux de consommation
Une étude parue en avril 2018 a suggéré un repère de faible risque lié à
la consommation d’alcool équivalent à 10 verres standards (100 g
d’éthanol) par semaine (Wood et coll.,
2018 ). Cette
analyse portait sur 599 912 buveurs actifs provenant de 83 études
prospectives européennes sur les risques cardiovasculaires dans 19 pays.
Cette étude portait sur des buveurs actifs sans antécédent de pathologie
cardiovasculaire. Les non-buveurs (ex-buveurs ou jamais buveurs) ont été
exclus afin de limiter le risque de causalité inverse (des
sick-quitters qui auraient arrêté de consommer pour des
raisons de santé) ou des modifications d’effet non-mesuré (différences
entre buveurs et abstinents vie-entière comme par exemple un changement
de style de vie ou l’état de santé). Cette étude réalisée dans des pays
riches ou développés a mis en place un suivi longitudinal d’au moins un
an en corrigeant l’analyse pour la stabilité de la consommation
d’alcool. Plus de la moitié de la population rapportait une consommation
d’au moins 10 verres standards par semaine et 8,4 % plus de 35 verres
standards par semaine. L’analyse principale présentait une excellente
puissance statistique puisqu’elle a porté sur un total de 40 317 décès
et 39 018 premiers incidents cardiovasculaires. Les résultats montrent
une association positive curvilinéaire entre la consommation d’alcool et
la mortalité prématurée. Le plus faible risque de mortalité prématurée
est observé chez les sujets consommant 10 verres standards par semaine
ou moins. Au-dessus de ce seuil, une augmentation du risque de mortalité
d’accident vasculaire cérébral, de maladie coronarienne (infarctus du
myocarde exclu), d’insuffisance cardiaque, de maladie hypertensive
mortelle et d’anévrisme aortique mortel est observée. L’élévation de la
pression artérielle avec l’augmentation de la consommation d’alcool
expliquerait, au moins en partie, l’augmentation des risques
cardiovasculaires et notamment celui d’AVC. Cette étude montre un risque
diminué d’infarctus du myocarde comme cela a été suggéré par d’autres
auteurs (Leong et coll., 2014
). Cette
analyse portait sur 599 912 buveurs actifs provenant de 83 études
prospectives européennes sur les risques cardiovasculaires dans 19 pays.
Cette étude portait sur des buveurs actifs sans antécédent de pathologie
cardiovasculaire. Les non-buveurs (ex-buveurs ou jamais buveurs) ont été
exclus afin de limiter le risque de causalité inverse (des
sick-quitters qui auraient arrêté de consommer pour des
raisons de santé) ou des modifications d’effet non-mesuré (différences
entre buveurs et abstinents vie-entière comme par exemple un changement
de style de vie ou l’état de santé). Cette étude réalisée dans des pays
riches ou développés a mis en place un suivi longitudinal d’au moins un
an en corrigeant l’analyse pour la stabilité de la consommation
d’alcool. Plus de la moitié de la population rapportait une consommation
d’au moins 10 verres standards par semaine et 8,4 % plus de 35 verres
standards par semaine. L’analyse principale présentait une excellente
puissance statistique puisqu’elle a porté sur un total de 40 317 décès
et 39 018 premiers incidents cardiovasculaires. Les résultats montrent
une association positive curvilinéaire entre la consommation d’alcool et
la mortalité prématurée. Le plus faible risque de mortalité prématurée
est observé chez les sujets consommant 10 verres standards par semaine
ou moins. Au-dessus de ce seuil, une augmentation du risque de mortalité
d’accident vasculaire cérébral, de maladie coronarienne (infarctus du
myocarde exclu), d’insuffisance cardiaque, de maladie hypertensive
mortelle et d’anévrisme aortique mortel est observée. L’élévation de la
pression artérielle avec l’augmentation de la consommation d’alcool
expliquerait, au moins en partie, l’augmentation des risques
cardiovasculaires et notamment celui d’AVC. Cette étude montre un risque
diminué d’infarctus du myocarde comme cela a été suggéré par d’autres
auteurs (Leong et coll., 2014 ). Les auteurs associent cet effet sur
l’infarctus du myocarde à l’augmentation du taux du HDL-cholestérol
(lipoprotéine haute densité), cependant un lien de causalité n’est pas
démontré par d’autres auteurs (Kaur et coll.,
2014
). Les auteurs associent cet effet sur
l’infarctus du myocarde à l’augmentation du taux du HDL-cholestérol
(lipoprotéine haute densité), cependant un lien de causalité n’est pas
démontré par d’autres auteurs (Kaur et coll.,
2014 ). Des
analyses secondaires montrent que les anciens buveurs (n = 29 726) et
dans une moindre mesure les abstinents vie-entière (n = 53 851)
présentent un risque accru de maladie cardiovasculaire et de mortalité
toute cause comparativement aux individus avec les niveaux de
consommation les plus élevés de la population. Cependant, les groupes
comparés ici pourraient présenter des caractéristiques de santé
(mesurées ou non mesurées) bien différentes (genre, catégorie ethnique
ou raciale, niveau d’éducation, diabète). Les associations entre
consommation d’alcool et toutes causes de mortalité étaient plus fortes
chez les consommateurs de bière et de spiritueux comparativement aux
consommateurs de vin. Le profil de consommation a aussi été étudié et
les résultats montrent que les sujets qui rapportent un binge
drinking ou qui concentrent leur consommation hebdomadaire sur
deux occasions ou moins, présentent un niveau plus élevé de mortalité
toutes causes comparativement aux buveurs consommant la même quantité
d’alcool mais de manière plus régulière. Cependant, certains résultats
sont à prendre avec précaution car ceux sur le type de boissons et la
fréquence de consommation sont aussi liés à un statut tabagique et à un
moindre niveau socio-économique, suggérant ainsi de potentiels facteurs
confondants qui ne sont pas toujours pris en compte. Les auteurs
estiment aussi que la réduction de la consommation d’alcool (en dessous
de 10 verres par semaine et sans compensation par la diminution des
infarctus du myocarde) pourrait augmenter l’espérance de vie de deux
années chez les buveurs de 40 ans. Les résultats de la présente étude
sont plus robustes que ceux obtenus dans les pays pauvres ce qui
nécessite donc de poursuivre les recherches.
). Des
analyses secondaires montrent que les anciens buveurs (n = 29 726) et
dans une moindre mesure les abstinents vie-entière (n = 53 851)
présentent un risque accru de maladie cardiovasculaire et de mortalité
toute cause comparativement aux individus avec les niveaux de
consommation les plus élevés de la population. Cependant, les groupes
comparés ici pourraient présenter des caractéristiques de santé
(mesurées ou non mesurées) bien différentes (genre, catégorie ethnique
ou raciale, niveau d’éducation, diabète). Les associations entre
consommation d’alcool et toutes causes de mortalité étaient plus fortes
chez les consommateurs de bière et de spiritueux comparativement aux
consommateurs de vin. Le profil de consommation a aussi été étudié et
les résultats montrent que les sujets qui rapportent un binge
drinking ou qui concentrent leur consommation hebdomadaire sur
deux occasions ou moins, présentent un niveau plus élevé de mortalité
toutes causes comparativement aux buveurs consommant la même quantité
d’alcool mais de manière plus régulière. Cependant, certains résultats
sont à prendre avec précaution car ceux sur le type de boissons et la
fréquence de consommation sont aussi liés à un statut tabagique et à un
moindre niveau socio-économique, suggérant ainsi de potentiels facteurs
confondants qui ne sont pas toujours pris en compte. Les auteurs
estiment aussi que la réduction de la consommation d’alcool (en dessous
de 10 verres par semaine et sans compensation par la diminution des
infarctus du myocarde) pourrait augmenter l’espérance de vie de deux
années chez les buveurs de 40 ans. Les résultats de la présente étude
sont plus robustes que ceux obtenus dans les pays pauvres ce qui
nécessite donc de poursuivre les recherches.
 ). Cette
analyse portait sur 599 912 buveurs actifs provenant de 83 études
prospectives européennes sur les risques cardiovasculaires dans 19 pays.
Cette étude portait sur des buveurs actifs sans antécédent de pathologie
cardiovasculaire. Les non-buveurs (ex-buveurs ou jamais buveurs) ont été
exclus afin de limiter le risque de causalité inverse (des
sick-quitters qui auraient arrêté de consommer pour des
raisons de santé) ou des modifications d’effet non-mesuré (différences
entre buveurs et abstinents vie-entière comme par exemple un changement
de style de vie ou l’état de santé). Cette étude réalisée dans des pays
riches ou développés a mis en place un suivi longitudinal d’au moins un
an en corrigeant l’analyse pour la stabilité de la consommation
d’alcool. Plus de la moitié de la population rapportait une consommation
d’au moins 10 verres standards par semaine et 8,4 % plus de 35 verres
standards par semaine. L’analyse principale présentait une excellente
puissance statistique puisqu’elle a porté sur un total de 40 317 décès
et 39 018 premiers incidents cardiovasculaires. Les résultats montrent
une association positive curvilinéaire entre la consommation d’alcool et
la mortalité prématurée. Le plus faible risque de mortalité prématurée
est observé chez les sujets consommant 10 verres standards par semaine
ou moins. Au-dessus de ce seuil, une augmentation du risque de mortalité
d’accident vasculaire cérébral, de maladie coronarienne (infarctus du
myocarde exclu), d’insuffisance cardiaque, de maladie hypertensive
mortelle et d’anévrisme aortique mortel est observée. L’élévation de la
pression artérielle avec l’augmentation de la consommation d’alcool
expliquerait, au moins en partie, l’augmentation des risques
cardiovasculaires et notamment celui d’AVC. Cette étude montre un risque
diminué d’infarctus du myocarde comme cela a été suggéré par d’autres
auteurs (Leong et coll., 2014
). Cette
analyse portait sur 599 912 buveurs actifs provenant de 83 études
prospectives européennes sur les risques cardiovasculaires dans 19 pays.
Cette étude portait sur des buveurs actifs sans antécédent de pathologie
cardiovasculaire. Les non-buveurs (ex-buveurs ou jamais buveurs) ont été
exclus afin de limiter le risque de causalité inverse (des
sick-quitters qui auraient arrêté de consommer pour des
raisons de santé) ou des modifications d’effet non-mesuré (différences
entre buveurs et abstinents vie-entière comme par exemple un changement
de style de vie ou l’état de santé). Cette étude réalisée dans des pays
riches ou développés a mis en place un suivi longitudinal d’au moins un
an en corrigeant l’analyse pour la stabilité de la consommation
d’alcool. Plus de la moitié de la population rapportait une consommation
d’au moins 10 verres standards par semaine et 8,4 % plus de 35 verres
standards par semaine. L’analyse principale présentait une excellente
puissance statistique puisqu’elle a porté sur un total de 40 317 décès
et 39 018 premiers incidents cardiovasculaires. Les résultats montrent
une association positive curvilinéaire entre la consommation d’alcool et
la mortalité prématurée. Le plus faible risque de mortalité prématurée
est observé chez les sujets consommant 10 verres standards par semaine
ou moins. Au-dessus de ce seuil, une augmentation du risque de mortalité
d’accident vasculaire cérébral, de maladie coronarienne (infarctus du
myocarde exclu), d’insuffisance cardiaque, de maladie hypertensive
mortelle et d’anévrisme aortique mortel est observée. L’élévation de la
pression artérielle avec l’augmentation de la consommation d’alcool
expliquerait, au moins en partie, l’augmentation des risques
cardiovasculaires et notamment celui d’AVC. Cette étude montre un risque
diminué d’infarctus du myocarde comme cela a été suggéré par d’autres
auteurs (Leong et coll., 2014 ). Les auteurs associent cet effet sur
l’infarctus du myocarde à l’augmentation du taux du HDL-cholestérol
(lipoprotéine haute densité), cependant un lien de causalité n’est pas
démontré par d’autres auteurs (Kaur et coll.,
2014
). Les auteurs associent cet effet sur
l’infarctus du myocarde à l’augmentation du taux du HDL-cholestérol
(lipoprotéine haute densité), cependant un lien de causalité n’est pas
démontré par d’autres auteurs (Kaur et coll.,
2014 ). Des
analyses secondaires montrent que les anciens buveurs (n = 29 726) et
dans une moindre mesure les abstinents vie-entière (n = 53 851)
présentent un risque accru de maladie cardiovasculaire et de mortalité
toute cause comparativement aux individus avec les niveaux de
consommation les plus élevés de la population. Cependant, les groupes
comparés ici pourraient présenter des caractéristiques de santé
(mesurées ou non mesurées) bien différentes (genre, catégorie ethnique
ou raciale, niveau d’éducation, diabète). Les associations entre
consommation d’alcool et toutes causes de mortalité étaient plus fortes
chez les consommateurs de bière et de spiritueux comparativement aux
consommateurs de vin. Le profil de consommation a aussi été étudié et
les résultats montrent que les sujets qui rapportent un binge
drinking ou qui concentrent leur consommation hebdomadaire sur
deux occasions ou moins, présentent un niveau plus élevé de mortalité
toutes causes comparativement aux buveurs consommant la même quantité
d’alcool mais de manière plus régulière. Cependant, certains résultats
sont à prendre avec précaution car ceux sur le type de boissons et la
fréquence de consommation sont aussi liés à un statut tabagique et à un
moindre niveau socio-économique, suggérant ainsi de potentiels facteurs
confondants qui ne sont pas toujours pris en compte. Les auteurs
estiment aussi que la réduction de la consommation d’alcool (en dessous
de 10 verres par semaine et sans compensation par la diminution des
infarctus du myocarde) pourrait augmenter l’espérance de vie de deux
années chez les buveurs de 40 ans. Les résultats de la présente étude
sont plus robustes que ceux obtenus dans les pays pauvres ce qui
nécessite donc de poursuivre les recherches.
). Des
analyses secondaires montrent que les anciens buveurs (n = 29 726) et
dans une moindre mesure les abstinents vie-entière (n = 53 851)
présentent un risque accru de maladie cardiovasculaire et de mortalité
toute cause comparativement aux individus avec les niveaux de
consommation les plus élevés de la population. Cependant, les groupes
comparés ici pourraient présenter des caractéristiques de santé
(mesurées ou non mesurées) bien différentes (genre, catégorie ethnique
ou raciale, niveau d’éducation, diabète). Les associations entre
consommation d’alcool et toutes causes de mortalité étaient plus fortes
chez les consommateurs de bière et de spiritueux comparativement aux
consommateurs de vin. Le profil de consommation a aussi été étudié et
les résultats montrent que les sujets qui rapportent un binge
drinking ou qui concentrent leur consommation hebdomadaire sur
deux occasions ou moins, présentent un niveau plus élevé de mortalité
toutes causes comparativement aux buveurs consommant la même quantité
d’alcool mais de manière plus régulière. Cependant, certains résultats
sont à prendre avec précaution car ceux sur le type de boissons et la
fréquence de consommation sont aussi liés à un statut tabagique et à un
moindre niveau socio-économique, suggérant ainsi de potentiels facteurs
confondants qui ne sont pas toujours pris en compte. Les auteurs
estiment aussi que la réduction de la consommation d’alcool (en dessous
de 10 verres par semaine et sans compensation par la diminution des
infarctus du myocarde) pourrait augmenter l’espérance de vie de deux
années chez les buveurs de 40 ans. Les résultats de la présente étude
sont plus robustes que ceux obtenus dans les pays pauvres ce qui
nécessite donc de poursuivre les recherches.Une autre étude publiée 4 mois plus tard en août 2018 consiste en une
analyse systématique de l’étude 2016 du fardeau global des maladies (GBD
ou Global Burden Disease) (Griswold et coll.,
2018 ). Cette
étude a analysé la consommation d’alcool, la mortalité attribuable à
l’alcool et les années de vie en bonne santé perdues dans 195 pays et
territoires entre 1990 et 2016 en prenant en compte le sexe et les
individus âgés de 15 à 95 ans ainsi que les plus âgés. C’est une des
études les plus importantes avec 694 bases de données de consommation
d’alcool d’individus et de populations, comprenant 592 études
prospectives et rétrospectives. La consommation d’alcool a été ajustée
sur les ventes d’alcool et une méta-analyse a été réalisée sur les
risques relatifs de 23 conditions de santé associés à la consommation
d’alcool. L’étude s’est intéressée à quantifier le niveau de
consommation d’alcool pour lequel un risque minimal global est observé
pour la santé des individus. La prévalence des buveurs actifs a été
considérée comme la consommation d’au moins un verre standard l’année
précédente et l’abstinence comme l’absence de toute consommation l’année
écoulée. La prévalence des buveurs actifs variait considérablement entre
les pays avec une prévalence plus élevée pour les pays avec un haut
index sociodémographique (développement, niveau d’éducation, fertilité,
revenus) : 72 % des femmes et 83 % des hommes (versus 8,9 % des
femmes et 20 % des hommes dans les pays avec un index sociodémographique
faible à modéré). La différence entre hommes et femmes concernant la
prévalence des buveurs actifs variait aussi de manière importante (de
très faible à très élevée) entre les pays. La consommation quotidienne
d’alcool variait de manière importante entre les pays : 1,9 [IC 95 % :
1,3-2,7] et 2,9 [IC 95 % : 2,0-4,1] verres standards chez les femmes et
les hommes, respectivement, dans les pays à haut index
sociodémographique.
). Cette
étude a analysé la consommation d’alcool, la mortalité attribuable à
l’alcool et les années de vie en bonne santé perdues dans 195 pays et
territoires entre 1990 et 2016 en prenant en compte le sexe et les
individus âgés de 15 à 95 ans ainsi que les plus âgés. C’est une des
études les plus importantes avec 694 bases de données de consommation
d’alcool d’individus et de populations, comprenant 592 études
prospectives et rétrospectives. La consommation d’alcool a été ajustée
sur les ventes d’alcool et une méta-analyse a été réalisée sur les
risques relatifs de 23 conditions de santé associés à la consommation
d’alcool. L’étude s’est intéressée à quantifier le niveau de
consommation d’alcool pour lequel un risque minimal global est observé
pour la santé des individus. La prévalence des buveurs actifs a été
considérée comme la consommation d’au moins un verre standard l’année
précédente et l’abstinence comme l’absence de toute consommation l’année
écoulée. La prévalence des buveurs actifs variait considérablement entre
les pays avec une prévalence plus élevée pour les pays avec un haut
index sociodémographique (développement, niveau d’éducation, fertilité,
revenus) : 72 % des femmes et 83 % des hommes (versus 8,9 % des
femmes et 20 % des hommes dans les pays avec un index sociodémographique
faible à modéré). La différence entre hommes et femmes concernant la
prévalence des buveurs actifs variait aussi de manière importante (de
très faible à très élevée) entre les pays. La consommation quotidienne
d’alcool variait de manière importante entre les pays : 1,9 [IC 95 % :
1,3-2,7] et 2,9 [IC 95 % : 2,0-4,1] verres standards chez les femmes et
les hommes, respectivement, dans les pays à haut index
sociodémographique.
 ). Cette
étude a analysé la consommation d’alcool, la mortalité attribuable à
l’alcool et les années de vie en bonne santé perdues dans 195 pays et
territoires entre 1990 et 2016 en prenant en compte le sexe et les
individus âgés de 15 à 95 ans ainsi que les plus âgés. C’est une des
études les plus importantes avec 694 bases de données de consommation
d’alcool d’individus et de populations, comprenant 592 études
prospectives et rétrospectives. La consommation d’alcool a été ajustée
sur les ventes d’alcool et une méta-analyse a été réalisée sur les
risques relatifs de 23 conditions de santé associés à la consommation
d’alcool. L’étude s’est intéressée à quantifier le niveau de
consommation d’alcool pour lequel un risque minimal global est observé
pour la santé des individus. La prévalence des buveurs actifs a été
considérée comme la consommation d’au moins un verre standard l’année
précédente et l’abstinence comme l’absence de toute consommation l’année
écoulée. La prévalence des buveurs actifs variait considérablement entre
les pays avec une prévalence plus élevée pour les pays avec un haut
index sociodémographique (développement, niveau d’éducation, fertilité,
revenus) : 72 % des femmes et 83 % des hommes (versus 8,9 % des
femmes et 20 % des hommes dans les pays avec un index sociodémographique
faible à modéré). La différence entre hommes et femmes concernant la
prévalence des buveurs actifs variait aussi de manière importante (de
très faible à très élevée) entre les pays. La consommation quotidienne
d’alcool variait de manière importante entre les pays : 1,9 [IC 95 % :
1,3-2,7] et 2,9 [IC 95 % : 2,0-4,1] verres standards chez les femmes et
les hommes, respectivement, dans les pays à haut index
sociodémographique.
). Cette
étude a analysé la consommation d’alcool, la mortalité attribuable à
l’alcool et les années de vie en bonne santé perdues dans 195 pays et
territoires entre 1990 et 2016 en prenant en compte le sexe et les
individus âgés de 15 à 95 ans ainsi que les plus âgés. C’est une des
études les plus importantes avec 694 bases de données de consommation
d’alcool d’individus et de populations, comprenant 592 études
prospectives et rétrospectives. La consommation d’alcool a été ajustée
sur les ventes d’alcool et une méta-analyse a été réalisée sur les
risques relatifs de 23 conditions de santé associés à la consommation
d’alcool. L’étude s’est intéressée à quantifier le niveau de
consommation d’alcool pour lequel un risque minimal global est observé
pour la santé des individus. La prévalence des buveurs actifs a été
considérée comme la consommation d’au moins un verre standard l’année
précédente et l’abstinence comme l’absence de toute consommation l’année
écoulée. La prévalence des buveurs actifs variait considérablement entre
les pays avec une prévalence plus élevée pour les pays avec un haut
index sociodémographique (développement, niveau d’éducation, fertilité,
revenus) : 72 % des femmes et 83 % des hommes (versus 8,9 % des
femmes et 20 % des hommes dans les pays avec un index sociodémographique
faible à modéré). La différence entre hommes et femmes concernant la
prévalence des buveurs actifs variait aussi de manière importante (de
très faible à très élevée) entre les pays. La consommation quotidienne
d’alcool variait de manière importante entre les pays : 1,9 [IC 95 % :
1,3-2,7] et 2,9 [IC 95 % : 2,0-4,1] verres standards chez les femmes et
les hommes, respectivement, dans les pays à haut index
sociodémographique.Les résultats montrent que l’alcool occupe le 7e rang du
classement des facteurs de risque à la fois de mortalité et d’années de
vie en bonne santé perdues avec 2,2 % [IC 95 % : 1,5-3,0] de la
mortalité ajustée sur l’âge chez les femmes et 6,8 % [IC 95 % : 5,8-8,0]
de la mortalité ajustée sur l’âge chez les hommes. Chez les 15-49 ans,
l’alcool est le premier facteur de risque en 2016 avec 3,8 % [IC 95 % :
3,2-4,3] de la mortalité attribuable chez les femmes et 12,2 % [IC
95 % : 10,8-13,6] de la mortalité attribuable chez les hommes. Toujours
chez les 15-49 ans, les années de vie en bonne santé perdues sont de
2,3 % [IC 95 % : 2,0-2,6] et 8,9 % [IC 95 % : 7,8-9,9], respectivement
chez les femmes et les hommes. Chez les plus de 50 ans, les cancers
représentent la majeure partie des décès attribuables à l’alcool,
constituant 27,1 % [IC 95 % : 21,2-33,3] et 18,9 % [IC 95 % : 15,3-22,6]
de la mortalité chez les femmes et les hommes, respectivement. Dans les
pays à faible index sociodémographique, la première cause du fardeau
sanitaire est la tuberculose suivie de la cirrhose et d’autres maladies
chroniques du foie. Les relations entre niveau de consommation d’alcool
et risque relatif de certaines pathologies montrent une courbe en J pour
la maladie cardiaque ischémique mais pas pour les autres pathologies
(cancer du sein, diabètes, cancer de la bouche et tuberculose) où le
risque relatif augmente de manière continue (fonction monotone
croissante). Ainsi le risque relatif minimum est de 0,86 [IC :
0,80-0,96] pour les hommes et de 0,82 [IC : 0,72-0,95] pour les femmes,
observé pour une consommation de 0,83 verre standard par jour pour les
hommes et 0,92 verre standard par jour pour les femmes. On peut
constater que ce risque minimum est observé à des niveaux de
consommation bien inférieurs aux nouveaux repères de consommation (à
faible risque).
Cette étude arrive à la conclusion que le niveau de consommation d’alcool
pour lequel le risque de dommages est minimal est de zéro verre standard
par jour [IC : 0,0-0,08] (figure 2.7 ).
).
 ).
).Les auteurs concluent aussi que globalement la consommation d’alcool,
quel que soit le niveau de consommation, a des effets néfastes sur la
santé des différentes populations étudiées. Même si un risque réduit est
observé à des faibles niveaux de consommation pour la maladie cardiaque
ischémique et le diabète chez les femmes, il est largement compensé
lorsque l’on considère le risque global, particulièrement à cause de la
forte association entre la consommation d’alcool et le risque de cancer,
blessures et maladies transmissibles. Ces données vont dans le sens des
nouveaux repères de consommation qui mettent aussi en lumière que
« toute consommation peut comporter un risque pour sa santé ». Cette
étude souligne le fait qu’il est important que les pays à faible index
sociodémographique maintiennent ou développent des politiques publiques
fortes en ce qui concerne l’alcool. Elle souligne aussi l’importance de
revisiter les politiques publiques sur l’alcool et les programmes de
prévention ainsi que de considérer des recommandations sur l’abstinence.
Il faut aussi considérer les différentes limites de cette étude avec
notamment l’estimation de la consommation (production d’alcool illicite
ou non enregistrée), le profil de consommation des individus considéré
comme stable, l’estimation de la mortalité routière liée à l’alcool ou
celle induite par des violences liées à l’alcool qui n’est pas connue
dans tous les pays, la consommation des moins de 15 ans qui n’a pas été
estimée et enfin des maladies non prises en compte comme les démences et
le psoriasis. Ces limites ont pour effet de sous-estimer les risques
sanitaires et le fardeau global attribuable à l’alcool. La comparaison
d’un grand nombre de pays peut aussi conduire à des résultats largement
influencés par des facteurs sociaux et culturels. La mortalité
toutes-causes (ou totale) n’ayant pas été mesurée ne permettrait pas de
conclure « qu’il n’y a pas de niveau de consommation d’alcool qui
améliore la santé » (Di Castelnuovo et coll.,
2019 ). Ce
dernier point est important car il soulève la problématique du meilleur
critère de jugement à utiliser dans ce type d’analyse qui vise à
déterminer les effets de la consommation d’alcool sur la santé. Le lien
entre consommation d’alcool et santé pourrait dépendre du critère
utilisé entre mortalité ou morbidité (maladies spécifiques) et il semble
que davantage d’études utilisant la morbidité soient nécessaires afin
d’avoir une estimation plus pertinente du fardeau total des dommages
sanitaires liés à l’alcool (Shield et Rehm,
2019
). Ce
dernier point est important car il soulève la problématique du meilleur
critère de jugement à utiliser dans ce type d’analyse qui vise à
déterminer les effets de la consommation d’alcool sur la santé. Le lien
entre consommation d’alcool et santé pourrait dépendre du critère
utilisé entre mortalité ou morbidité (maladies spécifiques) et il semble
que davantage d’études utilisant la morbidité soient nécessaires afin
d’avoir une estimation plus pertinente du fardeau total des dommages
sanitaires liés à l’alcool (Shield et Rehm,
2019 ).
Certains auteurs défendent l’idée que la mortalité toutes causes est le
meilleur critère à utiliser même s’il s’agit souvent de la combinaison
de nombreuses études épidémiologiques dont on ne peut jamais totalement
exclure la présence de facteurs de confusion et de biais (Di Castelnuovo
et coll., 2006
).
Certains auteurs défendent l’idée que la mortalité toutes causes est le
meilleur critère à utiliser même s’il s’agit souvent de la combinaison
de nombreuses études épidémiologiques dont on ne peut jamais totalement
exclure la présence de facteurs de confusion et de biais (Di Castelnuovo
et coll., 2006 ;
Costanzo et coll., 2019
;
Costanzo et coll., 2019 ). Il faut aussi considérer le fait que la
relation entre niveau de consommation d’alcool et la mortalité toute
cause est difficilement démontrable dans des méta-analyses d’études de
cohortes (Rehm, 2019
). Il faut aussi considérer le fait que la
relation entre niveau de consommation d’alcool et la mortalité toute
cause est difficilement démontrable dans des méta-analyses d’études de
cohortes (Rehm, 2019 ). En effet cette relation dépend de la
distribution des causes de décès dans une société et les cohortes ne
sont pas sélectionnées pour être, et ne sont jamais, représentatives de
la population générale (absence des sans-abris, des personnes
incarcérées ou encore des personnes placées en institution par exemple),
car elles sont sélectionnées principalement pour minimiser le taux
d’abandon (les perdus de vue) (Rehm,
2019
). En effet cette relation dépend de la
distribution des causes de décès dans une société et les cohortes ne
sont pas sélectionnées pour être, et ne sont jamais, représentatives de
la population générale (absence des sans-abris, des personnes
incarcérées ou encore des personnes placées en institution par exemple),
car elles sont sélectionnées principalement pour minimiser le taux
d’abandon (les perdus de vue) (Rehm,
2019 ). C’est
un point important car cela implique que les méta-analyses d’études sur
l’usage d’alcool et la mortalité toute cause donneront des courbes
non-représentatives de la population générale et ceci pour n’importe
quel pays. Il faudrait combiner toutes les courbes de risque spécifique
pour chaque cause sous forme de moyenne pondérée et se faisant les
courbes de risque s’aplatissent ou les courbes en J disparaissent
complètement notamment en ce qui concerne les causes cardiovasculaires
de décès (Rehm, 2019
). C’est
un point important car cela implique que les méta-analyses d’études sur
l’usage d’alcool et la mortalité toute cause donneront des courbes
non-représentatives de la population générale et ceci pour n’importe
quel pays. Il faudrait combiner toutes les courbes de risque spécifique
pour chaque cause sous forme de moyenne pondérée et se faisant les
courbes de risque s’aplatissent ou les courbes en J disparaissent
complètement notamment en ce qui concerne les causes cardiovasculaires
de décès (Rehm, 2019 ). Cela s’observe dans la dernière publication
GBD 2016 ou leur combinaison des fonctions de risque, incluant le
potentiel effet « protecteur » de la maladie cardiaque ischémique est
contrebalancé par les effets délétères de l’alcool, donnant ainsi une
courbe « plate » pour les niveaux de consommation d’alcool moyens les
plus faibles (Griswold et coll., 2018
). Cela s’observe dans la dernière publication
GBD 2016 ou leur combinaison des fonctions de risque, incluant le
potentiel effet « protecteur » de la maladie cardiaque ischémique est
contrebalancé par les effets délétères de l’alcool, donnant ainsi une
courbe « plate » pour les niveaux de consommation d’alcool moyens les
plus faibles (Griswold et coll., 2018 ).
).
 ). Ce
dernier point est important car il soulève la problématique du meilleur
critère de jugement à utiliser dans ce type d’analyse qui vise à
déterminer les effets de la consommation d’alcool sur la santé. Le lien
entre consommation d’alcool et santé pourrait dépendre du critère
utilisé entre mortalité ou morbidité (maladies spécifiques) et il semble
que davantage d’études utilisant la morbidité soient nécessaires afin
d’avoir une estimation plus pertinente du fardeau total des dommages
sanitaires liés à l’alcool (Shield et Rehm,
2019
). Ce
dernier point est important car il soulève la problématique du meilleur
critère de jugement à utiliser dans ce type d’analyse qui vise à
déterminer les effets de la consommation d’alcool sur la santé. Le lien
entre consommation d’alcool et santé pourrait dépendre du critère
utilisé entre mortalité ou morbidité (maladies spécifiques) et il semble
que davantage d’études utilisant la morbidité soient nécessaires afin
d’avoir une estimation plus pertinente du fardeau total des dommages
sanitaires liés à l’alcool (Shield et Rehm,
2019 ).
Certains auteurs défendent l’idée que la mortalité toutes causes est le
meilleur critère à utiliser même s’il s’agit souvent de la combinaison
de nombreuses études épidémiologiques dont on ne peut jamais totalement
exclure la présence de facteurs de confusion et de biais (Di Castelnuovo
et coll., 2006
).
Certains auteurs défendent l’idée que la mortalité toutes causes est le
meilleur critère à utiliser même s’il s’agit souvent de la combinaison
de nombreuses études épidémiologiques dont on ne peut jamais totalement
exclure la présence de facteurs de confusion et de biais (Di Castelnuovo
et coll., 2006 ;
Costanzo et coll., 2019
;
Costanzo et coll., 2019 ). Il faut aussi considérer le fait que la
relation entre niveau de consommation d’alcool et la mortalité toute
cause est difficilement démontrable dans des méta-analyses d’études de
cohortes (Rehm, 2019
). Il faut aussi considérer le fait que la
relation entre niveau de consommation d’alcool et la mortalité toute
cause est difficilement démontrable dans des méta-analyses d’études de
cohortes (Rehm, 2019 ). En effet cette relation dépend de la
distribution des causes de décès dans une société et les cohortes ne
sont pas sélectionnées pour être, et ne sont jamais, représentatives de
la population générale (absence des sans-abris, des personnes
incarcérées ou encore des personnes placées en institution par exemple),
car elles sont sélectionnées principalement pour minimiser le taux
d’abandon (les perdus de vue) (Rehm,
2019
). En effet cette relation dépend de la
distribution des causes de décès dans une société et les cohortes ne
sont pas sélectionnées pour être, et ne sont jamais, représentatives de
la population générale (absence des sans-abris, des personnes
incarcérées ou encore des personnes placées en institution par exemple),
car elles sont sélectionnées principalement pour minimiser le taux
d’abandon (les perdus de vue) (Rehm,
2019 ). C’est
un point important car cela implique que les méta-analyses d’études sur
l’usage d’alcool et la mortalité toute cause donneront des courbes
non-représentatives de la population générale et ceci pour n’importe
quel pays. Il faudrait combiner toutes les courbes de risque spécifique
pour chaque cause sous forme de moyenne pondérée et se faisant les
courbes de risque s’aplatissent ou les courbes en J disparaissent
complètement notamment en ce qui concerne les causes cardiovasculaires
de décès (Rehm, 2019
). C’est
un point important car cela implique que les méta-analyses d’études sur
l’usage d’alcool et la mortalité toute cause donneront des courbes
non-représentatives de la population générale et ceci pour n’importe
quel pays. Il faudrait combiner toutes les courbes de risque spécifique
pour chaque cause sous forme de moyenne pondérée et se faisant les
courbes de risque s’aplatissent ou les courbes en J disparaissent
complètement notamment en ce qui concerne les causes cardiovasculaires
de décès (Rehm, 2019 ). Cela s’observe dans la dernière publication
GBD 2016 ou leur combinaison des fonctions de risque, incluant le
potentiel effet « protecteur » de la maladie cardiaque ischémique est
contrebalancé par les effets délétères de l’alcool, donnant ainsi une
courbe « plate » pour les niveaux de consommation d’alcool moyens les
plus faibles (Griswold et coll., 2018
). Cela s’observe dans la dernière publication
GBD 2016 ou leur combinaison des fonctions de risque, incluant le
potentiel effet « protecteur » de la maladie cardiaque ischémique est
contrebalancé par les effets délétères de l’alcool, donnant ainsi une
courbe « plate » pour les niveaux de consommation d’alcool moyens les
plus faibles (Griswold et coll., 2018 ).
).Avancées des connaissances grâce à de nouvelles méthodologies
De très nombreuses recherches ont concerné l’analyse du risque de
mortalité « toutes causes » dû à la consommation d’alcool en étudiant
des cohortes particulières, des enquêtes ou des méta-analyses de ces
études (Holman et coll., 1996 ; Gmel et coll.,
2002
; Gmel et coll.,
2002 ).
Certaines études et notamment celles sur la mortalité « toutes causes »
qui ont conclu à un risque minimum avec de faibles niveaux de
consommation d’alcool étaient limitées par la faible taille des
populations étudiées, le faible niveau de contrôle des facteurs de
confusion et le mauvais choix du groupe de référence pour calculer les
risques relatifs. Des études très récentes qui ont utilisé des
méthodologies comme la randomisation mendélienne, les études de
combinaison de cohortes (pooling cohort studies) et les
méta-analyses « multivariables-ajustées », ne démontrent pas de risque
minimum sur la mortalité toutes causes ou celle liée aux pathologies
cardiovasculaires (Holmes et coll.,
2014
).
Certaines études et notamment celles sur la mortalité « toutes causes »
qui ont conclu à un risque minimum avec de faibles niveaux de
consommation d’alcool étaient limitées par la faible taille des
populations étudiées, le faible niveau de contrôle des facteurs de
confusion et le mauvais choix du groupe de référence pour calculer les
risques relatifs. Des études très récentes qui ont utilisé des
méthodologies comme la randomisation mendélienne, les études de
combinaison de cohortes (pooling cohort studies) et les
méta-analyses « multivariables-ajustées », ne démontrent pas de risque
minimum sur la mortalité toutes causes ou celle liée aux pathologies
cardiovasculaires (Holmes et coll.,
2014 ; Knott
et coll., 2015
; Knott
et coll., 2015 ;
Stockwell et coll., 2016
;
Stockwell et coll., 2016 ).
).
 ; Gmel et coll.,
2002
; Gmel et coll.,
2002 ).
Certaines études et notamment celles sur la mortalité « toutes causes »
qui ont conclu à un risque minimum avec de faibles niveaux de
consommation d’alcool étaient limitées par la faible taille des
populations étudiées, le faible niveau de contrôle des facteurs de
confusion et le mauvais choix du groupe de référence pour calculer les
risques relatifs. Des études très récentes qui ont utilisé des
méthodologies comme la randomisation mendélienne, les études de
combinaison de cohortes (pooling cohort studies) et les
méta-analyses « multivariables-ajustées », ne démontrent pas de risque
minimum sur la mortalité toutes causes ou celle liée aux pathologies
cardiovasculaires (Holmes et coll.,
2014
).
Certaines études et notamment celles sur la mortalité « toutes causes »
qui ont conclu à un risque minimum avec de faibles niveaux de
consommation d’alcool étaient limitées par la faible taille des
populations étudiées, le faible niveau de contrôle des facteurs de
confusion et le mauvais choix du groupe de référence pour calculer les
risques relatifs. Des études très récentes qui ont utilisé des
méthodologies comme la randomisation mendélienne, les études de
combinaison de cohortes (pooling cohort studies) et les
méta-analyses « multivariables-ajustées », ne démontrent pas de risque
minimum sur la mortalité toutes causes ou celle liée aux pathologies
cardiovasculaires (Holmes et coll.,
2014 ; Knott
et coll., 2015
; Knott
et coll., 2015 ;
Stockwell et coll., 2016
;
Stockwell et coll., 2016 ).
).Randomisation mendélienne
Des études récentes ont utilisé la randomisation mendélienne (RM)
comme nouvelle approche pour rechercher le lien entre consommation
d’alcool et santé et plus particulièrement avec les maladies
cardiovasculaires (Holmes et coll.,
2014 ;
Millwood et coll., 2019
;
Millwood et coll., 2019 ).
).
 ;
Millwood et coll., 2019
;
Millwood et coll., 2019 ).
).La science de l’épidémiologie observationnelle utilisée pour détecter
des associations entre la consommation d’alcool et la maladie
souffre de l’existence de facteurs de confusion qui peuvent
contribuer à la génération de données erronées et difficilement
reproductibles qui viennent parasiter l’état des connaissances. Ces
deux dernières décennies la littérature sur le sujet montre que de
nombreux essais contrôlés randomisés n’ont pas retrouvé les données
des études épidémiologiques observationnelles alors qu’ils testaient
la même hypothèse. Les facteurs de confusion les plus fréquents sont
la causalité inverse (où la maladie influence l’apparente exposition
et non l’inverse) et les biais de sélection (par exemple un
recrutement de sujets hospitalisés qui ne serait pas représentatif
de la population générale). Par exemple concernant l’alcool, les
individus avec des symptômes à un stade précoce d’une maladie
cardiovasculaire pourraient réduire leur consommation et dans cette
situation la consommation d’alcool pourrait apparaître comme un
facteur protecteur contre cette maladie cardiovasculaire. Cette
causalité inverse peut aussi être observée dans le cas de biais de
déclaration lorsque l’individu a connaissance de sa pathologie. Un
patient atteint d’une maladie cardiovasculaire pourrait minimiser sa
consommation d’alcool puisqu’il lui aurait déjà été conseillé de
diminuer sa consommation d’alcool.
Une limite importante des études épidémiologiques sur l’alcool
consiste en l’incertitude de la consommation (c’est-à-dire
l’exposition). Les profils de consommation sont variables et la
consommation d’alcool peut être largement sous-déclarée voire
sous-estimée.
Une approche alternative réside dans les expériences de randomisation
mendélienne (RM) qui sont basées sur la loi de Mendel d’arrangement
indépendant c’est-à-dire que chaque trait est hérité de manière
indépendante des autres traits à la génération suivante. Les
individus héritent donc des allèles et des polymorphismes (variants)
génétiques de chaque parent de manière aléatoire. Si des
polymorphismes spécifiques présentent une association forte avec une
exposition particulière, les individus peuvent donc être considérés
comme ayant été « randomisés » à la naissance vis-à-vis de cette
exposition d’intérêt. Dans la RM, la ségrégation aléatoire des
allèles (gènes) permet de les diviser en groupes indépendants témoin
et exposé, les facteurs de confusion se distribuant de manière égale
entre les deux groupes. Cette expérience naturelle de RM est
similaire à celle des essais contrôlés randomisés qui nécessitent
une randomisation des individus dans des groupes témoin et exposé et
en faisant cela, les facteurs de confusion sont considérés comme
étant distribués de manière identique entre les groupes (Gupta et
coll., 2017 ).
L’utilisation de la RM permet d’éviter le problème des facteurs
confondants non-mesurés et des erreurs de mesure de la recherche
épidémiologique où les expériences contrôlées comme les essais
contrôlés randomisés ne sont pas réalisables. En effet, les données
de la RM ne sont pas affectées par les facteurs de confusion ou des
biais tels que le statut socio-économique ou la causalité inverse
car les variables mesurées au niveau par exemple biologiques ou
cliniques ne peuvent pas modifier la génétique des individus. Dans
la RM, les gènes servent de variables instrumentales pour des
facteurs environnementaux modifiables (par exemple la consommation
d’alcool, l’indice de masse corporelle, la consommation de tabac) et
permettent de détecter le lien de causalité avec la maladie étudiée
(figure 2.8
).
L’utilisation de la RM permet d’éviter le problème des facteurs
confondants non-mesurés et des erreurs de mesure de la recherche
épidémiologique où les expériences contrôlées comme les essais
contrôlés randomisés ne sont pas réalisables. En effet, les données
de la RM ne sont pas affectées par les facteurs de confusion ou des
biais tels que le statut socio-économique ou la causalité inverse
car les variables mesurées au niveau par exemple biologiques ou
cliniques ne peuvent pas modifier la génétique des individus. Dans
la RM, les gènes servent de variables instrumentales pour des
facteurs environnementaux modifiables (par exemple la consommation
d’alcool, l’indice de masse corporelle, la consommation de tabac) et
permettent de détecter le lien de causalité avec la maladie étudiée
(figure 2.8 ). Même si en
général c’est un trait (ou endophénotype) de la maladie qui est pris
en compte dans la RM, il faut noter la limite potentiellement due au
fait que l’usage d’alcool et la consommation à risque d’alcool sont
liés à l’intervention de nombreux gènes et présentent donc une
origine polygénique.
). Même si en
général c’est un trait (ou endophénotype) de la maladie qui est pris
en compte dans la RM, il faut noter la limite potentiellement due au
fait que l’usage d’alcool et la consommation à risque d’alcool sont
liés à l’intervention de nombreux gènes et présentent donc une
origine polygénique.
 ).
L’utilisation de la RM permet d’éviter le problème des facteurs
confondants non-mesurés et des erreurs de mesure de la recherche
épidémiologique où les expériences contrôlées comme les essais
contrôlés randomisés ne sont pas réalisables. En effet, les données
de la RM ne sont pas affectées par les facteurs de confusion ou des
biais tels que le statut socio-économique ou la causalité inverse
car les variables mesurées au niveau par exemple biologiques ou
cliniques ne peuvent pas modifier la génétique des individus. Dans
la RM, les gènes servent de variables instrumentales pour des
facteurs environnementaux modifiables (par exemple la consommation
d’alcool, l’indice de masse corporelle, la consommation de tabac) et
permettent de détecter le lien de causalité avec la maladie étudiée
(figure 2.8
).
L’utilisation de la RM permet d’éviter le problème des facteurs
confondants non-mesurés et des erreurs de mesure de la recherche
épidémiologique où les expériences contrôlées comme les essais
contrôlés randomisés ne sont pas réalisables. En effet, les données
de la RM ne sont pas affectées par les facteurs de confusion ou des
biais tels que le statut socio-économique ou la causalité inverse
car les variables mesurées au niveau par exemple biologiques ou
cliniques ne peuvent pas modifier la génétique des individus. Dans
la RM, les gènes servent de variables instrumentales pour des
facteurs environnementaux modifiables (par exemple la consommation
d’alcool, l’indice de masse corporelle, la consommation de tabac) et
permettent de détecter le lien de causalité avec la maladie étudiée
(figure 2.8 ). Même si en
général c’est un trait (ou endophénotype) de la maladie qui est pris
en compte dans la RM, il faut noter la limite potentiellement due au
fait que l’usage d’alcool et la consommation à risque d’alcool sont
liés à l’intervention de nombreux gènes et présentent donc une
origine polygénique.
). Même si en
général c’est un trait (ou endophénotype) de la maladie qui est pris
en compte dans la RM, il faut noter la limite potentiellement due au
fait que l’usage d’alcool et la consommation à risque d’alcool sont
liés à l’intervention de nombreux gènes et présentent donc une
origine polygénique.La variable instrumentale génétique sert d’indicateur d’exposition
modifiable ou de trait d’intérêt dans la RM et joue donc un rôle
particulièrement crucial. Elle doit donc être associée de manière
certaine et robuste à l’exposition modifiable ou le trait et être
indépendante des facteurs de confusion non-observés qui influencent
l’exposition ou la maladie. Elle doit être associée avec la maladie
seulement via l’exposition étudiée, et chaque variable
génétique a un effet causal unique (monotonicité). Cette
monotonicité peut ne pas être respectée en cas d’interaction
gène-environnement qui entraînerait une différence d’expression
génique en fonction d’une différence environnementale. D’autres
facteurs comme la stratification de population (ancêtres génétiques
différents entre les différents sous-groupes d’une population), le
déséquilibre de liaison (corrélation entre allèles) et la
pléiotropie (un gène et plusieurs phénotypes) peuvent aussi produire
des estimations biaisées. Les gènes ne sont pas associés à une large
étendue de facteurs comportementaux et socio-culturels, ils peuvent
donc servir d’indicateurs d’exposition modifiable environnementale
car moins sujets aux facteurs de confusion en comparaison avec la
mesure directe des expositions. De plus, la détermination du
génotype est aléatoire (randomisée) et prend place à la conception
ce qui permet d’éviter le biais de causalité inverse, c’est-à-dire
que l’état de santé (maladie) influence l’exposition plutôt que
l’inverse. La direction de la causalité entre deux facteurs est
difficilement identifiable dans les études d’association et sa
détermination est plus facile dans les expériences de RM qui aident
à détecter de manière non biaisée des effets de causalité. Au total,
les variants génétiques offrent des instruments non-biaisés qui
peuvent être utilisés comme indicateurs d’exposition
environnementale pour étudier leur relation de causalité avec la
maladie d’intérêt. Le terme d’épidémiologie causale a donc été
proposé et la RM s’étoffe maintenant d’une approche à deux étapes
avec la prise en compte de facteurs épigénétiques. Dans la
hiérarchie des niveaux de preuve, la RM se situe entre les études
observationnelles et les essais contrôlés randomisés. Il faut aussi
considérer les limites de ces nouvelles approches (Gupta et coll.,
2017 ).
).
 ).
).L’alcool est oxydé en acétaldéhyde par l’alcool déshydrogénase (ADH)
et l’acétaldéhyde est lui-même oxydé en acétate par l’aldéhyde
déshydrogénase (ALDH). La moitié des japonais est hétérozygote ou
homozygote pour un variant nul de l’ALDH2 et le pic de concentration
sanguine de l’acétaldéhyde après avoir consommé de l’alcool est
respectivement 18 fois et 5 fois plus élevé chez les homozygotes du
variant nul et chez les hétérozygotes comparativement aux individus
homozygotes ne portant pas la mutation (Enomoto et coll.,
1991 ).
Cette mutation rend la consommation d’alcool déplaisante par
l’induction entres autres d’un flush facial (bouffée vasomotrice),
des palpitations et une somnolence. Le génotype est responsable
d’une très grande différence de la consommation d’alcool (Takagi et
coll., 2002
).
Cette mutation rend la consommation d’alcool déplaisante par
l’induction entres autres d’un flush facial (bouffée vasomotrice),
des palpitations et une somnolence. Le génotype est responsable
d’une très grande différence de la consommation d’alcool (Takagi et
coll., 2002 ). Cependant, deux facteurs, l’âge et l’usage de la cigarette,
dont on pourrait attendre qu’ils constituent des facteurs de
confusion dans des études d’associations observationnelles
classiques entre alcool et maladie, ne sont pas liés au génotype en
dépit d’une forte association du génotype avec la consommation
d’alcool. En conséquence, on s’attendrait à ce que le génotype ALDH2
influence les maladies connues pour être liées à la consommation
d’alcool. Comme preuve de concept, une étude a montré que
l’homozygotie du variant nul ALDH2, associée à une faible
consommation d’alcool, est en effet liée à un risque réduit de
cirrhose hépatique (Chao et coll.,
1994
). Cependant, deux facteurs, l’âge et l’usage de la cigarette,
dont on pourrait attendre qu’ils constituent des facteurs de
confusion dans des études d’associations observationnelles
classiques entre alcool et maladie, ne sont pas liés au génotype en
dépit d’une forte association du génotype avec la consommation
d’alcool. En conséquence, on s’attendrait à ce que le génotype ALDH2
influence les maladies connues pour être liées à la consommation
d’alcool. Comme preuve de concept, une étude a montré que
l’homozygotie du variant nul ALDH2, associée à une faible
consommation d’alcool, est en effet liée à un risque réduit de
cirrhose hépatique (Chao et coll.,
1994 ).
).
 ).
Cette mutation rend la consommation d’alcool déplaisante par
l’induction entres autres d’un flush facial (bouffée vasomotrice),
des palpitations et une somnolence. Le génotype est responsable
d’une très grande différence de la consommation d’alcool (Takagi et
coll., 2002
).
Cette mutation rend la consommation d’alcool déplaisante par
l’induction entres autres d’un flush facial (bouffée vasomotrice),
des palpitations et une somnolence. Le génotype est responsable
d’une très grande différence de la consommation d’alcool (Takagi et
coll., 2002 ). Cependant, deux facteurs, l’âge et l’usage de la cigarette,
dont on pourrait attendre qu’ils constituent des facteurs de
confusion dans des études d’associations observationnelles
classiques entre alcool et maladie, ne sont pas liés au génotype en
dépit d’une forte association du génotype avec la consommation
d’alcool. En conséquence, on s’attendrait à ce que le génotype ALDH2
influence les maladies connues pour être liées à la consommation
d’alcool. Comme preuve de concept, une étude a montré que
l’homozygotie du variant nul ALDH2, associée à une faible
consommation d’alcool, est en effet liée à un risque réduit de
cirrhose hépatique (Chao et coll.,
1994
). Cependant, deux facteurs, l’âge et l’usage de la cigarette,
dont on pourrait attendre qu’ils constituent des facteurs de
confusion dans des études d’associations observationnelles
classiques entre alcool et maladie, ne sont pas liés au génotype en
dépit d’une forte association du génotype avec la consommation
d’alcool. En conséquence, on s’attendrait à ce que le génotype ALDH2
influence les maladies connues pour être liées à la consommation
d’alcool. Comme preuve de concept, une étude a montré que
l’homozygotie du variant nul ALDH2, associée à une faible
consommation d’alcool, est en effet liée à un risque réduit de
cirrhose hépatique (Chao et coll.,
1994 ).
).Une étude a suggéré que la consommation d’alcool augmente le risque
de cancer de l’œsophage et l’importance de son rôle a été remis en
question (Memik, 2003 ). Une méta-analyse a démontré que les
sujets homozygotes pour le variant nul ALDH2, qui consomment
beaucoup moins d’alcool, ont un risque beaucoup plus réduit de
présenter un cancer de l’œsophage (Lewis,
2005
). Une méta-analyse a démontré que les
sujets homozygotes pour le variant nul ALDH2, qui consomment
beaucoup moins d’alcool, ont un risque beaucoup plus réduit de
présenter un cancer de l’œsophage (Lewis,
2005 ). En
effet cette réduction du risque est proche de celle prédite par
l’effet du génotype sur la consommation d’alcool sur le risque de
cancer de l’œsophage dans une méta-analyse d’études
observationnelles (Gutjahr et coll.,
2001
). En
effet cette réduction du risque est proche de celle prédite par
l’effet du génotype sur la consommation d’alcool sur le risque de
cancer de l’œsophage dans une méta-analyse d’études
observationnelles (Gutjahr et coll.,
2001 ). De
manière très intéressante, il est frappant de constater que le
risque de cancer de l’œsophage est plus élevé chez les hétérozygotes
qui boivent plutôt moins d’alcool que les homozygotes du variant
fonctionnel. Ces données suggèrent que la consommation d’alcool
influence le risque de cancer de l’œsophage par l’augmentation du
taux d’acétaldéhyde. L’augmentation du risque parmi les
hétérozygotes est seulement visible chez ceux qui boivent de
l’alcool mais qui le métabolisent inefficacement, et présentent donc
des taux élevés d’acétaldéhyde circulant. Cet exemple met en lumière
que l’alcool est un facteur de risque modifiable de l’environnement
dans le cancer de l’œsophage et que l’effet de l’alcool est relayé
par la production d’acétaldéhyde.
). De
manière très intéressante, il est frappant de constater que le
risque de cancer de l’œsophage est plus élevé chez les hétérozygotes
qui boivent plutôt moins d’alcool que les homozygotes du variant
fonctionnel. Ces données suggèrent que la consommation d’alcool
influence le risque de cancer de l’œsophage par l’augmentation du
taux d’acétaldéhyde. L’augmentation du risque parmi les
hétérozygotes est seulement visible chez ceux qui boivent de
l’alcool mais qui le métabolisent inefficacement, et présentent donc
des taux élevés d’acétaldéhyde circulant. Cet exemple met en lumière
que l’alcool est un facteur de risque modifiable de l’environnement
dans le cancer de l’œsophage et que l’effet de l’alcool est relayé
par la production d’acétaldéhyde.
 ). Une méta-analyse a démontré que les
sujets homozygotes pour le variant nul ALDH2, qui consomment
beaucoup moins d’alcool, ont un risque beaucoup plus réduit de
présenter un cancer de l’œsophage (Lewis,
2005
). Une méta-analyse a démontré que les
sujets homozygotes pour le variant nul ALDH2, qui consomment
beaucoup moins d’alcool, ont un risque beaucoup plus réduit de
présenter un cancer de l’œsophage (Lewis,
2005 ). En
effet cette réduction du risque est proche de celle prédite par
l’effet du génotype sur la consommation d’alcool sur le risque de
cancer de l’œsophage dans une méta-analyse d’études
observationnelles (Gutjahr et coll.,
2001
). En
effet cette réduction du risque est proche de celle prédite par
l’effet du génotype sur la consommation d’alcool sur le risque de
cancer de l’œsophage dans une méta-analyse d’études
observationnelles (Gutjahr et coll.,
2001 ). De
manière très intéressante, il est frappant de constater que le
risque de cancer de l’œsophage est plus élevé chez les hétérozygotes
qui boivent plutôt moins d’alcool que les homozygotes du variant
fonctionnel. Ces données suggèrent que la consommation d’alcool
influence le risque de cancer de l’œsophage par l’augmentation du
taux d’acétaldéhyde. L’augmentation du risque parmi les
hétérozygotes est seulement visible chez ceux qui boivent de
l’alcool mais qui le métabolisent inefficacement, et présentent donc
des taux élevés d’acétaldéhyde circulant. Cet exemple met en lumière
que l’alcool est un facteur de risque modifiable de l’environnement
dans le cancer de l’œsophage et que l’effet de l’alcool est relayé
par la production d’acétaldéhyde.
). De
manière très intéressante, il est frappant de constater que le
risque de cancer de l’œsophage est plus élevé chez les hétérozygotes
qui boivent plutôt moins d’alcool que les homozygotes du variant
fonctionnel. Ces données suggèrent que la consommation d’alcool
influence le risque de cancer de l’œsophage par l’augmentation du
taux d’acétaldéhyde. L’augmentation du risque parmi les
hétérozygotes est seulement visible chez ceux qui boivent de
l’alcool mais qui le métabolisent inefficacement, et présentent donc
des taux élevés d’acétaldéhyde circulant. Cet exemple met en lumière
que l’alcool est un facteur de risque modifiable de l’environnement
dans le cancer de l’œsophage et que l’effet de l’alcool est relayé
par la production d’acétaldéhyde.En 2014, Holmes et ses collaborateurs (Holmes et coll.,
2014 ) ont
utilisé le variant rs1229984 du gène codant l’ADH1B, enzyme
principale dans le métabolisme de l’alcool (Edenberg,
2007
) ont
utilisé le variant rs1229984 du gène codant l’ADH1B, enzyme
principale dans le métabolisme de l’alcool (Edenberg,
2007 ),
comme outil pour rechercher un lien de causalité entre la
consommation d’alcool et les maladies cardiovasculaires. Les
porteurs de la mutation (allèle A) présentent un flush facial suite
à la consommation d’alcool, des plus faibles niveaux de consommation
d’alcool et d’alcoolémie (Yokoyama et coll.,
2014
),
comme outil pour rechercher un lien de causalité entre la
consommation d’alcool et les maladies cardiovasculaires. Les
porteurs de la mutation (allèle A) présentent un flush facial suite
à la consommation d’alcool, des plus faibles niveaux de consommation
d’alcool et d’alcoolémie (Yokoyama et coll.,
2014 ),
ainsi qu’un risque réduit d’alcoolo-dépendance chez les adolescents
(Bierut et coll., 2012
),
ainsi qu’un risque réduit d’alcoolo-dépendance chez les adolescents
(Bierut et coll., 2012 ) et les adultes (MacGregor et coll.,
2009
) et les adultes (MacGregor et coll.,
2009 ;
Bierut et coll., 2012
;
Bierut et coll., 2012 ). Cet instrument génétique a déjà été
choisi dans des études sur le rôle de la consommation d’alcool dans
l’hypertension et différents cancers (Kato et coll.,
2011
). Cet instrument génétique a déjà été
choisi dans des études sur le rôle de la consommation d’alcool dans
l’hypertension et différents cancers (Kato et coll.,
2011 ;
Drogan et coll., 2012
;
Drogan et coll., 2012 ; Lawlor et coll.,
2013
; Lawlor et coll.,
2013 ).
Cette étude de RM est une méta-analyse de 56 études épidémiologiques
comprenant 261 991 sujets d’origine européenne dont 202 559 cas de
maladie coronarienne et 10 164 cas d’accident vasculaire cérébral.
Dans cette étude, les sujets porteurs de l’allèle A consomment moins
d’alcool par semaine (-17,2 % [IC 95 % : 15,6-18,9]), ont moins
d’épisodes de binge drinking (OR1
= 0,78 [IC 95 % : 0,73-0,84]) et plus de jours
d’abstinence (OR = 1,27 [IC 95 % : 1,21-1,34]) que les sujets ne
portant pas l’allèle A. Les porteurs de l’allèle A ont aussi une
pression artérielle systolique inférieure, des taux
d’interleukine-6, un tour de taille et un indice de masse corporelle
réduits. Les résultats montrent que les porteurs de l’allèle A
présentent moins de maladies coronariennes (OR = 0,90 [IC 95 % :
0,84-0,96]). L’effet protecteur de la mutation est retrouvé dans les
différentes catégories de niveau de consommation d’alcool
(0, > 0-< 5,5, ≥ 5,5-16, ≥ 16 unités par semaine). Les porteurs
de l’allèle A présentent aussi moins d’AVC ischémiques (OR = 0,83
[IC 95 % : 0,72-0,95]), mais pas de différence concernant l’ensemble
des différents types d’AVC. Les auteurs concluent que chez les
porteurs de la mutation du gène codant ADH1, les non-buveurs et la
réduction de la consommation chez les buveurs (même chez ceux qui
boivent le moins) le risque de maladie coronarienne et d’AVC
ischémique est réduit. Les auteurs suggèrent que la réduction de la
consommation d’alcool est bénéfique du point de vue cardiovasculaire
même chez ceux qui boivent le moins. Ces résultats ne vont donc pas
dans le sens d’un effet protecteur de faibles niveaux de
consommation d’alcool.
).
Cette étude de RM est une méta-analyse de 56 études épidémiologiques
comprenant 261 991 sujets d’origine européenne dont 202 559 cas de
maladie coronarienne et 10 164 cas d’accident vasculaire cérébral.
Dans cette étude, les sujets porteurs de l’allèle A consomment moins
d’alcool par semaine (-17,2 % [IC 95 % : 15,6-18,9]), ont moins
d’épisodes de binge drinking (OR1
= 0,78 [IC 95 % : 0,73-0,84]) et plus de jours
d’abstinence (OR = 1,27 [IC 95 % : 1,21-1,34]) que les sujets ne
portant pas l’allèle A. Les porteurs de l’allèle A ont aussi une
pression artérielle systolique inférieure, des taux
d’interleukine-6, un tour de taille et un indice de masse corporelle
réduits. Les résultats montrent que les porteurs de l’allèle A
présentent moins de maladies coronariennes (OR = 0,90 [IC 95 % :
0,84-0,96]). L’effet protecteur de la mutation est retrouvé dans les
différentes catégories de niveau de consommation d’alcool
(0, > 0-< 5,5, ≥ 5,5-16, ≥ 16 unités par semaine). Les porteurs
de l’allèle A présentent aussi moins d’AVC ischémiques (OR = 0,83
[IC 95 % : 0,72-0,95]), mais pas de différence concernant l’ensemble
des différents types d’AVC. Les auteurs concluent que chez les
porteurs de la mutation du gène codant ADH1, les non-buveurs et la
réduction de la consommation chez les buveurs (même chez ceux qui
boivent le moins) le risque de maladie coronarienne et d’AVC
ischémique est réduit. Les auteurs suggèrent que la réduction de la
consommation d’alcool est bénéfique du point de vue cardiovasculaire
même chez ceux qui boivent le moins. Ces résultats ne vont donc pas
dans le sens d’un effet protecteur de faibles niveaux de
consommation d’alcool.
 ) ont
utilisé le variant rs1229984 du gène codant l’ADH1B, enzyme
principale dans le métabolisme de l’alcool (Edenberg,
2007
) ont
utilisé le variant rs1229984 du gène codant l’ADH1B, enzyme
principale dans le métabolisme de l’alcool (Edenberg,
2007 ),
comme outil pour rechercher un lien de causalité entre la
consommation d’alcool et les maladies cardiovasculaires. Les
porteurs de la mutation (allèle A) présentent un flush facial suite
à la consommation d’alcool, des plus faibles niveaux de consommation
d’alcool et d’alcoolémie (Yokoyama et coll.,
2014
),
comme outil pour rechercher un lien de causalité entre la
consommation d’alcool et les maladies cardiovasculaires. Les
porteurs de la mutation (allèle A) présentent un flush facial suite
à la consommation d’alcool, des plus faibles niveaux de consommation
d’alcool et d’alcoolémie (Yokoyama et coll.,
2014 ),
ainsi qu’un risque réduit d’alcoolo-dépendance chez les adolescents
(Bierut et coll., 2012
),
ainsi qu’un risque réduit d’alcoolo-dépendance chez les adolescents
(Bierut et coll., 2012 ) et les adultes (MacGregor et coll.,
2009
) et les adultes (MacGregor et coll.,
2009 ;
Bierut et coll., 2012
;
Bierut et coll., 2012 ). Cet instrument génétique a déjà été
choisi dans des études sur le rôle de la consommation d’alcool dans
l’hypertension et différents cancers (Kato et coll.,
2011
). Cet instrument génétique a déjà été
choisi dans des études sur le rôle de la consommation d’alcool dans
l’hypertension et différents cancers (Kato et coll.,
2011 ;
Drogan et coll., 2012
;
Drogan et coll., 2012 ; Lawlor et coll.,
2013
; Lawlor et coll.,
2013 ).
Cette étude de RM est une méta-analyse de 56 études épidémiologiques
comprenant 261 991 sujets d’origine européenne dont 202 559 cas de
maladie coronarienne et 10 164 cas d’accident vasculaire cérébral.
Dans cette étude, les sujets porteurs de l’allèle A consomment moins
d’alcool par semaine (-17,2 % [IC 95 % : 15,6-18,9]), ont moins
d’épisodes de binge drinking (OR1
= 0,78 [IC 95 % : 0,73-0,84]) et plus de jours
d’abstinence (OR = 1,27 [IC 95 % : 1,21-1,34]) que les sujets ne
portant pas l’allèle A. Les porteurs de l’allèle A ont aussi une
pression artérielle systolique inférieure, des taux
d’interleukine-6, un tour de taille et un indice de masse corporelle
réduits. Les résultats montrent que les porteurs de l’allèle A
présentent moins de maladies coronariennes (OR = 0,90 [IC 95 % :
0,84-0,96]). L’effet protecteur de la mutation est retrouvé dans les
différentes catégories de niveau de consommation d’alcool
(0, > 0-< 5,5, ≥ 5,5-16, ≥ 16 unités par semaine). Les porteurs
de l’allèle A présentent aussi moins d’AVC ischémiques (OR = 0,83
[IC 95 % : 0,72-0,95]), mais pas de différence concernant l’ensemble
des différents types d’AVC. Les auteurs concluent que chez les
porteurs de la mutation du gène codant ADH1, les non-buveurs et la
réduction de la consommation chez les buveurs (même chez ceux qui
boivent le moins) le risque de maladie coronarienne et d’AVC
ischémique est réduit. Les auteurs suggèrent que la réduction de la
consommation d’alcool est bénéfique du point de vue cardiovasculaire
même chez ceux qui boivent le moins. Ces résultats ne vont donc pas
dans le sens d’un effet protecteur de faibles niveaux de
consommation d’alcool.
).
Cette étude de RM est une méta-analyse de 56 études épidémiologiques
comprenant 261 991 sujets d’origine européenne dont 202 559 cas de
maladie coronarienne et 10 164 cas d’accident vasculaire cérébral.
Dans cette étude, les sujets porteurs de l’allèle A consomment moins
d’alcool par semaine (-17,2 % [IC 95 % : 15,6-18,9]), ont moins
d’épisodes de binge drinking (OR1
= 0,78 [IC 95 % : 0,73-0,84]) et plus de jours
d’abstinence (OR = 1,27 [IC 95 % : 1,21-1,34]) que les sujets ne
portant pas l’allèle A. Les porteurs de l’allèle A ont aussi une
pression artérielle systolique inférieure, des taux
d’interleukine-6, un tour de taille et un indice de masse corporelle
réduits. Les résultats montrent que les porteurs de l’allèle A
présentent moins de maladies coronariennes (OR = 0,90 [IC 95 % :
0,84-0,96]). L’effet protecteur de la mutation est retrouvé dans les
différentes catégories de niveau de consommation d’alcool
(0, > 0-< 5,5, ≥ 5,5-16, ≥ 16 unités par semaine). Les porteurs
de l’allèle A présentent aussi moins d’AVC ischémiques (OR = 0,83
[IC 95 % : 0,72-0,95]), mais pas de différence concernant l’ensemble
des différents types d’AVC. Les auteurs concluent que chez les
porteurs de la mutation du gène codant ADH1, les non-buveurs et la
réduction de la consommation chez les buveurs (même chez ceux qui
boivent le moins) le risque de maladie coronarienne et d’AVC
ischémique est réduit. Les auteurs suggèrent que la réduction de la
consommation d’alcool est bénéfique du point de vue cardiovasculaire
même chez ceux qui boivent le moins. Ces résultats ne vont donc pas
dans le sens d’un effet protecteur de faibles niveaux de
consommation d’alcool.Ce variant génétique a aussi été utilisé dans des études explorant le
lien de causalité entre la consommation d’alcool et la mortalité ou
la démence. Une étude australienne sur la mortalité a ainsi utilisé
une cohorte de 3 496 hommes âgés de 70 à 89 ans dont 225 étaient
porteurs de la mutation ADH1B rs1229984 ayant consommé ou non de
l’alcool (jamais, précédemment, ≤ 2 verres (soit 20 g d’éthanol pur)
par jour, 2 à 4 verres par jour, 4 à 6 verres par jour, > 6 verres
par jour) (Almeida et coll., 2017 ). Les porteurs de la mutation consommaient
moins d’alcool que les non-porteurs. Les résultats de l’étude
montrent une augmentation du risque de mortalité avec les niveaux
croissants de consommation d’alcool suggérant ainsi un lien de
causalité. Cette étude n’a pas démontré de diminution de la
mortalité avec une consommation d’alcool faible à modérée.
Concernant les démences, plusieurs études n’ont pas démontré de lien
de causalité entre la consommation d’alcool prédite génétiquement et
le risque d’atteintes cognitives (Almeida et coll.,
2014
). Les porteurs de la mutation consommaient
moins d’alcool que les non-porteurs. Les résultats de l’étude
montrent une augmentation du risque de mortalité avec les niveaux
croissants de consommation d’alcool suggérant ainsi un lien de
causalité. Cette étude n’a pas démontré de diminution de la
mortalité avec une consommation d’alcool faible à modérée.
Concernant les démences, plusieurs études n’ont pas démontré de lien
de causalité entre la consommation d’alcool prédite génétiquement et
le risque d’atteintes cognitives (Almeida et coll.,
2014 ;
Kumari et coll., 2014
;
Kumari et coll., 2014 ; Larsson et coll.,
2017
; Larsson et coll.,
2017 ).
).
 ). Les porteurs de la mutation consommaient
moins d’alcool que les non-porteurs. Les résultats de l’étude
montrent une augmentation du risque de mortalité avec les niveaux
croissants de consommation d’alcool suggérant ainsi un lien de
causalité. Cette étude n’a pas démontré de diminution de la
mortalité avec une consommation d’alcool faible à modérée.
Concernant les démences, plusieurs études n’ont pas démontré de lien
de causalité entre la consommation d’alcool prédite génétiquement et
le risque d’atteintes cognitives (Almeida et coll.,
2014
). Les porteurs de la mutation consommaient
moins d’alcool que les non-porteurs. Les résultats de l’étude
montrent une augmentation du risque de mortalité avec les niveaux
croissants de consommation d’alcool suggérant ainsi un lien de
causalité. Cette étude n’a pas démontré de diminution de la
mortalité avec une consommation d’alcool faible à modérée.
Concernant les démences, plusieurs études n’ont pas démontré de lien
de causalité entre la consommation d’alcool prédite génétiquement et
le risque d’atteintes cognitives (Almeida et coll.,
2014 ;
Kumari et coll., 2014
;
Kumari et coll., 2014 ; Larsson et coll.,
2017
; Larsson et coll.,
2017 ).
).Plus récemment, une étude (Millwood et coll.,
2019 ) de
RM sur 161 498 participants recrutés dans 10 territoires de Chine a
génotypé deux variants communs dans les populations asiatiques de
l’est avec le rs122994-ADH1B et le rs671-ALDH2. Les sujets ont été
suivis pendant 10 ans notamment pour les maladies cardiovasculaires
(AVC ischémique, hémorragie intracérébrale et infarctus du
myocarde). Les risques relatifs associant incidence des pathologies
et la consommation d’alcool rapportée (épidémiologie classique) ou
celle prédite d’après le génotype (épidémiologie génétique ou RM)
ont été calculés en effectuant une stratification selon la région
afin de contrôler les variations de prévalence des maladies et des
consommations d’alcool prédites par le génotype. Les différents
génotypes (en combinant les 2 variants soit 9 génotypes différents)
et les 10 régions de Chine permettent de définir 6 catégories de
consommation d’alcool : 4, 18, 34, 78, 130 et 256 g par semaine. La
classification des individus dépend donc ici de leur génotype et de
leur région et non de leur consommation d’alcool. Différents profils
de consommateurs ont été considérés l’année précédant le
recrutement : les ex-buveurs (aucune consommation ou consommation
occasionnelle mais avec une consommation d’alcool la plupart des
semaines avant le recrutement), les non-buveurs (pas d’alcool
consommé et jamais de consommation la plupart des semaines), les
buveurs occasionnels (usage occasionnel et jamais de consommation la
plupart des semaines) et les buveurs actifs (usage d’alcool la
plupart des semaines).
) de
RM sur 161 498 participants recrutés dans 10 territoires de Chine a
génotypé deux variants communs dans les populations asiatiques de
l’est avec le rs122994-ADH1B et le rs671-ALDH2. Les sujets ont été
suivis pendant 10 ans notamment pour les maladies cardiovasculaires
(AVC ischémique, hémorragie intracérébrale et infarctus du
myocarde). Les risques relatifs associant incidence des pathologies
et la consommation d’alcool rapportée (épidémiologie classique) ou
celle prédite d’après le génotype (épidémiologie génétique ou RM)
ont été calculés en effectuant une stratification selon la région
afin de contrôler les variations de prévalence des maladies et des
consommations d’alcool prédites par le génotype. Les différents
génotypes (en combinant les 2 variants soit 9 génotypes différents)
et les 10 régions de Chine permettent de définir 6 catégories de
consommation d’alcool : 4, 18, 34, 78, 130 et 256 g par semaine. La
classification des individus dépend donc ici de leur génotype et de
leur région et non de leur consommation d’alcool. Différents profils
de consommateurs ont été considérés l’année précédant le
recrutement : les ex-buveurs (aucune consommation ou consommation
occasionnelle mais avec une consommation d’alcool la plupart des
semaines avant le recrutement), les non-buveurs (pas d’alcool
consommé et jamais de consommation la plupart des semaines), les
buveurs occasionnels (usage occasionnel et jamais de consommation la
plupart des semaines) et les buveurs actifs (usage d’alcool la
plupart des semaines).
 ) de
RM sur 161 498 participants recrutés dans 10 territoires de Chine a
génotypé deux variants communs dans les populations asiatiques de
l’est avec le rs122994-ADH1B et le rs671-ALDH2. Les sujets ont été
suivis pendant 10 ans notamment pour les maladies cardiovasculaires
(AVC ischémique, hémorragie intracérébrale et infarctus du
myocarde). Les risques relatifs associant incidence des pathologies
et la consommation d’alcool rapportée (épidémiologie classique) ou
celle prédite d’après le génotype (épidémiologie génétique ou RM)
ont été calculés en effectuant une stratification selon la région
afin de contrôler les variations de prévalence des maladies et des
consommations d’alcool prédites par le génotype. Les différents
génotypes (en combinant les 2 variants soit 9 génotypes différents)
et les 10 régions de Chine permettent de définir 6 catégories de
consommation d’alcool : 4, 18, 34, 78, 130 et 256 g par semaine. La
classification des individus dépend donc ici de leur génotype et de
leur région et non de leur consommation d’alcool. Différents profils
de consommateurs ont été considérés l’année précédant le
recrutement : les ex-buveurs (aucune consommation ou consommation
occasionnelle mais avec une consommation d’alcool la plupart des
semaines avant le recrutement), les non-buveurs (pas d’alcool
consommé et jamais de consommation la plupart des semaines), les
buveurs occasionnels (usage occasionnel et jamais de consommation la
plupart des semaines) et les buveurs actifs (usage d’alcool la
plupart des semaines).
) de
RM sur 161 498 participants recrutés dans 10 territoires de Chine a
génotypé deux variants communs dans les populations asiatiques de
l’est avec le rs122994-ADH1B et le rs671-ALDH2. Les sujets ont été
suivis pendant 10 ans notamment pour les maladies cardiovasculaires
(AVC ischémique, hémorragie intracérébrale et infarctus du
myocarde). Les risques relatifs associant incidence des pathologies
et la consommation d’alcool rapportée (épidémiologie classique) ou
celle prédite d’après le génotype (épidémiologie génétique ou RM)
ont été calculés en effectuant une stratification selon la région
afin de contrôler les variations de prévalence des maladies et des
consommations d’alcool prédites par le génotype. Les différents
génotypes (en combinant les 2 variants soit 9 génotypes différents)
et les 10 régions de Chine permettent de définir 6 catégories de
consommation d’alcool : 4, 18, 34, 78, 130 et 256 g par semaine. La
classification des individus dépend donc ici de leur génotype et de
leur région et non de leur consommation d’alcool. Différents profils
de consommateurs ont été considérés l’année précédant le
recrutement : les ex-buveurs (aucune consommation ou consommation
occasionnelle mais avec une consommation d’alcool la plupart des
semaines avant le recrutement), les non-buveurs (pas d’alcool
consommé et jamais de consommation la plupart des semaines), les
buveurs occasionnels (usage occasionnel et jamais de consommation la
plupart des semaines) et les buveurs actifs (usage d’alcool la
plupart des semaines).Dans cette étude, 33 % des hommes (69 897/21 0205) ont rapporté une
consommation d’alcool la plupart des semaines, principalement de
spiritueux comparativement à seulement 2 % des femmes
(6 245/302 510). Les données ont été ajustées pour le territoire,
l’âge, le niveau d’éducation, les revenus et la consommation de
tabac. Parmi les hommes, l’épidémiologie conventionnelle montre des
associations de type courbe en U entre la consommation d’alcool
rapportée et l’incidence de l’AVC ischémique, l’hémorragie cérébrale
et l’infarctus du myocarde. Les hommes déclarant consommer environ
10 verres standards par semaine (1 à 2 verres par jour) présentent
un risque réduit comparativement aux non-buveurs ou à ceux
consommant plus d’alcool. De manière très frappante, l’analyse basée
sur les consommations d’alcool prédites par le génotype ne conduit
pas du tout à des relations selon des courbes en U mais plutôt des
relations linéaires. Les consommations prédites varient entre 4 et
256 g par semaine, soit entre zéro et environ 4 verres standards par
jour. L’alcool augmente la pression artérielle (d’environ 5 mmHg) et
le taux de cholestérol HDL. L’alcool augmente le risque d’AVC (de
27 % pour l’AVC ischémique et 58 % pour l’hémorragie intracérébrale)
et dans la présente étude l’alcool n’influence pas le risque
d’infarctus du myocarde. Ainsi, pour l’AVC ischémique et
l’hémorragie intracérébrale, les risques relatifs étaient
respectivement de 1,27 [IC 95 % : 1,13-1,43] et de 1,58 [IC 95 % :
1,36-1,84] pour la consommation de 28 verres standards par semaine
(40 g par jour) alors qu’aucune association n’a été trouvée pour le
risque d’infarctus du myocarde 0,96 [IC 95 % : 0,78-1,18]. Les
données génétiques révèlent que l’alcool est responsable d’environ
8 % des AVC ischémiques et 16 % des hémorragies intracérébrales. Les
deux types d’analyse (épidémiologique classique et génétique)
montrent une association positive robuste avec la pression
artérielle systolique. Aucun résultat significatif n’a été obtenu
chez les femmes pour lesquelles la taille de l’échantillon était
faible. Les auteurs concluent que la RM permet de démontrer qu’il
n’y a pas de rôle protecteur d’un faible niveau de consommation
d’alcool vis-à-vis du risque d’AVC. Sur la figure suivante
(figure 2.9 ) est montré à
titre d’exemple le résultat concernant le risque d’AVC (tous types)
en fonction des deux types d’analyse.
) est montré à
titre d’exemple le résultat concernant le risque d’AVC (tous types)
en fonction des deux types d’analyse.
 ) est montré à
titre d’exemple le résultat concernant le risque d’AVC (tous types)
en fonction des deux types d’analyse.
) est montré à
titre d’exemple le résultat concernant le risque d’AVC (tous types)
en fonction des deux types d’analyse.Les résultats obtenus dans cette étude sur l’augmentation du risque
d’AVC avec l’augmentation de la consommation d’alcool ainsi que les
résultats sur l’infarctus du myocarde sont en accord avec ceux d’une
méta-analyse récente (Wood et coll.,
2018 ).
).
 ).
).Certaines limites dans cette étude sont à prendre en considération
comme le fait que la population étudiée ici consomme majoritairement
des spiritueux et avec un profil de consommation non précisé mais
qui s’apparenterait plus au binge drinking. Les niveaux de
consommation très différents entre les régions peuvent suggérer des
différences également en termes de conditions sociales,
environnementales et de style de vie. Il faut aussi garder à
l’esprit que des individus porteurs de mutations qui limiteraient
leur consommation d’alcool peuvent consommer en dépit des effets
négatifs induits par l’ingestion d’alcool, en d’autres termes les
mutations génétiques expliquent seulement une certaine part du
niveau et du profil de consommation (Gmel,
2017 ), et
toute variable instrumentale est limitée par sa puissance
explicative.
), et
toute variable instrumentale est limitée par sa puissance
explicative.
 ), et
toute variable instrumentale est limitée par sa puissance
explicative.
), et
toute variable instrumentale est limitée par sa puissance
explicative.Même si certaines limites sont à considérer, il est remarquable de
constater que l’analyse basée sur des facteurs génétiques qui
prédisposent à la consommation d’alcool, fait disparaître un
potentiel effet protecteur de l’alcool, même si la consommation
d’alcool est largement influencée par des facteurs culturels et
environnementaux. Au total, le plus faible risque d’AVC observé chez
les buveurs occasionnels comparativement aux non-buveurs ou aux
ex-buveurs qui est suggéré par les analyses épidémiologiques
conventionnelles reflète le biais de causalité inverse ou
l’existence de facteurs de confusion et cette diminution du risque
« s’évapore » avec une analyse d’épidémiologie génétique.
Nouveaux repères de consommation d’alcool en France
Le risque de mortalité lié à des faibles niveaux de consommation d’alcool
est toujours un sujet de recherche d’actualité qui suscite de nombreuses
controverses. Plusieurs études récentes se sont intéressées à la
détermination de l’impact des faibles niveaux de consommation sur la
mortalité globale ou celle liée à une pathologie particulière. De
nombreux travaux, eux aussi récents, ont concerné les problèmes
méthodologiques des études. De nouvelles méthodologies comme
l’épidémiologie génétique ou randomisation mendélienne viennent nous
éclairer sur le lien de causalité entre les faibles niveaux de
consommation d’alcool et le risque de mortalité.
Cet impact des faibles niveaux de consommation revêt une importance
capitale pour estimer le fardeau global des maladies (Gakidou et coll.,
2017 ), le
développement des politiques publiques de lutte contre les maladies
liées à l’alcool (Babor et coll., 2010
), le
développement des politiques publiques de lutte contre les maladies
liées à l’alcool (Babor et coll., 2010 ) et enfin l’établissement des recommandations
nationales sur les repères de consommation (Stockwell et Room,
2012
) et enfin l’établissement des recommandations
nationales sur les repères de consommation (Stockwell et Room,
2012 ).
).
 ), le
développement des politiques publiques de lutte contre les maladies
liées à l’alcool (Babor et coll., 2010
), le
développement des politiques publiques de lutte contre les maladies
liées à l’alcool (Babor et coll., 2010 ) et enfin l’établissement des recommandations
nationales sur les repères de consommation (Stockwell et Room,
2012
) et enfin l’établissement des recommandations
nationales sur les repères de consommation (Stockwell et Room,
2012 ).
).La Mission interministérielle de lutte contre les drogues et les
conduites addictives (Mildeca) et la Direction générale de la santé
(DGS) ont mandaté Santé publique France et l’Institut national du cancer
pour produire un avis d’experts sur les repères de consommation d’alcool
(Ducimetiere, 2017 ) (voir la communication « Propositions d’évolution du discours public
concernant les repères de consommation d’alcool en France »).
) (voir la communication « Propositions d’évolution du discours public
concernant les repères de consommation d’alcool en France »).
 ) (voir la communication « Propositions d’évolution du discours public
concernant les repères de consommation d’alcool en France »).
) (voir la communication « Propositions d’évolution du discours public
concernant les repères de consommation d’alcool en France »).Cet avis d’experts a été publié en mai 2017. Dans cet avis d’experts, le
risque absolu de mortalité a été calculé en fonction des différents
niveaux de consommation. Il s’agit d’une modélisation de la mortalité
« vie-entière » (15-74 ans) attribuable à la consommation d’alcool
visant à déterminer un risque « faible » ou « acceptable » (proportion
de décès faible) en fonction du niveau de consommation (consommation
alors considérée comme à faible risque). Cette modélisation se base sur
une quantité d’alcool consommée quotidiennement et tous les jours tout
au long de la vie (consommation d’alcool stable tout au long de la vie)
et sur des risques eux aussi vie-entière. La distribution de la
consommation n’a pas été prise en compte et les non-buveurs ont été pris
comme groupe de référence (chiffres du Baromètre santé). Une subtilité a
été introduite dans cet avis où il est question non pas de seuil mais
plutôt de repère évitant ainsi l’écueil de seuil au-dessous duquel il
n’existerait aucun risque. Les résultats de cette modélisation ont
conduit à choisir un risque « faible » ou « acceptable » compris entre
1 % et 1 ‰. Le risque de 1 % est atteint dès la consommation de 15 g/j
(1,5 verre standard) chez les femmes et 25 g/j (2,5 verres standards)
chez les hommes. Cet avis d’experts recommande au final de ne pas
dépasser 10 verres standards par semaine et 2 verres standards par jour,
soit au moins 2 jours sans consommation dans la semaine. Cette nouvelle
recommandation ne fait plus de distinction en fonction du sexe afin de
simplifier la communication. Ces nouveaux repères mettent en lumière la
nécessité d’évoquer maintenant l’idée d’une consommation à faible risque
et non plus l’idée de consommation « avec modération » qui n’est pas
assez précise relativement au fait que toute consommation pourrait
comporter un risque pour la santé. Les anglais ont fait évoluer leurs
recommandations sur l’alcool en 2016 en choisissant un risque absolu de
mortalité de 1 % et en arrivant au repère de 11 verres par semaine
(Burton et Sheron, 2018).
Conclusion
Au total, des nouvelles données et des nouvelles méthodologies appliquées
à l’étude de l’association entre consommation d’alcool et risques pour
la santé ont fait avancer l’état des connaissances notamment sur les
faibles niveaux de consommation d’alcool. Il ne semble plus tenable en
2020 de mettre en avant de potentiels effets « protecteurs » de l’alcool
car lorsque les risques sur la santé sont appréciés de manière globale,
ces effets sont très largement compensés par les effets délétères de
l’alcool. La consommation d’alcool est associée avec l’augmentation du
risque de plusieurs cancers dont le cancer du sein et le risque existe à
des doses aussi faibles que 10 g d’éthanol pur, soit un verre, par jour.
Les nouvelles données sur les risques encourus dès les faibles niveaux
de consommation d’alcool ont poussé plusieurs pays, dont la France, à
revoir leurs recommandations et à fixer des « repères » acceptables et
crédibles scientifiquement. Il est frappant de constater que les
résultats des études scientifiques convergent vers ce repère des dix
verres standards par semaine et deux verres standards par jour et que
dans le même temps les recommandations de différents pays vont aussi
dans le même sens. Même si de potentiels effets « protecteurs »
existaient, ils seraient obtenus pour des consommations ne dépassant pas
les nouveaux repères de consommation. Enfin, de nombreux experts
s’accordent et recommandent de ne pas conseiller d’initier une
consommation d’alcool même faible à des fins d’amélioration de la santé
chez des non-buveurs. Les nouvelles données sur les effets des faibles
niveaux de consommation doivent nous interpeller sur la nécessité de
renforcer les messages d’information, de sensibilisation et de
prévention. La réduction de la consommation d’alcool même lorsque les
niveaux sont déjà faibles à modérés permettrait d’éviter un nombre non
négligeable de décès et l’incidence de certaines pathologies. Des
actions d’abstinence du type « Dry January » en Angleterre et
« Tournée Minérale » en Belgique rencontrent un grand succès et sont
l’occasion non seulement de réduire les effets de l’alcool sur la santé
des populations mais aussi d’interpeller les individus sur leur propre
consommation. La France s’est engagée à réduire de 10 % la consommation
d’alcool et les études montrent que cet objectif permettrait une fois
atteint de réduire significativement la morbidité et la mortalité liées
à l’alcool.
Références
[1] Aberg F, Helenius-Hietala J, Puukka P, et al . Binge drinking and the risk of liver events:
a population-based cohort study.
Liver Int. 2017;
37:1373- 81

[2] Allen NE, Beral V, Casabonne D, et al . Moderate alcohol intake and cancer incidence
in women.
J Natl Cancer Inst. 2009;
101:296- 305

[3] Almeida OP, McCaul K, Hankey GJ, et al . Excessive alcohol consumption increases
mortality in later life: a genetic analysis of the health in
men cohort study.
Addict Biol. 2017;
22:570- 8

[4] Almeida OP, Hankey GJ, Yeap BB, et al . Alcohol consumption and cognitive impairment
in older men: a mendelian randomization
study.
Neurology. 2014;
82:1038- 44

[5] Askgaard G, Grønbæk M, Kjær MS, et al . Alcohol drinking pattern and risk of
alcoholic liver cirrhosis: a prospective cohort
study.
J Hepatol. 2015;
62:1061- 7

[6] Baan R, Straif K, Grosse Y, et al . Carcinogenicity of alcoholic
beverages.
Lancet Oncol. 2007;
8:292- 3

[7] Babor TF, Caetano R, Casswell S, et al . Alcohol: no ordinary commodity. Research and
public policy.
Oxford:Oxford University Press;
2010.


[8] Bagnardi V, Rota M, Botteri E, et al . Alcohol consumption and site-specific cancer
risk: a comprehensive dose-response
meta-analysis.
Br J Cancer. 2015;
112:580- 93

[9] Bagnardi V, Rota M, Botteri E, et al . Light alcohol drinking and cancer: a
meta-analysis.
Ann Oncol. 2013;
24:301- 8

[10] Barrett-Connor E, Gaetano G de, Djoussé L, et al . Comments on moderate alcohol consumption and
mortality.
J Stud Alcohol Drugs. 2016;
77:834- 6

[11] Becker U. Prediction of risk of liver disease by
alcohol intake, sex, and age: a prospective population
study.
Hepatology. 1996;
23:1025- 9

[12] Bellentani S, Tiribelli C. The spectrum of liver disease in the general
population: lesson from the dionysos
study.
J Hepatol. 2001;
35:531- 7

[13] Bergmann MM, Rehm J, Klipstein-Grobusch K, et al . The association of pattern of lifetime
alcohol use and cause of death in the European prospective
investigation into cancer and nutrition (EPIC)
study.
Int J Epidemiol. 2013;
42:1772- 90

[14] Bierut LJ, Goate AM, Breslau N, et al . ADH1B is associated with alcohol dependence
and alcohol consumption in populations of European and
African ancestry.
Mol Psychiatry. 2012;
17:445- 50

[15] Bonaldi C, Hill C. La mortalité attribuable à l’alcool en France
en 2015.
Bull Épidémiol Hebd. 2019;
5-6:98- 107

[16] Britton A, Ben-Shlomo Y, Benzeval M, et al . Life course trajectories of alcohol
consumption in the United Kingdom using longitudinal data
from nine cohort studies.
BMC Medicine. 2015;
13: 47p. 

[18] Butt P, Beirness D, Gliksman L, et al . Alcohol and health in Canada: a summary of
evidence and guidelines for low-risk
drinking.
Ottawa:Canadian Centre on Substance
Abuse;
2011.


[19] Buykx P, Li J, Gavens L, et al . Public awareness of the link between alcohol
and cancer in England in 2015: a population-based
survey.
BMC Public Health. 2016;
16: 1194p. 

[21] Cao Y, Willett WC, Rimm EB, et al . Light to moderate intake of alcohol, drinking
patterns, and risk of cancer: results from two prospective
US cohort studies.
BMJ. 2015;
351: h4238p. 

[22] Chao YC, Liou SR, Chung YY, et al . Polymorphism of alcohol and aldehyde
dehydrogenase genes and alcoholic cirrhosis in chinese
patients.
Hepatology. 1994;
19:360- 6

[23] Chikritzhs T, Stockwell T, Naimi T, et al . Has the leaning tower of presumed health
benefits from moderate alcohol use finally
collapsed?.
Addiction. 2015;
110:726- 7

[24] Choi YJ, Myung SK, Lee JH. Light alcohol drinking and risk of cancer: a
meta-analysis of cohort studies.
Cancer Res Treat. 2018;
50:474- 48

[25] Corrao G, Bagnardi V, Zambon A, et al . A meta-analysis of alcohol consumption and
the risk of 15 diseases.
Prev Med. 2004;
38:613- 9

[26] Costanzo S, Gaetano G de, Di Castelnuovo A, et al . Moderate alcohol consumption and lower total
mortality risk: justified doubts or established
facts?.
Nutr Metab Cardiovasc Dis. 2019;
29:1003- 8

[28]Department of Health. How to keep health risks from drinking alcohol
to a low level: public consultation on proposed new
guidelines.
Dublin:Institute of Public
Health;
2016.


[29] Dervaux A, Laqueille X. Le traitement par thiamine (vitamine B1) dans
l’alcoolodépendance.
Presse Med. 2017;
46:165- 71

[30] Di Castelnuovo A, Costanzo S, Bagnardi V, et al . Alcohol dosing and total mortality in men and
women: an updated meta-analysis of 34 prospective
studies.
Arch Intern Med. 2006;
166:2437- 45

[31] Di Castelnuovo AF, Costanzo S, Gaetano G de. Alcohol and the global burden of
disease.
Lancet. 2019;
393: 2389p. 

[32] Ding EL, Mukamal KJ. Robustness of the J-shaped association of
alcohol with coronary heart disease risk.
J Stud Alcohol Drugs. 2017;
78:389- 91

[33] Dorans KS, Mostofsky E, Levitan EB, et al . Alcohol and incident heart failure among
middle-aged and elderly men: cohort of Swedish
men.
Circ Heart Fail. 2015;
8:422- 7

[34] Drogan D, Sheldrick AJ, Schütze M, et al . Alcohol consumption, genetic variants in
alcohol deydrogenases, and risk of cardiovascular diseases:
a prospective study and meta-analysis.
PLoS One. 2012;
7: e32176p. 

[35] Ducimetière P. Avis d’experts relatif à l’évolution du
discours public en matière de consommation d’alcool en
France.
Saint-Maurice:Santé Publique France;
2017.


[36]EASL Clinical Practice
Guidelines. Management of alcohol-related liver
disease.
J Hepatol. 2018;
69:154- 81

[37] Edenberg HJ. The genetics of alcohol metabolism: role of
alcohol dehydrogenase and aldehyde dehydrogenase
variants.
Alcohol Res Health. 2007;
30:5- 13

[38] Enomoto N, Takase S, Yasuhara M, et al . Acetaldehyde metabolism in different aldehyde
dehydrogenase-2 genotypes.
Alcohol Clin Exp Res. 1991;
15:141- 4

[39] Ettinger PO, Wu CF, La Cruz C de, et al . Arrhythmias and the Holiday Heart:
alcohol-associated cardiac rhythm
disorders.
Am Heart J. 1978;
95:555- 62

[40] Ezzati M, Hoorn VS, Lopez AD, et al . Comparative quantification of mortality and
burden of disease attributable to selected risk
factors.
In: Lopez AD et al., editors.
Global burden of disease and risk
factors.
Washington (DC):The International Bank for Reconstruction
and Development/The World Bank;
2006;


[42] Feunekes GIJ, van’t Veer P, van Staveren WA, et al . Alcohol intake assessment: the sober
facts.
Am J Epidemiol. 1999;
150:105- 12

[43] Fillmore KM, Roizen R, Farrell M, et al . Wartime Paris, cirrhosis mortality, and the
ceteris paribus assumption.
J Stud Alcohol. 2002;
63:436- 46

[44] Fillmore KM, Stockwell T, Chikritzhs T, et al . Moderate alcohol use and reduced mortality
risk: systematic error in prospective
studies.
Ann Epidemiol. 2007;
17 (5 suppl):S16- 23

[45] Gakidou E, Afshin A, Abajobir AA, et al . Global, regional, and national comparative
risk assessment of 84 behavioural, environmental and
occupational, and metabolic risks or clusters of risks,
19902016: a systematic analysis for the Global Burden of
Disease Study 2016.
Lancet. 2017;
390:1345- 422

[46] Gémes K, Janszky I, Laugsand LE, et al . Alcohol consumption is associated with a
lower incidence of acute myocardial infarction: results from
a large prospective population-based study in
Norway.
J Intern Med. 2016;
279:365- 75

[47] Gmel G. Beneficial effects of moderate alcohol use-a
case for Occam’s razor?.
Addiction. 2017;
112:215- 7

[48] Gmel G, Gutjahr E, Rehm J. How stable is the risk curve between alcohol
and all-cause mortality and what factors influence the
shape? A precision-weighted hierarchical
meta-analysis.
Eur J Epidemiol. 2002;
18:631- 42

[49] Goulden R. Moderate Alcohol consumption is not
associated with reduced all-cause
mortality.
Am J Med. 2016;
129:180- 6

[50] Griswold MG. Alcohol use and burden for 195 countries and
territories, 1990-2016: a systematic analysis for the Global
Burden of Disease Study 2016.
Lancet. 2018;
392:1015- 35

[51] Guérin S, Laplanche A, Dunant A, et al . Alcohol-attributable mortality in
France.
Eur J Public Health. 2013;
23:588- 93

[52] Gupta V, Walia GK, Sachdeva MP. Mendelian randomization: an approach for
exploring causal relations in
epidemiology.
Public Health. 2017;
145:113- 9

[53] Gutjahr E, Gmel G, Rehm J. Relation between average alcohol consumption
and disease: an overview.
Eur Addict Res. 2001;
7:117- 27

[54] Hamajima N, Hirose K, Tajima K, et al . Alcohol, tobacco and breast cancer:
collaborative reanalysis of individual data from 53
epidemiological studies, including 58 515 women with breast
cancer and 95 067 women without the
disease.
Br J Cancer. 2002;
87:1234- 45

[55] Hange D, Sigurdsson JA, Björkelund C, et al . A 32-year longitudinal study of alcohol
consumption in Swedish women: reduced risk of myocardial
infarction but increased risk of cancer.
Scand J Prim Health Care. 2015;
33:153- 62

[57] Holman CDAJ, English DR, Milne E, et al . Meta-analysis of alcohol and all-cause
mortality: a validation of NHMRC
recommendations.
Med J Aust. 1996;
164:141- 5

[58] Holmes VM, Dale CE, Zuccolo L, et al . Association between alcohol and
cardiovascular disease: Mendelian randomisation analysis
based on individual participant data.
BMJ. 2014;
349: g4164p. 

[59] Hydes TJ, Burton R, Inskip H, et al . A comparison of gender-linked population
cancer risks between alcohol and tobacco: how many
cigarettes are there in a bottle of
wine?.
BMC Public Health. 2019;
19: 316p. 

[60]IARC Working Group on the Evaluation of
Carcinogenic Risks to Humans. Alcohol consumption and ethyl
carbamate.
IARC monographs on the evaluation of
carcinogenic risks to humans.
Geneva:World Health Organization, International
Agency for Research on Cancer;
2010;


[61] Ilomaki J, Jokanovic N, Tan ECK, et al . Alcohol consumption, dementia and cognitive
decline: an overview of systematic
reviews.
Curr Clin Pharmacol. 2015;
10:204- 12

[62] Jones L, Bellis MA, Dan D, et al . Alcohol-attributable fractions for england:
alcohol-attributable mortality and hospital
admissions.
Liverpool:North West Public Health
Observatory;
2008.


[63] Kato N, Takeuchi F, Tabara Y, et al . Meta-analysis of genome-wide association
studies identifies common variants associated with blood
pressure variation in east Asians.
Nat Genet. 2011;
43:531- 8

[64] Kaur N, Pandey A, Negi H, et al . Effect of HDL-raising drugs on cardiovascular
outcomes: a systematic review and
meta-regression.
PLoS One. 2014;
9: e94585p. 

[65] Klatsky AL, Li Y, Tran HN, et al . Alcohol intake, beverage choice, and cancer:
a cohort study in a large kaiser permanente
population.
Perm J. 2015;
19:28- 34

[66] Klatsky AL, Udaltsova N, Li Y, et al . Moderate alcohol intake and cancer: the role
of underreporting.
Cancer Causes Control. 2014;
25:693- 9

[67] Klatsky AL, Gunderson EP, Kipp H, et al . Higher prevalence of systemic hypertension
among moderate alcohol drinkers: an exploration of the role
of underreporting.
J Stud Alcohol. 2006;
67:421- 8

[68] Knott CS, Coombs N, Stamatakis E, et al . All cause mortality and the case for age
specific alcohol consumption guidelines: pooled analyses of
up to 10 population based cohorts.
BMJ. 2015;
350: h384p. 

[69] Kumari M, Holmes VM, Dale CE, et al . Alcohol consumption and cognitive
performance: a Mendelian randomization
study.
Addiction. 2014;
109:1462- 71

[70] Larsson SC, Traylor M, Malik R, et al . Modifiable pathways in Alzheimer’s disease:
Mendelian randomisation analysis.
BMJ. 2017;
j5375p. 

[71] Larsson SC, Orsini N, Wolk A. Alcohol consumption and risk of heart
failure: a dose-response meta-analysis of prospective
studies.
Eur J Heart Fail. 2015;
17:367- 73

[72] Larsson SC, Drca N, Wolk A. Alcohol consumption and risk of atrial
fibrillation: a prospective study and dose-response
meta-analysis.
J Am Coll Cardiol. 2014;
64:281- 9

[73] Latino-Martel P, Arwidson P, Ancellin R, et al . Alcohol consumption and cancer risk:
revisiting guidelines for sensible
drinking.
CMAJ. 2011;
183:1861- 5

[74] Lawlor DA, Nordestgaard BG, Benn M, et al . Exploring causal associations between alcohol
and coronary heart disease risk factors: findings from a
Mendelian randomization study in the Copenhagen general
population study.
Eur Heart J. 2013;
34:2519- 28

[75] Lelbach WK. Cirrhosis in the alcoholic and its relation
to the volume of alcohol abuse.
Ann NY Acad Sci. 1975;
252:85- 105

[76] Leon DA, Chenet L, Shkolnikov VM, et al . Huge variation in Russian mortality rates
1984-94: artefact, alcohol, or what?.
Lancet. 1997;
350:383- 8

[77] Leong DP, Smyth A, Teo KK, et al . Patterns of alcohol consumption and
myocardial infarction risk.
Circulation. 2014;
130:390- 8

[78] Lewis SJ. Alcohol, ALDH2, and esophageal cancer: a
meta-analysis which illustrates the potentials and
limitations of a Mendelian randomization
approach.
Cancer Epidemiol Biomark Prev. 2005;
14:1967- 71

[79] Liang W, Chikritzhs T, Mendelson JE. The association between alcohol exposure and
self-reported health status: the effect of separating former
and current drinkers.
PLoS One. 2013;
8: e55881p. 

[80] Liu Y, Mitsuhashi T, Yamakawa M, et al . Alcohol consumption and incident dementia in
older Japanese adults: the Okayama study.
Geriatr Gerontol Int. 2019;
19:740- 6

[81] MacGregor S, Lind PA, Bucholz KK, et al . Associations of ADH and ALDH2 gene variation
with self report alcohol reactions, consumption and
dependence: an integrated analysis.
Hum Mol Genet. 2009;
18:580- 93

[82] Makelä P, Paljärvi T, Poikolainen K. Heavy and nonheavy drinking occasions,
all-cause and cardiovascular mortality and hospitalizations:
a follow-up study in a population with a low consumption
level.
J Stud Alcohol. 2005;
66:722- 8

[83] Masson S, Emmerson I, Henderson E, et al . Clinical but not histological factors predict
long-term prognosis in patients with histologically advanced
non-decompensated alcoholic liver
disease.
Liver Int. 2014;
34:235- 42

[84] Mcmanus DD, Yin X, Gladstone R, et al . Alcohol consumption, left atrial diameter,
and atrial fibrillation.
J Am Heart Assoc. 2016;
5: e004060p. 

[85] Memik F. Alcohol and esophageal cancer, is there an
exaggerated accusation?.
Hepatogastroenterology. 2003;
50:1953- 5

[86] Miles L. The new WCRF/AICR report Food, nutrition,
physical activity and the prevention of cancer: a global
perspective.
Nutrition Bulletin. 2008;
33:26- 32

[87] Millwood IY, Walters RG, Mei XW, et al . Conventional and genetic evidence on alcohol
and vascular disease aetiology: a prospective study of
500 000 men and women in China.
Lancet. 2019;
393:1831- 42

[88] Mostofsky E, Chahal HS, Mukamal KJ, et al . Alcohol and immediate risk of cardiovascular
events: a systematic review and dose-response
meta-analysis.
Circulation. 2016;
133:979- 87

[89] Myung SK. Erroneous conclusions about the association
between light alcohol drinking and the risk of cancer:
comments on Bagnardi et al.’s
meta-analysis.
Ann Oncol. 2016;
27: 2139p. 

[90] Naassila M. Alcool: un impact sur la santé, même à
faibles doses.
Bull Épidémiol Hebd. 2019;
10-11:176- 7

[91] Naimi TS, Stadtmueller LA, Chikritzhs T, et al . Alcohol, age, and mortality: estimating
selection bias due to premature death.
J Stud Alcohol Drugs. 2019;
80:63- 8

[92] Naimi TS, Stockwell T, Zhao J, et al . Selection biases in observational studies
affect associations between moderate alcohol consumption and
mortality.
Addiction. 2017;
112:207- 14

[93] Naimi TS, Xuan Z, Brown DW, et al . Confounding and studies of moderate alcohol
consumption: the case of drinking frequency and implications
for low-risk drinking guidelines.
Addiction. 2013;
108:1534- 43

[94] Naimi TS, Brown DW, Brewer RD, et al . Cardiovascular risk factors and confounders
among nondrinking and moderate-drinking U.S.
adults.
Am J Prev Med. 2005;
28:369- 73

[95]National Institute on Alcohol Abuse and
Alcoholism. NIAAA council approves definition of binge
drinking.
NIAAA Newsletter. 2004;
3: 3p. 

[96] Nemtsov VA. Alcohol-related human losses in Russia in the
1980s and 1990s.
Addiction. 2002;
97:1413- 25

[97] Neufeld M, Rehm J. Alcohol consumption and mortality in Russia
since 2000: are there any changes following the alcohol
policy changes starting in 2006?.
Alcohol Alcoholism. 2013;
48:222- 30

[98] O’Donnell MJ, Chin SL, Rangarajan S, et al . Global and regional effects of potentially
modifiable risk factors associated with acute stroke in 32
countries (INTERSTROKE): a case-control
study.
Lancet. 2016;
388:761- 75

[99] Ortolá R, García-Esquinas E, López-García E, et al . Alcohol consumption and all-cause mortality
in older adults in Spain: an analysis accounting for the
main methodological issues.
Addiction. 2019;
114:59- 68

[100] Paille F, Reynaud M. L’alcool, une des toutes premières causes
d’hospitalisation en France.
Bull Épidemiol Hebd. 2015;
24-25:440- 9

[101] Pflaum T, Hausler T, Baumung C, et al . Carcinogenic compounds in alcoholic
beverages: an update.
Arch Toxicol. 2016;
90:2349- 67

[102] Piazza-Gardner AK, Gaffud TJB, Barry AE. The impact of alcohol on Alzheimer’s disease:
a systematic review.
Aging Ment Health. 2013;
17:133- 46

[103] Pun VC, Lin H, Kim JH, et al . Impacts of alcohol duty reductions on
cardiovascular mortality among elderly Chinese: a 10-year
time series analysis.
J Epidemiol Community Health. 2013;
67:514- 8

[104] Purnell C, Gao S, Callahan CM, et al . Cardiovascular risk factors and incident
alzheimer disease: a systematic review of the
literature.
Alzheimer Dis Assoc Disord. 2009;
23:1- 10

[105] Rehm J, Hasan OSM, Black SE, et al . Alcohol use and dementia: a systematic
scoping review.
Alzheimers Res Ther. 2019;
11: 1p. 

[106] Rehm J. Why the relationship between level of
alcohol-use and all-cause mortality cannot be addressed with
meta-analyses of cohort studies.
Drug Alcohol Rev. 2019;
38:3- 4

[107] Rehm J, Roerecke M. Cardiovascular effects of alcohol
consumption.
Trends Cardiovasc Med. 2017;
27:534- 8

[108] Rehm J, Kailasapillai S, Larsen E, et al . A systematic review of the epidemiology of
unrecorded alcohol consumption and the chemical composition
of unrecorded alcohol.
Addiction. 2014;
109:880- 93

[109] Rehm J, Samokhvalov VA, Shield KD. Global burden of alcoholic liver
diseases.
J Hepatol. 2013;
59:160- 8

[110] Rehm J, Taylor B, Mohapatra S, et al . Alcohol as a risk factor for liver cirrhosis:
a systematic review and meta-analysis.
Drug Alcohol Rev. 2010a;
29:437- 45

[111] Rehm J, Baliunas D, Borges GLG, et al . The relation between different dimensions of
alcohol consumption and burden of disease: an
overview.
Addiction. 2010b;
105:817- 43

[112] Rehm J, Irving H, Ye Y, et al . Are lifetime abstainers the best control
group in alcohol epidemiology? On the stability and validity
of reported lifetime abstention.
Am J Epidemiol. 2008;
168:866- 71

[113] Rehm J, Room R, Monteiro M, et al . Alcohol as a risk factor for global burden of
disease.
Eur Addict Res. 2003a;
9:157- 64

[114] Rehm J, Room R, Graham K, et al . The relationship of average volume of alcohol
consumption and patterns of drinking to burden of disease:
an overview.
Addiction. 2003b;
98:1209- 28

[115] Renaud S, Lorgeril M de. Wine, alcohol, platelets, and the French
paradox for coronary heart disease.
Lancet. 1992;
339:1523- 26

[116] Roerecke M, Rehm J. Alcohol consumption, drinking patterns, and
ischemic heart disease: a narrative review of meta-analyses
and a systematic review and meta-analysis of the impact of
heavy drinking occasions on risk for moderate
drinkers.
BMC Medicine. 2014;
12: 182p. 

[117] Romieu I, Scoccianti C, Chajes V, et al . Alcohol intake and breast cancer in the
European prospective investigation into cancer and
nutrition.
Int J Cancer. 2015;
137:1921- 30

[118] Sabia S, Fayosse A, Dumurgier J, et al . Alcohol consumption and risk of dementia: 23
year follow-up of Whitehall II cohort
study.
BMJ. 2018;
362: k2927p. 

[119] Schwartz N, Nishri D, Chin Cheong S, et al . Is there an association between trends in
alcohol consumption and cancer mortality? Findings from a
multicountry analysis.
Eur J Cancer Prev. 2019;
28:45- 53

[120] Schwarzinger M, Pollock BG, Hasan OSM, et al . Contribution of alcohol use disorders to the
burden of dementia in France 2008-13: a nationwide
retrospective cohort study.
Lancet Publ Health. 2018;
3:E124- 32

[121] Schwarzinger M, Baillot S, Yazdanpanah Y, et al . Contribution of alcohol use disorders on the
burden of chronic hepatitis C in France, 20082013: a
nationwide retrospective cohort study.
J Hepatol. 2017;
67:454- 61

[122] Secretan B, Straif K, Baan R, et al . A review of human carcinogens. Part E:
tobacco, areca nut, alcohol, coal smoke, and salted
fish.
Lancet Oncol. 2009;
10:1033- 4

[123] Seitz HK, Bataller R, Cortez-Pinto H, et al . Alcoholic liver disease.
Nat Rev Dis Primers. 2018;
4: 16p. 

[124] Shaper AG, Wannamethee G, Walker M. Alcohol and mortality in british men:
explaining the u-shaped curve.
Lancet. 1988;
332:1267- 73

[125] Shield KD, Rehm J. Commentary on Costanzo et al. (2019): the
need for secondary analyses of prospective cohort
studies-creating a better understanding of alcohol
consumption and hospitalization.
Addiction. 2019;
114:651- 2

[126] Shield KD, Marant Micallef C, Hill C, et al . New cancer cases in France in 2015
attributable to different levels of alcohol
consumption.
Addiction. 2018;
113:247- 56

[127] Shield KD, Parry C, Rehm J. Chronic diseases and conditions related to
alcohol use.
Alcohol Res. 2013;
35:155- 71

[128] Shirpoor A. Ethanol and the cardiovascular system: friend
or enemy?.
Alcohol Clin Exp Res. 2018;
42:244- 7

[129] Simpson RF, Hermon C, Liu B, et al . Alcohol drinking patterns and liver cirrhosis
risk: analysis of the prospective UK million women
study.
Lancet Public Health. 2019;
4:E41- 8

[130] Sinclair J, McCann M, Sheldon E, et al . The acceptability of addressing alcohol
consumption as a modifiable risk factor for breast cancer: a
mixed method study within breast screening services and
symptomatic breast clinics.
BMJ Open. 2019;
9: e027371p. 

[131] Sipila P, Rose RJ, Kaprio J. Drinking and mortality: long-term follow-up
of drinking-discordant twin pairs.
Addiction. 2016;
111:245- 54

[132] Smyth A, Teo KK, Rangarajan S, et al . Alcohol consumption and cardiovascular
disease, cancer, injury, admission to hospital, and
mortality: a prospective cohort study.
Lancet. 2015;
386:1945- 54

[133] Sommers MS, Dyehouse JM, Howe SR, et al . Validity of self-reported alcohol consumption
in nondependent drinkers with unintentional
injuries.
Alcohol Clin Exp Res. 2000;
24:1406- 13

[134] Stockwell T, Zhao J, Panwar S, et al . Do moderate drinkers have reduced mortality
risk? A systematic review and meta-analysis of alcohol
consumption and all-cause mortality.
J Stud Alcohol Drugs. 2016;
77:185- 98

[135] Stockwell T, Zhao J, Macdonald S. Who under-reports their alcohol consumption
in telephone surveys and by how much? An application of the
yesterday method in a national Canadian substance use
survey.
Addiction. 2014;
109:1657- 66

[136] Stockwell T, Chikritzhs T. Commentary: another serious challenge to the
hypothesis that moderate drinking is good for
health?.
Int J Epidemiol. 2013;
42:1792- 4

[137] Stockwell T, Room R. Constructing and responding to low-risk
drinking guidelines: conceptualisation, evidence and
reception.
Drug Alcohol Rev. 2012;
31:121- 5

[138] Takagi S, Iwai N, Yamauchi R, et al . Aldehyde dehydrogenase 2 gene is a risk
factor for myocardial infarction in Japanese
men.
Hypertens Res. 2002;
25:677- 81

[139] Toma A, Pare G, Leong DP. Alcohol and cardiovascular disease: how much
is too much?.
Curr Atheroscler Rep. 2017;
19:1- 7

[140] Topiwala A, Allan CL, Valkanova V, et al . Moderate alcohol consumption as risk factor
for adverse brain outcomes and cognitive decline:
longitudinal cohort study.
BMJ. 2017;
357: j2353p. 

[141] Venkataraman A, Kalk N, Sewell G, et al . Alcohol and Alzheimer’s disease-does alcohol
dependence contribute to beta-amyloid deposition,
neuroinflammation and neurodegeneration in Alzheimer’s
disease?.
Alcohol Alcohol. 2017;
52:151- 8

[142] Verbaten MN. Chronic effects of low to moderate alcohol
consumption on structural and functional properties of the
brain: beneficial or not?.
Hum Psychopharmacol. 2009;
24:199- 205

[143] Wadman M. NIH pulls the plug on controversial alcohol
trial.
Science. 2018;
doi:10.1126/science.aau4964. 

[144] Whitman IR, Pletcher MJ, Vittinghoff E, et al . Perceptions, information sources, and
behavior regarding alcohol and heart
health.
Am J Cardiol. 2015;
116:642- 6

[145] Wilson LF, Baade PD, Green AC, et al . The impact of reducing alcohol consumption in
Australia: an estimate of the proportion of potentially
avoidable cancers 20132037.
Int J Cancer. 2019;
145:2944- 53

[146] Wood AM, Kaptoge S, Butterworth AS, et al . Risk thresholds for alcohol consumption:
combined analysis of individual-participant data for 599 912
current drinkers in 83 prospective
studies.
Lancet. 2018;
391:1513- 23

[147]World Cancer Research Fund. Diet, nutrition, physical activity and
gallbladder cancer.
Continuous Update Project.
2015;


[148]World Cancer Research Fund/American Institute
for Cancer Research. Diet, nutrition, physical activity and cancer:
a global perspective.
Continuous Update Project Expert
Report.
2018;


[149]World Health Organisation. Global status report on alcohol and health
2014. Global status report on alcohol.
Geneva:WHO;
2014;
1392

[151]World Health Organization. Global action plan for the prevention and
control of noncommunicable diseases
2013-2020.
Geneva:WHO;
2013;


[152] Wozniak MB, Brennan P, Brenner DR, et al . Alcohol consumption and the risk of renal
cancers in the European prospective investigation into
cancer and nutrition (EPIC).
Int J Cancer. 2015;
137:1953- 66

[153] Xu W, Wang H, Wan Y, et al . Alcohol consumption and dementia risk: a
dose-response meta-analysis of prospective
studies.
Eur J Epidemiol. 2017;
32:31- 42

[154] Yokoyama A, Yokoyama T, Mizukami T, et al . Blood ethanol levels of nonabstinent Japanese
alcoholic men in the morning after drinking and their ADH1B
and ALDH2 genotypes.
Alcohol Alcoholism. 2014;
49:31- 7

[155] Zakhari S, Hoek JB. Epidemiology of moderate alcohol consumption
and breast cancer: association or
causation?.
Cancers. 2018;
10: 349p. 

[156] Zhang C, Qin YY, Chen Q, et al . Alcohol intake and risk of stroke: a
dose-response meta-analysis of prospective
studies.
Int J Cardiol. 2014;
174:669- 77

[157] Zhao J, Stockwell T, Roemer A, et al . Is alcohol consumption a risk factor for
prostate cancer? A systematic review and
meta-analysis.
BMC Cancer. 2016;
16: 845p. 

[158] Zheng YL, Lian F, Shi Q, et al . Alcohol intake and associated risk of major
cardiovascular outcomes in women compared with men: a
systematic review and meta-analysis of prospective
observational studies.
BMC Public Health. 2015;
15: 773p. 

→ Aller vers SYNTHESE