Aspects cliniques et prise en charge de la maladie
2007
| ANALYSE |
11-
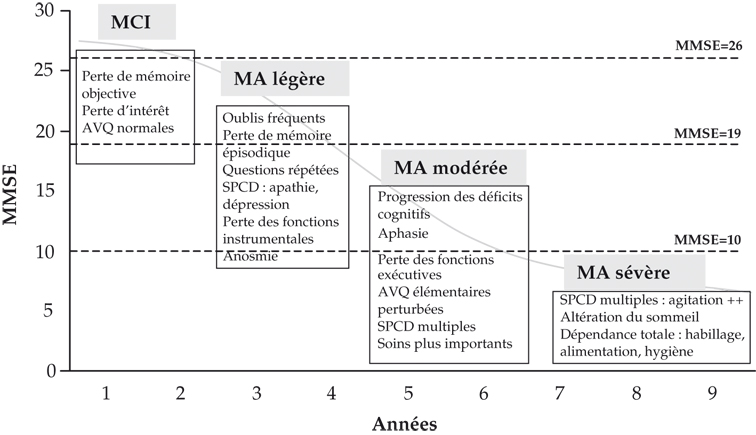
Évolution clinique
L'évolution de la maladie d'Alzheimer est relativement stéréotypée et suit la progression neuropathologique (notamment l'extension de la dégénérescence neurofibrillaire). L'évaluation de la progression de la maladie peut se faire sur différents paramètres : déclin des fonctions cognitives, évaluation de la dépendance ou encore par rapport aux changements de lieux de vie. Mais ces éléments dépendent également d'autres facteurs comme les pathologies associées, le statut familial et la qualité de la prise en charge à domicile, elle-même fonction du niveau de ressources et des aides offertes, qui varient selon les régions. Plus récemment, il a été proposé de suivre la progression de la maladie sur l'imagerie cérébrale, notamment l'aggravation de l'atrophie. Il est à noter qu'il existe des formes d'évolution rapide de la maladie, de très mauvais pronostic, qui probablement justifieraient une attention particulière.
Déclin cognitif
La maladie d'Alzheimer est une maladie évolutive avec des différences individuelles marquées de la pente de déclin (Wilson et coll., 2000b ; Behl et coll., 2005
; Behl et coll., 2005 ).
).
 ; Behl et coll., 2005
; Behl et coll., 2005 ).
).Mesures de la progression du déclin cognitif
Le déclin cognitif ne serait pas linéaire dans le temps (Mortimer et coll., 1992 ; Neumann et coll., 2001
; Neumann et coll., 2001 ) ni homogène (Morris et coll., 1993
) ni homogène (Morris et coll., 1993 ; Aisen et coll., 2000
; Aisen et coll., 2000 ; Mulnard et coll., 2000
; Mulnard et coll., 2000 ). Il est plus lent aux stades légers et sévères de la maladie et plus rapide aux stades intermédiaires (Morris et coll., 1993
). Il est plus lent aux stades légers et sévères de la maladie et plus rapide aux stades intermédiaires (Morris et coll., 1993 ; Brooks et coll., 1993
; Brooks et coll., 1993 ; Stern et coll., 1994a
; Stern et coll., 1994a ; Teri et coll., 1995
; Teri et coll., 1995 ; Storandt et coll., 2002
; Storandt et coll., 2002 ). La vitesse de déclin initial prédit le déclin ultérieur, rapide ou lent (Doody et coll., 2001
). La vitesse de déclin initial prédit le déclin ultérieur, rapide ou lent (Doody et coll., 2001 ; Capitani et coll., 2004
; Capitani et coll., 2004 ). La variabilité de la vitesse de déclin n'est toutefois pas bien expliquée (Galasko et coll., 1991
). La variabilité de la vitesse de déclin n'est toutefois pas bien expliquée (Galasko et coll., 1991 ). Il pourrait s'agir du manque de sensibilité du MMSE (Mini Mental State Examination) aux amplitudes de déclin cognitif aux stades légers et sévères de la maladie conduisant à mettre dans un même groupe des patients présentant en fait des déclins cognitifs différents dès l'entrée dans les études (Atchison et coll., 2004
). Il pourrait s'agir du manque de sensibilité du MMSE (Mini Mental State Examination) aux amplitudes de déclin cognitif aux stades légers et sévères de la maladie conduisant à mettre dans un même groupe des patients présentant en fait des déclins cognitifs différents dès l'entrée dans les études (Atchison et coll., 2004 ). Une étude prospective portant sur 289 patients atteints de maladie d'Alzheimer et 230 personnes âgées non démentes n'a pas réussi à prédire, au plan individuel, les patients qui auront un déclin cognitif lent ou rapide (Storandt et coll., 2002
). Une étude prospective portant sur 289 patients atteints de maladie d'Alzheimer et 230 personnes âgées non démentes n'a pas réussi à prédire, au plan individuel, les patients qui auront un déclin cognitif lent ou rapide (Storandt et coll., 2002 ). L'alcoolisme et d'autres problèmes de santé, notamment neurologiques, sont des facteurs aggravants, avec des déclins 1,4 à 5 fois plus rapides chez les patients concernés (Teri et coll., 1990
). L'alcoolisme et d'autres problèmes de santé, notamment neurologiques, sont des facteurs aggravants, avec des déclins 1,4 à 5 fois plus rapides chez les patients concernés (Teri et coll., 1990 ). La pente de progression est un facteur de pronostic (Kraemer et coll., 1994
). La pente de progression est un facteur de pronostic (Kraemer et coll., 1994 ). Le fait d'être stable pendant au moins 2 ans (« plateau ») est un facteur de bon pronostic sur un suivi de 7 ans (Piccini et coll., 1995
). Le fait d'être stable pendant au moins 2 ans (« plateau ») est un facteur de bon pronostic sur un suivi de 7 ans (Piccini et coll., 1995 ). La sévérité du déclin cognitif initial (au moment de la première visite) est, de façon logique, un facteur de mauvais pronostic souvent retrouvé (Drachman et coll., 1990
). La sévérité du déclin cognitif initial (au moment de la première visite) est, de façon logique, un facteur de mauvais pronostic souvent retrouvé (Drachman et coll., 1990 ; Marra et coll., 2000
; Marra et coll., 2000 ). Il ne semble pas y avoir de lien entre les antécédents familiaux de démence et la progression de la maladie (Cortes, 2006
). Il ne semble pas y avoir de lien entre les antécédents familiaux de démence et la progression de la maladie (Cortes, 2006 ). Le déclin cognitif est variable d'un individu à l'autre. On considère comme « déclineur » rapide un patient qui perd 3 points par an ou plus au score de MMSE (O'Hara et coll., 2002
). Le déclin cognitif est variable d'un individu à l'autre. On considère comme « déclineur » rapide un patient qui perd 3 points par an ou plus au score de MMSE (O'Hara et coll., 2002 ) et un « déclineur » lent un patient dont le score au MMSE diminue de moins de 2 points par an (Lopez et coll., 2005
) et un « déclineur » lent un patient dont le score au MMSE diminue de moins de 2 points par an (Lopez et coll., 2005 ).
).
 ; Neumann et coll., 2001
; Neumann et coll., 2001 ) ni homogène (Morris et coll., 1993
) ni homogène (Morris et coll., 1993 ; Aisen et coll., 2000
; Aisen et coll., 2000 ; Mulnard et coll., 2000
; Mulnard et coll., 2000 ). Il est plus lent aux stades légers et sévères de la maladie et plus rapide aux stades intermédiaires (Morris et coll., 1993
). Il est plus lent aux stades légers et sévères de la maladie et plus rapide aux stades intermédiaires (Morris et coll., 1993 ; Brooks et coll., 1993
; Brooks et coll., 1993 ; Stern et coll., 1994a
; Stern et coll., 1994a ; Teri et coll., 1995
; Teri et coll., 1995 ; Storandt et coll., 2002
; Storandt et coll., 2002 ). La vitesse de déclin initial prédit le déclin ultérieur, rapide ou lent (Doody et coll., 2001
). La vitesse de déclin initial prédit le déclin ultérieur, rapide ou lent (Doody et coll., 2001 ; Capitani et coll., 2004
; Capitani et coll., 2004 ). La variabilité de la vitesse de déclin n'est toutefois pas bien expliquée (Galasko et coll., 1991
). La variabilité de la vitesse de déclin n'est toutefois pas bien expliquée (Galasko et coll., 1991 ). Il pourrait s'agir du manque de sensibilité du MMSE (Mini Mental State Examination) aux amplitudes de déclin cognitif aux stades légers et sévères de la maladie conduisant à mettre dans un même groupe des patients présentant en fait des déclins cognitifs différents dès l'entrée dans les études (Atchison et coll., 2004
). Il pourrait s'agir du manque de sensibilité du MMSE (Mini Mental State Examination) aux amplitudes de déclin cognitif aux stades légers et sévères de la maladie conduisant à mettre dans un même groupe des patients présentant en fait des déclins cognitifs différents dès l'entrée dans les études (Atchison et coll., 2004 ). Une étude prospective portant sur 289 patients atteints de maladie d'Alzheimer et 230 personnes âgées non démentes n'a pas réussi à prédire, au plan individuel, les patients qui auront un déclin cognitif lent ou rapide (Storandt et coll., 2002
). Une étude prospective portant sur 289 patients atteints de maladie d'Alzheimer et 230 personnes âgées non démentes n'a pas réussi à prédire, au plan individuel, les patients qui auront un déclin cognitif lent ou rapide (Storandt et coll., 2002 ). L'alcoolisme et d'autres problèmes de santé, notamment neurologiques, sont des facteurs aggravants, avec des déclins 1,4 à 5 fois plus rapides chez les patients concernés (Teri et coll., 1990
). L'alcoolisme et d'autres problèmes de santé, notamment neurologiques, sont des facteurs aggravants, avec des déclins 1,4 à 5 fois plus rapides chez les patients concernés (Teri et coll., 1990 ). La pente de progression est un facteur de pronostic (Kraemer et coll., 1994
). La pente de progression est un facteur de pronostic (Kraemer et coll., 1994 ). Le fait d'être stable pendant au moins 2 ans (« plateau ») est un facteur de bon pronostic sur un suivi de 7 ans (Piccini et coll., 1995
). Le fait d'être stable pendant au moins 2 ans (« plateau ») est un facteur de bon pronostic sur un suivi de 7 ans (Piccini et coll., 1995 ). La sévérité du déclin cognitif initial (au moment de la première visite) est, de façon logique, un facteur de mauvais pronostic souvent retrouvé (Drachman et coll., 1990
). La sévérité du déclin cognitif initial (au moment de la première visite) est, de façon logique, un facteur de mauvais pronostic souvent retrouvé (Drachman et coll., 1990 ; Marra et coll., 2000
; Marra et coll., 2000 ). Il ne semble pas y avoir de lien entre les antécédents familiaux de démence et la progression de la maladie (Cortes, 2006
). Il ne semble pas y avoir de lien entre les antécédents familiaux de démence et la progression de la maladie (Cortes, 2006 ). Le déclin cognitif est variable d'un individu à l'autre. On considère comme « déclineur » rapide un patient qui perd 3 points par an ou plus au score de MMSE (O'Hara et coll., 2002
). Le déclin cognitif est variable d'un individu à l'autre. On considère comme « déclineur » rapide un patient qui perd 3 points par an ou plus au score de MMSE (O'Hara et coll., 2002 ) et un « déclineur » lent un patient dont le score au MMSE diminue de moins de 2 points par an (Lopez et coll., 2005
) et un « déclineur » lent un patient dont le score au MMSE diminue de moins de 2 points par an (Lopez et coll., 2005 ).
).Selon les études, le score au MMSE décroît annuellement de 1,8 à 6,7 points (Katzman et coll., 1988 ; Thal et coll., 1988
; Thal et coll., 1988 ; Burns et coll., 1991
; Burns et coll., 1991 ; Morris et coll., 1993
; Morris et coll., 1993 et 2004
et 2004 ; Holmes et coll., 2005
; Holmes et coll., 2005 ) ; de 3,4 points/an en moyenne selon le Consortium to Establish a Registry for Alzheimer's Disease (CERAD) américain (Clark et coll., 1999
) ; de 3,4 points/an en moyenne selon le Consortium to Establish a Registry for Alzheimer's Disease (CERAD) américain (Clark et coll., 1999 ) ; 2,4 points/an chez les patients de plus de 75 ans à un stade léger à modéré (Agüero-Torres et coll., 1998a
) ; 2,4 points/an chez les patients de plus de 75 ans à un stade léger à modéré (Agüero-Torres et coll., 1998a ) ; 2,3 points/an chez les patients de plus de 85 ans (Aevarsson et Skoog, 2000
) ; 2,3 points/an chez les patients de plus de 85 ans (Aevarsson et Skoog, 2000 ), aux alentours de 2,5 points/an à un stade modéré (Salmon et coll., 1990
), aux alentours de 2,5 points/an à un stade modéré (Salmon et coll., 1990 ; Teri et coll., 1990
; Teri et coll., 1990 ). Il décroît de 3,3 points/an dans une méta-analyse de 43 études regroupant 3 492 patients (IC 95 % [2,9-3,7]) (Han et coll., 2000
). Il décroît de 3,3 points/an dans une méta-analyse de 43 études regroupant 3 492 patients (IC 95 % [2,9-3,7]) (Han et coll., 2000 ). Un élément susceptible de jouer dans l'amplitude de l'effet est le score au MMSE à l'entrée dans l'étude et le nombre d'évaluations (Han et coll., 2000
). Un élément susceptible de jouer dans l'amplitude de l'effet est le score au MMSE à l'entrée dans l'étude et le nombre d'évaluations (Han et coll., 2000 ). Dans 2 cohortes anglaises (Londres et Oxford) de patients suivis tous les ans jusqu'à 3 ans, jamais traités par inhibiteur d'acétylcholinestérase (IAChE), la médiane de déclin annuel du MMSE était de 2,3 points avec une étendue (différence entre les valeurs observées les plus élevées et les plus faibles) de 22 points. Cette médiane n'était pas statistiquement différente dans le groupe le plus âgé et le plus sévère initialement (n=151, médiane d'âge 82 ans, étendue 30 ans, MMSE=11, étendue 28) et le groupe le plus jeune et le moins sévère (n=188, médiane d'âge 75 ans, étendue 38 ans, MMSE=22, étendue 23) : -2 (étendue 22) versus -2,3 (étendue 21), p=0,09 (Holmes et coll., 2005
). Dans 2 cohortes anglaises (Londres et Oxford) de patients suivis tous les ans jusqu'à 3 ans, jamais traités par inhibiteur d'acétylcholinestérase (IAChE), la médiane de déclin annuel du MMSE était de 2,3 points avec une étendue (différence entre les valeurs observées les plus élevées et les plus faibles) de 22 points. Cette médiane n'était pas statistiquement différente dans le groupe le plus âgé et le plus sévère initialement (n=151, médiane d'âge 82 ans, étendue 30 ans, MMSE=11, étendue 28) et le groupe le plus jeune et le moins sévère (n=188, médiane d'âge 75 ans, étendue 38 ans, MMSE=22, étendue 23) : -2 (étendue 22) versus -2,3 (étendue 21), p=0,09 (Holmes et coll., 2005 ).
).
 ; Thal et coll., 1988
; Thal et coll., 1988 ; Burns et coll., 1991
; Burns et coll., 1991 ; Morris et coll., 1993
; Morris et coll., 1993 et 2004
et 2004 ; Holmes et coll., 2005
; Holmes et coll., 2005 ) ; de 3,4 points/an en moyenne selon le Consortium to Establish a Registry for Alzheimer's Disease (CERAD) américain (Clark et coll., 1999
) ; de 3,4 points/an en moyenne selon le Consortium to Establish a Registry for Alzheimer's Disease (CERAD) américain (Clark et coll., 1999 ) ; 2,4 points/an chez les patients de plus de 75 ans à un stade léger à modéré (Agüero-Torres et coll., 1998a
) ; 2,4 points/an chez les patients de plus de 75 ans à un stade léger à modéré (Agüero-Torres et coll., 1998a ) ; 2,3 points/an chez les patients de plus de 85 ans (Aevarsson et Skoog, 2000
) ; 2,3 points/an chez les patients de plus de 85 ans (Aevarsson et Skoog, 2000 ), aux alentours de 2,5 points/an à un stade modéré (Salmon et coll., 1990
), aux alentours de 2,5 points/an à un stade modéré (Salmon et coll., 1990 ; Teri et coll., 1990
; Teri et coll., 1990 ). Il décroît de 3,3 points/an dans une méta-analyse de 43 études regroupant 3 492 patients (IC 95 % [2,9-3,7]) (Han et coll., 2000
). Il décroît de 3,3 points/an dans une méta-analyse de 43 études regroupant 3 492 patients (IC 95 % [2,9-3,7]) (Han et coll., 2000 ). Un élément susceptible de jouer dans l'amplitude de l'effet est le score au MMSE à l'entrée dans l'étude et le nombre d'évaluations (Han et coll., 2000
). Un élément susceptible de jouer dans l'amplitude de l'effet est le score au MMSE à l'entrée dans l'étude et le nombre d'évaluations (Han et coll., 2000 ). Dans 2 cohortes anglaises (Londres et Oxford) de patients suivis tous les ans jusqu'à 3 ans, jamais traités par inhibiteur d'acétylcholinestérase (IAChE), la médiane de déclin annuel du MMSE était de 2,3 points avec une étendue (différence entre les valeurs observées les plus élevées et les plus faibles) de 22 points. Cette médiane n'était pas statistiquement différente dans le groupe le plus âgé et le plus sévère initialement (n=151, médiane d'âge 82 ans, étendue 30 ans, MMSE=11, étendue 28) et le groupe le plus jeune et le moins sévère (n=188, médiane d'âge 75 ans, étendue 38 ans, MMSE=22, étendue 23) : -2 (étendue 22) versus -2,3 (étendue 21), p=0,09 (Holmes et coll., 2005
). Dans 2 cohortes anglaises (Londres et Oxford) de patients suivis tous les ans jusqu'à 3 ans, jamais traités par inhibiteur d'acétylcholinestérase (IAChE), la médiane de déclin annuel du MMSE était de 2,3 points avec une étendue (différence entre les valeurs observées les plus élevées et les plus faibles) de 22 points. Cette médiane n'était pas statistiquement différente dans le groupe le plus âgé et le plus sévère initialement (n=151, médiane d'âge 82 ans, étendue 30 ans, MMSE=11, étendue 28) et le groupe le plus jeune et le moins sévère (n=188, médiane d'âge 75 ans, étendue 38 ans, MMSE=22, étendue 23) : -2 (étendue 22) versus -2,3 (étendue 21), p=0,09 (Holmes et coll., 2005 ).
). Il a été suggéré de modéliser la progression de la maladie d'Alzheimer par une fonction cubique ou logarithmique de la progression du score au MMSE (Mendiondo et coll., 2000 ). Le MMSE a une valeur limitée pour mesurer l'évolution de la maladie à l'échelon individuel pour des périodes inférieures à 3 ans à cause d'erreurs de mesure assez importantes et de grandes variations dans le déclin annuel des scores (Clark et coll., 1999
). Le MMSE a une valeur limitée pour mesurer l'évolution de la maladie à l'échelon individuel pour des périodes inférieures à 3 ans à cause d'erreurs de mesure assez importantes et de grandes variations dans le déclin annuel des scores (Clark et coll., 1999 ).
).
 ). Le MMSE a une valeur limitée pour mesurer l'évolution de la maladie à l'échelon individuel pour des périodes inférieures à 3 ans à cause d'erreurs de mesure assez importantes et de grandes variations dans le déclin annuel des scores (Clark et coll., 1999
). Le MMSE a une valeur limitée pour mesurer l'évolution de la maladie à l'échelon individuel pour des périodes inférieures à 3 ans à cause d'erreurs de mesure assez importantes et de grandes variations dans le déclin annuel des scores (Clark et coll., 1999 ).
).L'échelle DRS (Dementia Rating Scale) de Mattis (Mattis, 1976 ) en 144 points présente des performances métriques supérieures au MMSE pour évaluer la progression des troubles cognitifs (Gould et coll., 2001
) en 144 points présente des performances métriques supérieures au MMSE pour évaluer la progression des troubles cognitifs (Gould et coll., 2001 ), mais elle n'est pas utilisée dans les études épidémiologiques ni dans les essais thérapeutiques du fait de la longueur du temps de passation.
), mais elle n'est pas utilisée dans les études épidémiologiques ni dans les essais thérapeutiques du fait de la longueur du temps de passation.
 ) en 144 points présente des performances métriques supérieures au MMSE pour évaluer la progression des troubles cognitifs (Gould et coll., 2001
) en 144 points présente des performances métriques supérieures au MMSE pour évaluer la progression des troubles cognitifs (Gould et coll., 2001 ), mais elle n'est pas utilisée dans les études épidémiologiques ni dans les essais thérapeutiques du fait de la longueur du temps de passation.
), mais elle n'est pas utilisée dans les études épidémiologiques ni dans les essais thérapeutiques du fait de la longueur du temps de passation.L'ADAS-Cog (Alzheimer's Disease Assessment Scale-cognitive subscale) augmente de 6,3 à 11,4 points par an (Helmes et coll., 1995 ; Suh et coll., 2004
; Suh et coll., 2004 ). La progression évaluée par l'ADAS-Cog ne semble pas non plus linéaire. Dans les essais cliniques, l'évolution sous placebo va de 3,44 (ET : 4,7) à 6,3 (ET : 6,4) points par an (Aisen et coll., 2000
). La progression évaluée par l'ADAS-Cog ne semble pas non plus linéaire. Dans les essais cliniques, l'évolution sous placebo va de 3,44 (ET : 4,7) à 6,3 (ET : 6,4) points par an (Aisen et coll., 2000 ; Mulnard et coll., 2000
; Mulnard et coll., 2000 ; Feldman et coll., 2005
; Feldman et coll., 2005 ) ; elle est plus rapide chez les patients au stade modéré (MMSE<18) qu'au stade léger (MMSE>18) (Feldman et coll., 2005
) ; elle est plus rapide chez les patients au stade modéré (MMSE<18) qu'au stade léger (MMSE>18) (Feldman et coll., 2005 ).
).
 ; Suh et coll., 2004
; Suh et coll., 2004 ). La progression évaluée par l'ADAS-Cog ne semble pas non plus linéaire. Dans les essais cliniques, l'évolution sous placebo va de 3,44 (ET : 4,7) à 6,3 (ET : 6,4) points par an (Aisen et coll., 2000
). La progression évaluée par l'ADAS-Cog ne semble pas non plus linéaire. Dans les essais cliniques, l'évolution sous placebo va de 3,44 (ET : 4,7) à 6,3 (ET : 6,4) points par an (Aisen et coll., 2000 ; Mulnard et coll., 2000
; Mulnard et coll., 2000 ; Feldman et coll., 2005
; Feldman et coll., 2005 ) ; elle est plus rapide chez les patients au stade modéré (MMSE<18) qu'au stade léger (MMSE>18) (Feldman et coll., 2005
) ; elle est plus rapide chez les patients au stade modéré (MMSE<18) qu'au stade léger (MMSE>18) (Feldman et coll., 2005 ).
). La CDR (Clinical Dementia Rating) augmente sous placebo de 0,2 (ET : 0,4) par an (Mulnard et coll., 2000 ), la « sum of boxes » de 2,2 (ET : 1,8) par an (Aisen et coll., 2000
), la « sum of boxes » de 2,2 (ET : 1,8) par an (Aisen et coll., 2000 ).
).
 ), la « sum of boxes » de 2,2 (ET : 1,8) par an (Aisen et coll., 2000
), la « sum of boxes » de 2,2 (ET : 1,8) par an (Aisen et coll., 2000 ).
).Facteurs influençant la vitesse du déclin cognitif
Un certain nombre de patients ont initialement des troubles mnésiques isolés. Cette phase de plateau initiale de durée variable, décrite déjà depuis plusieurs années (Haxby et coll., 1992 ), pourrait correspondre au « Mild Cognitive Impairment » (MCI). Les premiers symptômes concernent la mémoire épisodique et les fonctions exécutives élaborées, puis la mémoire sémantique, la vitesse de traitement de l'information et les fonctions visuo-spatiales (Almkvist et Bäckman, 1993
), pourrait correspondre au « Mild Cognitive Impairment » (MCI). Les premiers symptômes concernent la mémoire épisodique et les fonctions exécutives élaborées, puis la mémoire sémantique, la vitesse de traitement de l'information et les fonctions visuo-spatiales (Almkvist et Bäckman, 1993 ). Le langage est touché de façon variable : la compréhension élaborée et l'écriture (dysorthographie) avant les troubles de la dénomination (Faber-Langendoen et coll., 1988
). Le langage est touché de façon variable : la compréhension élaborée et l'écriture (dysorthographie) avant les troubles de la dénomination (Faber-Langendoen et coll., 1988 ).
).
 ), pourrait correspondre au « Mild Cognitive Impairment » (MCI). Les premiers symptômes concernent la mémoire épisodique et les fonctions exécutives élaborées, puis la mémoire sémantique, la vitesse de traitement de l'information et les fonctions visuo-spatiales (Almkvist et Bäckman, 1993
), pourrait correspondre au « Mild Cognitive Impairment » (MCI). Les premiers symptômes concernent la mémoire épisodique et les fonctions exécutives élaborées, puis la mémoire sémantique, la vitesse de traitement de l'information et les fonctions visuo-spatiales (Almkvist et Bäckman, 1993 ). Le langage est touché de façon variable : la compréhension élaborée et l'écriture (dysorthographie) avant les troubles de la dénomination (Faber-Langendoen et coll., 1988
). Le langage est touché de façon variable : la compréhension élaborée et l'écriture (dysorthographie) avant les troubles de la dénomination (Faber-Langendoen et coll., 1988 ).
). La forme avec troubles mnésiques prédominants (forme temporale), avec peu ou pas de troubles des fonctions exécutives, serait de meilleur pronostic (Butters et coll., 1996 ).
).
 ).
).Des facteurs de mauvais pronostic pour l'évolution de la maladie ont été identifiés : sexe masculin (Burns et coll., 1991 ; Beard et coll., 1994
; Beard et coll., 1994 ; Neumann et coll., 2001
; Neumann et coll., 2001 ), apraxie (Smith et coll., 2001
), apraxie (Smith et coll., 2001 ), signes « pariétaux » (Burns et coll., 1991
), signes « pariétaux » (Burns et coll., 1991 ), troubles du langage (Huff et coll., 1990
), troubles du langage (Huff et coll., 1990 ; Bracco et coll., 1994
; Bracco et coll., 1994 ; Moritz et coll., 1997
; Moritz et coll., 1997 ), non confirmés par d'autres études (Hui et coll., 2003
), non confirmés par d'autres études (Hui et coll., 2003 ), signes d'atteinte frontale (Mann et coll., 1992
), signes d'atteinte frontale (Mann et coll., 1992 ), petite boîte crânienne (Graves et coll., 1996
), petite boîte crânienne (Graves et coll., 1996 ), symptômes psychotiques et symptômes parkinsoniens (Stern et coll., 1994b
), symptômes psychotiques et symptômes parkinsoniens (Stern et coll., 1994b ).
).
 ; Beard et coll., 1994
; Beard et coll., 1994 ; Neumann et coll., 2001
; Neumann et coll., 2001 ), apraxie (Smith et coll., 2001
), apraxie (Smith et coll., 2001 ), signes « pariétaux » (Burns et coll., 1991
), signes « pariétaux » (Burns et coll., 1991 ), troubles du langage (Huff et coll., 1990
), troubles du langage (Huff et coll., 1990 ; Bracco et coll., 1994
; Bracco et coll., 1994 ; Moritz et coll., 1997
; Moritz et coll., 1997 ), non confirmés par d'autres études (Hui et coll., 2003
), non confirmés par d'autres études (Hui et coll., 2003 ), signes d'atteinte frontale (Mann et coll., 1992
), signes d'atteinte frontale (Mann et coll., 1992 ), petite boîte crânienne (Graves et coll., 1996
), petite boîte crânienne (Graves et coll., 1996 ), symptômes psychotiques et symptômes parkinsoniens (Stern et coll., 1994b
), symptômes psychotiques et symptômes parkinsoniens (Stern et coll., 1994b ).
).Hallucinations et symptômes parkinsoniens sont deux signes majeurs de démence à corps de Lewy, et l'on peut se demander si l'utilisation des neuroleptiques, qui compromet le pronostic vital de ces patients, n'est pas à l'origine du constat de moins bon pronostic chez les patients présentant ces symptômes (Chui et coll., 1994 ). Dans une étude longitudinale de patients au stade léger à modéré de maladie d'Alzheimer n'ayant jamais reçu de neuroleptiques, la présence de signes parkinsoniens était liée à une institutionnalisation plus précoce, et, selon les études, soit à un déclin cognitif et un décès plus rapide (Scarmeas et coll., 2005a
). Dans une étude longitudinale de patients au stade léger à modéré de maladie d'Alzheimer n'ayant jamais reçu de neuroleptiques, la présence de signes parkinsoniens était liée à une institutionnalisation plus précoce, et, selon les études, soit à un déclin cognitif et un décès plus rapide (Scarmeas et coll., 2005a ), soit à aucune de ces variables (Lopez et coll., 1997
), soit à aucune de ces variables (Lopez et coll., 1997 ). Une autre étude a montré que le score Unified Parkinson's Disease Rating Scale (UPDRS) était associé au déclin cognitif et fonctionnel. De même, en contrôlant les symptômes parkinsoniens et la prise d'antipsychotiques, Wilson et coll. (2000a
). Une autre étude a montré que le score Unified Parkinson's Disease Rating Scale (UPDRS) était associé au déclin cognitif et fonctionnel. De même, en contrôlant les symptômes parkinsoniens et la prise d'antipsychotiques, Wilson et coll. (2000a ) ont trouvé que les hallucinations sont associées à une évolution plus rapide de la maladie d'Alzheimer, notamment les hallucinations visuelles (Wilson et coll., 2006
) ont trouvé que les hallucinations sont associées à une évolution plus rapide de la maladie d'Alzheimer, notamment les hallucinations visuelles (Wilson et coll., 2006 ). Une autre étude a trouvé qu'elles étaient associées non seulement au déclin cognitif (RR=1,62 ; IC 95 % [1,06-2,47]) mais aussi au déclin fonctionnel (RR=2,25 ; IC 95 % [1,54-2,27]), à l'entrée en institution (RR=1,60 ; IC 95 % [1,13-2,28]) et au décès (RR=1,49 ; IC 95 % [1,03-2,14]) (Scarmeas et coll., 2005b
). Une autre étude a trouvé qu'elles étaient associées non seulement au déclin cognitif (RR=1,62 ; IC 95 % [1,06-2,47]) mais aussi au déclin fonctionnel (RR=2,25 ; IC 95 % [1,54-2,27]), à l'entrée en institution (RR=1,60 ; IC 95 % [1,13-2,28]) et au décès (RR=1,49 ; IC 95 % [1,03-2,14]) (Scarmeas et coll., 2005b ). En ce qui concerne l'agitation et les troubles du comportement que l'on trouve parfois liés à un mauvais pronostic, ils sont le plus souvent dus à une douleur ou à un inconfort provoqués par une affection somatique surajoutée, dont le diagnostic est difficile et qui peut parfois engager le pronostic vital. Il faut noter que les patients atteints de maladie d'Alzheimer perçoivent différemment la douleur (Scherder et coll., 2001
). En ce qui concerne l'agitation et les troubles du comportement que l'on trouve parfois liés à un mauvais pronostic, ils sont le plus souvent dus à une douleur ou à un inconfort provoqués par une affection somatique surajoutée, dont le diagnostic est difficile et qui peut parfois engager le pronostic vital. Il faut noter que les patients atteints de maladie d'Alzheimer perçoivent différemment la douleur (Scherder et coll., 2001 ).
).
 ). Dans une étude longitudinale de patients au stade léger à modéré de maladie d'Alzheimer n'ayant jamais reçu de neuroleptiques, la présence de signes parkinsoniens était liée à une institutionnalisation plus précoce, et, selon les études, soit à un déclin cognitif et un décès plus rapide (Scarmeas et coll., 2005a
). Dans une étude longitudinale de patients au stade léger à modéré de maladie d'Alzheimer n'ayant jamais reçu de neuroleptiques, la présence de signes parkinsoniens était liée à une institutionnalisation plus précoce, et, selon les études, soit à un déclin cognitif et un décès plus rapide (Scarmeas et coll., 2005a ), soit à aucune de ces variables (Lopez et coll., 1997
), soit à aucune de ces variables (Lopez et coll., 1997 ). Une autre étude a montré que le score Unified Parkinson's Disease Rating Scale (UPDRS) était associé au déclin cognitif et fonctionnel. De même, en contrôlant les symptômes parkinsoniens et la prise d'antipsychotiques, Wilson et coll. (2000a
). Une autre étude a montré que le score Unified Parkinson's Disease Rating Scale (UPDRS) était associé au déclin cognitif et fonctionnel. De même, en contrôlant les symptômes parkinsoniens et la prise d'antipsychotiques, Wilson et coll. (2000a ) ont trouvé que les hallucinations sont associées à une évolution plus rapide de la maladie d'Alzheimer, notamment les hallucinations visuelles (Wilson et coll., 2006
) ont trouvé que les hallucinations sont associées à une évolution plus rapide de la maladie d'Alzheimer, notamment les hallucinations visuelles (Wilson et coll., 2006 ). Une autre étude a trouvé qu'elles étaient associées non seulement au déclin cognitif (RR=1,62 ; IC 95 % [1,06-2,47]) mais aussi au déclin fonctionnel (RR=2,25 ; IC 95 % [1,54-2,27]), à l'entrée en institution (RR=1,60 ; IC 95 % [1,13-2,28]) et au décès (RR=1,49 ; IC 95 % [1,03-2,14]) (Scarmeas et coll., 2005b
). Une autre étude a trouvé qu'elles étaient associées non seulement au déclin cognitif (RR=1,62 ; IC 95 % [1,06-2,47]) mais aussi au déclin fonctionnel (RR=2,25 ; IC 95 % [1,54-2,27]), à l'entrée en institution (RR=1,60 ; IC 95 % [1,13-2,28]) et au décès (RR=1,49 ; IC 95 % [1,03-2,14]) (Scarmeas et coll., 2005b ). En ce qui concerne l'agitation et les troubles du comportement que l'on trouve parfois liés à un mauvais pronostic, ils sont le plus souvent dus à une douleur ou à un inconfort provoqués par une affection somatique surajoutée, dont le diagnostic est difficile et qui peut parfois engager le pronostic vital. Il faut noter que les patients atteints de maladie d'Alzheimer perçoivent différemment la douleur (Scherder et coll., 2001
). En ce qui concerne l'agitation et les troubles du comportement que l'on trouve parfois liés à un mauvais pronostic, ils sont le plus souvent dus à une douleur ou à un inconfort provoqués par une affection somatique surajoutée, dont le diagnostic est difficile et qui peut parfois engager le pronostic vital. Il faut noter que les patients atteints de maladie d'Alzheimer perçoivent différemment la douleur (Scherder et coll., 2001 ).
).Le déclin plus rapide et la plus forte mortalité chez les hommes pourraient s'expliquer par la co-existence de plus nombreuses pathologies et prescriptions thérapeutiques (Gambassi et coll., 1999a ), notamment la prise d'anticholinergiques (Lu et Tune, 2003
), notamment la prise d'anticholinergiques (Lu et Tune, 2003 ), et la pathologie vasculaire associée (Bowler et coll., 1998
), et la pathologie vasculaire associée (Bowler et coll., 1998 ). Les facteurs de risque vasculaire n'ont cependant pas d'influence sur la progression de la maladie d'Alzheimer à 18 mois chez 224 patients sans maladie cérébrovasculaire (Regan et coll., 2006
). Les facteurs de risque vasculaire n'ont cependant pas d'influence sur la progression de la maladie d'Alzheimer à 18 mois chez 224 patients sans maladie cérébrovasculaire (Regan et coll., 2006 ), ou sur le passage du stade léger au stade modéré à 3 ans sur une cohorte de 247 patients ayant des antécédents vasculaires (Bhargava et coll., 2006
), ou sur le passage du stade léger au stade modéré à 3 ans sur une cohorte de 247 patients ayant des antécédents vasculaires (Bhargava et coll., 2006 ). Toutefois, l'hypertension artérielle chez les patients de moins de 65 ans (Bellew et coll., 2004
). Toutefois, l'hypertension artérielle chez les patients de moins de 65 ans (Bellew et coll., 2004 ), et la baisse de fonctionnalité des microvaisseaux cérébraux mesurée par Doppler transcrânien (Silvestri et coll., 2006
), et la baisse de fonctionnalité des microvaisseaux cérébraux mesurée par Doppler transcrânien (Silvestri et coll., 2006 ) pourraient influencer le déclin cognitif.
) pourraient influencer le déclin cognitif.
 ), notamment la prise d'anticholinergiques (Lu et Tune, 2003
), notamment la prise d'anticholinergiques (Lu et Tune, 2003 ), et la pathologie vasculaire associée (Bowler et coll., 1998
), et la pathologie vasculaire associée (Bowler et coll., 1998 ). Les facteurs de risque vasculaire n'ont cependant pas d'influence sur la progression de la maladie d'Alzheimer à 18 mois chez 224 patients sans maladie cérébrovasculaire (Regan et coll., 2006
). Les facteurs de risque vasculaire n'ont cependant pas d'influence sur la progression de la maladie d'Alzheimer à 18 mois chez 224 patients sans maladie cérébrovasculaire (Regan et coll., 2006 ), ou sur le passage du stade léger au stade modéré à 3 ans sur une cohorte de 247 patients ayant des antécédents vasculaires (Bhargava et coll., 2006
), ou sur le passage du stade léger au stade modéré à 3 ans sur une cohorte de 247 patients ayant des antécédents vasculaires (Bhargava et coll., 2006 ). Toutefois, l'hypertension artérielle chez les patients de moins de 65 ans (Bellew et coll., 2004
). Toutefois, l'hypertension artérielle chez les patients de moins de 65 ans (Bellew et coll., 2004 ), et la baisse de fonctionnalité des microvaisseaux cérébraux mesurée par Doppler transcrânien (Silvestri et coll., 2006
), et la baisse de fonctionnalité des microvaisseaux cérébraux mesurée par Doppler transcrânien (Silvestri et coll., 2006 ) pourraient influencer le déclin cognitif.
) pourraient influencer le déclin cognitif. L'influence du niveau d'éducation est discuté, avec des résultats contradictoires selon les études : évolution plus rapide chez les patients ayant un niveau culturel élevé, la « réserve » cérébrale différant les premiers symptômes à lésions histologiques équivalentes (Scarmeas et coll., 2006 ), résultat inverse avec déclin cognitif plus rapide dans les groupes illettrés et peu éduqués (Agüero-Torres et coll., 1998a
), résultat inverse avec déclin cognitif plus rapide dans les groupes illettrés et peu éduqués (Agüero-Torres et coll., 1998a ; Fritsch et coll., 2001
; Fritsch et coll., 2001 ; Sachs-Ericsson et Blazer, 2005
; Sachs-Ericsson et Blazer, 2005 ), ou encore absence d'effet (Bowler et coll., 1998
), ou encore absence d'effet (Bowler et coll., 1998 ). L'absence d'effet global du niveau d'éducation pourrait en fait masquer des différences selon les fonctions cognitives, une étude ayant montré que les tests de pensée abstraite déclinaient plus vite chez les patients ayant un niveau d'étude élevé alors que les fonctions mnésiques et attentionnelles déclinaient plus rapidement chez les patients avec un faible niveau d'étude (Le Carret et coll., 2005
). L'absence d'effet global du niveau d'éducation pourrait en fait masquer des différences selon les fonctions cognitives, une étude ayant montré que les tests de pensée abstraite déclinaient plus vite chez les patients ayant un niveau d'étude élevé alors que les fonctions mnésiques et attentionnelles déclinaient plus rapidement chez les patients avec un faible niveau d'étude (Le Carret et coll., 2005 ).
).
 ), résultat inverse avec déclin cognitif plus rapide dans les groupes illettrés et peu éduqués (Agüero-Torres et coll., 1998a
), résultat inverse avec déclin cognitif plus rapide dans les groupes illettrés et peu éduqués (Agüero-Torres et coll., 1998a ; Fritsch et coll., 2001
; Fritsch et coll., 2001 ; Sachs-Ericsson et Blazer, 2005
; Sachs-Ericsson et Blazer, 2005 ), ou encore absence d'effet (Bowler et coll., 1998
), ou encore absence d'effet (Bowler et coll., 1998 ). L'absence d'effet global du niveau d'éducation pourrait en fait masquer des différences selon les fonctions cognitives, une étude ayant montré que les tests de pensée abstraite déclinaient plus vite chez les patients ayant un niveau d'étude élevé alors que les fonctions mnésiques et attentionnelles déclinaient plus rapidement chez les patients avec un faible niveau d'étude (Le Carret et coll., 2005
). L'absence d'effet global du niveau d'éducation pourrait en fait masquer des différences selon les fonctions cognitives, une étude ayant montré que les tests de pensée abstraite déclinaient plus vite chez les patients ayant un niveau d'étude élevé alors que les fonctions mnésiques et attentionnelles déclinaient plus rapidement chez les patients avec un faible niveau d'étude (Le Carret et coll., 2005 ).
).Le fait d'être porteur d'au moins un allèle ε4 de l'apolipoprotéine E, s'il est associé à un plus grand risque d'être atteint de la maladie d'Alzheimer ou de progression du stade de MCI au stade démentiel (Tschanz et coll., 2006 ), est moins clairement associé à un déclin plus rapide (Martins et coll., 2005
), est moins clairement associé à un déclin plus rapide (Martins et coll., 2005 ). Il pourrait ne pas influencer la progression de la maladie une fois celle-ci installée (Hoyt et coll., 2005
). Il pourrait ne pas influencer la progression de la maladie une fois celle-ci installée (Hoyt et coll., 2005 ; Kleiman et coll., 2006
; Kleiman et coll., 2006 ) ou peut-être l'influencer selon que l'on utilise des modèles statistiques mixtes linéaires ou non linéaires (Camicioli et Kryscio, 2005
) ou peut-être l'influencer selon que l'on utilise des modèles statistiques mixtes linéaires ou non linéaires (Camicioli et Kryscio, 2005 ; Martins et coll., 2005
; Martins et coll., 2005 ). Une étude a montré que les porteurs de l'allèle K de la butyrylcholinestérase avaient un déclin cognitif plus lent lorsque leur MMSE était inférieur à 8 (Holmes et coll., 2005
). Une étude a montré que les porteurs de l'allèle K de la butyrylcholinestérase avaient un déclin cognitif plus lent lorsque leur MMSE était inférieur à 8 (Holmes et coll., 2005 ).
).
 ), est moins clairement associé à un déclin plus rapide (Martins et coll., 2005
), est moins clairement associé à un déclin plus rapide (Martins et coll., 2005 ). Il pourrait ne pas influencer la progression de la maladie une fois celle-ci installée (Hoyt et coll., 2005
). Il pourrait ne pas influencer la progression de la maladie une fois celle-ci installée (Hoyt et coll., 2005 ; Kleiman et coll., 2006
; Kleiman et coll., 2006 ) ou peut-être l'influencer selon que l'on utilise des modèles statistiques mixtes linéaires ou non linéaires (Camicioli et Kryscio, 2005
) ou peut-être l'influencer selon que l'on utilise des modèles statistiques mixtes linéaires ou non linéaires (Camicioli et Kryscio, 2005 ; Martins et coll., 2005
; Martins et coll., 2005 ). Une étude a montré que les porteurs de l'allèle K de la butyrylcholinestérase avaient un déclin cognitif plus lent lorsque leur MMSE était inférieur à 8 (Holmes et coll., 2005
). Une étude a montré que les porteurs de l'allèle K de la butyrylcholinestérase avaient un déclin cognitif plus lent lorsque leur MMSE était inférieur à 8 (Holmes et coll., 2005 ).
).Progression de l'atrophie cérébrale
L'atrophie cérébrale mesurée par des IRM répétées à intervalles réguliers est un marqueur de progression de la maladie d'Alzheimer et pourrait être un critère d'évaluation thérapeutique. Réduire la variabilité intra-individuelle des mesures en répétant les examens permettrait de réduire la durée des essais et le nombre de patients. La progression de l'atrophie cérébrale globale est de 2,23 % par an (IC 95 % [1,90-2,56]) chez les patients atteints de la maladie d'Alzheimer ayant un MMSE moyen de 19,2±4 après 4,6±2,3 années d'évolution depuis le début des symptômes, comparativement à 0,49 % (IC 95 % [0,37-0,61]) chez les sujets témoins (Schott, 2006 ). Les mesures volumiques cérébrales en IRM pourraient être utilisées pour estimer la vitesse de progression du déclin cognitif (Adak et coll., 2004
). Les mesures volumiques cérébrales en IRM pourraient être utilisées pour estimer la vitesse de progression du déclin cognitif (Adak et coll., 2004 ). La présence et la progression de lésions de la substance blanche périventriculaire sont associées à un risque de progression de l'atrophie temporale interne chez les patients atteints de la maladie d'Alzheimer (de Leeuw et coll., 2006
). La présence et la progression de lésions de la substance blanche périventriculaire sont associées à un risque de progression de l'atrophie temporale interne chez les patients atteints de la maladie d'Alzheimer (de Leeuw et coll., 2006 ).
).
 ). Les mesures volumiques cérébrales en IRM pourraient être utilisées pour estimer la vitesse de progression du déclin cognitif (Adak et coll., 2004
). Les mesures volumiques cérébrales en IRM pourraient être utilisées pour estimer la vitesse de progression du déclin cognitif (Adak et coll., 2004 ). La présence et la progression de lésions de la substance blanche périventriculaire sont associées à un risque de progression de l'atrophie temporale interne chez les patients atteints de la maladie d'Alzheimer (de Leeuw et coll., 2006
). La présence et la progression de lésions de la substance blanche périventriculaire sont associées à un risque de progression de l'atrophie temporale interne chez les patients atteints de la maladie d'Alzheimer (de Leeuw et coll., 2006 ).
).Perte d'autonomie et évolution vers la dépendance
L'évolution de la maladie d'Alzheimer s'accompagne d'une perte d'autonomie et de l'apparition d'incapacités diverses. L'autonomie se réfère au libre arbitre de la personne alors que la dépendance est définie par le besoin d'aide. Autrement dit, l'autonomie peut se définir par la capacité de la personne à se gouverner elle-même. Elle présuppose la capacité de jugement, c'est-à-dire la capacité de prévoir et de choisir, et la liberté de pouvoir agir, accepter ou refuser en fonction de son jugement. La dépendance, quant à elle, correspond à l'impossibilité partielle ou totale pour une personne d'effectuer sans aide les activités de la vie quotidienne (OMS, 1980 ). La majorité des travaux sur l'histoire naturelle de la maladie d'Alzheimer concerne l'évolution de l'atteinte cognitive et ses conséquences, en particulier en terme de dépendance. L'évolution des capacités de jugement demeure mal connue (Marson et coll., 1997
). La majorité des travaux sur l'histoire naturelle de la maladie d'Alzheimer concerne l'évolution de l'atteinte cognitive et ses conséquences, en particulier en terme de dépendance. L'évolution des capacités de jugement demeure mal connue (Marson et coll., 1997 ; Earnst et coll., 2000
; Earnst et coll., 2000 ; Karlawish et coll., 2005
; Karlawish et coll., 2005 ; Huthwaite et coll., 2006
; Huthwaite et coll., 2006 ; Stewart et coll., 2006
; Stewart et coll., 2006 ; Moye et Marson, 2007
; Moye et Marson, 2007 ).
).
 ). La majorité des travaux sur l'histoire naturelle de la maladie d'Alzheimer concerne l'évolution de l'atteinte cognitive et ses conséquences, en particulier en terme de dépendance. L'évolution des capacités de jugement demeure mal connue (Marson et coll., 1997
). La majorité des travaux sur l'histoire naturelle de la maladie d'Alzheimer concerne l'évolution de l'atteinte cognitive et ses conséquences, en particulier en terme de dépendance. L'évolution des capacités de jugement demeure mal connue (Marson et coll., 1997 ; Earnst et coll., 2000
; Earnst et coll., 2000 ; Karlawish et coll., 2005
; Karlawish et coll., 2005 ; Huthwaite et coll., 2006
; Huthwaite et coll., 2006 ; Stewart et coll., 2006
; Stewart et coll., 2006 ; Moye et Marson, 2007
; Moye et Marson, 2007 ).
). L'évaluation des incapacités fait appel à des échelles qui mesurent les capacités à réaliser les différentes activités de la vie quotidienne (tableau 11.I ).
).
 ).
). Tableau 11.I Principales échelles utilisées pour le suivi de la dépendance dans la maladie d'Alzheimer
|
Échelles d'évaluation de la dépendance
|
Référence
|
|---|---|
|
Instrumental Activities of Daily Living (IADL)
| |
|
Activities of Daily Living (ADL)
| |
|
Disability Assessment for Dementia (DAD)
| |
|
Grille AGGIR
|
Site Internet(1)
|
|
Global Deterioration Scale-Functional Assessment Staging
| |
|
Progressive Disease Scale
| |
|
Alzheimer Disease Cooperative Study-Activities of Daily Living (ADCS-ADL)
| |
|
Physical Self-Maintenance Scale
| |
|
Functional Rating Scale
| |
Parmi elles, les échelles des activités instrumentales de la vie quotidienne (IADL) (Lawton et Brody, 1969 ) et des activités de base de la vie quotidienne (ADL) (Katz et coll., 1963
) et des activités de base de la vie quotidienne (ADL) (Katz et coll., 1963 ) sont les plus utilisées en pratique courante. L'IADL évalue 8 items : utilisation du téléphone, utilisation des moyens de transports, gestion des finances, prise des médicaments, accomplissement des courses, accomplissement de la cuisine, entretien de la maison et accomplissement de la lessive. L'ADL, quant à elle, évalue les capacités de base de la personne pour les activités quotidiennes et comprend 6 items évaluant l'hygiène corporelle, l'habillage, la toilette, la locomotion, la continence et la prise des repas. Ces deux outils sont largement utilisés dans la pratique clinique. Il faut toutefois souligner l'hétérogénéité des outils utilisés dans les essais cliniques ou les suivis prospectifs : l'ADL et l'IADL mais aussi la Global Deterioration Scale-Functional Assessment Staging (échelle hiérarchique cotant 16 stades de détérioration) (Auer et Reisberg, 1997
) sont les plus utilisées en pratique courante. L'IADL évalue 8 items : utilisation du téléphone, utilisation des moyens de transports, gestion des finances, prise des médicaments, accomplissement des courses, accomplissement de la cuisine, entretien de la maison et accomplissement de la lessive. L'ADL, quant à elle, évalue les capacités de base de la personne pour les activités quotidiennes et comprend 6 items évaluant l'hygiène corporelle, l'habillage, la toilette, la locomotion, la continence et la prise des repas. Ces deux outils sont largement utilisés dans la pratique clinique. Il faut toutefois souligner l'hétérogénéité des outils utilisés dans les essais cliniques ou les suivis prospectifs : l'ADL et l'IADL mais aussi la Global Deterioration Scale-Functional Assessment Staging (échelle hiérarchique cotant 16 stades de détérioration) (Auer et Reisberg, 1997 ), la Progressive Disease Scale dans laquelle l'évaluation est réalisée à partir d'une échelle analogique visuelle remplie par l'aidant (DeJong et coll., 1989
), la Progressive Disease Scale dans laquelle l'évaluation est réalisée à partir d'une échelle analogique visuelle remplie par l'aidant (DeJong et coll., 1989 ), la Disability Assessment for Dementia dans laquelle l'évaluation de chaque fonction est subdivisée en trois parties : initiation, programmation et réalisation (Gélinas et coll., 1999
), la Disability Assessment for Dementia dans laquelle l'évaluation de chaque fonction est subdivisée en trois parties : initiation, programmation et réalisation (Gélinas et coll., 1999 ) ou encore l'Alzheimer Disease Cooperative Study-Activities of Daily Living (ADCS-ADL) associant l'évaluation des activités complexes et de base de la vie quotidienne (Galasko et coll., 1997
) ou encore l'Alzheimer Disease Cooperative Study-Activities of Daily Living (ADCS-ADL) associant l'évaluation des activités complexes et de base de la vie quotidienne (Galasko et coll., 1997 ).
).
 ) et des activités de base de la vie quotidienne (ADL) (Katz et coll., 1963
) et des activités de base de la vie quotidienne (ADL) (Katz et coll., 1963 ) sont les plus utilisées en pratique courante. L'IADL évalue 8 items : utilisation du téléphone, utilisation des moyens de transports, gestion des finances, prise des médicaments, accomplissement des courses, accomplissement de la cuisine, entretien de la maison et accomplissement de la lessive. L'ADL, quant à elle, évalue les capacités de base de la personne pour les activités quotidiennes et comprend 6 items évaluant l'hygiène corporelle, l'habillage, la toilette, la locomotion, la continence et la prise des repas. Ces deux outils sont largement utilisés dans la pratique clinique. Il faut toutefois souligner l'hétérogénéité des outils utilisés dans les essais cliniques ou les suivis prospectifs : l'ADL et l'IADL mais aussi la Global Deterioration Scale-Functional Assessment Staging (échelle hiérarchique cotant 16 stades de détérioration) (Auer et Reisberg, 1997
) sont les plus utilisées en pratique courante. L'IADL évalue 8 items : utilisation du téléphone, utilisation des moyens de transports, gestion des finances, prise des médicaments, accomplissement des courses, accomplissement de la cuisine, entretien de la maison et accomplissement de la lessive. L'ADL, quant à elle, évalue les capacités de base de la personne pour les activités quotidiennes et comprend 6 items évaluant l'hygiène corporelle, l'habillage, la toilette, la locomotion, la continence et la prise des repas. Ces deux outils sont largement utilisés dans la pratique clinique. Il faut toutefois souligner l'hétérogénéité des outils utilisés dans les essais cliniques ou les suivis prospectifs : l'ADL et l'IADL mais aussi la Global Deterioration Scale-Functional Assessment Staging (échelle hiérarchique cotant 16 stades de détérioration) (Auer et Reisberg, 1997 ), la Progressive Disease Scale dans laquelle l'évaluation est réalisée à partir d'une échelle analogique visuelle remplie par l'aidant (DeJong et coll., 1989
), la Progressive Disease Scale dans laquelle l'évaluation est réalisée à partir d'une échelle analogique visuelle remplie par l'aidant (DeJong et coll., 1989 ), la Disability Assessment for Dementia dans laquelle l'évaluation de chaque fonction est subdivisée en trois parties : initiation, programmation et réalisation (Gélinas et coll., 1999
), la Disability Assessment for Dementia dans laquelle l'évaluation de chaque fonction est subdivisée en trois parties : initiation, programmation et réalisation (Gélinas et coll., 1999 ) ou encore l'Alzheimer Disease Cooperative Study-Activities of Daily Living (ADCS-ADL) associant l'évaluation des activités complexes et de base de la vie quotidienne (Galasko et coll., 1997
) ou encore l'Alzheimer Disease Cooperative Study-Activities of Daily Living (ADCS-ADL) associant l'évaluation des activités complexes et de base de la vie quotidienne (Galasko et coll., 1997 ).
). De nombreux travaux montrent que la réduction des activités quotidiennes dans la maladie d'Alzheimer est présente dès les stades débutants et touche précocement deux secteurs : la vie sociale et les loisirs. La réduction des activités sociales est un des premiers signes qui attire l'attention de l'entourage au même titre que les difficultés mnésiques (Stern et coll., 1994c ; Thomas et coll., 2002
; Thomas et coll., 2002 ; Gély-Nargeot et coll., 2003
; Gély-Nargeot et coll., 2003 ; Blasi et coll., 2005
; Blasi et coll., 2005 ) ; elle est fortement liée à l'apathie, à la baisse de la motivation et aux difficultés de planification (Derouesne et coll., 2002
) ; elle est fortement liée à l'apathie, à la baisse de la motivation et aux difficultés de planification (Derouesne et coll., 2002 ). L'étude Paquid confirme qu'à la phase pré-clinique, il existe déjà un retentissement perceptible sur les capacités fonctionnelles, caractérisé par une altération de certains items des IADL, trois à cinq ans avant le diagnostic de la maladie. Les activités atteintes très précocement concernent l'utilisation du téléphone ou des moyens de transport, la responsabilité pour la prise des médicaments et la gestion du budget. Le risque de démence incidente trois ans plus tard croît avec le nombre d'items de l'IADL atteints ; il est multiplié par 9,5, après ajustement sur l'âge, chez les sujets présentant 4 incapacités (Barberger-Gateau et coll., 1999
). L'étude Paquid confirme qu'à la phase pré-clinique, il existe déjà un retentissement perceptible sur les capacités fonctionnelles, caractérisé par une altération de certains items des IADL, trois à cinq ans avant le diagnostic de la maladie. Les activités atteintes très précocement concernent l'utilisation du téléphone ou des moyens de transport, la responsabilité pour la prise des médicaments et la gestion du budget. Le risque de démence incidente trois ans plus tard croît avec le nombre d'items de l'IADL atteints ; il est multiplié par 9,5, après ajustement sur l'âge, chez les sujets présentant 4 incapacités (Barberger-Gateau et coll., 1999 ). Pour les auteurs, ces résultats sont à rapprocher des altérations mises en évidence par les tests neuropsychologiques observées à un stade pré-clinique de la démence, qui portent essentiellement sur les activités les plus contrôlées. Un travail récent de la même équipe a permis d'analyser les données à 8 et 10 ans de 1 517 sujets participant à l'étude Paquid. À l'inclusion, 285 personnes avaient les critères du MCI et parmi elles 15,2 % ont développé une démence à 2 ans. L'évaluation de l'IADL révèle une altération chez 34,2 % des sujets MCI (contre 5,4 % des sujets témoins). Parmi les personnes diagnostiquées comme MCI, celles présentant une altération à l'IADL sont significativement plus à risque d'évoluer vers une démence dans les 2 ans (30,7 % versus 7,8 %) (Peres et coll., 2006
). Pour les auteurs, ces résultats sont à rapprocher des altérations mises en évidence par les tests neuropsychologiques observées à un stade pré-clinique de la démence, qui portent essentiellement sur les activités les plus contrôlées. Un travail récent de la même équipe a permis d'analyser les données à 8 et 10 ans de 1 517 sujets participant à l'étude Paquid. À l'inclusion, 285 personnes avaient les critères du MCI et parmi elles 15,2 % ont développé une démence à 2 ans. L'évaluation de l'IADL révèle une altération chez 34,2 % des sujets MCI (contre 5,4 % des sujets témoins). Parmi les personnes diagnostiquées comme MCI, celles présentant une altération à l'IADL sont significativement plus à risque d'évoluer vers une démence dans les 2 ans (30,7 % versus 7,8 %) (Peres et coll., 2006 ).
).
 ; Thomas et coll., 2002
; Thomas et coll., 2002 ; Gély-Nargeot et coll., 2003
; Gély-Nargeot et coll., 2003 ; Blasi et coll., 2005
; Blasi et coll., 2005 ) ; elle est fortement liée à l'apathie, à la baisse de la motivation et aux difficultés de planification (Derouesne et coll., 2002
) ; elle est fortement liée à l'apathie, à la baisse de la motivation et aux difficultés de planification (Derouesne et coll., 2002 ). L'étude Paquid confirme qu'à la phase pré-clinique, il existe déjà un retentissement perceptible sur les capacités fonctionnelles, caractérisé par une altération de certains items des IADL, trois à cinq ans avant le diagnostic de la maladie. Les activités atteintes très précocement concernent l'utilisation du téléphone ou des moyens de transport, la responsabilité pour la prise des médicaments et la gestion du budget. Le risque de démence incidente trois ans plus tard croît avec le nombre d'items de l'IADL atteints ; il est multiplié par 9,5, après ajustement sur l'âge, chez les sujets présentant 4 incapacités (Barberger-Gateau et coll., 1999
). L'étude Paquid confirme qu'à la phase pré-clinique, il existe déjà un retentissement perceptible sur les capacités fonctionnelles, caractérisé par une altération de certains items des IADL, trois à cinq ans avant le diagnostic de la maladie. Les activités atteintes très précocement concernent l'utilisation du téléphone ou des moyens de transport, la responsabilité pour la prise des médicaments et la gestion du budget. Le risque de démence incidente trois ans plus tard croît avec le nombre d'items de l'IADL atteints ; il est multiplié par 9,5, après ajustement sur l'âge, chez les sujets présentant 4 incapacités (Barberger-Gateau et coll., 1999 ). Pour les auteurs, ces résultats sont à rapprocher des altérations mises en évidence par les tests neuropsychologiques observées à un stade pré-clinique de la démence, qui portent essentiellement sur les activités les plus contrôlées. Un travail récent de la même équipe a permis d'analyser les données à 8 et 10 ans de 1 517 sujets participant à l'étude Paquid. À l'inclusion, 285 personnes avaient les critères du MCI et parmi elles 15,2 % ont développé une démence à 2 ans. L'évaluation de l'IADL révèle une altération chez 34,2 % des sujets MCI (contre 5,4 % des sujets témoins). Parmi les personnes diagnostiquées comme MCI, celles présentant une altération à l'IADL sont significativement plus à risque d'évoluer vers une démence dans les 2 ans (30,7 % versus 7,8 %) (Peres et coll., 2006
). Pour les auteurs, ces résultats sont à rapprocher des altérations mises en évidence par les tests neuropsychologiques observées à un stade pré-clinique de la démence, qui portent essentiellement sur les activités les plus contrôlées. Un travail récent de la même équipe a permis d'analyser les données à 8 et 10 ans de 1 517 sujets participant à l'étude Paquid. À l'inclusion, 285 personnes avaient les critères du MCI et parmi elles 15,2 % ont développé une démence à 2 ans. L'évaluation de l'IADL révèle une altération chez 34,2 % des sujets MCI (contre 5,4 % des sujets témoins). Parmi les personnes diagnostiquées comme MCI, celles présentant une altération à l'IADL sont significativement plus à risque d'évoluer vers une démence dans les 2 ans (30,7 % versus 7,8 %) (Peres et coll., 2006 ).
). Artero et coll. (2001 ) rapportent les résultats d'un suivi longitudinal d'une cohorte de 833 sujets âgés de plus de 65 ans de la région de Montpellier. Ces personnes ont subi un examen neuropsychologique explorant les différents aspects de la cognition. Les tests ont permis d'identifier 308 personnes présentant une altération cognitive sans démence (MCI). Ce groupe, ainsi qu'un groupe témoin de 289 sujets sans aucune altération cognitive, ont été suivis sur une période de 2 ans. Parmi les 308 personnes présentant les critères de MCI, 19 ont évolué vers une démence alors que les autres sont restés stables. Les auteurs notent un taux relativement élevé de dépendance pour certaines des activités de la vie quotidienne comme utiliser les toilettes (16,1 %), prendre un bain (7,9 %) ou encore utiliser le téléphone (7,5 %) dans le groupe présentant une altération cognitive initiale par rapport au groupe témoin présentant des performances normales (respectivement : 3,3 %, 0 %, 0 %). La prévalence de ces incapacités est encore plus élevée dans le groupe des personnes évoluant vers une authentique maladie démentielle durant le suivi : incapacités ou difficultés pour prendre un bain (26,3 %), utiliser le téléphone (31,6 %) (Artero et coll., 2001
) rapportent les résultats d'un suivi longitudinal d'une cohorte de 833 sujets âgés de plus de 65 ans de la région de Montpellier. Ces personnes ont subi un examen neuropsychologique explorant les différents aspects de la cognition. Les tests ont permis d'identifier 308 personnes présentant une altération cognitive sans démence (MCI). Ce groupe, ainsi qu'un groupe témoin de 289 sujets sans aucune altération cognitive, ont été suivis sur une période de 2 ans. Parmi les 308 personnes présentant les critères de MCI, 19 ont évolué vers une démence alors que les autres sont restés stables. Les auteurs notent un taux relativement élevé de dépendance pour certaines des activités de la vie quotidienne comme utiliser les toilettes (16,1 %), prendre un bain (7,9 %) ou encore utiliser le téléphone (7,5 %) dans le groupe présentant une altération cognitive initiale par rapport au groupe témoin présentant des performances normales (respectivement : 3,3 %, 0 %, 0 %). La prévalence de ces incapacités est encore plus élevée dans le groupe des personnes évoluant vers une authentique maladie démentielle durant le suivi : incapacités ou difficultés pour prendre un bain (26,3 %), utiliser le téléphone (31,6 %) (Artero et coll., 2001 ). Par conséquent, il semble que même au stade de MCI, certaines personnes peuvent déjà présenter des incapacités à réaliser certaines tâches de la vie quotidienne (Artero et coll., 2001
). Par conséquent, il semble que même au stade de MCI, certaines personnes peuvent déjà présenter des incapacités à réaliser certaines tâches de la vie quotidienne (Artero et coll., 2001 ; Tabert et coll., 2002
; Tabert et coll., 2002 ; Nygard, 2003
; Nygard, 2003 ; Peres et coll., 2006
; Peres et coll., 2006 ).
).
 ) rapportent les résultats d'un suivi longitudinal d'une cohorte de 833 sujets âgés de plus de 65 ans de la région de Montpellier. Ces personnes ont subi un examen neuropsychologique explorant les différents aspects de la cognition. Les tests ont permis d'identifier 308 personnes présentant une altération cognitive sans démence (MCI). Ce groupe, ainsi qu'un groupe témoin de 289 sujets sans aucune altération cognitive, ont été suivis sur une période de 2 ans. Parmi les 308 personnes présentant les critères de MCI, 19 ont évolué vers une démence alors que les autres sont restés stables. Les auteurs notent un taux relativement élevé de dépendance pour certaines des activités de la vie quotidienne comme utiliser les toilettes (16,1 %), prendre un bain (7,9 %) ou encore utiliser le téléphone (7,5 %) dans le groupe présentant une altération cognitive initiale par rapport au groupe témoin présentant des performances normales (respectivement : 3,3 %, 0 %, 0 %). La prévalence de ces incapacités est encore plus élevée dans le groupe des personnes évoluant vers une authentique maladie démentielle durant le suivi : incapacités ou difficultés pour prendre un bain (26,3 %), utiliser le téléphone (31,6 %) (Artero et coll., 2001
) rapportent les résultats d'un suivi longitudinal d'une cohorte de 833 sujets âgés de plus de 65 ans de la région de Montpellier. Ces personnes ont subi un examen neuropsychologique explorant les différents aspects de la cognition. Les tests ont permis d'identifier 308 personnes présentant une altération cognitive sans démence (MCI). Ce groupe, ainsi qu'un groupe témoin de 289 sujets sans aucune altération cognitive, ont été suivis sur une période de 2 ans. Parmi les 308 personnes présentant les critères de MCI, 19 ont évolué vers une démence alors que les autres sont restés stables. Les auteurs notent un taux relativement élevé de dépendance pour certaines des activités de la vie quotidienne comme utiliser les toilettes (16,1 %), prendre un bain (7,9 %) ou encore utiliser le téléphone (7,5 %) dans le groupe présentant une altération cognitive initiale par rapport au groupe témoin présentant des performances normales (respectivement : 3,3 %, 0 %, 0 %). La prévalence de ces incapacités est encore plus élevée dans le groupe des personnes évoluant vers une authentique maladie démentielle durant le suivi : incapacités ou difficultés pour prendre un bain (26,3 %), utiliser le téléphone (31,6 %) (Artero et coll., 2001 ). Par conséquent, il semble que même au stade de MCI, certaines personnes peuvent déjà présenter des incapacités à réaliser certaines tâches de la vie quotidienne (Artero et coll., 2001
). Par conséquent, il semble que même au stade de MCI, certaines personnes peuvent déjà présenter des incapacités à réaliser certaines tâches de la vie quotidienne (Artero et coll., 2001 ; Tabert et coll., 2002
; Tabert et coll., 2002 ; Nygard, 2003
; Nygard, 2003 ; Peres et coll., 2006
; Peres et coll., 2006 ).
).La réduction des activités quotidiennes est un élément essentiel au diagnostic de « démence » selon la définition de l'Association américaine de psychiatrie (American Psychiatric Association, 1994 ). Pour de nombreux sujets âgés, la survenue de la dépendance dans les activités de la vie quotidienne est le début de la grande spirale de la fragilité à l'origine d'un plus grand besoin des aides formelles et informelles et d'une grande fréquence des hospitalisations et des placements en maison de retraite (Kemper, 1992
). Pour de nombreux sujets âgés, la survenue de la dépendance dans les activités de la vie quotidienne est le début de la grande spirale de la fragilité à l'origine d'un plus grand besoin des aides formelles et informelles et d'une grande fréquence des hospitalisations et des placements en maison de retraite (Kemper, 1992 ; Gambassi et coll., 1999a
; Gambassi et coll., 1999a ). La pathologie démentielle est une des premières causes de dépendance des sujets âgés (Agüero-Torres et coll., 1998b
). La pathologie démentielle est une des premières causes de dépendance des sujets âgés (Agüero-Torres et coll., 1998b ) et la grande majorité des études souligne l'impact négatif de la dépendance sur la qualité de vie des patients atteints de pathologie démentielle (Andersen et coll., 2004
) et la grande majorité des études souligne l'impact négatif de la dépendance sur la qualité de vie des patients atteints de pathologie démentielle (Andersen et coll., 2004 ). Freels et coll. (1992
). Freels et coll. (1992 ) ont analysé les données de 240 patients atteints de maladie d'Alzheimer, âgés en moyenne de 74,5 ans. Le score moyen au MMSE était de 15,5. Cinquante-huit pour cent de la population présentaient une dépendance pour au moins une des activités de base de la vie quotidienne avec le plus fréquemment des difficultés pour s'habiller (37,1 %) et pour la toilette (33,3 %). L'analyse multivariée, après prise en compte des différents symptômes psychiatriques et des conditions co-morbides, a mis en évidence une association significative entre la dépendance et le déficit des fonctions cognitives (Freels et coll., 1992
) ont analysé les données de 240 patients atteints de maladie d'Alzheimer, âgés en moyenne de 74,5 ans. Le score moyen au MMSE était de 15,5. Cinquante-huit pour cent de la population présentaient une dépendance pour au moins une des activités de base de la vie quotidienne avec le plus fréquemment des difficultés pour s'habiller (37,1 %) et pour la toilette (33,3 %). L'analyse multivariée, après prise en compte des différents symptômes psychiatriques et des conditions co-morbides, a mis en évidence une association significative entre la dépendance et le déficit des fonctions cognitives (Freels et coll., 1992 ). Les enquêtes longitudinales confirment cette notion (Moritz et Berkman, 1995
). Les enquêtes longitudinales confirment cette notion (Moritz et Berkman, 1995 ; Gill et coll., 1997
; Gill et coll., 1997 ; Tabbarah et coll., 2002
; Tabbarah et coll., 2002 ; Rascovsky et coll., 2005
; Rascovsky et coll., 2005 ). Ainsi, Gill et coll. (1996
). Ainsi, Gill et coll. (1996 ) ont suivi pendant 3 ans une cohorte de 775 sujets de plus de 72 ans vivant à domicile et initialement autonomes pour les activités de la vie quotidienne. Parmi ces personnes, 221 (soit 28,5 %) ont développé une dépendance durant l'étude. Les résultats de ce travail montrent que l'altération des fonctions cognitives est un facteur de risque indépendant de l'apparition d'incapacités pour les activités de base de la vie quotidienne.
) ont suivi pendant 3 ans une cohorte de 775 sujets de plus de 72 ans vivant à domicile et initialement autonomes pour les activités de la vie quotidienne. Parmi ces personnes, 221 (soit 28,5 %) ont développé une dépendance durant l'étude. Les résultats de ce travail montrent que l'altération des fonctions cognitives est un facteur de risque indépendant de l'apparition d'incapacités pour les activités de base de la vie quotidienne.
 ). Pour de nombreux sujets âgés, la survenue de la dépendance dans les activités de la vie quotidienne est le début de la grande spirale de la fragilité à l'origine d'un plus grand besoin des aides formelles et informelles et d'une grande fréquence des hospitalisations et des placements en maison de retraite (Kemper, 1992
). Pour de nombreux sujets âgés, la survenue de la dépendance dans les activités de la vie quotidienne est le début de la grande spirale de la fragilité à l'origine d'un plus grand besoin des aides formelles et informelles et d'une grande fréquence des hospitalisations et des placements en maison de retraite (Kemper, 1992 ; Gambassi et coll., 1999a
; Gambassi et coll., 1999a ). La pathologie démentielle est une des premières causes de dépendance des sujets âgés (Agüero-Torres et coll., 1998b
). La pathologie démentielle est une des premières causes de dépendance des sujets âgés (Agüero-Torres et coll., 1998b ) et la grande majorité des études souligne l'impact négatif de la dépendance sur la qualité de vie des patients atteints de pathologie démentielle (Andersen et coll., 2004
) et la grande majorité des études souligne l'impact négatif de la dépendance sur la qualité de vie des patients atteints de pathologie démentielle (Andersen et coll., 2004 ). Freels et coll. (1992
). Freels et coll. (1992 ) ont analysé les données de 240 patients atteints de maladie d'Alzheimer, âgés en moyenne de 74,5 ans. Le score moyen au MMSE était de 15,5. Cinquante-huit pour cent de la population présentaient une dépendance pour au moins une des activités de base de la vie quotidienne avec le plus fréquemment des difficultés pour s'habiller (37,1 %) et pour la toilette (33,3 %). L'analyse multivariée, après prise en compte des différents symptômes psychiatriques et des conditions co-morbides, a mis en évidence une association significative entre la dépendance et le déficit des fonctions cognitives (Freels et coll., 1992
) ont analysé les données de 240 patients atteints de maladie d'Alzheimer, âgés en moyenne de 74,5 ans. Le score moyen au MMSE était de 15,5. Cinquante-huit pour cent de la population présentaient une dépendance pour au moins une des activités de base de la vie quotidienne avec le plus fréquemment des difficultés pour s'habiller (37,1 %) et pour la toilette (33,3 %). L'analyse multivariée, après prise en compte des différents symptômes psychiatriques et des conditions co-morbides, a mis en évidence une association significative entre la dépendance et le déficit des fonctions cognitives (Freels et coll., 1992 ). Les enquêtes longitudinales confirment cette notion (Moritz et Berkman, 1995
). Les enquêtes longitudinales confirment cette notion (Moritz et Berkman, 1995 ; Gill et coll., 1997
; Gill et coll., 1997 ; Tabbarah et coll., 2002
; Tabbarah et coll., 2002 ; Rascovsky et coll., 2005
; Rascovsky et coll., 2005 ). Ainsi, Gill et coll. (1996
). Ainsi, Gill et coll. (1996 ) ont suivi pendant 3 ans une cohorte de 775 sujets de plus de 72 ans vivant à domicile et initialement autonomes pour les activités de la vie quotidienne. Parmi ces personnes, 221 (soit 28,5 %) ont développé une dépendance durant l'étude. Les résultats de ce travail montrent que l'altération des fonctions cognitives est un facteur de risque indépendant de l'apparition d'incapacités pour les activités de base de la vie quotidienne.
) ont suivi pendant 3 ans une cohorte de 775 sujets de plus de 72 ans vivant à domicile et initialement autonomes pour les activités de la vie quotidienne. Parmi ces personnes, 221 (soit 28,5 %) ont développé une dépendance durant l'étude. Les résultats de ce travail montrent que l'altération des fonctions cognitives est un facteur de risque indépendant de l'apparition d'incapacités pour les activités de base de la vie quotidienne. Toutefois, il existe une très grande variabilité dans l'aggravation de la dépendance au cours du temps chez des sujets atteints de maladie d'Alzheimer (Galasko et coll., 1991 ; Green et coll., 1993
; Green et coll., 1993 ; Byrne et coll., 2000
; Byrne et coll., 2000 ; Brickman et coll., 2002
; Brickman et coll., 2002 ; Holmes et Lovestone, 2003
; Holmes et Lovestone, 2003 ; Stavitsky et coll., 2006
; Stavitsky et coll., 2006 ; Wicklund et coll., 2007
; Wicklund et coll., 2007 ). En effet, même si l'évolution de l'altération des fonctions cognitives est un facteur déterminant, d'autres paramètres interviennent comme par exemple les pathologies cardiovasculaires, les maladies rhumatologiques ou encore les déficits sensoriels (Galasko et coll., 1991
). En effet, même si l'évolution de l'altération des fonctions cognitives est un facteur déterminant, d'autres paramètres interviennent comme par exemple les pathologies cardiovasculaires, les maladies rhumatologiques ou encore les déficits sensoriels (Galasko et coll., 1991 ). La comparaison de la vitesse d'aggravation de la dépendance à travers les différentes études est d'autre part difficile car les outils d'évaluation utilisés ne sont pas toujours identiques (Mohs et coll., 2000
). La comparaison de la vitesse d'aggravation de la dépendance à travers les différentes études est d'autre part difficile car les outils d'évaluation utilisés ne sont pas toujours identiques (Mohs et coll., 2000 ). Green et coll. rapportent en 1993
). Green et coll. rapportent en 1993 , bien avant la mise sur le marché des thérapeutiques pharmacologiques spécifiques, une perte de 2,44 (±3,87) points par an à l'échelle PSMS (Physical Self-Maintenance Scale) qui évalue 6 items (utiliser les toilettes, manger, s'habiller, prendre soin de soi, marcher et se laver). Les 104 patients inclus dans cette étude ont été suivis sur une durée de 31 mois en moyenne (Green et coll., 1993
, bien avant la mise sur le marché des thérapeutiques pharmacologiques spécifiques, une perte de 2,44 (±3,87) points par an à l'échelle PSMS (Physical Self-Maintenance Scale) qui évalue 6 items (utiliser les toilettes, manger, s'habiller, prendre soin de soi, marcher et se laver). Les 104 patients inclus dans cette étude ont été suivis sur une durée de 31 mois en moyenne (Green et coll., 1993 ). Feldman et coll. (1995
). Feldman et coll. (1995 ) rapportent quant à eux un déclin de 3,12 points par an (IC 95 % [2,49-3,75]) à l'échelle FRS (Functional Rating Scale) chez 173 patients atteints de maladie d'Alzheimer. Cette échelle évalue 8 domaines (4 cognitifs et 4 non cognitifs), chaque domaine étant évalué de 1 à 5 selon la sévérité (Crockett et coll., 1989
) rapportent quant à eux un déclin de 3,12 points par an (IC 95 % [2,49-3,75]) à l'échelle FRS (Functional Rating Scale) chez 173 patients atteints de maladie d'Alzheimer. Cette échelle évalue 8 domaines (4 cognitifs et 4 non cognitifs), chaque domaine étant évalué de 1 à 5 selon la sévérité (Crockett et coll., 1989 ). L'analyse des données de 1 289 sujets atteints de maladie d'Alzheimer ayant participé aux essais randomisés avec la galantamine montre qu'une évolution de 4 points à l'échelle d'ADAS-Cog est associée à une aggravation de 35 % (IC 95 % [28-43]) de la dépendance évaluée par la Disability Assessment for Dementia (DAD) (Caro et coll., 2002
). L'analyse des données de 1 289 sujets atteints de maladie d'Alzheimer ayant participé aux essais randomisés avec la galantamine montre qu'une évolution de 4 points à l'échelle d'ADAS-Cog est associée à une aggravation de 35 % (IC 95 % [28-43]) de la dépendance évaluée par la Disability Assessment for Dementia (DAD) (Caro et coll., 2002 ). Feldman et coll. (2001
). Feldman et coll. (2001 ) rapportent un déclin mensuel de 1 point à l'échelle DAD chez 144 sujets du groupe placebo ayant participé à l'étude SAB INT 12. Ces personnes avaient toutes une maladie d'Alzheimer légère à modérée à l'inclusion (MMSE entre 14 et 22) et ont été suivies durant 52 semaines. Le déclin mensuel de 1 point correspond à la perte d'un des items de la DAD tous les 2 mois. Les auteurs soulignent le lien entre la sévérité cognitive de la maladie et une évolution plus rapide vers la dépendance. L'évaluation par l'ADCS-ADL (Alzheimer Disease Cooperative Study-Activities of Daily Living) de 187 sujets atteints de maladie d'Alzheimer suivis pendant 1 an montre une perte de 9,9 points (±9,6) (score de 0 à 78) parallèlement à l'altération cognitive (perte de 3,9 points ±4,2 au MMSE). L'évolution sur une durée de 2 ans de l'ADL au sein de la cohorte REAL.FR, cohorte française de patients atteints de maladie d'Alzheimer (stade léger à modéré) traités en grande majorité par les inhibiteurs d'acétylcholinestérase, montre un déclin de 1,32 point alors que le score au MMSE baisse de 4,57±0,23 durant la même période. Les items les plus affectés concernent l'hygiène corporelle, l'habillage et la toilette. Quant à l'échelle IADL, les scores déclinent de 1,54±1,76 points sur les 2 années de suivi. Enfin, l'évaluation semestrielle de l'IADL au sein d'une cohorte de 104 patients suivis avant la mise sur le marché des traitements spécifiques de la démence, révèle une perte de 2,06±3,27 points par an sur cette même échelle (Green et coll., 1993
) rapportent un déclin mensuel de 1 point à l'échelle DAD chez 144 sujets du groupe placebo ayant participé à l'étude SAB INT 12. Ces personnes avaient toutes une maladie d'Alzheimer légère à modérée à l'inclusion (MMSE entre 14 et 22) et ont été suivies durant 52 semaines. Le déclin mensuel de 1 point correspond à la perte d'un des items de la DAD tous les 2 mois. Les auteurs soulignent le lien entre la sévérité cognitive de la maladie et une évolution plus rapide vers la dépendance. L'évaluation par l'ADCS-ADL (Alzheimer Disease Cooperative Study-Activities of Daily Living) de 187 sujets atteints de maladie d'Alzheimer suivis pendant 1 an montre une perte de 9,9 points (±9,6) (score de 0 à 78) parallèlement à l'altération cognitive (perte de 3,9 points ±4,2 au MMSE). L'évolution sur une durée de 2 ans de l'ADL au sein de la cohorte REAL.FR, cohorte française de patients atteints de maladie d'Alzheimer (stade léger à modéré) traités en grande majorité par les inhibiteurs d'acétylcholinestérase, montre un déclin de 1,32 point alors que le score au MMSE baisse de 4,57±0,23 durant la même période. Les items les plus affectés concernent l'hygiène corporelle, l'habillage et la toilette. Quant à l'échelle IADL, les scores déclinent de 1,54±1,76 points sur les 2 années de suivi. Enfin, l'évaluation semestrielle de l'IADL au sein d'une cohorte de 104 patients suivis avant la mise sur le marché des traitements spécifiques de la démence, révèle une perte de 2,06±3,27 points par an sur cette même échelle (Green et coll., 1993 ).
).
 ; Green et coll., 1993
; Green et coll., 1993 ; Byrne et coll., 2000
; Byrne et coll., 2000 ; Brickman et coll., 2002
; Brickman et coll., 2002 ; Holmes et Lovestone, 2003
; Holmes et Lovestone, 2003 ; Stavitsky et coll., 2006
; Stavitsky et coll., 2006 ; Wicklund et coll., 2007
; Wicklund et coll., 2007 ). En effet, même si l'évolution de l'altération des fonctions cognitives est un facteur déterminant, d'autres paramètres interviennent comme par exemple les pathologies cardiovasculaires, les maladies rhumatologiques ou encore les déficits sensoriels (Galasko et coll., 1991
). En effet, même si l'évolution de l'altération des fonctions cognitives est un facteur déterminant, d'autres paramètres interviennent comme par exemple les pathologies cardiovasculaires, les maladies rhumatologiques ou encore les déficits sensoriels (Galasko et coll., 1991 ). La comparaison de la vitesse d'aggravation de la dépendance à travers les différentes études est d'autre part difficile car les outils d'évaluation utilisés ne sont pas toujours identiques (Mohs et coll., 2000
). La comparaison de la vitesse d'aggravation de la dépendance à travers les différentes études est d'autre part difficile car les outils d'évaluation utilisés ne sont pas toujours identiques (Mohs et coll., 2000 ). Green et coll. rapportent en 1993
). Green et coll. rapportent en 1993 , bien avant la mise sur le marché des thérapeutiques pharmacologiques spécifiques, une perte de 2,44 (±3,87) points par an à l'échelle PSMS (Physical Self-Maintenance Scale) qui évalue 6 items (utiliser les toilettes, manger, s'habiller, prendre soin de soi, marcher et se laver). Les 104 patients inclus dans cette étude ont été suivis sur une durée de 31 mois en moyenne (Green et coll., 1993
, bien avant la mise sur le marché des thérapeutiques pharmacologiques spécifiques, une perte de 2,44 (±3,87) points par an à l'échelle PSMS (Physical Self-Maintenance Scale) qui évalue 6 items (utiliser les toilettes, manger, s'habiller, prendre soin de soi, marcher et se laver). Les 104 patients inclus dans cette étude ont été suivis sur une durée de 31 mois en moyenne (Green et coll., 1993 ). Feldman et coll. (1995
). Feldman et coll. (1995 ) rapportent quant à eux un déclin de 3,12 points par an (IC 95 % [2,49-3,75]) à l'échelle FRS (Functional Rating Scale) chez 173 patients atteints de maladie d'Alzheimer. Cette échelle évalue 8 domaines (4 cognitifs et 4 non cognitifs), chaque domaine étant évalué de 1 à 5 selon la sévérité (Crockett et coll., 1989
) rapportent quant à eux un déclin de 3,12 points par an (IC 95 % [2,49-3,75]) à l'échelle FRS (Functional Rating Scale) chez 173 patients atteints de maladie d'Alzheimer. Cette échelle évalue 8 domaines (4 cognitifs et 4 non cognitifs), chaque domaine étant évalué de 1 à 5 selon la sévérité (Crockett et coll., 1989 ). L'analyse des données de 1 289 sujets atteints de maladie d'Alzheimer ayant participé aux essais randomisés avec la galantamine montre qu'une évolution de 4 points à l'échelle d'ADAS-Cog est associée à une aggravation de 35 % (IC 95 % [28-43]) de la dépendance évaluée par la Disability Assessment for Dementia (DAD) (Caro et coll., 2002
). L'analyse des données de 1 289 sujets atteints de maladie d'Alzheimer ayant participé aux essais randomisés avec la galantamine montre qu'une évolution de 4 points à l'échelle d'ADAS-Cog est associée à une aggravation de 35 % (IC 95 % [28-43]) de la dépendance évaluée par la Disability Assessment for Dementia (DAD) (Caro et coll., 2002 ). Feldman et coll. (2001
). Feldman et coll. (2001 ) rapportent un déclin mensuel de 1 point à l'échelle DAD chez 144 sujets du groupe placebo ayant participé à l'étude SAB INT 12. Ces personnes avaient toutes une maladie d'Alzheimer légère à modérée à l'inclusion (MMSE entre 14 et 22) et ont été suivies durant 52 semaines. Le déclin mensuel de 1 point correspond à la perte d'un des items de la DAD tous les 2 mois. Les auteurs soulignent le lien entre la sévérité cognitive de la maladie et une évolution plus rapide vers la dépendance. L'évaluation par l'ADCS-ADL (Alzheimer Disease Cooperative Study-Activities of Daily Living) de 187 sujets atteints de maladie d'Alzheimer suivis pendant 1 an montre une perte de 9,9 points (±9,6) (score de 0 à 78) parallèlement à l'altération cognitive (perte de 3,9 points ±4,2 au MMSE). L'évolution sur une durée de 2 ans de l'ADL au sein de la cohorte REAL.FR, cohorte française de patients atteints de maladie d'Alzheimer (stade léger à modéré) traités en grande majorité par les inhibiteurs d'acétylcholinestérase, montre un déclin de 1,32 point alors que le score au MMSE baisse de 4,57±0,23 durant la même période. Les items les plus affectés concernent l'hygiène corporelle, l'habillage et la toilette. Quant à l'échelle IADL, les scores déclinent de 1,54±1,76 points sur les 2 années de suivi. Enfin, l'évaluation semestrielle de l'IADL au sein d'une cohorte de 104 patients suivis avant la mise sur le marché des traitements spécifiques de la démence, révèle une perte de 2,06±3,27 points par an sur cette même échelle (Green et coll., 1993
) rapportent un déclin mensuel de 1 point à l'échelle DAD chez 144 sujets du groupe placebo ayant participé à l'étude SAB INT 12. Ces personnes avaient toutes une maladie d'Alzheimer légère à modérée à l'inclusion (MMSE entre 14 et 22) et ont été suivies durant 52 semaines. Le déclin mensuel de 1 point correspond à la perte d'un des items de la DAD tous les 2 mois. Les auteurs soulignent le lien entre la sévérité cognitive de la maladie et une évolution plus rapide vers la dépendance. L'évaluation par l'ADCS-ADL (Alzheimer Disease Cooperative Study-Activities of Daily Living) de 187 sujets atteints de maladie d'Alzheimer suivis pendant 1 an montre une perte de 9,9 points (±9,6) (score de 0 à 78) parallèlement à l'altération cognitive (perte de 3,9 points ±4,2 au MMSE). L'évolution sur une durée de 2 ans de l'ADL au sein de la cohorte REAL.FR, cohorte française de patients atteints de maladie d'Alzheimer (stade léger à modéré) traités en grande majorité par les inhibiteurs d'acétylcholinestérase, montre un déclin de 1,32 point alors que le score au MMSE baisse de 4,57±0,23 durant la même période. Les items les plus affectés concernent l'hygiène corporelle, l'habillage et la toilette. Quant à l'échelle IADL, les scores déclinent de 1,54±1,76 points sur les 2 années de suivi. Enfin, l'évaluation semestrielle de l'IADL au sein d'une cohorte de 104 patients suivis avant la mise sur le marché des traitements spécifiques de la démence, révèle une perte de 2,06±3,27 points par an sur cette même échelle (Green et coll., 1993 ).
).En résumé, ces différentes données mettent en évidence la complémentarité de l'approche fonctionnelle gérontologique et de l'approche neurologique classique dans le dépistage et le suivi des sujets déments ou à haut risque de démence. Elles soulignent par ailleurs l'importance de l'évaluation des déficits fonctionnels et des handicaps dans l'élaboration du projet de soins. En effet, le retentissement sur la vie quotidienne des différents déficits cognitifs ou fonctionnels doit pouvoir être évalué. La répercussion se discutera en général en terme de « risques », lesquels seront différents selon le stade de la maladie : par exemple, la conduite automobile, l'autonomie financière et la gestion du budget, et l'adéquation du patient à son mode de vie à domicile (figure 11.1 ).
).
 ).
).Survie
La prise en charge médicale des patients déments est généralement moins bonne que celle des patients non déments. On trouve par exemple moins de maladies cardiovasculaires et de cancers dans les certificats de décès des patients souffrant de maladie d'Alzheimer que dans la population générale, ce qui montre que ces pathologies sont moins souvent diagnostiquées, la sémiologie n'étant pas évocatrice (Beard et coll., 1996 ). D'ailleurs, dans une étude finlandaise, 66 % des patients déments ont au moins une maladie non diagnostiquée, comparativement à 48 % chez les sujets du même âge (65 ans et plus) non déments (Lopponen et coll., 2004
). D'ailleurs, dans une étude finlandaise, 66 % des patients déments ont au moins une maladie non diagnostiquée, comparativement à 48 % chez les sujets du même âge (65 ans et plus) non déments (Lopponen et coll., 2004 ), notamment une hypercholestérolémie et une hypothyroïdie. Lorsque la démence est sévère, la cause de décès la plus fréquemment signalée est la pneumonie, alors que lorsque la démence est moins sévère, les certificats relèvent plus de maladies cardiaques et accidents vasculaires cérébraux (Kukull et coll., 1994
), notamment une hypercholestérolémie et une hypothyroïdie. Lorsque la démence est sévère, la cause de décès la plus fréquemment signalée est la pneumonie, alors que lorsque la démence est moins sévère, les certificats relèvent plus de maladies cardiaques et accidents vasculaires cérébraux (Kukull et coll., 1994 ). Dans une étude longitudinale où la cause du décès a été recherchée systématiquement par autopsie chez 91 patients déments, 8/16 embolies pulmonaires et 11/33 bronchopathies n'avaient pas été diagnostiquées (Keene et coll., 2001
). Dans une étude longitudinale où la cause du décès a été recherchée systématiquement par autopsie chez 91 patients déments, 8/16 embolies pulmonaires et 11/33 bronchopathies n'avaient pas été diagnostiquées (Keene et coll., 2001 ). À l'inverse, ces diagnostics avaient été portés chez 4 patients sans être confirmés par l'autopsie. Seulement 53 % des autopsies confirmaient la cause exacte du décès.
). À l'inverse, ces diagnostics avaient été portés chez 4 patients sans être confirmés par l'autopsie. Seulement 53 % des autopsies confirmaient la cause exacte du décès.
 ). D'ailleurs, dans une étude finlandaise, 66 % des patients déments ont au moins une maladie non diagnostiquée, comparativement à 48 % chez les sujets du même âge (65 ans et plus) non déments (Lopponen et coll., 2004
). D'ailleurs, dans une étude finlandaise, 66 % des patients déments ont au moins une maladie non diagnostiquée, comparativement à 48 % chez les sujets du même âge (65 ans et plus) non déments (Lopponen et coll., 2004 ), notamment une hypercholestérolémie et une hypothyroïdie. Lorsque la démence est sévère, la cause de décès la plus fréquemment signalée est la pneumonie, alors que lorsque la démence est moins sévère, les certificats relèvent plus de maladies cardiaques et accidents vasculaires cérébraux (Kukull et coll., 1994
), notamment une hypercholestérolémie et une hypothyroïdie. Lorsque la démence est sévère, la cause de décès la plus fréquemment signalée est la pneumonie, alors que lorsque la démence est moins sévère, les certificats relèvent plus de maladies cardiaques et accidents vasculaires cérébraux (Kukull et coll., 1994 ). Dans une étude longitudinale où la cause du décès a été recherchée systématiquement par autopsie chez 91 patients déments, 8/16 embolies pulmonaires et 11/33 bronchopathies n'avaient pas été diagnostiquées (Keene et coll., 2001
). Dans une étude longitudinale où la cause du décès a été recherchée systématiquement par autopsie chez 91 patients déments, 8/16 embolies pulmonaires et 11/33 bronchopathies n'avaient pas été diagnostiquées (Keene et coll., 2001 ). À l'inverse, ces diagnostics avaient été portés chez 4 patients sans être confirmés par l'autopsie. Seulement 53 % des autopsies confirmaient la cause exacte du décès.
). À l'inverse, ces diagnostics avaient été portés chez 4 patients sans être confirmés par l'autopsie. Seulement 53 % des autopsies confirmaient la cause exacte du décès.Quoi qu'il en soit, il est établi que la maladie d'Alzheimer compromet considérablement l'espérance de vie (Aevarsson et coll., 1998 ; Baldereschi et coll., 1999
; Baldereschi et coll., 1999 ; Noale et coll., 2003
; Noale et coll., 2003 ; Tschanz et coll., 2004
; Tschanz et coll., 2004 ; Fitzpatrick et coll., 2005
; Fitzpatrick et coll., 2005 ; Ganguli et coll., 2005
; Ganguli et coll., 2005 ), quel que soit le stade de la démence (Storandt et coll., 2002
), quel que soit le stade de la démence (Storandt et coll., 2002 ). La mortalité des patients déments est doublée chez les patients de plus de 85 ans comparativement aux personnes non démentes (Heeren et coll., 1992
). La mortalité des patients déments est doublée chez les patients de plus de 85 ans comparativement aux personnes non démentes (Heeren et coll., 1992 ). La mortalité est très liée à la pente du déclin cognitif (Heeren et coll., 1992
). La mortalité est très liée à la pente du déclin cognitif (Heeren et coll., 1992 ; Boersma et coll., 1999
; Boersma et coll., 1999 ; Bassuk et coll., 2000
; Bassuk et coll., 2000 ; Hui et coll., 2003
; Hui et coll., 2003 ). Dans une étude longitudinale de 4 ans chez 354 patients atteints de maladie d'Alzheimer suivis en centre mémoire, d'âge moyen 75 ans et de MMSE initial à 19, le risque de décès était plus de 8 fois supérieur chez les patients présentant le déclin cognitif le plus rapide par rapport à ceux dont le déclin était le moins important (Hui et coll., 2003
). Dans une étude longitudinale de 4 ans chez 354 patients atteints de maladie d'Alzheimer suivis en centre mémoire, d'âge moyen 75 ans et de MMSE initial à 19, le risque de décès était plus de 8 fois supérieur chez les patients présentant le déclin cognitif le plus rapide par rapport à ceux dont le déclin était le moins important (Hui et coll., 2003 ). En revanche, le niveau cognitif initial intervenait peu.
). En revanche, le niveau cognitif initial intervenait peu.
 ; Baldereschi et coll., 1999
; Baldereschi et coll., 1999 ; Noale et coll., 2003
; Noale et coll., 2003 ; Tschanz et coll., 2004
; Tschanz et coll., 2004 ; Fitzpatrick et coll., 2005
; Fitzpatrick et coll., 2005 ; Ganguli et coll., 2005
; Ganguli et coll., 2005 ), quel que soit le stade de la démence (Storandt et coll., 2002
), quel que soit le stade de la démence (Storandt et coll., 2002 ). La mortalité des patients déments est doublée chez les patients de plus de 85 ans comparativement aux personnes non démentes (Heeren et coll., 1992
). La mortalité des patients déments est doublée chez les patients de plus de 85 ans comparativement aux personnes non démentes (Heeren et coll., 1992 ). La mortalité est très liée à la pente du déclin cognitif (Heeren et coll., 1992
). La mortalité est très liée à la pente du déclin cognitif (Heeren et coll., 1992 ; Boersma et coll., 1999
; Boersma et coll., 1999 ; Bassuk et coll., 2000
; Bassuk et coll., 2000 ; Hui et coll., 2003
; Hui et coll., 2003 ). Dans une étude longitudinale de 4 ans chez 354 patients atteints de maladie d'Alzheimer suivis en centre mémoire, d'âge moyen 75 ans et de MMSE initial à 19, le risque de décès était plus de 8 fois supérieur chez les patients présentant le déclin cognitif le plus rapide par rapport à ceux dont le déclin était le moins important (Hui et coll., 2003
). Dans une étude longitudinale de 4 ans chez 354 patients atteints de maladie d'Alzheimer suivis en centre mémoire, d'âge moyen 75 ans et de MMSE initial à 19, le risque de décès était plus de 8 fois supérieur chez les patients présentant le déclin cognitif le plus rapide par rapport à ceux dont le déclin était le moins important (Hui et coll., 2003 ). En revanche, le niveau cognitif initial intervenait peu.
). En revanche, le niveau cognitif initial intervenait peu.Le risque de décès imputable à la démence dans l'étude Paquid est de 1,82 (IC 95 % [1,77-2,68]) sur les analyses réalisées à partir des données issues de 8 ans de suivi de 2 923 personnes âgées (Helmer et coll., 2001 ). Dans une étude prospective de 15 ans sur une population défavorisée de Pennsylvanie de plus de 65 ans, la maladie d'Alzheimer augmentait la mortalité de 40 % après ajustement (Ganguli et coll., 2005
). Dans une étude prospective de 15 ans sur une population défavorisée de Pennsylvanie de plus de 65 ans, la maladie d'Alzheimer augmentait la mortalité de 40 % après ajustement (Ganguli et coll., 2005 ). La démence est le facteur de risque de mortalité le plus important dans tous les groupes d'âges chez les sujets de plus de 65 ans, particulièrement chez les 65-74 ans (Hazard Ratio ajusté=7,3 ; IC 95 % [4,5-11,7]) alors qu'à 85 ans, le risque ajusté n'est plus que de 2,2 (IC 95 % [1,7-2,8]) lorsque la démence est prévalente (Tschanz et coll., 2004
). La démence est le facteur de risque de mortalité le plus important dans tous les groupes d'âges chez les sujets de plus de 65 ans, particulièrement chez les 65-74 ans (Hazard Ratio ajusté=7,3 ; IC 95 % [4,5-11,7]) alors qu'à 85 ans, le risque ajusté n'est plus que de 2,2 (IC 95 % [1,7-2,8]) lorsque la démence est prévalente (Tschanz et coll., 2004 ).
).
 ). Dans une étude prospective de 15 ans sur une population défavorisée de Pennsylvanie de plus de 65 ans, la maladie d'Alzheimer augmentait la mortalité de 40 % après ajustement (Ganguli et coll., 2005
). Dans une étude prospective de 15 ans sur une population défavorisée de Pennsylvanie de plus de 65 ans, la maladie d'Alzheimer augmentait la mortalité de 40 % après ajustement (Ganguli et coll., 2005 ). La démence est le facteur de risque de mortalité le plus important dans tous les groupes d'âges chez les sujets de plus de 65 ans, particulièrement chez les 65-74 ans (Hazard Ratio ajusté=7,3 ; IC 95 % [4,5-11,7]) alors qu'à 85 ans, le risque ajusté n'est plus que de 2,2 (IC 95 % [1,7-2,8]) lorsque la démence est prévalente (Tschanz et coll., 2004
). La démence est le facteur de risque de mortalité le plus important dans tous les groupes d'âges chez les sujets de plus de 65 ans, particulièrement chez les 65-74 ans (Hazard Ratio ajusté=7,3 ; IC 95 % [4,5-11,7]) alors qu'à 85 ans, le risque ajusté n'est plus que de 2,2 (IC 95 % [1,7-2,8]) lorsque la démence est prévalente (Tschanz et coll., 2004 ).
). Il y a peu d'informations sur la survie en cas de démence pré sénile (survenant avant 65 ans). Dans une étude de cohorte, la survie médiane à partir du diagnostic était d'environ 6 ans (7,5 ans à partir des premiers symptômes pour l'ensemble de la cohorte), que la démence soit de type Alzheimer (les trois-quarts) ou vasculaire, quels que soient l'âge et le genre (Kay et coll., 2000 ).
).
 ).
).Selon les études, la durée de survie est estimée soit à partir du moment où le patient entre dans l'étude soit à partir du début des symptômes (Stern et coll., 1997 ; Agüero-Torres et coll., 1998a
; Agüero-Torres et coll., 1998a et b
et b ). La médiane de survie est variable selon les études : de 5,7 ans (Mölsä et coll., 1986
). La médiane de survie est variable selon les études : de 5,7 ans (Mölsä et coll., 1986 ) à 9,3 ans (Walsh et coll., 1990
) à 9,3 ans (Walsh et coll., 1990 ) après le début des symptômes et 5,4 ans (IC 95 % [4,9-5,9]) après ajustement (Tschanz et coll., 2004
) après le début des symptômes et 5,4 ans (IC 95 % [4,9-5,9]) après ajustement (Tschanz et coll., 2004 ). À partir d'une banque de cerveaux, la durée de survie après le début des symptômes est estimée en moyenne 8,5 ans (Jost et Grossberg, 1995
). À partir d'une banque de cerveaux, la durée de survie après le début des symptômes est estimée en moyenne 8,5 ans (Jost et Grossberg, 1995 ), avec des extrêmes allant de 2 à 20 ans. Après l'entrée dans un registre comme le Consortium to Establish a Registry for Alzheimer's Disease (CERAD) américain, la survie est en moyenne de 6 ans (5,7 ans chez l'homme et 7,2 ans chez les femmes) (Heyman et coll., 1996
), avec des extrêmes allant de 2 à 20 ans. Après l'entrée dans un registre comme le Consortium to Establish a Registry for Alzheimer's Disease (CERAD) américain, la survie est en moyenne de 6 ans (5,7 ans chez l'homme et 7,2 ans chez les femmes) (Heyman et coll., 1996 ). Dans une cohorte de patients âgés de plus de 65 ans (âge moyen 84 ans), la médiane de survie était de 6,6 ans avant correction, et seulement de 3,3 ans (IC 95 % [2,7-4,0]) après correction du biais de durée d'évolution (Wolfson et coll., 2001
). Dans une cohorte de patients âgés de plus de 65 ans (âge moyen 84 ans), la médiane de survie était de 6,6 ans avant correction, et seulement de 3,3 ans (IC 95 % [2,7-4,0]) après correction du biais de durée d'évolution (Wolfson et coll., 2001 ). La correction de ce biais permet de tenir compte du fait que des patients peuvent mourir avant que le diagnostic de démence ne soit porté lorsque l'évolution est rapide, et que le pronostic est meilleur chez les patients dont la durée d'évolution est plus longue au moment de l'entrée dans l'étude (Wolfson et coll., 2001
). La correction de ce biais permet de tenir compte du fait que des patients peuvent mourir avant que le diagnostic de démence ne soit porté lorsque l'évolution est rapide, et que le pronostic est meilleur chez les patients dont la durée d'évolution est plus longue au moment de l'entrée dans l'étude (Wolfson et coll., 2001 ). Dans cette cohorte, la durée de survie est comparable dans la maladie d'Alzheimer probable, possible et dans la démence vasculaire. De façon attendue, la survie est plus courte chez les patients les plus âgés.
). Dans cette cohorte, la durée de survie est comparable dans la maladie d'Alzheimer probable, possible et dans la démence vasculaire. De façon attendue, la survie est plus courte chez les patients les plus âgés.
 ; Agüero-Torres et coll., 1998a
; Agüero-Torres et coll., 1998a et b
et b ). La médiane de survie est variable selon les études : de 5,7 ans (Mölsä et coll., 1986
). La médiane de survie est variable selon les études : de 5,7 ans (Mölsä et coll., 1986 ) à 9,3 ans (Walsh et coll., 1990
) à 9,3 ans (Walsh et coll., 1990 ) après le début des symptômes et 5,4 ans (IC 95 % [4,9-5,9]) après ajustement (Tschanz et coll., 2004
) après le début des symptômes et 5,4 ans (IC 95 % [4,9-5,9]) après ajustement (Tschanz et coll., 2004 ). À partir d'une banque de cerveaux, la durée de survie après le début des symptômes est estimée en moyenne 8,5 ans (Jost et Grossberg, 1995
). À partir d'une banque de cerveaux, la durée de survie après le début des symptômes est estimée en moyenne 8,5 ans (Jost et Grossberg, 1995 ), avec des extrêmes allant de 2 à 20 ans. Après l'entrée dans un registre comme le Consortium to Establish a Registry for Alzheimer's Disease (CERAD) américain, la survie est en moyenne de 6 ans (5,7 ans chez l'homme et 7,2 ans chez les femmes) (Heyman et coll., 1996
), avec des extrêmes allant de 2 à 20 ans. Après l'entrée dans un registre comme le Consortium to Establish a Registry for Alzheimer's Disease (CERAD) américain, la survie est en moyenne de 6 ans (5,7 ans chez l'homme et 7,2 ans chez les femmes) (Heyman et coll., 1996 ). Dans une cohorte de patients âgés de plus de 65 ans (âge moyen 84 ans), la médiane de survie était de 6,6 ans avant correction, et seulement de 3,3 ans (IC 95 % [2,7-4,0]) après correction du biais de durée d'évolution (Wolfson et coll., 2001
). Dans une cohorte de patients âgés de plus de 65 ans (âge moyen 84 ans), la médiane de survie était de 6,6 ans avant correction, et seulement de 3,3 ans (IC 95 % [2,7-4,0]) après correction du biais de durée d'évolution (Wolfson et coll., 2001 ). La correction de ce biais permet de tenir compte du fait que des patients peuvent mourir avant que le diagnostic de démence ne soit porté lorsque l'évolution est rapide, et que le pronostic est meilleur chez les patients dont la durée d'évolution est plus longue au moment de l'entrée dans l'étude (Wolfson et coll., 2001
). La correction de ce biais permet de tenir compte du fait que des patients peuvent mourir avant que le diagnostic de démence ne soit porté lorsque l'évolution est rapide, et que le pronostic est meilleur chez les patients dont la durée d'évolution est plus longue au moment de l'entrée dans l'étude (Wolfson et coll., 2001 ). Dans cette cohorte, la durée de survie est comparable dans la maladie d'Alzheimer probable, possible et dans la démence vasculaire. De façon attendue, la survie est plus courte chez les patients les plus âgés.
). Dans cette cohorte, la durée de survie est comparable dans la maladie d'Alzheimer probable, possible et dans la démence vasculaire. De façon attendue, la survie est plus courte chez les patients les plus âgés. La médiane de survie varie de 8,3 ans chez les personnes dont le diagnostic de maladie d'Alzheimer a été posé à l'âge de 65 ans, à 3,4 ans chez les personnes diagnostiquées à 90 ans (Brookmeyer et coll., 2002 ). La réduction de survie associée à la maladie d'Alzheimer est de 67 % chez les personnes de 65 ans et de 39 % chez les personnes de 90 ans (Brookmeyer et coll., 2002
). La réduction de survie associée à la maladie d'Alzheimer est de 67 % chez les personnes de 65 ans et de 39 % chez les personnes de 90 ans (Brookmeyer et coll., 2002 ; chiffres comparables dans l'étude de Ganguli et coll., 2005
; chiffres comparables dans l'étude de Ganguli et coll., 2005 ).
).
 ). La réduction de survie associée à la maladie d'Alzheimer est de 67 % chez les personnes de 65 ans et de 39 % chez les personnes de 90 ans (Brookmeyer et coll., 2002
). La réduction de survie associée à la maladie d'Alzheimer est de 67 % chez les personnes de 65 ans et de 39 % chez les personnes de 90 ans (Brookmeyer et coll., 2002 ; chiffres comparables dans l'étude de Ganguli et coll., 2005
; chiffres comparables dans l'étude de Ganguli et coll., 2005 ).
).Dans la majorité des travaux, l'âge et le sexe masculin sont des facteurs prédictifs de mortalité plus élevée chez les patients atteints de maladie d'Alzheimer (Gambassi et coll., 1999b ; Jagger et coll., 2000
; Jagger et coll., 2000 ; Helmer et coll., 2001
; Helmer et coll., 2001 ; Keene et coll., 2001
; Keene et coll., 2001 ; Lapane et coll., 2001
; Lapane et coll., 2001 ; Wolfson et coll., 2001
; Wolfson et coll., 2001 ; Larson et coll., 2004
; Larson et coll., 2004 ), avec un MMSE<17 (Larson et coll., 2004
), avec un MMSE<17 (Larson et coll., 2004 ; Tschanz et coll., 2004
; Tschanz et coll., 2004 ; Ganguli et coll., 2005
; Ganguli et coll., 2005 ).
).
 ; Jagger et coll., 2000
; Jagger et coll., 2000 ; Helmer et coll., 2001
; Helmer et coll., 2001 ; Keene et coll., 2001
; Keene et coll., 2001 ; Lapane et coll., 2001
; Lapane et coll., 2001 ; Wolfson et coll., 2001
; Wolfson et coll., 2001 ; Larson et coll., 2004
; Larson et coll., 2004 ), avec un MMSE<17 (Larson et coll., 2004
), avec un MMSE<17 (Larson et coll., 2004 ; Tschanz et coll., 2004
; Tschanz et coll., 2004 ; Ganguli et coll., 2005
; Ganguli et coll., 2005 ).
). D'autres facteurs ont été rapportés comme des facteurs de risque indépendants de la mortalité : la dépendance pour les activités de la vie quotidienne (Gambassi et coll., 1999a ; Melzer et coll., 1999
; Melzer et coll., 1999 ; Ganguli et coll., 2005
; Ganguli et coll., 2005 ), la dénutrition (Boersma et coll., 1999
), la dénutrition (Boersma et coll., 1999 ; Gambassi et coll., 1999a
; Gambassi et coll., 1999a ; Keene et coll., 2001
; Keene et coll., 2001 ) et les escarres (Gambassi et coll., 1999a
) et les escarres (Gambassi et coll., 1999a ), les comorbidités (Van Dijk et coll., 1996
), les comorbidités (Van Dijk et coll., 1996 ; Baldereschi et coll., 1999
; Baldereschi et coll., 1999 ), notamment l'insuffisance cardiaque, les coronaropathies, le diabète (Larson et coll., 2004
), notamment l'insuffisance cardiaque, les coronaropathies, le diabète (Larson et coll., 2004 ), mais aussi l'aphasie (Boersma et coll., 1999
), mais aussi l'aphasie (Boersma et coll., 1999 ), les fluences verbales basses (Cosentino et coll., 2006
), les fluences verbales basses (Cosentino et coll., 2006 ), les troubles de la marche et les chutes (Larson et coll., 2004
), les troubles de la marche et les chutes (Larson et coll., 2004 ). La présence d'une pathologie cérébro-vasculaire, d'un alcoolisme, d'un syndrome dépressif au moment du diagnostic de maladie d'Alzheimer est statistiquement liée à un décès plus rapide (Lopez et coll., 2000a
). La présence d'une pathologie cérébro-vasculaire, d'un alcoolisme, d'un syndrome dépressif au moment du diagnostic de maladie d'Alzheimer est statistiquement liée à un décès plus rapide (Lopez et coll., 2000a et b
et b ). Si l'on exclut les patients dont les symptômes parkinsoniens précédaient la démence ou ayant reçu des traitements susceptibles d'en provoquer, les signes parkinsoniens sont associés à une survie plus courte (Mitchell et Rockwood, 2000
). Si l'on exclut les patients dont les symptômes parkinsoniens précédaient la démence ou ayant reçu des traitements susceptibles d'en provoquer, les signes parkinsoniens sont associés à une survie plus courte (Mitchell et Rockwood, 2000 ), peut-être en rapport avec des lésions associées du tronc cérébral. Un tabagisme actif et important est également associé à une survie plus courte (Sabbagh et coll., 2005
), peut-être en rapport avec des lésions associées du tronc cérébral. Un tabagisme actif et important est également associé à une survie plus courte (Sabbagh et coll., 2005 ).
).
 ; Melzer et coll., 1999
; Melzer et coll., 1999 ; Ganguli et coll., 2005
; Ganguli et coll., 2005 ), la dénutrition (Boersma et coll., 1999
), la dénutrition (Boersma et coll., 1999 ; Gambassi et coll., 1999a
; Gambassi et coll., 1999a ; Keene et coll., 2001
; Keene et coll., 2001 ) et les escarres (Gambassi et coll., 1999a
) et les escarres (Gambassi et coll., 1999a ), les comorbidités (Van Dijk et coll., 1996
), les comorbidités (Van Dijk et coll., 1996 ; Baldereschi et coll., 1999
; Baldereschi et coll., 1999 ), notamment l'insuffisance cardiaque, les coronaropathies, le diabète (Larson et coll., 2004
), notamment l'insuffisance cardiaque, les coronaropathies, le diabète (Larson et coll., 2004 ), mais aussi l'aphasie (Boersma et coll., 1999
), mais aussi l'aphasie (Boersma et coll., 1999 ), les fluences verbales basses (Cosentino et coll., 2006
), les fluences verbales basses (Cosentino et coll., 2006 ), les troubles de la marche et les chutes (Larson et coll., 2004
), les troubles de la marche et les chutes (Larson et coll., 2004 ). La présence d'une pathologie cérébro-vasculaire, d'un alcoolisme, d'un syndrome dépressif au moment du diagnostic de maladie d'Alzheimer est statistiquement liée à un décès plus rapide (Lopez et coll., 2000a
). La présence d'une pathologie cérébro-vasculaire, d'un alcoolisme, d'un syndrome dépressif au moment du diagnostic de maladie d'Alzheimer est statistiquement liée à un décès plus rapide (Lopez et coll., 2000a et b
et b ). Si l'on exclut les patients dont les symptômes parkinsoniens précédaient la démence ou ayant reçu des traitements susceptibles d'en provoquer, les signes parkinsoniens sont associés à une survie plus courte (Mitchell et Rockwood, 2000
). Si l'on exclut les patients dont les symptômes parkinsoniens précédaient la démence ou ayant reçu des traitements susceptibles d'en provoquer, les signes parkinsoniens sont associés à une survie plus courte (Mitchell et Rockwood, 2000 ), peut-être en rapport avec des lésions associées du tronc cérébral. Un tabagisme actif et important est également associé à une survie plus courte (Sabbagh et coll., 2005
), peut-être en rapport avec des lésions associées du tronc cérébral. Un tabagisme actif et important est également associé à une survie plus courte (Sabbagh et coll., 2005 ).
).La durée de survie augmente avec le temps : elle est plus longue dans les années 1990 que dans les années 1960 (Beard, 1994 ), ce qui est probablement dû à de meilleurs soins, même si les patients déments restent moins bien soignés que les autres (Moroney et coll., 1999
), ce qui est probablement dû à de meilleurs soins, même si les patients déments restent moins bien soignés que les autres (Moroney et coll., 1999 ).
).
 ), ce qui est probablement dû à de meilleurs soins, même si les patients déments restent moins bien soignés que les autres (Moroney et coll., 1999
), ce qui est probablement dû à de meilleurs soins, même si les patients déments restent moins bien soignés que les autres (Moroney et coll., 1999 ).
). Les causes de décès des patients atteints de maladie d'Alzheimer sont principalement les pneumopathies, les pathologies cardiovasculaires dont les embolies pulmonaires, les accidents vasculaires cérébraux (Kukull et coll., 1994 ; Beard et coll., 1996
; Beard et coll., 1996 ; Thomas et coll., 1997
; Thomas et coll., 1997 ; Ostbye et coll., 1999
; Ostbye et coll., 1999 ; Keene et coll., 2001
; Keene et coll., 2001 ; Ganguli et coll., 2005
; Ganguli et coll., 2005 ). Le risque de décès par accident vasculaire cérébral est multiplié par 3,7 en cas de maladie d'Alzheimer (Groupe d'Étude Paquid, 1997
). Le risque de décès par accident vasculaire cérébral est multiplié par 3,7 en cas de maladie d'Alzheimer (Groupe d'Étude Paquid, 1997 ).
).
 ; Beard et coll., 1996
; Beard et coll., 1996 ; Thomas et coll., 1997
; Thomas et coll., 1997 ; Ostbye et coll., 1999
; Ostbye et coll., 1999 ; Keene et coll., 2001
; Keene et coll., 2001 ; Ganguli et coll., 2005
; Ganguli et coll., 2005 ). Le risque de décès par accident vasculaire cérébral est multiplié par 3,7 en cas de maladie d'Alzheimer (Groupe d'Étude Paquid, 1997
). Le risque de décès par accident vasculaire cérébral est multiplié par 3,7 en cas de maladie d'Alzheimer (Groupe d'Étude Paquid, 1997 ).
). Dans une étude reprenant les causes de décès confirmées par autopsie chez 91 patients déments dont 81 % avec une maladie d'Alzheimer, il a été noté que durant la période précédant le décès, 35 % des patients étaient confinés au lit ou au fauteuil, 58 % étaient hypophagiques et 73 % présentaient une incontinence urinaire ou fécale. Trois-quarts de ces patients avaient été institutionnalisés en moyenne 18 mois avant le décès (Keene et coll., 2001 ). Les troubles de la déglutition et l'altération du statut nutritionnel sont probablement des facteurs favorisants (van der Steen et coll., 2003
). Les troubles de la déglutition et l'altération du statut nutritionnel sont probablement des facteurs favorisants (van der Steen et coll., 2003 ).
).
 ). Les troubles de la déglutition et l'altération du statut nutritionnel sont probablement des facteurs favorisants (van der Steen et coll., 2003
). Les troubles de la déglutition et l'altération du statut nutritionnel sont probablement des facteurs favorisants (van der Steen et coll., 2003 ).
).L'hospitalisation pour un épisode médical aigu est liée à un déclin progressif et un taux de mortalité élevé à un an chez les patients âgés. Cependant, l'âge et la démence ne sont pas des facteurs indépendants de mortalité après ajustement sur les facteurs indépendants identifiés par régression logistique (genre masculin, perte d'autonomie, insuffisance cardiaque, cancer, insuffisance rénale et hypoalbuminémie) (Walter et coll., 2001 ). L'alimentation par sonde gastrique n'est pas associée à une survie plus longue (Meier et coll., 2001
). L'alimentation par sonde gastrique n'est pas associée à une survie plus longue (Meier et coll., 2001 ).
).
 ). L'alimentation par sonde gastrique n'est pas associée à une survie plus longue (Meier et coll., 2001
). L'alimentation par sonde gastrique n'est pas associée à une survie plus longue (Meier et coll., 2001 ).
).Entrée en institution
Les patients ayant une maladie d'Alzheimer prévalente ou incidente ont plus de risque de vivre en institution à l'inclusion dans l'étude, ou d'y entrer pendant le suivi, que les patients sans démence (Jagger et coll., 2000 ). Cette observation est restée stable, aux États-Unis pendant la période 1993-2000 (Banaszak-Holl et coll., 2004
). Cette observation est restée stable, aux États-Unis pendant la période 1993-2000 (Banaszak-Holl et coll., 2004 ). Le risque d'entrée en institution est lié au déclin du score au MMSE (Hauber et coll., 2000
). Le risque d'entrée en institution est lié au déclin du score au MMSE (Hauber et coll., 2000 ), parfois à l'âge, au niveau d'éducation, au statut marital (Hauber et coll., 2000
), parfois à l'âge, au niveau d'éducation, au statut marital (Hauber et coll., 2000 ), mais pas dans l'étude de Knopman et coll. (1999
), mais pas dans l'étude de Knopman et coll. (1999 ). Il apparaît que le risque d'institutionnalisation est peu lié au genre (Knopman et coll., 1999
). Il apparaît que le risque d'institutionnalisation est peu lié au genre (Knopman et coll., 1999 ; Hauber et coll., 2000
; Hauber et coll., 2000 ). Une étude prospective réalisée à Toulouse sur 585 patients a montré que le score de Zarit (témoignant du fardeau de l'aidant) et le mode de vie (à domicile avec un membre de la famille autre qu'un époux, ou seul) étaient les deux facteurs indépendants d'entrée en institution à 1 an (Soto et coll., 2006
). Une étude prospective réalisée à Toulouse sur 585 patients a montré que le score de Zarit (témoignant du fardeau de l'aidant) et le mode de vie (à domicile avec un membre de la famille autre qu'un époux, ou seul) étaient les deux facteurs indépendants d'entrée en institution à 1 an (Soto et coll., 2006 ). Le MMSE<16 n'était pas un facteur de risque indépendant. Une étude australienne a montré que dans les 5 ans qui suivent le diagnostic de démence, 76 % des patients étaient institutionnalisés et 42 % décédés (Banerjee et coll., 2003
). Le MMSE<16 n'était pas un facteur de risque indépendant. Une étude australienne a montré que dans les 5 ans qui suivent le diagnostic de démence, 76 % des patients étaient institutionnalisés et 42 % décédés (Banerjee et coll., 2003 ). L'information et le soutien des proches diminuaient sensiblement ces chiffres. Le fait que l'aidant vivant avec le patient ait une bonne évaluation de sa qualité de vie et un faible score à l'estimation de son « fardeau » est inversement associé à l'entrée en institution, soulignant l'intérêt des interventions directement en faveur de l'aidant (Banerjee et coll., 2003
). L'information et le soutien des proches diminuaient sensiblement ces chiffres. Le fait que l'aidant vivant avec le patient ait une bonne évaluation de sa qualité de vie et un faible score à l'estimation de son « fardeau » est inversement associé à l'entrée en institution, soulignant l'intérêt des interventions directement en faveur de l'aidant (Banerjee et coll., 2003 ). Les patients dont les aidants sont des époux sont moins à risque d'entrer en institution que les autres (Pot et coll., 2001
). Les patients dont les aidants sont des époux sont moins à risque d'entrer en institution que les autres (Pot et coll., 2001 ). Une étude réalisée aux États-Unis chez des patients ayant participé à un essai thérapeutique a montré que 33 % des patients, au stade modéré (MMSE moyen 12,6) à l'entrée dans l'étude et à 5 ans d'évolution de la maladie, sont entrés en institution dans les 2 ans, indépendamment de la durée de la maladie et du fait que l'aidant co-habite avec le patient (Knopman et coll., 1999
). Une étude réalisée aux États-Unis chez des patients ayant participé à un essai thérapeutique a montré que 33 % des patients, au stade modéré (MMSE moyen 12,6) à l'entrée dans l'étude et à 5 ans d'évolution de la maladie, sont entrés en institution dans les 2 ans, indépendamment de la durée de la maladie et du fait que l'aidant co-habite avec le patient (Knopman et coll., 1999 ). La perte de l'autonomie et les troubles du comportement étaient des facteurs robustes associés à l'institutionnalisation. La participation à des protocoles d'essais thérapeutiques réduit le risque d'institutionnalisation et l'une des explications serait le soutien des familles à cette occasion (Albert et coll., 1997
). La perte de l'autonomie et les troubles du comportement étaient des facteurs robustes associés à l'institutionnalisation. La participation à des protocoles d'essais thérapeutiques réduit le risque d'institutionnalisation et l'une des explications serait le soutien des familles à cette occasion (Albert et coll., 1997 ). La psychopathologie des aidants n'est pas un facteur de risque d'entrée en institution, ce qui pose question, compte tenu des conséquences de la maladie sur eux-mêmes (Pot et coll., 2001
). La psychopathologie des aidants n'est pas un facteur de risque d'entrée en institution, ce qui pose question, compte tenu des conséquences de la maladie sur eux-mêmes (Pot et coll., 2001 ). Concernant les délais d'institutionnalisation, les études sont difficilement comparables entre elles car le changement de lieu de vie dépend de nombreux facteurs indépendants de la démence elle-même, comme les politiques de santé et la prise en charge sociale variables selon les pays, ou encore la présence d'autres comorbidités. L'étude du CERAD a observé une médiane de délai d'institutionnalisation de 3,1 ans après le début de l'étude chez des sujets présentant une maladie d'Alzheimer modérée (médiane du MMSE : 19). La médiane de survie après l'admission en maison de retraite était de 2,1 ans pour les hommes et de 4,5 ans pour les femmes (Heyman et coll., 1997
). Concernant les délais d'institutionnalisation, les études sont difficilement comparables entre elles car le changement de lieu de vie dépend de nombreux facteurs indépendants de la démence elle-même, comme les politiques de santé et la prise en charge sociale variables selon les pays, ou encore la présence d'autres comorbidités. L'étude du CERAD a observé une médiane de délai d'institutionnalisation de 3,1 ans après le début de l'étude chez des sujets présentant une maladie d'Alzheimer modérée (médiane du MMSE : 19). La médiane de survie après l'admission en maison de retraite était de 2,1 ans pour les hommes et de 4,5 ans pour les femmes (Heyman et coll., 1997 ). L'étude européenne des patients déments de plus de 65 ans montre une médiane de 3,25 ans pour l'institutionnalisation à partir du début du suivi (Jagger et coll., 2000
). L'étude européenne des patients déments de plus de 65 ans montre une médiane de 3,25 ans pour l'institutionnalisation à partir du début du suivi (Jagger et coll., 2000 ). Ce travail confirme en outre que la survenue de démence est un facteur de risque significatif d'entrée en maison de retraite.
). Ce travail confirme en outre que la survenue de démence est un facteur de risque significatif d'entrée en maison de retraite.
 ). Cette observation est restée stable, aux États-Unis pendant la période 1993-2000 (Banaszak-Holl et coll., 2004
). Cette observation est restée stable, aux États-Unis pendant la période 1993-2000 (Banaszak-Holl et coll., 2004 ). Le risque d'entrée en institution est lié au déclin du score au MMSE (Hauber et coll., 2000
). Le risque d'entrée en institution est lié au déclin du score au MMSE (Hauber et coll., 2000 ), parfois à l'âge, au niveau d'éducation, au statut marital (Hauber et coll., 2000
), parfois à l'âge, au niveau d'éducation, au statut marital (Hauber et coll., 2000 ), mais pas dans l'étude de Knopman et coll. (1999
), mais pas dans l'étude de Knopman et coll. (1999 ). Il apparaît que le risque d'institutionnalisation est peu lié au genre (Knopman et coll., 1999
). Il apparaît que le risque d'institutionnalisation est peu lié au genre (Knopman et coll., 1999 ; Hauber et coll., 2000
; Hauber et coll., 2000 ). Une étude prospective réalisée à Toulouse sur 585 patients a montré que le score de Zarit (témoignant du fardeau de l'aidant) et le mode de vie (à domicile avec un membre de la famille autre qu'un époux, ou seul) étaient les deux facteurs indépendants d'entrée en institution à 1 an (Soto et coll., 2006
). Une étude prospective réalisée à Toulouse sur 585 patients a montré que le score de Zarit (témoignant du fardeau de l'aidant) et le mode de vie (à domicile avec un membre de la famille autre qu'un époux, ou seul) étaient les deux facteurs indépendants d'entrée en institution à 1 an (Soto et coll., 2006 ). Le MMSE<16 n'était pas un facteur de risque indépendant. Une étude australienne a montré que dans les 5 ans qui suivent le diagnostic de démence, 76 % des patients étaient institutionnalisés et 42 % décédés (Banerjee et coll., 2003
). Le MMSE<16 n'était pas un facteur de risque indépendant. Une étude australienne a montré que dans les 5 ans qui suivent le diagnostic de démence, 76 % des patients étaient institutionnalisés et 42 % décédés (Banerjee et coll., 2003 ). L'information et le soutien des proches diminuaient sensiblement ces chiffres. Le fait que l'aidant vivant avec le patient ait une bonne évaluation de sa qualité de vie et un faible score à l'estimation de son « fardeau » est inversement associé à l'entrée en institution, soulignant l'intérêt des interventions directement en faveur de l'aidant (Banerjee et coll., 2003
). L'information et le soutien des proches diminuaient sensiblement ces chiffres. Le fait que l'aidant vivant avec le patient ait une bonne évaluation de sa qualité de vie et un faible score à l'estimation de son « fardeau » est inversement associé à l'entrée en institution, soulignant l'intérêt des interventions directement en faveur de l'aidant (Banerjee et coll., 2003 ). Les patients dont les aidants sont des époux sont moins à risque d'entrer en institution que les autres (Pot et coll., 2001
). Les patients dont les aidants sont des époux sont moins à risque d'entrer en institution que les autres (Pot et coll., 2001 ). Une étude réalisée aux États-Unis chez des patients ayant participé à un essai thérapeutique a montré que 33 % des patients, au stade modéré (MMSE moyen 12,6) à l'entrée dans l'étude et à 5 ans d'évolution de la maladie, sont entrés en institution dans les 2 ans, indépendamment de la durée de la maladie et du fait que l'aidant co-habite avec le patient (Knopman et coll., 1999
). Une étude réalisée aux États-Unis chez des patients ayant participé à un essai thérapeutique a montré que 33 % des patients, au stade modéré (MMSE moyen 12,6) à l'entrée dans l'étude et à 5 ans d'évolution de la maladie, sont entrés en institution dans les 2 ans, indépendamment de la durée de la maladie et du fait que l'aidant co-habite avec le patient (Knopman et coll., 1999 ). La perte de l'autonomie et les troubles du comportement étaient des facteurs robustes associés à l'institutionnalisation. La participation à des protocoles d'essais thérapeutiques réduit le risque d'institutionnalisation et l'une des explications serait le soutien des familles à cette occasion (Albert et coll., 1997
). La perte de l'autonomie et les troubles du comportement étaient des facteurs robustes associés à l'institutionnalisation. La participation à des protocoles d'essais thérapeutiques réduit le risque d'institutionnalisation et l'une des explications serait le soutien des familles à cette occasion (Albert et coll., 1997 ). La psychopathologie des aidants n'est pas un facteur de risque d'entrée en institution, ce qui pose question, compte tenu des conséquences de la maladie sur eux-mêmes (Pot et coll., 2001
). La psychopathologie des aidants n'est pas un facteur de risque d'entrée en institution, ce qui pose question, compte tenu des conséquences de la maladie sur eux-mêmes (Pot et coll., 2001 ). Concernant les délais d'institutionnalisation, les études sont difficilement comparables entre elles car le changement de lieu de vie dépend de nombreux facteurs indépendants de la démence elle-même, comme les politiques de santé et la prise en charge sociale variables selon les pays, ou encore la présence d'autres comorbidités. L'étude du CERAD a observé une médiane de délai d'institutionnalisation de 3,1 ans après le début de l'étude chez des sujets présentant une maladie d'Alzheimer modérée (médiane du MMSE : 19). La médiane de survie après l'admission en maison de retraite était de 2,1 ans pour les hommes et de 4,5 ans pour les femmes (Heyman et coll., 1997
). Concernant les délais d'institutionnalisation, les études sont difficilement comparables entre elles car le changement de lieu de vie dépend de nombreux facteurs indépendants de la démence elle-même, comme les politiques de santé et la prise en charge sociale variables selon les pays, ou encore la présence d'autres comorbidités. L'étude du CERAD a observé une médiane de délai d'institutionnalisation de 3,1 ans après le début de l'étude chez des sujets présentant une maladie d'Alzheimer modérée (médiane du MMSE : 19). La médiane de survie après l'admission en maison de retraite était de 2,1 ans pour les hommes et de 4,5 ans pour les femmes (Heyman et coll., 1997 ). L'étude européenne des patients déments de plus de 65 ans montre une médiane de 3,25 ans pour l'institutionnalisation à partir du début du suivi (Jagger et coll., 2000
). L'étude européenne des patients déments de plus de 65 ans montre une médiane de 3,25 ans pour l'institutionnalisation à partir du début du suivi (Jagger et coll., 2000 ). Ce travail confirme en outre que la survenue de démence est un facteur de risque significatif d'entrée en maison de retraite.
). Ce travail confirme en outre que la survenue de démence est un facteur de risque significatif d'entrée en maison de retraite. Les troubles de comportement, notamment l'agitation, sont associés à l'institutionnalisation (Hope et coll., 1998 ). Depuis longtemps, les facteurs de mortalité et de mise en institution connus sont l'âge, la nature non-Alzheimer de la démence et les troubles psychologiques de l'entourage (Brodaty et coll., 1993
). Depuis longtemps, les facteurs de mortalité et de mise en institution connus sont l'âge, la nature non-Alzheimer de la démence et les troubles psychologiques de l'entourage (Brodaty et coll., 1993 ). La maladie d'Alzheimer frappe non seulement un individu mais aussi sa famille, et le soutien et l'information des proches font partie intégrante de la prise en charge des patients.
). La maladie d'Alzheimer frappe non seulement un individu mais aussi sa famille, et le soutien et l'information des proches font partie intégrante de la prise en charge des patients.
 ). Depuis longtemps, les facteurs de mortalité et de mise en institution connus sont l'âge, la nature non-Alzheimer de la démence et les troubles psychologiques de l'entourage (Brodaty et coll., 1993
). Depuis longtemps, les facteurs de mortalité et de mise en institution connus sont l'âge, la nature non-Alzheimer de la démence et les troubles psychologiques de l'entourage (Brodaty et coll., 1993 ). La maladie d'Alzheimer frappe non seulement un individu mais aussi sa famille, et le soutien et l'information des proches font partie intégrante de la prise en charge des patients.
). La maladie d'Alzheimer frappe non seulement un individu mais aussi sa famille, et le soutien et l'information des proches font partie intégrante de la prise en charge des patients.Chez les patients à un stade de démence avancé, la mortalité à 6 mois après l'entrée en institution varie de 28 à 35 % et le risque peut être prédit par une échelle médicale et fonctionnelle composite (Mitchell et coll., 2004 ). Plus les patients entrent tard en institution, moins l'institutionnalisation raccourcit la survie (McClendon et coll., 2006
). Plus les patients entrent tard en institution, moins l'institutionnalisation raccourcit la survie (McClendon et coll., 2006 ). La comorbidité diminue de moitié la survie (Van Dijk et coll., 1996
). La comorbidité diminue de moitié la survie (Van Dijk et coll., 1996 ).
).
 ). Plus les patients entrent tard en institution, moins l'institutionnalisation raccourcit la survie (McClendon et coll., 2006
). Plus les patients entrent tard en institution, moins l'institutionnalisation raccourcit la survie (McClendon et coll., 2006 ). La comorbidité diminue de moitié la survie (Van Dijk et coll., 1996
). La comorbidité diminue de moitié la survie (Van Dijk et coll., 1996 ).
).En conclusion,
l'évolution clinique de la maladie d'Alzheimer traduit toute la complexité du problème de la prise en charge de la maladie et des malades, nécessairement médicale (sanitaire) mais aussi sociale. La dépendance est au cœ ur de la maladie, jusque dans sa définition, mais elle évolue sur de nombreux mois et années, parallèlement à l'évolution cognitive, aux troubles du comportement, à la situation sociale, familiale, financière, juridique, psychologique du sujet.
La maladie d'Alzheimer est un tout qu'il faut savoir appréhender dans sa globalité. Passé la période difficile du diagnostic, ce n'est probablement pas une maladie si difficile à vivre pourvu que des soins appropriés et les conditions d'un soutien adapté du malade et de sa famille soient réunis. Il est indispensable que la phase initiale ou de début de la maladie soit mieux connue du grand public, autant que la phase de dépendance lourde qui en stigmatise l'image actuelle dans l'opinion publique, surtout si on veut développer la prévention tertiaire, c'est-à-dire repousser le stade sévère de la maladie à un âge où ce stade sera nécessairement très court voire absent.
Bibliographie
[1] adak s, illouz k, gorman w, tandon r, zimmerman ea. Predicting the rate of cognitive decline in aging and early Alzheimer disease.
Neurology. 2004;
63:108- 114

[2] aevarsson o, skoog i. A longitudinal population study of the Mini-Mental State Examination in the very old: relation to dementia and education.
Dement Geriatr Cogn Disord. 2000;
11:166- 175

[3] aevarsson o, svanborg a, skoog i. Seven-year survival rate after age 85 years. Relation to Alzheimer disease and vascular dementia.
Arch Neurol. 1998;
55:1226- 1232

[4]agence nationale d’accréditation et d’evaluation en santé (anaes). Recommandations pratiques pour le diagnostic de la maladie d’Alzheimer.
2000;
http://www.anaes.fr. 

[5] agüero-torres h, fratiglioni l, guo z, viitanen m, winblad b. Prognostic factors in very old demented adults: a seven-year follow-up from a population-based survey in Stockholm.
J Am Geriatr Soc. 1998a;
46:444- 452

[6] agüero-torres h, fratiglioni l, guo z, viitanen m, von strauss e, winblad b. Dementia is the major cause of functional dependence in the elderly: 3-year follow-up data from a population-based study.
Am J Public Health. 1998b;
88:1452- 1456

[7] aisen ps, davis kl, berg jd, schafer k, campbell k. A randomized controlled trial of prednisone in Alzheimer’s disease. Alzheimer’s Disease Cooperative Study.
Neurology. 2000;
54:588- 593

[8] albert sm, sano m, marder k, jacobs dm, brandt j. Participation in clinical trials and long-term outcomes in Alzheimer’s disease.
Neurology. 1997;
49:38- 43

[9] almkvist o, bäckman l. Progression in Alzheimer’s disease : sequencing of neuropsychological decline.
Int J Geriatr Psychiatr. 1993;
8:755- 763

[10]american psychiatric association. Diagnostic and statistical manual of mental disorders (4th edition).
American Psychiatric Association;
1994.


[11] andersen ck, wittrup-jensen ku, lolk a, andersen k, kragh-sorensen p. Ability to perform activities of daily living is the main factor affecting quality of life in patients with dementia.
Health Qual Life Outcomes. 2004;
2:52

[12] artero s, touchon j, ritchie k. Disability and mild cognitive impairment: a longitudinal population-based study.
Int J Geriatr Psychiatry. 2001;
16:1092- 1097

[13] atchison tb, bradshaw m, massman pj. Investigation of profile difference between Alzheimer’s disease patients declining at different rates: examination of baseline neuropsychological data.
Arch Clin Neuropsychol. 2004;
19:1007- 1015

[15] baldereschi m, di carlo a, maggi s, grigoletto f, scarlato g. Dementia is a major predictor of death among the Italian elderly.
Neurology. 1999;
52:709- 713

[16] banaszak-holl j, fendrick am, foster nl, herzog ar, kabeto mu. Predicting nursing home admission: estimates form a 7-year follow-up of a nationally representative sample of older Americans.
Alzheimer Dis Assoc Disord. 2004;
18:83- 89

[17] banerjee s, murray j, foley b, atkins l, schneider j. Predictors of institutionalisation in people with dementia.
J Neurol Neurosurg Psychiatry. 2003;
74:1315- 1316

[18] barberger-gateau p, fabrigoule c, rouch i, letenneur l, dartigues jf. Neuropsychological correlates of self-reported performance in instrumental activities of daily living and prediction of dementia.
J Gerontol B Psychol Sci Soc Sci. 1999;
54:P293- P303

[19] bassuk ss, wypij d, berkman lf. Cognitive impairment and mortality in the community-dwelling elderly.
Am J Epidemiol. 2000;
151:676- 688

[20] beard cm. Are patients with Alzheimer’s disease surviving longer in recent years?.
Neurology. 1994;
44:1869- 1871

[21] beard cm, kokmen e, sigler c, smith ge, petterson t. Cause of death in Alzheimer’s disease.
Ann Epidemiol. 1996;
6:195- 200

[22] behl p, stefurak tl, black se. Progress in clinical neurosciences: cognitive markers of progression in Alzheimer’s disease;.
Can J Neurol Sci. 2005;
32:140- 151

[23] bellew km, pigeon jg, stang pe, fleischman w, gardner rm. Hypertension and the rate of cognitive decline in patients with dementia of the Alzheimer type.
Alzheimer Dis Assoc Disord. 2004;
18:208- 213

[24] bhargava d, weiner mf, hynan ls, diaz-arrastia r, lipton am. Vascular disease and risk factors, rate of progression, and survival in Alzheimer’s disease.
J Geriatr Psychiatr Neurol. 2006;
19:78- 82

[25] blasi s, brubacher d, zehnder ae, monsch au, berres m, spiegel r. Assessment of everyday behavior in Alzheimer’s disease patients: its significance for diagnostics and prediction of disease progression.
Am J Alzheimers Dis Other Demen. 2005;
20:151- 158

[26] boersma f, van den brink w, deeg djh, eefsting ja, van tilburg w. Survival in a population-based cohort of dementia patients: predictors and causes of mortality.
Int J Geriatr Psychiatr. 1999;
14:748- 753

[27] bowler jv, munoz dg, merskey h, hachinski v. Factors affecting the age of onset and rate of progression of Alzheimer’s disease.
J Neurol Neurosurg Psychiatry. 1998;
65:184- 190

[28] bracco l, gallato r, grigoletto f, lippi a, lepore v. Factors affecting course and survival in Alzheimer’s disease. A 9-year longitudinal study.
Arch Neurol. 1994;
51:1213- 1219

[29] brickman am, riba a, bell k, marder k, albert m. Longitudinal assessment of patient dependence in Alzheimer disease.
Arch Neurol. 2002;
59:1304- 1308

[30] brodaty h, mcgilchrist c, harris l, peters ke. Time until institutionalization and death in patients with dementia.
Arch Neurol. 1993;
50:643- 650

[31] brookmeyer r, vcorrada mm, curriero fc, kawas c. Survival following a diagnosis of Alzheimer disease.
Arch Neurol. 2002;
59:1764- 1767

[32] brooks jor, kraemer hc, tanke ed, yesavage ja. The methodology of studying decline in Alzheimer’s disease.
J Am Geriatr Soc. 1993;
41:623- 628

[33] burns a, jacoby r, levy r. Progression of cognitive impairment in Alzheimer’s disease.
J Am Geriatr Soc. 1991;
39:39- 45

[34] butters ma, lopez ol, becker jt. Focal temporal lobe dysfunction in probable Alzheimer’s diseae predicts a slow rate of cognitive decline.
Neurology. 1996;
46:687- 692

[35] byrne lm, wilson pm, bucks rs, hughes ao, wilcock gk. The sensitivity to change over time of the Bristol Activities of Daily Living Scale in Alzheimer’s disease.
Int J Geriatr Psychiatry. 2000;
15:656- 661

[36] camicioli r, kryscio r. Nature throws curveballs: APOE and nonlinear decline in Alzheimer disease.
Neurology. 2005;
65:1855- 1856

[37] capitani e, cazzaniga r, francescani a, spinnler h. Cognitive deterioration in Alzheimer’s disease: is the early course predictive of the later stages?.
Neurological Sciences. 2004;
25:198- 204

[38] caro j, ward a, ishak k, migliaccio-walle k, getsios d. To what degree does cognitive impairment in Alzheimer’s disease predict dependence of patients on caregivers?.
BMC Neurol. 2002;
2:6

[39] chui hc, lyness sa, sobel e, schneider ls. Extrapyramidal signs and psychiatric symptoms predict faster cognitive decline in Alzheimer’s disease.
Arch Neurol. 1994;
51:676- 681

[40] clark cm, sheppard l, fillenbaum gg, galasko d, morris jc. Variability in annual Mini-Mental State Examination score in patients with probable Alzheimer disease.
Arch Neurol. 1999;
56:857- 862

[41] cortes f, gillette-guyonnet s, nourhashemi f, christelle c, vellas b. Family history of dementia does not influence the progression of Alzheimer’ disease at two years: results fromt eh REAL.FR Study.
Am J Alzheimers Dis Other Demen. 2006;
21:131- 136

[42] cosentino s, scarmeas n, albert sm, stern y. Verbal fluency predicts mortality in Alzheimer disease.
Cogn Behav Neurol. 2006;
19:123- 129

[43] crockett d, tuokko h, koch w, parks r. The assessment of everyday functioning using the Present Functionning Questionnaire and the Functional rating Scale in elderly samples.
Clin Gerontol. 1989;
8:3- 25

[44] de leeuw fe, korf es, barkhof f, scheltens p. White matter lesions are associated with progression of medial temporal lobe atrophy in Alzheimer disease.
Stroke. 2006;
37:2248- 2252

[45] dejong r, osterlund ow, roy gw. Measurement of quality-of-life changes in patients with Alzheimer’s disease.
Clin Ther. 1989;
11:545- 554

[46] derouesne c, thibault s, lozeron p, baudouin-madec v, piquard a, lacomblez l. Perturbations of activities of daily living in Alzheimer’s disease. A study of 172 patients with the using a questionnaire completed by caregivers.
Rev Neurol. 2002;
158:684- 700

[47] doody rs, massman p, dunn jk. A method for estimating progression rates in Alzheimer disease.
Arch Neurol. 2001;
58:449- 454

[48] drachman da, o’donnell bf, lew ra, swearer jm. The prognosis in Alzheimer’s disease. ’How far’ rather than ’How fast’ best predicts the course.
Arch Neurol. 1990;
47:851- 856

[49] earnst ks, marson dc, harrell le. Cognitive models of physicians’ legal standard and personal judgments of competency in patients with Alzheimer’s disease.
J Am Geriatr Soc. 2000;
48:919- 927

[50] faber-langendoen k, morris jc, knesevich jw, labarge e, miller jp. Aphasia in senile dementia of the Alzheimer type.
Ann Neurol. 1988;
23:365- 370

[51] feldman h, schulzer m, wang s, tuokko h, beatie bl. The Functional Rating Scale in AD assessment: a longitudinal Study.
In: iqbal k, mortimer ja, winblad b, wisniewski hm, editors.
Research advances in Alzheimer’s disease and related disorders..
Paris:;
1995.
p. -


[52] feldman h, sauter a, donald a, gelinas i, gauthier s. The disability assessment for dementia scale: a 12-month study of functional ability in mild to moderate severity Alzheimer disease.
Alzheimer Dis Assoc Disord. 2001;
15:89- 95

[53] feldman hh, van baelen b, kavanagh sm, torfs ke. Cognition, function, and caregiving time patterns in patients with mild-to-moderate Alzheimer disease: a 12-month analysis.
Alzheimer Dis Assoc Disord. 2005;
19:29- 36

[54] fitzpatrick al, kuller lh, lopez ol, kawas ch, jagust w. Survival following dementia onset: Alzheimer’s disease and vascular dementia.
J Neurol Sci. 2005;
229:43- 49

[55] freels s, cohen d, eisdorfer c, paveza g, gorelick p. Functional status and clinical findings in patients with Alzheimer’s disease.
J Gerontol. 1992;
47:M177- M182

[56] fritsch t, mcclendon mj, smyth ka, lerner aj, chen ch. Effects of educational attainment on the clinical expression of Alzheimer’s disease: results from a research registry.
Am J Alzheimers Dis Other Demen. 2001;
16:369- 376

[57] galasko d, corey-bloom j, thal lj. Monitoring progression in Alzheimer’s disease.
J Am Geriatr Soc. 1991;
39:932- 941

[58] galasko d, bennett d, sano m, ernesto c, thomas r. An inventory to assess activities of daily living for clinical trials in Alzheimer’s disease. The Alzheimer’s Disease Cooperative Study.
Alzheimer Dis Assoc Disord. 1997;
11:S33- S39

[59] gambassi g, landi f, lapane kl, sgadari a, mor v, bernabei r. Predictors of mortality in patients with Alzheimer’s disease living in nursing homes.
J Neurol Neurosurg Psychiatry. 1999a;
67:59- 65

[60] gambassi g, laplane kl, landi f, sgadari a, mor v. Gender differences in the relation between comorbidity and mortality of patients with Alzheimer’s disease.
Neurology. 1999b;
53:508- 516

[61] ganguli m, dodge hh, shen c, pandav rs, dekosky st. Alzheimer disease and mortality. A 15-year epidemiological study.
Arch Neurol. 2005;
62:779- 774

[62] gelinas i, gauthier l, mcintyre m, gauthier s. Development of a functional measure for persons with Alzheimer’s disease: the disability assessment for dementia.
Am J Occup Ther. 1999;
53:471- 481

[63] gély-nargeot mc, derouesne c, semès j, groupe opdal . Enquête européenne sur l’établissement du diagnostic de la maladie d’Alzheimer. Etude réalisée à partir du recueil de l’opinion des aidants familiaux.
Psychol Neuropsychiatr Vieil. 2003;
1:45- 56

[64] gill tm, williams cs, richardson ed, tinetti me. Impairments in physical performance and cognitive status as predisposing factors for functional dependence among nondisabled older persons.
J Gerontol A Biol Sci Med Sci. 1996;
51:M283- M288

[65] gill tm, williams cs, richardson ed, berkman lf, tinetti me. A predictive model for ADL dependence in community-living older adults based on a reduced set of cognitive status items.
J Am Geriatr Soc. 1997;
45:441- 445

[66] gould r, abramson i, galasko d, salmon d. Rate of cognitive change in Alzheimer’s disease: methodoligical approaches using random effects models.
J Int Neuropsychol Soc. 2001;
7:813- 824

[67] graves ab, mortimer ja, larson eb, wenzlow a, bowen jd. Head circumference as a measure of cognitive reserve association with severity impairment in Alzheimer’s disease.
Br J Psychiatry. 1996;
169:86- 92

[68] green cr, mohs rc, schmeidler j, aryan m, davis kl. Functional decline in Alzheimer’s disease: a longitudinal study.
J Am Geriatr Soc. 1993;
41:654- 661

[70] han l, cole m, bellavance f, mccusker j, primeau f. Tracking cognitive decline in Alzheimer’s disease using the mini-mental state examination: a meta-analysis.
Int Psychogeriatr. 2000;
12:231- 247

[71] hauber ab, gnanasakthy a, snyder eh, bala mv, richter a. Potential savings in the cost of caring for Alzheimer’s disease. Treatment with rivastigmine.
Pharmacoeconomics. 2000;
17:351- 360

[72] haxby jv, raffaele k, gillette j, schapiro mb, rapoport si. Individual trajectories of cognitive decline in patients with dementia of the Alzheimer type.
J Clin Exp Neuropsychol. 1992;
14:575- 592

[73] heeren tj, van hemert am, rooymans hg. A communicty-based study of survival in dementia.
Acta Psychiat Scand. 1992;
85:415- 418

[74] helmer c, joly p, letenneur l, commenges d, dartigues jf. Mortality with dementia: results from a French prospective community-based cohort.
Am J Epidemiol. 2001;
54:642- 648

[75] helmes e, merskey h, fox h, fry rn, bowler jv. Pattern of deterioration in senile dementia of the Alzheimer type.
Arch Neurol. 1995;
52:306- 310

[76] heyman a, peterson b, fillenbaum g, pieper c. The Consortium to Establish a Registry for Alzheimer’s disease (CERAD). Part XIV: demographic and clinical predictors of survival in patients with Alzheimer’s disease.
Neurology. 1996;
46:656- 660

[77] heyman a, peterson b, fillenbaum g, pieper c. Predictors of time to insitutionalization of patients with Alzheimer’s disease: The CERAD experience, Part XVII.
Neurology. 1997;
48:1304- 1309

[78] holmes c, lovestone s. Long-term cognitive and functional decline in late onset Alzheimer’s disease: therapeutic implications.
Age Ageing. 2003;
32:200- 204

[79] holmes c, ballard c, lehmann d, smith ad, beaumont h. Rate of progression of cognitive decline in Alzheimer’s disease: effect of butyrylcholinesterase K gene variation.
J Neurol Neurosurg Psychiatry. 2005;
76:640- 643

[80] hope t, keene j, gedling k, fairburn cg, jacoby r. Predictors of institutionalization for people with dementia living at home with a carer.
Int J Geriatr Psychiatr. 1998;
13:682- 690

[81] hoyt bd, massman pj, schatschneider c, cooke n, doody rs. Individual growth curve analysis of APOE epsilon 4-associated cognitive decline in Alzheimer disease.
Arch Neurol. 2005;
62:454- 459

[82] huff fj, belle sh, shim yk, ganguli m, boller f. Prevalence and prognostic value of neurologic abnormalities in Alzheimer’s disease.
Dementia. 1990;
1:32- 40

[83] hui js, wilson rs, bennett da, bienias jl, gilley dw. Rate of cognitive decline and mortality in Alzheimer’s disease.
Neurology. 2003;
61:1356- 1361

[84] huthwaite js, martin rc, griffith hr, anderson b, harrell le, marson dc. Declining medical decision-making capacity in mild AD: a two-year longitudinal study.
Behav Sci Law. 2006;
24:453- 463

[85] jagger c, andersen k, breteler mm, copeland jr, helmer c. Prognosis with dementia in Europe: a collaborative study population-based cohorts. Neurologic diseases in the Elderly Research Group.
Neurology. 2000;
54 (11)5:S16- S20

[86] jost bc, grossberg gt. The natural history of Alzheimer’s disease: a brain bank study.
J Am Geriatr Soc. 1995;
43:1248- 1255

[87] karlawish jh, casarett dj, james bd, xie sx, kim sy. The ability of persons with Alzheimer disease (AD) to make a decision about taking an AD treatment.
Neurology. 2005;
64:1514- 1519

[88] katz s, ford ab, moskowitz rw, jackson ba, jaffe mw. Studies of illness in the aged. The index of ADL : a standardized measure of biological and psychological function.
Journal of the American Medical Association. 1963;
185:914- 919

[89] katzman r, brown t, thal lj, fuld pa, aronson m. Comparison of rate of annual change of mental status score in four independent studies of patients with Alzheimer’s disease.
Ann Neurol. 1988;
24:384- 389

[90] kay dw, forster dp, newens aj. Long-term survical, place of death, and death certification in clinically diagnosed pre-senile dementia in northern England. Follow-up after 8-12 years.
Br J Psychiatry. 2000;
177:565- 566

[91] keene j, hope t, fairburn cg, jacoby r. Death and dementia.
Int J Geriatr Psychiatr. 2001;
16:969- 974

[92] kemper p. The use of formal and informal home care by disabled elderly.
Health Serv Res. 1992;
27:421- 451

[93] kleiman t, zdanys k, black b, rightmer t, grey m. Apolipoprotein E epsilon4 allele is unrelated to cognitive or functional decline in Alzheimer’s disease: retrospective and prospective analysis.
Dement Geriatr Cogn Disord. 2006;
22:73- 82

[94] knopman ds, berg jd, thomas r, grundman m, thal lj. Nursing home placement is related ot dementia progression: experience from a clinical trial. Alzheimer’s Disease Cooperative Study.
Neurology. 1999;
52:714- 718

[95] kraemer hc, tinklenberg j, yesavage ja. ’How far’ vs ’How fast" in Alzheimer’s disease. The question revisited.
Arch Neurol. 1994;
51:275- 279

[96] kukull wa, brenner de, speck ce, nochlin d, bowen j. Causes of death associated with Alzheimer’s disease: variation by level of cognitive impairment before death.
J Am Geriatr Soc. 1994;
42:723- 726

[97] lapane kl, gambassi g, landi f, sgadari a, mor v. Gender differences in predictors of mortality in nursing home residents with AD.
Neurology. 2001;
56:650- 654

[98] larson eb, shadlen mf, wang l, mccormick wc, bowen jd. Survival after initial diagnosis of Alzheimer disease.
Annals of Internal Medicine. 2004;
140:501- 509

[99] lawton mp, brody e. Assessment of older people : self-maintening and instrumental activities of daily living.
Gerontologist. 1969;
9:179- 186

[100] le carret n, auriacombe s, letenneur l, bergua v, dartigues jf. Influence of education on the pattern of cognitive deterioration in AD patients: the cognitive reserve hypothesis.
Brain Cognition. 2005;
57:120- 126

[101] lopez ol, wisnieski sr, becker jt, boller f, dekosky st. Extrapyramidal signs in patients with probable Alzheimer disease.
Arch Neurol. 1997;
54:969- 975

[102] lopez ol, becker jt, klunk w, saxton j, hamilton rl. Research evaluation and diagnosis of probable Alzheimer’s disease over the last two decades: I.
Neurology. 2000a;
55:1854- 1862

[103] lopez ol, becker jt, klunk w, saxton j, hamilton rl. Research evaluation and diagnosis of possible Alzheimer’s disease over the two decades: II.
Neurology. 2000b;
55:1863- 1869

[104] lopez ol, becker jt, saxton j, sweet ra, klunk w. Alteration of a clinically meaningful outcome in the natural history of Alzheimer’s disease by cholinesterase inhibition.
J Am Geriatr Soc. 2005;
53:83- 87

[105] lopponen mk, isoaho re, raiha ij, vahlberg tj, loikas sm. Undiagnosed diseases in patients with dementia – a potential target group for intervention.
Dement Geriatr Cogn Disord. 2004;
18:321- 329

[106] lu cj, tune le. Chronic exposure to anticholinergic medications adversely affects the course of Alzheimer disease.
Am J Geriatr Psychiatry. 2003;
11:458- 461

[107] mann um, mohr e, gearing m, chase tn. Heterogeneity in Alzheimer’s disease: progression rate segregated by distinct neuropsychological and cerebral metabolic profiles.
J Neurol Neurosurg Psychiatry. 1992;
55:956- 959

[108] marra c, silveri mc, gainotti g. Predictors of cognitive decline in the early stage of probable Alzheimer’s disease.
Dement Geriatr Cogn Disord. 2000;
11:212- 218

[109] marson dc, hawkins l, mcinturff b, harrell le. Cognitive models that predict physician judgments of capacity to consent in mild Alzheimer’s disease.
J Am Geriatr Soc. 1997;
45:458- 464

[110] martins car, oulhaj a, de jager ca, williams jh. APOE alleles predict the rate of cognitive decline in Alzheimer disease: a nonlinear model.
Neurology. 2005;
65:1888- 1893

[111] mattis s. Mental status examination for organic mental syndrome in the elderly patients.
In: bellak l, karasu tb, editors.
Geriatric psychiatry: a handbook for psychiatrists and primary care physicians..
New York:Grune & Stratton;
1976.
p. 77- 101

[112] mcclendon mj, smyth ka, neundorfer mm. Long-term-care placement and survival of persons with Alzheimer’s disease.
J Gerontol B Psychol Sci Soc Sci. 2006;
61:P220- P227

[113] meier de, ahronheim jc, morris jc, baskin-lyons s, morrison rs. High short-term mortality in hospitalized patients with advanced dementia: lack of benefit of tube feeding.
Arch Intern Med. 2001;
161:594- 599

[114] melzer d, mcwilliams b, brayne c, johnson t, bond j. Profile of disability in elderly people: estimates from a longitudinal population study.
BMJ. 1999;
318:1108- 1111

[115] mendiondo ms, ashford jw, kryscio rj, schmitt fa. Modelling mini mental state examination changes in Alzheimer’s disease.
Stat Med. 2000;
19:1607- 1616

[116] mitchell sl, rockwood k. The association between parkinsonism, Alzheimer’s disease, and mortality: a comprehensive approach.
J Am Geriatr Soc. 2000;
48:422- 425

[117] mitchell sl, kiely dk, hamel mb, park ps, morris jn. Estimating prognosis for nursing home residents with advanced dementia.
J Am Med Assoc. 2004;
291:2734- 2740

[118] mohs rc, schmeidler j, aryan m. Longitudinal studies of cognitive, functional and behavioural change in patients with Alzheimer’s disease.
Stat Med. 2000;
19:1401- 1409

[119] mölsä pk, marttila rj, rinne ik. Survival and cause of death in Alzheimer’s disease and multi-infarct dementia.
Acta Neurol Scand. 1986;
74:103- 107

[120] moritz dj, kasl sv, berkman lf. Cognitive functioning and the incidence of limitations in activities of daily living in an elderly community sample.
Am J Epidemiol. 1995;
141:41- 49

[121] moritz dj, fox pj, luscombe fa, kraemer hc. Neurological and psychiatric predictors of mortality in patients with Alzheimer disease in California.
Arch Neurol. 1997;
54:878- 885

[122] moroney jt, tseng c-l, paik mc, mohr jp, desmond dw. Treatment for the secondary prevention of stroke in older patients: the influence of dementia status.
J Am Geriatr Soc. 1999;
47:824- 829

[123] morris jc, edland s, clark c, galasko d, koss e. The consortium to establish a registry for Alzheimer’s disease (CERAD). Part IV. Rates of cognitive change in the longitudinal assessment of probable Alzheimer’s disease.
Neurology. 1993;
43:2457- 2465

[124] morris mc, evans da, bienias jl, scherr pa, tangney cc. Dietary niacin and the risk of incident Alzheimer’s disease and of cognitive decline?.
J Neurol neurosurg Psychiatry. 2004;
75:1093- 1099

[125] mortimer ja, ebbitt b, jun sp, finch md. Predictors of cognitive and functional progression in patients with probable Alzheimer’s disease.
Neurology. 1992;
42:1689- 1696

[126] moye j, marson dc. Assessment of decision-making capacity in older adults: an emerging area of practice and research.
J Gerontol B Psychol Sci Soc Sci. 2007;
62:P3- P11

[127] mulnard ra, cotman cw, kawas c, van dyck ch, sano m. Estrogen replacement therapy for treatment of mild to moderate Alzheimer disease: a randomized controlled trial. Alzheimer’s Disease Cooperative Study.
JAMA. 2000;
283:1007- 1015

[128] neumann pj, araki ss, arcelus a, longo a, papadopoulos g. Measuring Alzheimer’s disease progression with transition probabilities: estimates from CERAD.
Neurology. 2001;
57:957- 964

[129] noale m, maggi s, mininuci n, marzari c, destro c. Dementia and disability: impact on mortality. The Italian Longitudinal Study on Aging.
Dement Geriatr Cogn Disord. 2003;
16:7- 14

[130] nygard l. Instrumental activities of daily living: a stepping-stone towards Alzheimer’s disease diagnosis in subjects with mild cognitive impairment?.
Acta Neurol Scand Suppl. 2003;
179:42- 46

[131] o’hara r, thompson jm, kraemer hc, fenn c, taylor jl. Which Alzheimer patients are at risk for rapid cognitive decline?.
J Geriatr Psychiatr Neurol. 2002;
15:233- 238

[132]organisation mondiale de la santé (oms). International classification of impairments, disabilities and handicaps: a manual of classification relating to the consequences of disease.
Geneva:WHO;
1980.


[133]organisation mondiale de la santé (oms). Classification Internationale des Maladies. Dixième révision. Chapitre V (F): Troubles mentaux et troubles du comportement. Description cliniques et directives pour le diagnostic.
Paris:Masson;
1993.
305pp. 

[134] ostbye t, hill g, steenhuis r. Mortality in elderly Canadians with and without dementia. A 5-year follow-up.
Neurology. 1999;
53:521- 526

[135] peres k, chrysostome v, fabrigoule c, orgogozo jm, dartigues jf, barberger-gateau p. Restriction in complex activities of daily living in MCI: impact on outcome.
Neurology. 2006;
67:461- 466

[136] piccini c, bracco l, falcini m, pracucci g, amaducci l. Natural history of Alzheimer’s disease: pronostic value of plateaux.
Journal of Neurological Sciences. 1995;
131:177- 182

[137] pot am, deeg djh, knipscheer cpm. Institutionalization of demented elderly: the role of caregiver characteristics.
Int J Geriatr Psychiatr. 2001;
16:273- 280

[138] rascovsky k, salmon dp, lipton am, leverenz jb, decarli c. Rate of progression differs in frontotemporal dementia and Alzheimer disease.
Neurology. 2005;
65:397- 403

[139] regan c, katona c, walker z, hooper j, donovan j. Relationship of vascular risk to the progression of Alzheimer disease.
Neurology. 2006;
67:1326- 1327

[140] sabbagh mn, tyas sl, emery sc, hansen la, alford mf. Smoking affects the phenotype of Alzheimer disease.
Neurology. 2005;
64:1301- 1303

[141] sachs-ericsson n, blazer dg. Racial differences in cognitive decline in a sample of community-dwelling older adults: the mediating role of education and literacy.
Am J Psychiatry. 2005;
13:968- 975

[142] salmon dp, thal lj, butters n, heindel wc. Longitudinal evaluation of dementia of the Alzheimer type: a comparison of 3 standardized mental status examinations.
Neurology. 1990;
40:1225- 1230

[143] scarmeas n, albert m, brandt j, blacker d, hadjigeorgiou g. Motor signs predict poor outcomes in Alzheimer disease.
Neurology. 2005a;
64:1696- 1703

[144] scarmeas n, brandt j, albert m, hadjigeorgiou g, papadimitriou a. Delusions and hallucinations are associated with worse outcome in Alzheimer disease.
Arch Neurol. 2005b;
62:1601- 1608

[145] scarmeas n, albert sm, manly jj, stern y. Education and rates of cognitive decline in incident Alzheimer’s disease.
J Neurol Neurosurg Psychiatry. 2006;
77:308- 316

[146] scherder e, bouma a, slaets j, ooms m, ribbe m. Repeated pain assessment in Alzheimer’s disease.
Dement Geriatr Cogn Disord. 2001;
12:400- 407

[147] schott jm, frost c, whitwell jl, macmanus dg, boyes rg. Combining short interval MRI in Alzheimer’s disease. Implications for therapeutic trials.
J Neurol. 2006;
253:1147- 1153

[148] silvestri m, pasqualetti p, baruffaldi r, jhandouk y, matteis m. Cerebrovascular reactivity and cognitive decline in patients with Alzheimer disease.
Stroke. 2006;
37:1010- 1015

[149] smith mz, esiri mm, barnetson l, king e, nagy z. Constructional apraxia in Alzheimer’s disease: association with occipital lobe pathology and accelerated cognitive decline.
Dement Geriatr Cogn Disord. 2001;
12:281- 288

[150] soto me, andrieu s, gillette-guyonnet s, cantet c, nourhashemi f. Risk factors for functional decline and institutionalisation among community-dwelling older adults with mild to severe Alzheimer’s disease: one year of follow-up.
Age Ageing. 2006;
35:308- 310

[151] stavitsky k, brickman am, scarmeas n, torgan rl, tang mx. The progression of cognition, psychiatric symptoms, and functional abilities in dementia with Lewy bodies and Alzheimer disease.
Arch Neurol. 2006;
63:1450- 1456

[152] stern rg, mohs rc, davidson m, schmeidler j, silverman j. A longitudinal study of Alzheimer’s disease: measurement, rate, and predictors of cognitive deterioration.
Am J Psychiatry. 1994a;
151:390- 396

[153] stern y, brandt j, jacobs dm, tang mx, marder k. Utility of extrapyramidal signs and psychosis as predictors of cognitive and functional decline, nursing home admission, and death in Alzheimer’s disease. Prospective analysis from predictors study.
Neurology. 1994b;
44:2300- 2307

[154] stern y, albert sm, sano m, richards m, miller l. Assessing patient dependence in Alzheimer’s disease.
J Gerontol. 1994c;
49:M216- M222

[155] stern y, tang mx, albert ms, brandt j, jacobs dm. Predicting time to nursing home care and death in individuals with Alzheimer disease.
JAMA. 1997;
277:806- 812

[156] stewart r. Mental health legislation and decision making capacity: autonomy in Alzheimer’s disease is ignored and neglected.
BMJ. 2006;
332:118- 119

[157] storandt m, grant ea, miller jp, morris jc. Rates of progression in mild cognitive impairment and early Alzheimer’s disease.
Neurology. 2002;
59:1034- 1041

[158] suh g-h, ju ys, yeon bk, shah a. A longitudinal study of Alzheimer’s disease: rates of cognitive and functional decline.
Int J Geriatr Psychiatr. 2004;
19:817- 824

[159] tabbarah m, crimmins em, seeman te. The relationship between cognitive and physical performance: MacArthur Studies of Successful Aging.
J Gerontol A Biol Sci Med Sci. 2002;
57:M228- M235

[160] tabert mh, albert sm, borukhova-milov l, camacho y, pelton g. Functional deficits in patients with mild cognitive impairment: prediction of AD.
Neurology. 2002;
58:758- 764

[161] teri l, hughes jp, larson eb. Cognitive deterioration in Alzheimer’s disease: behavioral and health factors.
J Gerontol. 1990;
45:58- 63

[162] teri l, mccurry sm, edland sd, kukull wa, larson eb. Cognitive decline in Alzheimer’s disease: a longitudinal investigation of risk factors for accelerated decline.
J Gerontol A Biol Sci Med Sci. 1995;
50A:M49- M55

[163] thal lj, grundman m, kluaber mr. Dementia: characteristics of a referral population and factors associated with progression.
Neurology. 1988;
38:1083- 1090

[164] thomas bm, starr jm, whalley lj. Death certification in treated cases of presenile Alzheimer’s disease and vascular dementia in Scotland.
Age Ageing. 1997;
26:401- 406

[165] thomas p, chantoin-merlet s, hazif-thomas c, belmin j, montagne b. Complaints of informal caregivers providing home care for dementia patients: the Pixel study.
Int J Geriatr Psychiatry. 2002;
17:1034- 1047

[166] tschanz jt, corcoran c, skoog i, khachaturian as, herrick j. Dementia: the leading predictor of death in a defined elderly population. The Cache County Study.
Neurology. 2004;
62:1156- 1162

[167] tschanz jt, welsh-bohmer ka, lytketsos cg, corcoran c, green rc. Conversion to dementia from mild cognitive disorder: the Cache County Study.
Neurology. 2006;
67:229- 234

[168] van der steen jt, ooms me, mehr dr, van der wal g, ribbe mw. Severe dementia and adverse outcomes of nursing home-acquired pneumonia: evidence for mediation by functional and pathophysiological decline.
J Am Geriatr Soc. 2003;
50:439- 448

[169] van dijk ptm, dippel dwj, van der meulen jhp, habbema jdf. Comorbidity and its effect on mortality in nursing home patients with dementia.
J Nerv Ment Dis. 1996;
184:180- 187

[170] walsh js, welch hg, larson eb. Survival of outpatients with Alzheimer-type dementia.
Ann Intern Med. 1990;
113:429- 434

[171] walter lc, brand rj, counsell sr, palmer rm, landefeld cs. Development and validation of a prognostic index for 1-year mortality in older adults after hospitalization.
J Am Med Assoc. 2001;
285:2987- 2994

[172] wicklund ah, johnson n, rademaker a, weitner bb, weintraub s. Profiles of decline in activities of daily living in non-Alzheimer dementia.
Alzheimer Dis Assoc Disord. 2007;
21:8- 13

[173] wilson rs, gilley dw, bennett da, beckett la, evans da. Hallucinations, delusions, and cognitive decline in Alzheimer’s disease.
J Neurol Neurosurg Psychiatry. 2000a;
69:172- 177

[174] wilson rs, gilley dw, bennett da, beckett la, evans da. Person-specific paths of cognitive decline in Alzheimer’s disease and their relation to age.
Psychol Aging. 2000b;
15:18- 28

[175] wilson rs, tang yp, aggarwal nt, gilley dw, mccann jj. Hallucinations, cognitive decline, and death in Alzheimer’s disease.
Neuroepidemiology. 2006;
26:68- 75

[176] wolfson c, wolfson db, asgharian m, m’lan ce, ostbye t. A reevaluation of the duration of survival after the onset of dementia.
N Engl J Med. 2001;
344:1111- 1116

→ Aller vers SYNTHESE