| |
| Med Sci (Paris). 36(10): 835–838. doi: 10.1051/medsci/2020148.Le microenvironnement sinusoïdal contrôle la mise en place et la différenciation des macrophages ganglionnaires Christopher G. Mueller,1* Abdouramane Camara,1 and Vincent Flacher1 1CNRS UPR 3572, Université de Strasbourg, IBMC
,
2 allée Konrad Roentgen
,
67000Strasbourg
,
France MeSH keywords: Animaux, Vaisseaux capillaires, Différenciation cellulaire, Humains, Immunité cellulaire, Noeuds lymphatiques, Vaisseaux lymphatiques, Macrophages, Niche de cellules souches, cytologie, physiologie |
Les sinus lymphatiques sont des unités fonctionnelles du ganglion lymphatique
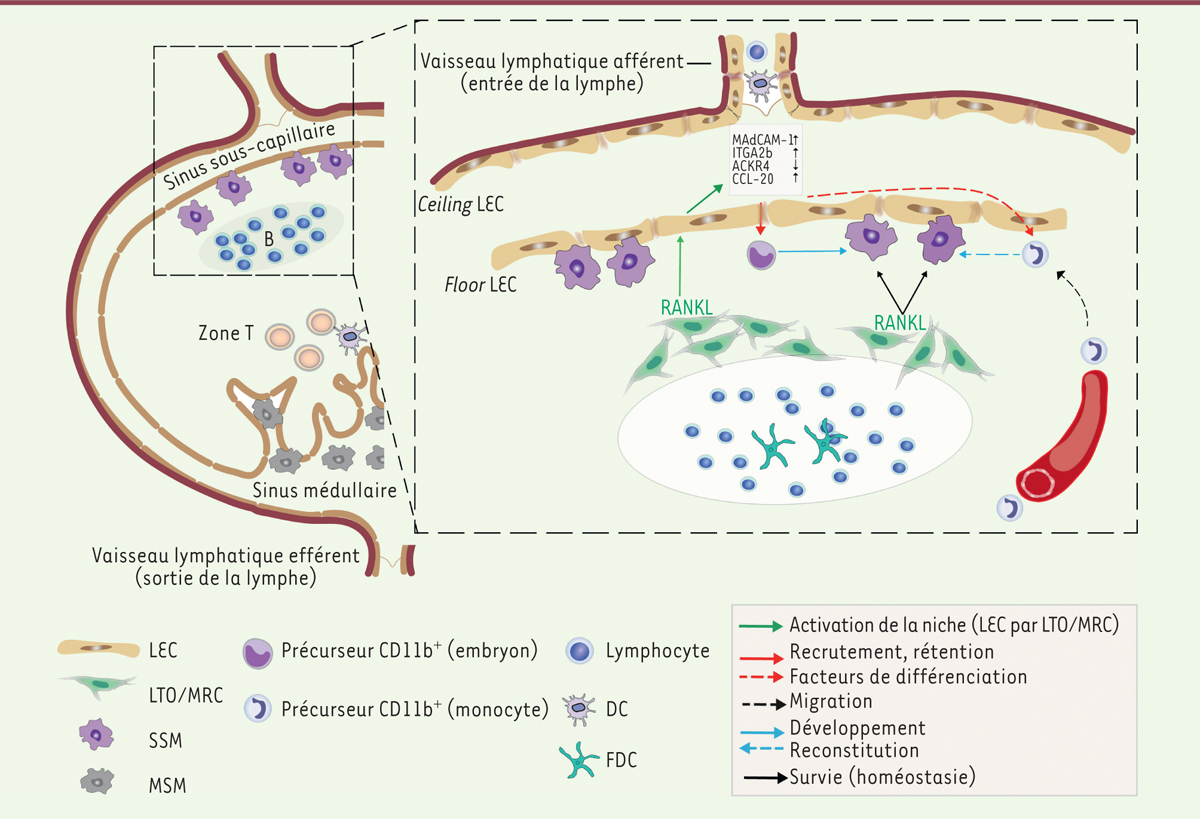
La fonction principale du ganglion lymphatique est de drainer la lymphe des tissus périphériques et d’en filtrer des antigènes ou des microorganismes infectieux. Leur capture contribue à tolérer les antigènes du soi ou à amorcer une réponse immunitaire. Afin de faciliter les rencontres entre les cellules et d’augmenter l’efficacité des réactions immunitaires, le ganglion lymphatique est divisé en plusieurs zones fonctionnelles
(
Figure 1
)
. Le parenchyme, qui contient notamment les cellules mésenchymateuses et les cellules endothéliales lymphatiques, contrôle l’organisation des différents types cellulaires en sécrétant des chimiokines, en produisant des facteurs d’adhérence cellulaire et en régulant le flux lymphatique. Le sinus sous-capsulaire permet à la lymphe afférente de distribuer les petites molécules à l’intérieur du ganglion, alors que les particules trop grandes pour les étroits conduits de l’organe sont captées par les macrophages. En effet, sous le « plancher » sinusoïdal se trouvent les macrophages du sinus sous-capsulaire (SSM,
subcapsular sinus macrophages
). Les SSM forment un réseau dense, étroitement lié à l’endothélium lymphatique et soutenu par les cellules mésenchymateuses (MRC,
marginal reticular cells
) bordant les follicules B
(
Figure 1
)
. De façon analogue, les macrophages de la zone médullaire (MSM,
medullary sinus macrophage
s) sont en contact avec les cellules endothéliales lymphatiques formant le sinus médullaire. Les SSM participent à la défense anti-virale en produisant l’interféron de type I et des cytokines inflammatoires stimulant l’activité des cellules immunitaires [
1
]. De plus, les antigènes pénétrant dans le ganglion par transcytose au travers des SSM sont ensuite capturés par les lymphocytes B afin de déclencher la réponse humorale. En capturant les cellules cancéreuses métastatiques ou leurs fragments cellulaires, les SSM peuvent aussi jouer un rôle dans la réponse anti-tumorale [
2
]. La fonction des MSM est également de phagocyter les antigènes et d’éliminer les microorganismes infectieux. Par ailleurs, il est probable qu’ils contribuent à la différenciation des lymphocytes B en plasmocytes [
3
].
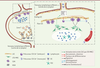 | Figure 1.
Différenciation des macrophages sinusoïdaux ganglionnaires par les cellules stromales et l’axe de signalisation RANKL-RANK.
Le ganglion lymphatique est structuré en compartiments. Les lymphocytes B sont groupés en follicules, se distinguant des zones riches en lymphocytes T et en cellules dendritiques (
dendritic cells
, DC). Les vaisseaux lymphatiques afférents et efférents forment des cavités, respectivement nommées sinus sous-capsulaire et sinus médullaire. Le « plafond » (
ceiling
; face externe) et le « plancher » (
floor
; face interne) du sinus sous-capsulaire sont constitués de cellules endothéliales lymphatiques (
lymphatic endothelial cells
, LEC). Les macrophages du sinus sous-capsulaire (
subcapsular sinus macrophages
, SSM) et les macrophages de la zone médullaire (
medullary sinus macrophage
s, MSM) sont en contact avec les cellules lymphatiques. La couche des SSM est soutenue par des cellules mésenchymateuses (
marginal reticular cells
, MRC, après la naissance, ou
lymphoid tissue organizer
, LTO, chez l’embryon). RANKL est exprimé par les cellules mésenchymateuses, et sa liaison au récepteur RANK active la voie de signalisation RANKL-RANK dans les LEC et les macrophages sinusoïdaux. Les cellules folliculaires dendritiques (
follicular dendritic cells,
FDC) jouent un rôle important dans la formation des follicules B et la différenciation des lymphocytes B en plasmocytes et lymphocytes B à mémoire.
|
|
Quelle est le rôle du microenvironnement sinusoïdal dans la différenciation des macrophages ?
La diversité phénotypique et fonctionnelle des macrophages résidant dans les tissus ne résulte pas d’une grande variété de précurseurs. Selon le concept de niche cellulaire, les différents types de macrophages résidents résultent des multiples signaux qui émanent des cellules avoisinantes, et sont donc spécifiques d’un organe donné [
4
]. Considérant l’importance des macrophages sinusoïdaux, nous avons voulu comprendre comment leur mise en place et leur différenciation sont contrôlées, et nous nous sommes donc intéressés aux cellules endothéliales lymphatiques et aux cellules mésenchymateuses. Les MRC, tout comme leurs précurseurs embryonnaires présumés, les cellules organisatrices des tissus lymphoïdes (
lymphoid tissue organizer,
LTO), se caractérisent par l’expression de RANKL (
receptor activator of NF-
k
B ligand
), un membre de la famille des facteurs de nécrose tumorale (
tumor necrosis factor,
TNF) [
5
]. RANKL, en activant la signalisation de son récepteur RANK, est connu pour promouvoir la différenciation des ostéoclastes, des macrophages spécialisés dans la résorption osseuse. Cependant, RANK est également exprimé par divers autres types cellulaires, notamment par de nombreuses cellules myéloïdes, ce qui nous a incités à postuler son implication dans la différenciation des macrophages sinusoïdaux [
6
].
|
RANKL induit la différenciation des SSM
Nous avons d’abord généré des souris mutantes chez lesquelles le gène
Rankl
est spécifiquement invalidé dans les LTO et les MRC. Ces cellules restent cependant présentes et fonctionnelles, et les ganglions lymphatiques se développent normalement. En revanche, le nombre des SSM et des MSM est fortement réduit. Étant donné que les macrophages sinusoïdaux expriment RANK, nous nous sommes demandé si un défaut de signalisation directe pourrait être à l’origine de leur raréfaction chez ces souris. Nous avons donc généré des souris invalidées pour le gène
Rank
dans tous les macrophages sinusoïdaux. Alors que l’invalidation du gène concernait à la fois les SSM et les MSM, seuls les SSM étaient absents chez ces souris, et leur zone habituelle de résidence était occupée par des cellules semblables aux MSM, ce qui indiquait que seule la différenciation des SSM requiert la signalisation directe par RANKL.
|
La niche des macrophages sinusoïdaux est confectionnée par des cellules endothéliales lymphatiques activées par RANKL
Ces résultats indiquent des fonctions de RANKL au-delà de son action directe sur la différenciation des SSM. Nous avions déjà montré que les cellules endothéliales lymphatiques sont sensibles à RANKL, qui est nécessaire, entre autres, à leur expression de MAdCAM-1 (
mucosal vascular addressin cell adhesion molecule 1
) [
7
]. Nous avons donc voulu savoir si cette activation par RANKL était à l’origine de signaux pouvant affecter les deux types de macrophages sinusoïdaux. L’invalidation de
Rank
a été induite spécifiquement dans les cellules endothéliales lymphatiques exprimant la recombinase Cre activée par le tamoxifène. Comme nous le supposions, lorsque ces cellules ne peuvent plus être activées
via
RANK, la présence des deux types de macrophages sinusoïdaux, SSM et MSM, est fortement réduite, sans qu’ils soient remplacés par un autre type de macrophages. De plus, alors que cette invalidation de
Rank
induite par le tamoxifène conduit, quel que soit l’âge, à une absence d’activation de l’endothélium lymphatique, la disparition des macrophages n’est visible qu’en cas d’administration du tamoxifène avant la naissance ou dans la limite de deux semaines post-natales. Ce résultat est compatible avec une origine embryonnaire des précurseurs des macrophages sinusoïdaux, et leur remplacement partiel après la naissance [
8
]. Ces résultats montrent donc que les cellules endothéliales lymphatiques activées par RANK participent à la création d’une niche accueillant les précurseurs des macrophages. En outre, ils prouvent l’importance de l’expression de RANKL par les LTO au stade embryonnaire, puis, plus tardivement, par les MRC.
Afin de déterminer la nature des signaux induits par l’activation de RANK, nous avons réalisé une analyse du transcriptome des cellules endothéliales lymphatiques, qui a révélé la production de chimiokines et de molécules d’adhérence cellulaire, suggérant un recrutement et une rétention de précurseurs des macrophages. En effet, l’analyse des ganglions primordiaux d’embryons de souris mutants dépourvus de RANK dans l’endothélium lymphatique a mis en évidence une forte réduction du nombre des cellules CD11b
+
susceptibles de se différencier en macrophages sinusoïdaux. Mais le transcriptome endothélial comporte également une signature génétique suggérant une influence directe sur la différenciation des macrophages.
|
Impact sur la réponse immunitaire
La niche que nous avons mise en évidence conserve-t-elle une fonction similaire en dehors du développement périnatal des macrophages sinusoïdaux ? Puisque, chez l’adulte, on observe une déplétion de ces macrophages en réponse à une inflammation ganglionnaire, nous avons injecté un adjuvant (ADN synthétique contenant des dinucléotides CpG non méthylés, activateurs du récepteur de type Toll TLR9, ce qui déclenche une réponse pro-inflammatoire) puis inactivé RANK dans les cellules endothéliales lymphatiques. Nous avons constaté que le réseau des macrophages, reconstitué normalement chez les souris témoins, n’est que partiellement rétabli en absence d’une activation de l’endothélium
via
RANK. Afin de transposer ces observations dans le contexte d’une réponse immunitaire, nous avons infecté les souris avec le virus de la vaccine modifié de type Ankara (MVA), et mesuré l’activation des lymphocytes B. Chez les souris dépourvues de RANKL dans les LTO/MRC ou de RANK dans les cellules endothéliales lymphatiques, la réaction du centre germinatif des ganglions lymphatiques et la production de plasmocytes étaient fortement réduites.
|
En conclusion, l’axe de signalisation RANKL-RANK mis en place entre les cellules mésenchymateuses et les cellules endothéliales lymphatiques intervient dans la création d’une niche pour les macrophages sinusoïdaux du ganglion lymphatique et leurs précurseurs. De plus, cet axe relie également cellules mésenchymateuses et précurseurs myéloïdes, et participe à la différenciation de ces derniers en SSM
(
Figure 1
)
. Ces découvertes soulèvent de nombreuses questions. Bien que l’apport du stroma mésenchymateux RANKL
+
ait été clairement démontré au cours du développement précoce, il laisse ouverte la possibilité d’une contribution d’autres types cellulaires exprimant RANKL dans le contexte de la réparation du réseau des macrophages sinusoïdaux après inflammation. Les lymphocytes T CD4
+
et CD8
+
activés expriment RANKL, tout comme les cellules lymphoïdes innées de type 3. Par ailleurs, on retrouve chez l’homme des lymphocytes B exprimant RANKL, plus abondants chez les patients atteints d’arthrite rhumatoïde [
9
]. Les lymphocytes B pourraient donc être en mesure de constituer un environnement favorable aux SSM. Finalement, alors que RANKL était principalement connu pour son rôle dans l’ostéoclastogenèse et le contrôle de la croissance osseuse, nos travaux de recherche permettent d’envisager des applications potentielles en immunothérapie.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Gray
EE
,
Cyster
JG
.
Lymph node macrophages. J.
.
Innate Immun.
2012;
;
4
:
:424.
–
436
.
2.
Pucci
F
,
Garris
CP
,
Lai
A
,
et al.
SCS macrophages suppress melanoma by restricting tumor-derived vesicle-B cell interactions.
.
Science.
2016;
;
352
:
:242.
–
246
.
3.
Mohr
E
,
Serre
RA
,
Manz
AF
,
et al.
Dendritic cells and monocyte/macrophages that create the IL-6/APRIL-rich lymph node microenvironments where plasmablasts mature.
.
J Immunol.
2009;
;
182
:
:2113.
–
2123
.
4.
Lavin
Y
,
Mortha
A
,
Rahman
M
,
Merad
M
.
Regulation of macrophage development and function in peripheral tissues.
.
Nat Rev Immunol.
2015;
;
15
:
:731.
–
744
.
5.
Mueller
CG
,
Hess
E
.
Emerging functions of RANKL in lymphoid tissues.
.
Front Immunol.
2012;
;
3
:
:261.
–
267
.
6.
Camara
A
,
Cordeiro
OG
,
Alloush
J
,
et al.
Lymph node mesenchymal and endothelial stromal cells cooperate via the RANK-RANKL cytokine axis to shape the sinusoidal macrophage niche.
.
Immunity.
2019;
;
50
:
:1467.
–
1481
.
7.
Cordeiro
OG
,
Chypre
N
,
Brouard
N
,
et al.
Integrin-alpha IIb identifies murine lymph node lymphatic endothelial cells responsive to RANKL.
.
PLoS One.
2016;
;
11
:
:e0151848.
.
8.
Mondor
I
,
Baratin
M
,
Lagueyrie
M
,
et al.
Lymphatic endothelial cells are essential components of the subcapsular sinus macrophage niche.
.
Immunity.
2019;
;
26
:
:30182.
–
30187
.
9.
Ota
Y
,
Niiro
H
,
Ota
N
,
et al.
Generation mechanism of RANKL
+
effector memory B cells: relevance to the pathogenesis of rheumatoid arthritis
.
.
Arthritis Res Ther.
2016;
;
18
:
:67.
.
|