| |
| Med Sci (Paris). 36(10): 900–907. doi: 10.1051/medsci/2020163.Rétinopathie du prématuré : de la prévention au traitement Alejandra Daruich,1,2,3 Dominique Bremond-Gignac,1,2,3 Francine Behar-Cohen,2,3,4 and Elsa Kermorvant2,3,5* 1Service d’ophtalmologie, Hôpital universitaire Necker-Enfants malades, AP-HP
,
149 rue de Sèvres
,
75015Paris
,
France 2Inserm, UMRS1138, Équipe 17, Université Sorbonne Paris Cité, Centre de recherche des Cordeliers
,
15 rue de l’École de Médecine
,
75006Paris
,
France 3Université de Paris
,
Paris
,
France 4Ophtalmopole, Hôpital Cochin, AP-HP
,
27 rue du Faubourg Saint-Jacques
,
75014Paris
,
France 5Service de pédiatrie et réanimation néonatales, AP-HP, Hôpital universitaire Necker-Enfants malades
,
149 rue de Sèvres
,
75015Paris
,
France |
La rétinopathie du prématuré (ROP), responsable de la majorité des séquelles visuelles des anciens prématurés, est une des principales causes évitables de cécité infantile [
1
], avec plus de 30 000 cas de malvoyance dans le monde en 2010 [
2
]. Son incidence varie selon le niveau des soins néonatals et des ressources disponibles. En France et en Europe, environ 30 % des prématurés de moins de 31 semaines d’âge gestationnel développent une ROP, et 5 % nécessitent un traitement [
3
,
4
].
|
De la physiopathologie aux pistes de prévention
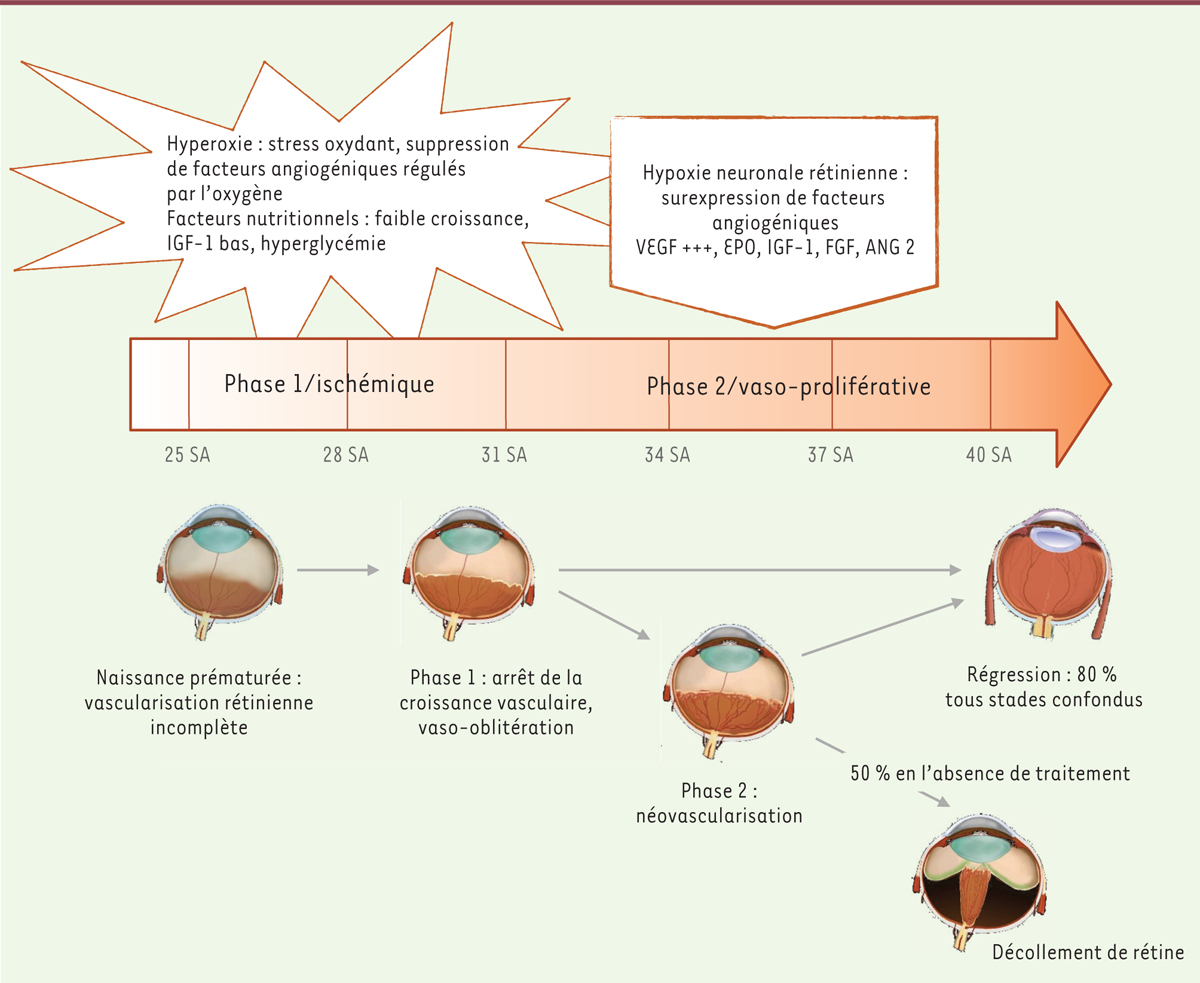
La ROP est une pathologie multi-factorielle du développement rétinien, notamment du réseau vasculaire rétinien. Celui-ci débute entre la 14
e
et la 16
e
semaine d’aménorrhée (SA) et se poursuit jusqu’au terme, progressant de la papille vers la périphérie de la rétine, atteinte vers la 36
e
SA pour la rétine nasale, et vers la 40
e
SA pour la rétine temporale. En cas de prématurité, la vascularisation rétinienne est inachevée à la naissance, laissant des zones avasculaires faire le lit de la ROP. Celle-ci se développe en deux phases. La première, dite phase ischémique, est caractérisée par l’interruption de la progression du lit capillaire rétinien associée à une dégénérescence des vaisseaux existants, favorisée par l’exposition du nouveau-né à des facteurs endogènes et exogènes
(
Figure 1
)
. La deuxième, dite phase proliférative, se manifeste par la prolifération de néovaisseaux à partir des zones d’ischémie avasculaires. Mais cette prolifération s’effectue de façon anarchique et inefficace puisque la rétine reste dépourvue de vaisseaux nourriciers. La croissance de néovaisseaux pathologiques est sous le contrôle de facteurs pro-angiogéniques, dont le VEGF (
vascular endothelial growth factor
)
(
Figure 1
)
, qui sont secrétés en réponse à l’hypoxie neuronale induite par la déprivation de vascularisation rétinienne. En l’absence de traitement, la néovascularisation peut s’accompagner de prolifération fibrogliale
1
et conduire à un décollement de rétine et à des hémorragies compromettant gravement le pronostic visuel.
 | Figure 1.
Physiopathologie de la rétinopathie du prématuré.
Les deux phases et les principaux mécanismes physiopathologiques mis en jeu dans le développement de la ROP.
|
Une meilleure connaissance des facteurs favorisant la ROP et une meilleure compréhension des mécanismes responsables de la perte vasculaire initiale sont nécessaires pour prévenir la maladie et préserver une vascularisation rétinienne normale qui garantit le développement visuel. La multiplicité des facteurs impliqués dans la survenue de la ROP plaide en faveur de stratégies préventives complémentaires et synergiques. La cascade à l’origine de l’arrêt de croissance et de la dégénérescence microvasculaire rétinienne dans la phase ischémique est complexe. Elle est influencée par des facteurs oxygéno-dépendants et des facteurs nutritionnels qui peuvent néanmoins être contrôlés. Facteurs oxygéno-dépendants Une hyperoxygénation de la rétine est un facteur reconnu dans la genèse de la ROP : l’oxygénothérapie mal contrôlée en a en effet été historiquement le premier facteur de risque identifié. Les mécanismes impliqués comprennent à la fois des lésions induites par le stress oxydant et nitro-oxydant, et la réduction du taux des facteurs de croissance vasculaire comme le VEGF et l’érythropoïétine (EPO).
L’implication du stress oxydant dans les mécanismes de la vaso-oblitération au cours de la phase ichémique a été bien documenté. Il résulte d’une augmentation de radicaux libres oxygénés lors de l’hyperoxie, associée à des défenses anti-oxydantes immatures chez le nouveau-né prématuré, notamment au niveau de la rétine, la rendant particulièrement vulnérable à l’attaque radicalaire [
5
]. Même en air ambiant, le nouveau-né prématuré est en situation d’hyperoxie relative, en comparaison de la pression partielle artérielle en oxygène à laquelle il était exposé
in utero
. En outre, contrairement à l’adulte, le nouveau-né prématuré a une capacité d’autorégulation du flux sanguin rétinien limitée, et donc une capacité limitée à moduler la distribution en oxygène au tissu rétinien en cas d’hyperoxémie [
5
]. La rétine est aussi particulièrement sensible aux phénomènes de peroxydation lipidique en raison de sa grande richesse en acides gras poly-insaturés. Parmi les médiateurs produits lors du stress oxydant, le thromboxane A2, le PAF (
platelet-activating factor
) et les isoprostanes, produits de peroxydation radicalaire de l’acide arachidonique, participent à la vaso-oblitération rétinienne par le biais d’une vasoconstriction et par un effet cytotoxique direct sur les cellules endothéliales [
5
]. Par ailleurs, l’expression et l’activité de la monoxyde d’azote (NO) synthase endothéliale (eNOS) sont augmentées
in vivo
lorsque l’état redox du tissu rétinien est déplacé vers un environnement oxydant [
6
], source de radicaux libres dérivés du NO. L’invalidation du gène codant la eNOS, comme son inhibition pharmacologique, atténuent ainsi la vaso-oblitération rétinienne induite par l’oxygène [
6
,
7
]. Parmi les médiateurs du stress nitro-oxydant, les acides trans-arachidoniques, produits de l’isomérisation de l’acide arachidonique par le radical NO2•, participent à la perte vasculaire rétinienne en augmentant l’expression de la thrombospondine-1, puissant facteur apoptotique endothélial [
8
].
En pratique clinique, le choix d’objectifs de saturation en oxygène élevés dans les premières semaines de vie, exposant à un risque important d’hyperoxie, comme une exposition à des épisodes hyperoxémiques et hypoxémiques nombreux, ou à des fluctuations de la fraction inspirée en oxygène et de la pression partielle en oxygène, sont associés à une incidence plus grande de ROP [
9
]. La première mesure préventive consiste donc à surveiller et contrôler rigoureusement l’oxygénothérapie, et à limiter les épisodes d’hyperoxémie et les fluctuations de la pression partielle en oxygène. Bien qu’efficace sur des modèles expérimentaux de ROP, l’administration par voie générale ou locale d’anti-oxydants n’a pas fait ses preuves en pratique clinique. Seule la vitamine E à fortes doses diminue l’incidence de la ROP sévère, mais au prix d’un surcroît d’infections bactériennes
2
[
10
].
Le deuxième mécanisme majeur responsable de la perte vasculaire initiale est la suppression de facteurs de croissance et de survie vasculaire, dont le VEGF et l’EPO. Cette régulation, qui dépend du niveau d’oxygénation, intervient au niveau transcriptionnel
via
le facteur de transcription HIF-1α (
hypoxia-inducible factor-1
a). En situation d’hyperoxie, HIF-1α est réduit et l’expression du VEGF et celle de ses récepteurs est effondrée, entraînant une apoptose des cellules endothéliales rétiniennes [
11
,
12
]. Dans les modèles animaux, l’administration de VEGF exogène [
11
,
12
], comme l’activation de son récepteur VEGFR-1 [
13
], atténuent partiellement la perte capillaire ; cette approche n’est toutefois pas transférable en pratique clinique. L’EPO, qui est utilisée en clinique dans les premières semaines de vie pour prévenir l’anémie de la prématurité, a, dans les modèles expérimentaux, un effet protecteur dépendant de la dose utilisée à la phase ischémique, mais un effet aggravant à la phase vaso-proliférative [
14
]. Si l’administration d’EPO dans les premières semaines de vie (donc en phase ischémique) n’est pas associée à une diminution du risque de ROP dans les études cliniques [
15
], ces données expérimentales incitent à interrompre son utilisation si le fond d’œil à partir de la 31/32
e
SA met en évidence une rétinopathie proliférative débutante, en raison d’un risque théorique d’aggravation.
Facteurs indépendants de l’oxygène : croissance et facteurs nutritionnels
Le faible âge gestationnel, le faible poids à la naissance et la qualité de la croissance post-natale ont été identifiés plus récemment comme des facteurs de risque majeurs de la ROP, révélant le rôle important de facteurs de croissance d’origine placentaire, comme l’IGF-1 (
insulin-like growth factor-1
) et une de ses protéines de transport, l’IGFBP-3 (
IGF-binding protein-3
), dans le développement vasculaire rétinien. En effet, ce dernier est retardé chez les souris dont le gène codant l’IGF-1 a été invalidé, et l’administration de la protéine atténue la vaso-oblitération chez la souris exposée à l’oxygène [
16
,
17
]. Chez le nouveau-né prématuré, des concentrations plasmatiques basses d’IGF-1 et d’IGFBP3 sont associées à la survenue d’une rétinopathie sévère [
16
,
18
].
L’optimisation de la croissance post-natale et la prévention de l’hypotrophie acquise par des apports nutritionnels adaptés pourraient être des éléments importants de prévention de la ROP. Une corrélation forte a été établie entre la faible prise pondérale post-natale et le risque de ROP sévère [
19
]. L’IGF-1 est en effet régulée par l’apport calorique total et l’apport protéique. Plus récemment, il a été montré que des apports nutritionnels caloriques totaux, en glucides et en lipides, plus faibles et/ou insuffisants (inférieurs aux recommandations) au cours des 4 premières semaines de vie, sont un facteur de risque indépendant de ROP sévère chez les très grands prématurés [
20
].
La supplémentation en IGF-1 recombinante a été proposée comme traitement préventif de la ROP chez les prématurés. Cependant, un essai clinique de phase II évaluant l’effet de l’administration d’un complexe IGF-1/IGFBP-3 sur la sévérité de la ROP [
21
] a eu des résultats décevants. Ces résultats, en regard de ceux obtenus antérieurement, pourraient être liés à l’amélioration des pratiques nutritionnelles en néonatologie depuis la publication des études princeps. En revanche, le lait maternel, qui contient à la fois des facteurs de croissance (IGF-1 et VEGF) et des anti-oxydants a été identifié comme un facteur protecteur contre la ROP dans une méta-analyse d’études observationnelles, tout comme la nutrition parentérale
3,
optimisée [
15
].
Par ailleurs, en raison des pratiques de nutrition parentérale (utilisation fréquente d’émulsions lipidiques contenant peu, voire pas d’acides gras polyinsaturés [AGPI] de la série ω-3), les très grands prématurés sont susceptibles de développer, au cours des premières semaines de vie, un déficit en AGPI-ω-3, notamment en acide docohexaénoique (DHA) [
22
]. Les AGPI-ω-3 sont des composants clés des membranes rétiniennes et s’accumulent de façon importante dans les tissus neuro-rétiniens pendant la vie fœtale et les premières semaines de vie. Ils participent à la réduction des lésions de rétinopathie induite par l’oxygène dans les modèles animaux,
via
notamment les résolvines et les neuroprotectines, qui modulent la production et/ou l’effet de facteurs inflammatoires comme les prostanoïdes et le TNF-a (
tumor necrosis factor)
[
23
]. Plusieurs essais randomisés de faible ampleur suggèrent que l’utilisation d’émulsions lipidiques contenant des AGPI-ω-3 pourrait réduire l’incidence de la ROP chez les grands prématurés [
24
]. Bien que le niveau de preuve apporté par ces études soit modeste, un apport suffisant en AGPI-ω-3, visant à prévenir la survenue d’un déficit précoce, paraît un objectif important à poursuivre.
Enfin, plusieurs études rétrospectives et une étude prospective [
25
] ont rapporté une association entre la survenue d’une hyperglycémie, complication fréquente de la grande prématurité, et une augmentation du risque de rétinopathie du prématuré. Des lésions de rétinopathie, impliquant des mécanismes inflammatoires, ont été reproduites dans un modèle animal d’hyperglycémie néonatale [
26
]. Bien que l’efficacité d’un contrôle glycémique étroit sur l’incidence de la ROP n’ait pas été démontré par un essai clinique, ces données plaident en faveur d’une approche visant à limiter la fréquence et l’intensité des épisodes hyperglycémiques chez le très grand prématuré.
|
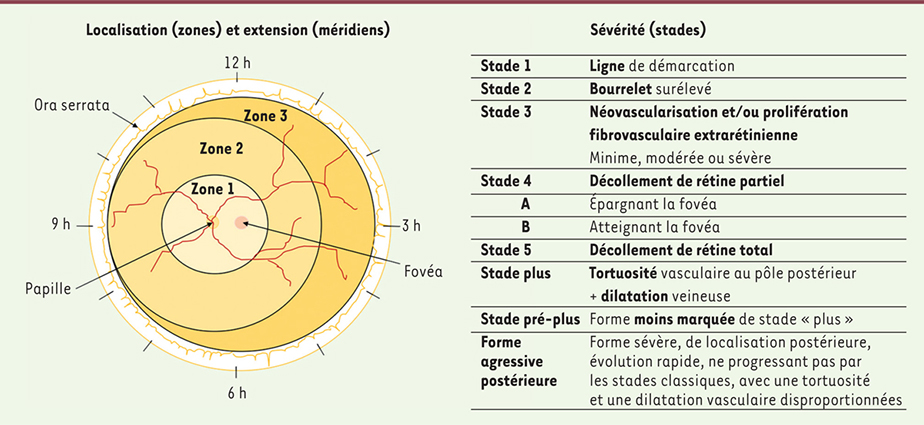
Le diagnostic de la ROP repose sur une surveillance du fond d’œil, dont le rythme a été établi par des consensus internationaux et des recommandations de sociétés spécialisées. La sévérité de la ROP est classée selon la localisation (zones), l’extension (méridiens horaires) et la gravité (stades) des lésions observées au fond d’œil [
27
]
(
Figure 2
)
. En France, le dépistage de la ROP est recommandé chez tous les prématurés nés avant 31 SA, avec un poids de naissance inférieur ou égal à 1 250 g, ou entre 1 251 et 2 000 g en cas d’évolution post-natale compliquée [
28
].
 | Figure 2.
Classification de la rétinopathie du prématuré (ROP) selon l’
International Committee for the Classification of Retinopathy of Prematurity
(ICROP).
La ROP est classée selon sa localisation (zones), son extension (méridiens horaires) et sa gravité (stades). La zone 1 est la zone centrale dont le rayon est le double de la distance inter-papillomaculaire. La zone 2 s’étend des limites de la zone 1 jusqu’à l’ora serrata en nasal et l’équateur anatomique en temporal. La zone 3 est représentée comme le croissant résiduel antérieur à la zone 2 en périphérie temporale. L’étendue de la maladie est indiquée par le nombre de méridiens horaires (par secteurs de 30°) impliqués. Cinq stades sont utilisés pour décrire la sévérité de la maladie. Les trois premiers stades reposent sur les anomalies observées à la jonction de la rétine vascularisée et la rétine avasculaire. Les deux stades les plus sévères dépendent de la présence et de l’étendue d’un décollement de rétine.
|
L’examen ophtalmologique est effectué à l’aide un blépharostat
4,
après dilatation pupillaire et instillation d’un anesthésique local. Il existe deux moyens de dépistage : l’ophtalmoscopie indirecte au casque (avec lentille 28 ou 30 dioptries)
5
, et la caméra numérique à grand champ (ou rétinophotographie grand champ). La première doit être effectuée par un ophtalmologiste entraîné. Les rétinophotographies grand champ peuvent par contre être prises par un personnel soignant entraîné (orthoptiste, infirmière) et interprétées par un ophtalmologiste expert [
29
]. Cette méthode est devenue la référence (
gold-standard
), car elle permet une documentation objective et facilite le diagnostic et le suivi. L’enregistrement de rétinophotographies numériques facilite également le dépistage de la ROP par télémédecine, en particulier dans les hôpitaux n’ayant pas accès à un ophtalmologiste pédiatrique, et permet une analyse automatisée qui pourrait devenir une aide au dépistage [
30
].
L’intervalle des examens de suivi est déterminé par la sévérité de la ROP et varie entre moins d’une semaine et 3 semaines
(
Tableau I
)
.
Tableau I.
| 1 semaine ou moins |
ROP stade 1 ou 2 dans la Zone 1
ROP stade 3 en Zone II |
| 1-2 semaines |
Vascularisation immature dans la Zone 1
ROP stade 2 dans la Zone 2
ROP régressive dans la Zone 1 |
| 2 semaines |
ROP stade 1 dans la Zone 2
ROP régressive dans la Zone 2 |
| 2-3 semaines |
ROP stade 1 ou 2 dans la Zone 3
ROP régressive dans la Zone 3 |
Intervalle des examens de suivi selon la sévérité de la ROP.
Le premier dépistage doit avoir lieu à 31 SA (semaine d’aménorrhée) si le terme est < 27 SA et à 4 semaines de vie si le terme est ≥ 27 SA. Le dépistage se poursuit jusqu’à vascularisation complète ou régression de la ROP dans les formes modérées. Le suivi est plus prolongé après traitement (voir
Figure 3
).
|
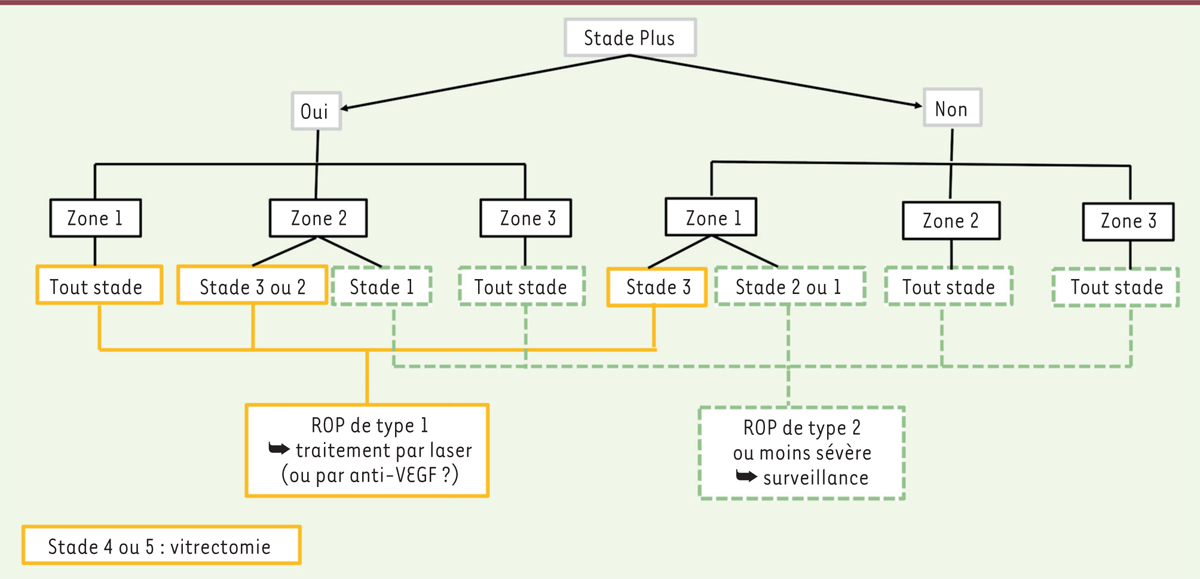
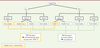 | Figure 3.
Arbre décisionnel pour la prise en charge de la rétinopathie du prématuré.
L’indication de traitement est définie par la maladie pré-seuil (ROP en zone 1 tout stade avec maladie plus ou stade 3 sans maladie plus et ROP en zone 2 stade 2 ou 3 avec maladie plus). Le traitement de choix est la photocoagulation laser, les anticorps anti-VEGF doivent être réservés à des cas ponctuels, notamment devant une ROP en zone 1 avec une vascularisation maculaire incomplète ; chez des prématurés trop fragiles pour supporter l’anesthésie générale et la procédure laser [
51
] (cette situation est souvent observée en cas de ROP type 1, zone I avec atteinte respiratoire sévère associée) ; ou encore en cas de faible visualisation empêchant la réalisation du laser (en l’absence de décollement de rétine). Il est préférable d’éviter les anticorps anti-VEGF en cas d’atteinte neurologique ou de suivi complexe. Par ailleurs, les anticorps anti-VEGF sont contre-indiqués dans les stades 4 et 5, car ils risquent de provoquer une contraction des membranes néovasculaires et d’aggraver un décollement de rétine [
40
]. Les stades 4 et 5 relèvent donc systématiquement d’une indication chirurgicale. En cas de traitement laser, la surveillance du fond d’œil se poursuit jusqu’à cicatrisation des impacts et régression de la maladie plus, avec aplatissement du bourrelet. En cas de traitement par injection intravitréenne d’anti-VEGF, le suivi est effectué jusqu’à vascularisation complète. En cas de persistance d’une zone avasculaire, un traitement laser complémentaire est recommandé [
40
].
|
|
Prise en charge de la ROP La ROP nécessite une prise en charge multidisciplinaire entre ophtalmologistes, néonatologistes et anesthésistes pédiatriques en milieu hospitalier spécialisé. Modalités de traitement Photocoagulation par laser
Le traitement, effectué sous anesthésie générale, a pour but la destruction de la rétine avasculaire et ischémique, pour diminuer la production de VEGF. Elle résulte d’impacts laser presque confluents réalisés sur toute la rétine avasculaire. Le taux d’échec est inférieur à 9 % [
31
] dans les 9 semaines post-traitement. La complication la plus sévère à long-terme est le développement d’une myopie, dont le degré semble corrélé au nombre d’impacts reçus et à l’extension de la ROP [
32
].
Ses indications sont bien établies et reposent sur les résultats de deux essais thérapeutiques majeurs, CRYO-ROP [
33
] et ETROP [
31
].
L’étude CRYO-ROP a permis de montrer, avec un recul de plus de 15 ans, que la destruction de la rétine avasculaire par cryothérapie (remplacée depuis par le laser) permet de diminuer le risque d’évolution vers des résultats structuraux défavorables (notamment décollement de rétine) de 48 % en l’absence de traitement, à 27 %, avec une diminution parallèle du risque d’acuité visuelle inférieure à 1/10 de 62 à 44 %. L’étude CRYO-ROP a ainsi permis de définir la « maladie seuil » à partir de laquelle un traitement laser était bénéfique (stade 3 avec maladie localisée plus en zone 1 ou 2, sur 5 quadrants horaires contigus ou 8 quadrants cumulés)
(
Figure 2
)
.
L’étude ETROP [
31
] a introduit la définition de ROP de type 1, ou pré-seuil qui inclut :
• une ROP en zone 1, tout stade plus • une ROP en zone 1, tout stade 3 sans maladie plus • une ROP en zone 2, stade 2 ou 3 avec maladie plus Et de ROP de type 2, qui inclut : • une ROP en zone 1, stade 1 ou 2 sans maladie plus • une ROP en zone 2, stade 3 sans plus
Dans cette étude, la ROP de type 1 à haut risque a montré une évolution moindre vers un résultat structurel défavorable à 9 mois, avec un traitement plus précoce que dans l’étude CRYO-ROP (15,9 % des yeux traités au seuil
vs
9,1 % des yeux traités au pré-seuil), élargissant ainsi les indications de traitement
(
Figure 3
)
. À l’âge de 6 ans, une acuité visuelle inférieure à 2,5/10 (moins de 6,4 cycles par degré par la méthode du regard préférentiel
6
) était observée chez 25 % des yeux traités au seuil
versus
16 % des yeux traités au pré-seuil en cas de ROP de type 1. En revanche, le pourcentage de patients avec déficience visuelle sévère (moins de 2,5/10) était plus élevé dans les yeux traités au pré-seuil que dans les yeux traités au seuil (21,3 %
vs
15,9 %) en cas de ROP de type 2 [
34
].
Anticorps anti-VEGF (bévacizumab, ranibizumab)
L’utilisation des anticorps anti-VEGF dans le traitement de phase proliférative de la ROP est en cours d’évaluation. Très peu d’essais randomisés évaluant l’efficacité de ces anticorps dans la ROP ont été publiés. Une méta-analyse récente suggère une efficacité similaire au traitement laser [
32
]. Mais de nombreuses interrogations persistent, notamment concernant la posologie optimale et la sécurité à long terme.
L’étude randomisée contrôlée BEAT-ROP [
35
] a montré la supériorité à court terme du traitement par le bévacizumab
7
en intravitréen (0,625 mg) par rapport à la photocoagulation laser dans la ROP de stade 3+ en zone 1 (voir
Figure 3
). Cette étude doit être néanmoins interprétée avec prudence car elle présente des limites méthodologiques. Des doses inférieures à 0,625 mg seraient efficaces dans les ROP de stade 3 en zone 1 [
36
]. Récemment, l’étude Rainbow [
37
], critiquée elle aussi pour ses limites méthodologiques, a montré une tendance (non significative) à la supériorité du traitement par le ranibizumab
8
(0,2 mg) sur celui par laser dans les ROP en zone 1, stade 1+, 2+, 3, ou 3+, ou en zone 2 stade 3+, ou ROP agressive postérieure
(
Figure 2
)
, ainsi qu’une moindre incidence de résultats structuraux défavorables à court terme.
Un avantage potentiel des anticorps anti-VEGF, par rapport au laser, serait la moindre incidence de myopie à long-terme [
32
], puisque la rétine périphérique n’est pas détruite et le champ visuel périphérique théoriquement préservé. Cependant, 55 % des yeux traités par le bévacizumab en monothérapie présentent une vascularisation rétinienne incomplète en périphérie (> 2 diamètres papillaires, soit environ 2 mm) ainsi que des ramifications anormales, ou
shunts
[
38
]. De plus, en cas de ROP stade 3, des récidives ont été rapportées plus tardivement que celles observées après le laser conventionnel (16
versus
6 semaines) [
39
], dans presque 80 % des cas [
40
]. Des taux de récidive plus élevés après traitement par le ranibizumab ont été également rapportés dans des études rétrospectives [
41
].
Les anticorps anti-VEGF sont administrés par injection intra-vitréenne (IVT), qui expose aux risque d’endophtalmie et de cataracte, contrairement à la photocoagulation laser, qui est une procédure extraoculaire. Ils présentent l’avantage théorique de pouvoir être administrés sous anesthésie locale, sans intubation mais en pratique, une anesthésie générale est fréquemment nécessaire [
42
].
L’incertitude sur les effets systémiques potentiels à long terme des anticorps anti-VEGF doit être prise en compte lors de la décision thérapeutique. En effet, il existe un passage dans la circulation sanguine de ces anticorps après IVT chez le prématuré. La clairance du bévacizumab présent dans la circulation nécessite au moins deux mois. Bien que les taux de VEGF sériques diminuent après traitement laser, la réduction induite par l’injection IVT d’anticorps anti-VEGF est plus importante [
43
,
44
]. Or, le VEGF est indispensable au développement cérébral, rénal et pulmonaire. Des inquiétudes se sont faites jour à la suite de la publication d’études épidémiologiques montrant une association entre traitement par anticorps anti-VEGF et anomalies neuro-développementales à long terme [
45
]. Ces données restent toutefois à confirmer [
46
]. La place des anticorps anti-VEGF dans le traitement de la ROP reste donc imparfaitement définie. Ils pourraient être cependant indiqués ponctuellement dans certaines situations cliniques spécifiques
(
Figure 3
)
[
40
].
Vitrectomie
Dans les stades avancés avec décollement de rétine (stades 4 et 5), le recours à la chirurgie par vitrectomie est nécessaire. Le but principal de cette approche est la libération de points critiques de traction rétinienne, sans provoquer de déhiscence
9,
, qui conduit à un pronostic dévastateur chez le prématuré. La ré-application de la rétine, avec préservation du cristallin et fixation visuelle centrale, est obtenue dans environs 90 % des ROP en stade 4A [
40
]. Bien que, pour la ROP en stade 5, la chirurgie soit complexe, un succès anatomique peut être observé dans un tiers des cas, mais avec un pronostic visuel limité [
47
].
Surveillance à long terme
Le suivi à long-terme des patients ayant présenté une ROP est d’une importance capitale, indépendamment des modalités thérapeutiques reçues, car des réactivations de la maladie ont été observées à l’adolescence et à l’âge adulte [
48
].
Une considération importante, pour laquelle il n’existe pas de recommandations à l’heure actuelle, est le suivi et l’éventuel traitement des ROP de type 2 non régressives, ou devant une vascularisation incomplète à la 45
e
SA. Une angiographie à la fluorescéine et un éventuel traitement par laser sont indiqués en cas d’anomalies vasculaires [
49
].
Le suivi à long terme est également justifié car tout prématuré, ayant ou non développé une ROP, présente un risque accru d’amblyopie
10
et de troubles réfractifs (myopie, astigmatisme), oculomoteurs (strabisme), neurovisuels (déficience visuelle) et de vision des couleurs. L’étude EXPRESS [
50
] a montré que 37,9 % des prématurés nés avant la 27
e
SA présentaient des anomalies ophtalmologiques à l’âge de six ans et demi contre 6,2 % des témoins appariés ; 4,8 % avaient une déficience visuelle (acuité visuelle inférieure 3/10) et 2,1 % étaient aveugles [
50
].
Un bilan ophtalmologique et orthoptique, avec cycloplégie
11
et fond d’œil, devrait ainsi être effectué chez tous les enfants prématurés avant 12 mois, puis à 2,5-3 ans et à 4-5 ans.
|
En conclusion, bien que la ROP puisse être réduite par un meilleur contrôle des facteurs exogènes la favorisant, son risque augmente, conséquence de la prise en charge intensive d’enfants extrêmement prématurés et de très faible poids de naissance, qui sont de plus en plus nombreux. Les conséquences visuelles et le handicap résultant de la ROP sont considérables et impactent la qualité de vie des anciens prématurés. Seule une approche multidisciplinaire, une prise en charge globale et un suivi multifactoriel peuvent limiter ces conséquences délétères et la fréquence de la ROP. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
De Verdier
K
,
Ulla
E
,
Löfgren
S
,
et al.
Children with blindness: major causes, developmental outcomes and implications for habilitation and educational support: a two-decade.
.
Swedish population-based study. Acta Ophthalmol.
2018;
;
96
:
:295.
–
300
.
2.
Blencowe
H
,
Lawn
JE
,
Vazquez
T
,
et al.
Preterm-associated visual impairment and estimates of retinopathy of prematurity at regional and global levels for 2010.
.
Pediatr Res.
2013;
;
74
(
(suppl 1)
):
:35.
–
49
.
3.
Chan
H
,
Cougnard-Grégoire
A
,
Korobelnik
JF
,
et al.
Screening for retinopathy of prematurity by telemedicine in a tertiary level neonatal intensive care unit in France: review of a six-year period.
.
J Fr Ophtalmol.
2018;
;
41
:
:926.
–
932
.
4.
Holmström
G
,
Tornqvist
K
,
Al-Hawasi
A
,
et al.
Increased frequency of retinopathy of prematurity over the last decade and significant regional differences.
.
Acta Ophthalmol.
2018;
;
96
:
:142.
–
148
.
5.
Sapieha
P
,
Joyal
JS
,
Rivera
JC
,
et al.
Retinopathy of prematurity: understanding ischemic retinal vasculopathies at an extreme of life.
.
J Clin Invest.
2010;
;
120
:
:3022.
–
3032
.
6.
Beauchamp
MH
,
Sennlaub
F
,
Speranza
G
,
et al.
Redox-dependent effects of nitric oxide on microvascular integrity in oxygen-induced retinopathy.
.
Free Radical Bio Med.
2004;
;
37
:
:1885.
–
1894
.
7.
Brooks
SE
,
Gu
X
,
Samuel
S
,
et al.
Reduced severity of oxygen-induced retinopathy in eNOS-deficient mice.
.
Invest Ophthalmol Vis Sci.
2001;
;
42
:
:222.
–
228
.
8.
Kermorvant-Duchemin
E
,
Sennlaub
F
,
Sirinyan
M
,
et al.
Trans-arachidonic acids generated during nitrative stress induce a thrombospondin-1-dependent microvascular degeneration.
.
Nat Med.
2005;
;
11
:
:1339.
–
1345
.
9.
Askie
LM
,
Darlow
BA
,
Davis
PG
, et al.
Effects of targeting lower versus higher arterial oxygen saturations on death or disability in preterm infants.
.
Cochrane Database Syst Rev.
2017;
;
4
:
:CD011190.
.
10.
Brion
LP
,
Bell
EF
,
Raghuveer
TS
.
Vitamin
E
supplementation for prevention of morbidity and mortality in preterm infants.
.
Cochrane Database Syst Rev.
2003
;
:CD003665.
.
11.
Alon
T
,
Hemo
I
,
Itin
A
,
et al.
Vascular endothelial growth factor acts as a survival factor for newly formed retinal vessels and has implications for retinopathy of prematurity.
.
Nat Med.
1995;
;
1
:
:1024.
–
1028
.
12.
Pierce
EA
,
Foley
ED
,
Smith
LE
.
Regulation of vascular endothelial growth factor by oxygen in a model of retinopathy of prematurity.
.
Arch Ophthalmol.
1996;
;
114
:
:1219.
–
28
(erratum 1997; 115 : 427).
.
13.
Shih
SC
,
Ju
M
,
Liu
N
,
et al.
Selective stimulation of VEGFR-1 prevents oxygen-induced retinal vascular degeneration in retinopathy of prematurity.
.
J Clin Invest.
2003;
;
112
:
:50.
–
57
.
14.
Chen
J
,
Connor
KM
,
Aderman
CM
,
et al.
Erythropoietin deficiency decreases vascular stability in mice.
.
J Clin Invest.
2008;
;
118
:
:526.
–
533
.
15.
Fang
JL
,
Sorita
A
,
Carey
WA
,
et al.
Interventions to prevent retinopathy of prematurity: a meta-analysis.
.
Pediatrics.
2016;
;
137
:
:e20153387.
.
16.
Hellstrom
A
,
Perruzzi
C
,
Ju
M
,
et al.
Low IGF-I suppresses VEGF-survival signaling in retinal endothelial cells: direct correlation with clinical retinopathy of prematurity.
.
Proc Natl Acad Sci USA.
2001;
;
98
:
:5804.
–
5808
.
17.
Vanhaesebrouck
S
,
Daniëls
H
,
Moons
L
,
et al.
Oxygen-induced retinopathy in mice: amplification by neonatal IGF-I deficit and attenuation by IGF-I administration.
.
Pediatr Res.
2009;
;
65
:
:307.
–
310
.
18.
Hellstrom
A
,
Engstrom
E
,
Hard
AL
,
et al.
Postnatal serum insulin-like growth factor I deficiency is associated with retinopathy of prematurity and other complications of premature birth.
.
Pediatrics.
2003;
;
112
:
:1016.
–
1020
.
19.
Hellström
A
,
Hård
A-L
,
Engström
E
,
et al.
Early weight gain predicts retinopathy in preterm infants: new, simple, efficient approach to screening.
.
Pediatrics.
2009;
;
123
:
:e638.
–
e645
.
20.
Stoltz Sjöström
E
,
Lundgren
P
,
Öhlund
I
, et al.
Low energy intake during the first 4 weeks of life increases the risk for severe retinopathy of prematurity in extremely preterm infants.
.
Arch Dis Child Fetal Neonatal Ed.
2016;
;
101
:
:F108.
–
13
.
21.
Ley
D
,
Hallberg
B
,
Hansen-Pupp
I
,
et al.
rhIGF-1/rhIGFBP-3 in preterm infants: a phase 2 randomized controlled trial.
.
J Pediatr.
2019;
;
206
:
:56.
–
65.e8
.
22.
Lapillonne
A
.
Eleni dit Trolli
S
,
Kermorvant-Duchemin
E
.
Postnatal docosahexaenoic acid deficiency is an inevitable consequence of current recommendations and practice in preterm infants.
.
Neonatology.
2010;
;
98
:
:397.
–
403
.
23.
Connor
KM
,
SanGiovanni
JP
,
Lofqvist
C
,
et al.
Increased dietary intake of omega-3-polyunsaturated fatty acids reduces pathological retinal angiogenesis.
.
Nat Med.
2007;
;
13
:
:868.
–
873
.
24.
Pawlik
D
,
Lauterbach
R
,
Walczak
M
,
et al.
Fish-oil fat emulsion supplementation reduces the risk of retinopathy in very low birth weight infants: a prospective, randomized study.
.
J Parenter Enteral Nutr.
2014;
;
38
:
:711.
–
716
.
25.
Mohsen
L
,
Abou-Alam
M
,
El-Dib
M
,
et al.
A prospective study on hyperglycemia and retinopathy of prematurity.
.
J Perinatol.
2014;
;
34
:
:453.
–
457
.
26.
Kermorvant-Duchemin
E
,
Pinel
AC
,
Lavalette
S
,
et al.
Neonatal hyperglycemia inhibits angiogenesis and induces inflammation and neuronal degeneration in the retina.
.
PLoS One.
2013;
;
8
:
:e79545.
.
27.
International committee for the classification of retinopathy of prematurity.
.
The international classification of retinopathy of prematurity revisited.
.
Arch Ophthalmol.
2005;
;
123
:
:991.
–
9
.
28.
Barjol
A
,
Lux
AL
,
Soudée
S
,
et al.
Recommandations françaises pour le dépistage de la rétinopathie des prématurés.
.
Paris:
:
Société Française d’Ophtalmologie;
,
2015
.
29.
Daniel
E
,
Quinn
GE
,
Hildebrand
PL
,
et al.
Validated system for centralized grading of retinopathy of prematurity: telemedicine approaches to evaluating acute-phase retinopathy of prematurity (e-ROP) study.
.
JAMA Ophthalmol.
2015;
;
133
:
:675.
–
682
.
30.
Campbell
JP
,
Ataer-Cansizoglu
E
,
Bolon-Canedo
V
,
et al.
Expert diagnosis of plus disease in retinopathy of prematurity from computer-based image analysis.
.
JAMA Ophthalmol.
2016;
;
134
:
:651.
–
657
.
31.
Early treatment for retinopathy of prematurity cooperative group.
Revised indications for the treatment of retinopathy of prematurity: results of the early treatment for retinopathy of prematurity randomized trial.
.
Arch Ophthalmol.
2003;
;
121
:
:1684.
–
1694
.
32.
Wang
SD
,
Zhang
GM
,
Shenzhen screening for retinopathy of prematurity cooperative group. Laser therapy versus intravitreal injection of anti-VEGF agents in monotherapy of ROP: a meta-analysis.
.
Int J Ophthalmol.
2020;
;
13
:
:806.
–
15
.
33.
Cryotherapy for retinopathy of prematurity cooperative group.
Multicenter trial of cryotherapy for retinopathy of prematurity.
.
Preliminary results. Arch Ophthalmol.
1988;
;
106
:
:471.
–
479
.
34.
The early treatment for retinopathy of prematurity cooperative group.
.
Grating visual acuity results in the early treatment for retinopathy of prematurity study.
.
Arch Ophthalmol.
2011;
;
129
:
:840.
–
6
.
35.
Mintz-Hittner
HA
,
Kennedy
KA
,
Chuang
AZ
,
et al.
Efficacy of intravitreal bevacizumab for stage 3
+
retinopathy of prematurity
.
.
N Engl J Med.
2011;
;
364
:
:603.
–
615
.
36.
Han
J
,
Kim
SE
,
Lee
SC
,
et al.
Low dose versus conventional dose of intravitreal bevacizumab injection for retinopathy of prematurity: a case series with paired-eye comparison.
.
Acta Ophthalmol.
2018;
;
96
:
:e475.
–
e478
.
37.
Stahl
A
,
Lepore
D
,
Fielder
A
,
et al.
Ranibizumab versus laser therapy for the treatment of very low birthweight infants with retinopathy of prematurity (Rainbow): an open-label randomised controlled trial.
.
Lancet.
2019;
;
394
:
:1551.
–
1559
.
38.
Lepore
D
,
Quinn
GE
,
Molle
F
,
et al.
Intravitreal bevacizumab versus laser treatment in type 1 retinopathy of prematurity: report on fluorescein angiographic findings.
.
Ophthalmology.
2014;
;
121
:
:2212.
–
2219
.
39.
Ittiara
S
,
Blair
MP
,
Shapiro
MJ
,
et al.
Exudative retinopathy and detachment: a late reactivation of retinopathy of prematurity after intravitreal bevacizumab.
.
J AAPOS.
2013;
;
17
:
:323.
–
325
.
40.
Yonekawa
Y
,
Thomas
BJ
,
Thanos
A
,
et al.
The cutting edge of retinopathy of prematurity care: expanding the boundaries of diagnosis and treatment.
.
Retina.
2017;
;
37
:
:2208.
–
2225
.
41.
Alyamaç Sukgen
E
,
Çömez
A
,
Koçluk
Y
, et al.
The process of retinal vascularization after anti-VEGF treatment in retinopathy of prematurity: a comparison study between ranibizumab and bevacizumab.
.
Ophthalmologica.
2016;
;
236
:
:139.
–
47
.
42.
Novitskaya
ES
,
Dahlmann-Noor
AH
,
Adams
GGW
, et al.
Retinopathy of prematurity treatment in the UK: trends in neonatal anaesthetic support and location of treatment from a national surveillance study.
.
Eur J Pediatr.
2020
; May 4. doi:
10.1007/s00431-020-03650-3
.
43.
Wu
WC
,
Lien
R
,
Liao
PJ
,
et al.
Serum levels of vascular endothelial growth factor and related factors after intravitreous bevacizumab injection for retinopathy of prematurity.
.
JAMA Ophthalmol.
2015;
;
133
:
:391.
–
397
.
44.
Hoerster
R
,
Muether
P
,
Dahlke
C
,
et al.
Serum concentrations of vascular endothelial growth factor in an infant treated with ranibizumab for retinopathy of prematurity.
.
Acta Ophthalmol.
2013;
;
91
:
:e74.
–
e75
.
45.
Natarajan
G
,
Shankaran
S
,
Nolen
TL
,
et al.
Neurodevelopmental outcomes of preterm infants with retinopathy of prematurity by treatment.
.
Pediatrics.
2019;
;
144
:
:e20183537.
.
46.
Ahmed
K
,
Ali
AS
,
Delwadia
N
, et al.
Neurodevelopmental outcomes following intravitreal bevacizumab with laser versus laser photocoagulation alone for retinopathy of prematurity.
.
Ophthalmic Surg Lasers Imaging Retina.
2020;
;
51
:
:220.
–
4
.
47.
Sen
P
,
Bhende
P
,
Rishi
E
, et al.
Anatomical and visual outcomes in stage 5 retinopathy of prematurity with microincision vitrectomy surgery.
.
Retina.
2020
; doi:
10.1097/IAE.0000000000002837
.
48.
Uner
OE
,
Rao
P
,
Hubbard
GB
.
Reactivation of retinopathy of prematurity in adults and adolescents.
.
Ophthalmol Retina.
2020
;
S2468–6530(20)30056–7.
.
49.
Al-Taie
R
,
Simkin
SK
,
Douçet
E
,
et al.
Persistent avascular retina in infants with a history of type 2 retinopathy of prematurity: to treat or not to treat?
.
J Pediatr Ophthalmol Strabismus.
2019;
;
56
:
:222.
–
228
.
50.
Hellgren
KM
,
Tornqvist
K
,
Jakobsson
PG
, et al.
Ophthalmologic outcome of extremely preterm infants at 6.5 years of age: extremely preterm infants in Sweden study (Express).
.
JAMA Ophthalmol.
2016;
;
134
:
:555.
–
62
.
51.
Chan-Ling
T
,
Gole
GA
,
Quinn
GE
,
et al.
Pathophysiology, screening and treatment of ROP: a multi-disciplinary perspective.
.
Prog Retin Eye Res.
2018;
;
62
:
:77.
–
119
.
|